O aumento do consumo de frutose pela população vem sendo associado às diversas alterações metabólicas, que favorecem ao aparecimento da obesidade e suas comorbidades. O objetivo deste trabalho foi avaliar os efeitos do consumo crônico de frutose sobre a ingestão alimentar, ganho de massa corporal e de tecido adiposo, além de níveis séricos de glicose e triglicerídeos.
MétodosRatos Wistar com 30 dias de vida foram divididos em dois grupos: frutose (F) e controle (C), os quais receberam um tratamento com livre acesso a ração comercial, água ou solução a 20% de frutose. A massa corporal foi avaliada semanalmente e o consumo alimentar aos 30, 60 e 90 dias. Aos 90 dias de vida, os animais foram eutanasiados por decapitação e retirados os depósitos de gordura (mesentérico, retroperitoneal e epididimal), e coletado o sangue para dosagem da glicose e triglicerídeos.
ResultadosNão houve diferença significativa entre o ganho de massa corporal, todavia os percentuais de gordura corporal foram maiores nos grupos que consumiram bebidas adoçadas. O grupo F consumiu menor quantidade de ração aos 60 e 90 dias e maior consumo de solução de frutose comparado ao controle hídrico nos períodos de 30 e 60 dias, e isso significou maior consumo calórico do grupo F e menor eficiência alimentar. Os depósitos de gordura retroperitoneal e epididimal, bem como a trigliceridemia apresentaram‐se elevados no grupo F quando comparado ao grupo C.
ConclusãoO tratamento por 60 dias com solução de frutose, apesar de não ter influenciado diretamente no ganho de massa corporal, foi capaz de aumentar a gordura corporal na região abdominal neste grupo, quando comparado com o grupo C, além de alterar níveis de triglicerídeos. E estes dois fatores implicam risco de doenças cardiovasculares.
Increased fructose consumption is associated with various metabolic changes that favor the onset of obesity and related comorbidities. The objective of this study was to assess the effects of chronic fructose consumption on body weight and adipose tissue, as well as on serum glucose and triglyceride levels.
MethodsThirty‐day‐old Wistar rats were divided into two groups: fructose (F) and control (C), which had free access to commercial chow and either water or a 20% fructose solution. Body mass was measured weekly and food consumption at 30, 60 and 90 days. At 90 days, the animals were killed by decapitation and fat deposits (mesenteric, epididymal and retroperitoneal) were removed and blood collected for measurement of glucose and triglyceride levels.
ResultsThere was no significant difference in body weight gain, but the percentage of body fat was higher in group F. This group also consumed less feed at 60 and 90 days and had higher consumption of fructose solution than water in group C at 30 and 60 days. This meant higher calorie intake in group F and lower feed efficiency. Retroperitoneal and epididymal fat deposits and triglycerides were higher in group F than in group C.
ConclusionConsumption of fructose solution for eight weeks, while not directly reflected in body weight gain, did increase abdominal fat in group F compared to group C, as well as changing triglyceride levels. These two factors increase risk of cardiovascular disease.
Os hábitos nutricionais desempenham um papel importante no desenvolvimento de doenças cardiovasculares (DCV) e os açúcares dietéticos parecem ter uma ligação com os seus fatores de risco1. Neste aspecto, investigações têm demonstrado os riscos à saúde que o consumo de frutose pode determinar, tanto no organismo humano2 quanto em roedores3, seja na forma pura ou em misturas de carboidratos, e em diferentes concentrações e períodos de ingestão.
A frutose ou levulose é um monossacarídeo, quimicamente formado por seis átomos de carbono unidos em ligações covalentes simples e apresentando um grupamento cetona na posição dois da sua cadeia de carbono ‐«C6H12O6», sendo considerada uma cetohexose. Esta é oferecida na dieta através do xarope de milho, sacarose, refrigerantes, frutas e derivados. Seu consumo na forma de soft drinks é considerado um problema de saúde pública4,5.
Embora a frutose tenha a mesma fórmula e massa molecular da glicose, do ponto de vista fisiológico, ambas são processadas de formas distintas. A frutose não necessita de estímulo da insulina para internalização celular. A fosforilação da frutose em frutose‐1‐fosfato ocorre pela ação da frutoquinase, levando a formação de duas trioses, a dihidroxicetona e a gliceraldeído. Esta enzima não é regulatória e, portanto, pode favorecer a formação de produtos lipogênicos. De forma semelhante, a glicose é fosforilada por duas vezes antes do acesso à via da frutose até seu desdobramento a di‐hidroxicetona e gliceraldeído, porém seu metabolismo depende de uma enzima limitante, a fosfofrutoquinase, que é inibida pelo ATP e pelo citrato, dificultando o acúmulo de intermediários ricos em carbono para entrar no ciclo de Krebs6.
Dentre as desordens metabólicas associadas à frutose estão a hipertrigliceridemia, hiperuricemia, hiperinsulinemia, esteatose hepática, comprometimento vascular, resistência periférica à insulina e aumento de adiposidade visceral, podendo haver ou não aumento do consumo alimentar, da massa corporal e obesidade5.
Estes efeitos têm despertado interesse sobre as repercussões da frutose à ocorrência de síndrome metabólica e DCV, de maneira que a elucidação dos mecanismos envolvidos no metabolismo desse monossacarídeo torna‐se importante. Desta forma, o objetivo deste trabalho foi avaliar os efeitos do consumo crônico de frutose sobre o consumo alimentar ganho de massa corporal e de tecido adiposo, além de níveis séricos de glicose e triglicerídeos.
MetodologiaDesenho experimentalTodos os procedimentos experimentais foram aprovados pelo comitê de ética em pesquisa da Universidade Federal do Rio de Janeiro. No qual, ratos machos da linhagem Wistar (aproximadamente 85g) oriundos do biotério local, aos 30 dias de idade, foram distribuídos em grupo controle (C) e grupo frutose (F), cada grupo com 10 animais que tiveram livre acesso a ração comercial e água (C) ou solução de frutose a 20% (F), durante 60 dias, sob ciclo de luz de 12h (6‐18h) em temperatura constante (24±1°C).
Consumo alimentarPara avaliar a ingestão alimentar, os ratos foram mantidos em gaiolas individuais e ambas as ingestões foram medidas pela diferença entre a oferta e a sobra de ração ou frutose/água num período de 24h, aos 30 dias (no início do tratamento), 60 dias (metade do tempo de tratamento) e 90 dias (final do tratamento). A ingestão energética foi estimada considerando 9kcal/g de lipídios, e 4kcal/g de proteína e carboidrato, este último proveniente do consumo da ração e da solução de frutose a 20%. Os dados foram expressos por 100g de peso corporal.
A eficiência alimentar foi estimada considerando a fórmula: (ganho de peso [g]/energia ingerida [kcal])x100, adaptada de Novelli et al.7, sendo o resultado apresentado na forma de percentual.
Massa corporal e depósitos de gorduraA massa corporal foi avaliada semanalmente, a partir do início do tratamento e estimado o ganho de cada grupo.
Os depósitos epididimal, mesentérico e retroperitoneal foram avaliados por gravimetria. O tecido adiposo total foi o somatório dos três compartimentos descritos anteriormente. Os resultados foram expressos em gramas de gordura por 100 gramas de carcaça (g/100g).
Glicemia e trigliceridemiaApós 12h de jejum, os animais foram eutanasiados em guilhotina e o sangue coletado e centrifugado a 2500rpm por 15 minutos a 4°C. Em seguida, o soro foi utilizado para dosagem da glicose pelo método enzimático, utilizando kit comercial (Glicose PAP Liquiform, Labtest Diagnóstica, BH‐MG). A dosagem de triglicerídeos foi determinada por método colorimétrico, utilizando kit comercial (Triglicérides Liquiform, Labtest Diagnóstica, MG, Brasil). Ambas as absorbâncias foram determinadas em 505nm.
Análise estatísticaOs resultados foram expressos como média±erro padrão da média (EPM) e utilizou‐se o teste t'Student, empregando o pacote SPSS (versão 20.0). Foi adotado o nível de significância de p<0,05.
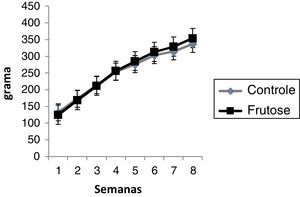
ResultadosOs grupos começaram o tratamento com a massa corporal equivalente e, ao final de oito semanas de tratamento, não foi verificada diferença significativa tanto semanal (Figura 1), quanto no ganho de massa final (Tabela 1), entre os grupos. Entretanto, o grupo F apresentou maior teor de tecido adiposo total, além de significativamente maiores percentuais de tecido adiposo epididimal e retroperitoneal. O tecido adiposo mesentérico teve um não significativo (Tabela 1).
Massa corporal, tecido adiposo e níveis séricos de glicose e triglicerídeo
| Controle (C) | Frutose (F) | |
|---|---|---|
| Ganho de peso corporal (g) (n=10) | 253±5,21 | 269,7±9,12 |
| Tecido adiposo retroperitoneal (g/100g) (n=9) | 0,58±0,06 | 0,94±0,07* |
| Tecido adiposo mesentérico (g/100g) (n=9) | 0,67±0,08 | 0,87±0,08 |
| Tecido epididimal (g/100g) (n=9) | 0,74±0,06 | 0,97±0,06* |
| Tecido adiposo total (g/100g) (n=9) | 1,99±0,06 | 2,78±0,18* |
| Glicemia (mg/dL) (n=9) | 96,2±3,71 | 104,7±5,53 |
| Trigliceridemia (mg/dL) (n=10) | 130,5±5,56 | 162,32±12,31* |
n:número de ratos.
Em relação ao consumo alimentar, o grupo F apresentou menor ingestão de ração nos períodos de 60 e 90 dias, entretanto o valor energético total, o consumo da solução de frutose foram maiores nos cortes de 30 e 60 dias, e a eficiência alimentar foi menor no grupo F durante estes dois períodos (Tabela 2).
Consumo alimentar e taxa de eficiência alimentar
| Parâmetros | Dias de vida | |||||
|---|---|---|---|---|---|---|
| Controle (C) | Frutose (F) | |||||
| 30 dias | 60 dias | 90 dias | 30 dias | 60 dias | 90 dias | |
| Consumo alimentar (g/100g) (n=9‐8) | 15,18±0,67 | 9,88±0,47 | 9,20±0,31 | 13,66±0,72 | 7,09±0,29* | 5,38±0,22* |
| Ingestão calórica (kcal/100g) (n=9‐8) | 63,76±2,82 | 41,48±1,96 | 38,64±1,30 | 85,81±3,90* | 47,32±1,35* | 41,54±1,46 |
| Ingestão hídrica/solução de frutose (mL/100g) (n=9‐8) | 28,32±2,34 | 17,64±0,40 | 19,91±0,81 | 35,56±2,23* | 21,90±1,22* | 23,64±1,88 |
| Eficiência alimentar (%) (n=9‐8) | 77±0,01 | 315±0,12 | 220±0,11 | 47±0,03* | 272±0,14* | 230±0,09 |
n:número de ratos.
Em relação aos parâmetros bioquímicos avaliados, não houve diferença nos níveis séricos de glicose entre os grupos. Todavia, o triglicerídeo foi maior no grupo F (Tabela 1).
DiscussãoNo presente estudo foi estabelecida a hipótese de que o consumo de solução de frutose a 20% por ratos Wistar seria capaz de promover aumento de massa corporal, tecido adiposo e modificação de níveis séricos de glicose e triglicerídeos.
A frutose parece interferir nos mecanismos de homeostase energética, porém não diretamente no consumo alimentar. De qualquer modo, a alteração destes parâmetros é ainda controversa e neste estudo não foi verificada diferença entre os grupos. Tal resultado sinaliza uma ineficiência no metabolismo da frutose em contribuir com energia efetiva e resultar em ganho de massa corporal, muito embora seja esperado que, como carboidrato, a frutose possa numa análise direta contribuir com 4kcal/g4.
Este resultado corrobora com o estudo de Dai e McNeill (1995)8, que não encontraram aumento progressivo na massa corporal entre os grupos C e F, mesmo num tratamento de 14 semanas. Entretanto, estudos utilizando solução de frutose a 10 e 20% encontraram associação positiva entre a ingestão deste monossacarídeo por longos períodos e ganho de massa corporal em hamster9,10.
Embora não tenha sido verificado neste estudo alteração na massa corporal, é dito que a frutose promove rompimento no complexo mecanismo de regulação do peso corporal e balanço energético11. Ademais, foi verificada que a massa adiposa total e dos depósitos epipididimal e retroperitoneal foram significativamente maiores no grupo F, demonstrando que a frutose pura pode contribuir para a adipogênse.
Interessantemente, alguns estudos apontam que a ingestão de frutose, em ratos, promove acúmulo maior de gordura corporal comparado com água e outros tipos de bebidas adoçadas9, além de aumentar o tamanho dos adipócito12 e aumentar a adiposidade visceral13. Em ratos, as gorduras retroperitoneal e epididimal correspondem à adiposidade central e visceral, respectivamente14, e essa adiposidade localizada na região abdominal é considerada um dos componentes da síndrome metabólica e tem um papel importante no risco para DCV15.
No começo do tratamento observamos um maior consumo de bebida adoçada aumentando juntamente a ingestão calórica, exemplificado por um consumo da solução de frutose maior nos cortes de 30 e 60 dias de vida, com equalização no final do tratamento. Em relação ao consumo de ração, o grupo F apresentou menor ingestão aos 60 e 90 dias de vida.
Do ponto de vista da concentração de energia molecular, a frutose se equivale à glicose, mas não é um carboidrato utilizado diretamente por células extra‐hepáticas para esta finalidade, visto que tais tecidos não expressam enzimas‐chave para os passos catabólicos iniciais da produção de energia a partir da frutose16. Assim, a baixa eficiência energética da frutose pode ser a razão do tratamento não ter contribuído para ganho de massa corporal, caracterizada pela eficiência alimentar.
A ingestão alimentar é modulada por estruturas límbico‐corticais do cérebro que estabelecem mecanismos de feedback com o hipotálamo, os quais estão relacionadas ao valor hedônico do alimento17. Neste contexto, é possível considerar que o consumo de frutose, em função da palatabilidade, pode levar a alterações nos mecanismos de fome e saciedade e dos sinais de recompensa18 de maneira direta, e motivar o consumo de energia independente da necessidade calórica. Além disso, o consumo de frutose leva à resistência a leptina e insulina, que são hormônios implicados na modulação da resposta hedônica à ingestão alimentar e de outros estímulos de prazer17.
Vários estudos têm investigado o efeito da frutose em misturas como xarope de milho ou sacarose; nós utilizamos frutose pura em solução aquosa a 20% como única fonte de líquido oferecida aos ratos tratados com frutose, enquanto o grupo controle consumiu apenas água e não uma solução contendo outro produto edulcorante. Há diferentes formas de oferta de frutose e de períodos de tratamento aplicado nos estudos, e, por isso, a dificuldade de comparação entre resultados.
A glicose sérica foi avaliada, mas não foi observada diferença entre os grupos e, embora a insulina não tenha sido verificada, há a possibilidade de se ter um aumento compensatório para manter a euglicemia. A resposta glicêmica frente à frutose tem sugerido resistência insulínica3, mas o que se observa são dados ainda contraditórios.
Estudo com humanos, corroborando com nossos dados em ratos, demonstrou que a ingestão de frutose comparada à glicose não promoveu aumento sistêmico dos níveis de glicose19, embora estudo anterior em ratos e humanos tenha sinalizado que o consumo elevado de frutose provoca alterações metabólicas periféricas que conjugam para a resistência à insulina20.
Em relação aos triglicerídeos, o grupo F apresentou maiores teores em relação ao grupo C. A hipertrigliceridemia é uma das desordens mais comuns causada pela dieta rica em frutose. O consumo aumentado de frutose provoca uma taxa maior de lipogênese de novo, este processo pode aumentar a disponibilidade de ácidos graxos por efeito direto na síntese destes compostos3,4,6.
ConclusãoMais estudos devem ser realizados para avaliar o efeito potencial da frutose pura ou em misturas de carboidratos, bem como comparar com outros açúcares para tentar elucidar se os efeitos descritos acima são pelo consumo de frutose per se ou energético que este consumo acarreta, visto que os dados na literatura ainda são controversos. Além disso, é possível identificar neste estudo potenciais alterações deste açúcar na adiposidade abdominal e no aumento dos níveis de triglicerídeo sérico, e estes dois fatores podem favorecer a um risco elevado para desenvolvimento de DCV.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que os procedimentos seguidos estavam de acordo com os regulamentos estabelecidos pelos responsáveis da Comissão de Investigação Clínica e ética e de acordo com os da Associação Médica Mundial e da Declaração de Helsinki.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes nesteartigo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados depacientes neste artigo.
Conflito de interessesOs autores declaram não haver conflito de interesses.