A disseção coronária espontânea é uma causa rara de síndrome coronária aguda e ocorre tipicamente em indivíduos jovens sem os fatores de risco cardiovasculares clássicos de doença arterial coronária. Apresenta etiologia multifatorial e tratamento não definido, pelo que a sua abordagem deve ser feita de forma selecionada baseada na apresentação clinica e anatomia coronária. Apresentam‐se dois casos clínicos de disseção coronária espontânea com diferente abordagem inicial, que espelham a importância da avaliação individualizada de acordo com a apresentação clínica.
Spontaneous coronary artery dissection is a rare cause of acute coronary syndrome that typically occurs in relatively young patients without classical cardiovascular risk factors for coronary artery disease. The etiology appears to be multifactorial and optimal management is not clearly established, so the treatment strategy is often selected based on clinical presentation and coronary anatomy. We present two cases of spontaneous coronary artery dissection with different initial approaches, highlighting the importance of a case‐by‐case assessment.
A disseção coronária espontânea é uma entidade rara e, por conseguinte, de etiologia, fisiopatologia e tratamento ainda não estabelecidos. São vários os fatores, como a clínica, o status hemodinâmico, ou a anatomia coronária, que influenciam a estratégia de tratamento, que na ausência de evidência robusta deve ser abordada de forma individualizada.
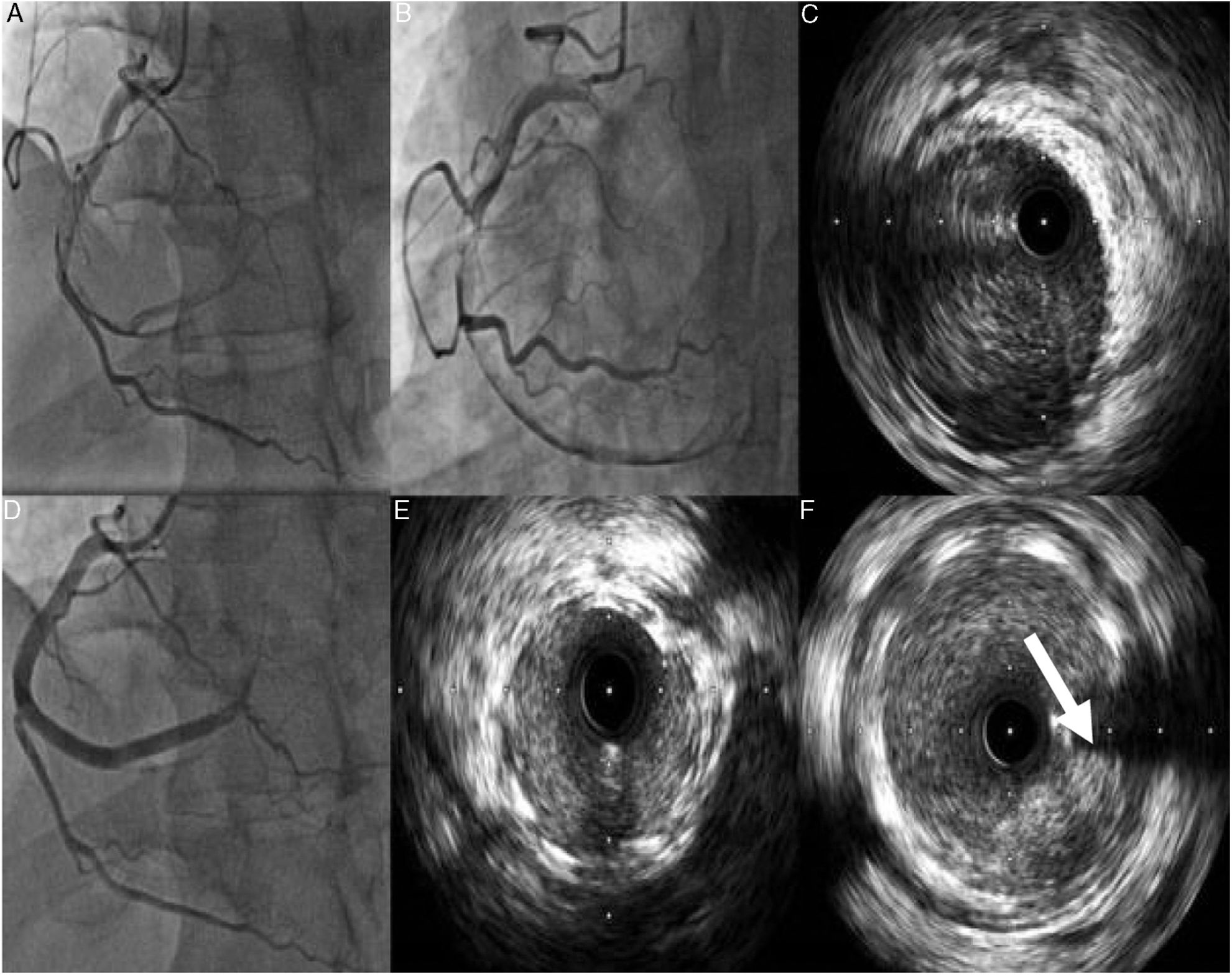
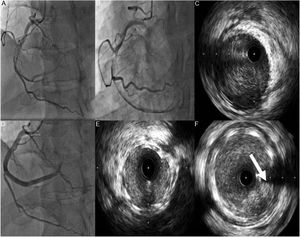
Caso clínico 1Doente do sexo masculino, 42 anos, previamente saudável, praticante regular de desporto, sem fatores de risco cardiovasculares conhecidos, nem antecedentes patológicos ou familiares relevantes e sem medicação crónica. Recorre ao serviço de urgência (SU) de um hospital por dor torácica com 12h de evolução, acompanhada de náuseas, sudação, tonturas e sem posição de alívio. À admissão no SU apresentava dor residual, encontrava‐se hemodinamicamente estável e sem alterações relevantes ao exame físico. O ECG mostrava ritmo sinusal 72/min e ondas Q patológicas na parede inferior. Por se apresentar ainda sintomático, foi enviado para um centro com capacidade para angioplastia primária, onde foi submetido a coronariografia que mostrou coronária esquerda sem lesões e uma coronária direita dominante com trombo e disseção espontânea ocupando todo o segmento médio e distal estendendo‐se até ao ramo póstero‐lateral condicionando fluxo TIMI 1 (Figura 1).
A e B: Coronariografia evidenciando artéria coronária direita (CD) com disseção espontânea desde o segmento médio com trombo condicionando fluxo TIMI 1. C: Imagem de IVUS mostrando disseção desde o ramo póstero‐lateral até ao segmento médio da CD com grande quantidade de trombo. D: Implantação de três stents com fármaco em overlap. E e F: Imagem de IVUS mostrando stents com boa expansão e aposição e protrusão de trombo (seta).
Dado o doente se encontrar ainda com dor durante a coronariografia diagnóstica, foi decidido proceder a angioplastia da coronária direita com apoio de imagem intravascular, com implantação de três stents diretos Resolute Onyx ® 3,5mm/30mm no segmento distal, 4/38mm proximal a este e com overlap e 4mm/22mm proximal a este último e com overlap, ficando com fluxo final TIMI 2 na descendente posterior e póstero‐lateral. Na imagem de controlo pós‐angioplastia com IVUS verificou‐se uma boa aposição e expansão dos stents, a presença de hematoma intramural, alguma protrusão de trombo intrastent e ainda de algum trombo na póstero‐lateral (Figura 1).
O doente evoluiu em classe Killip I com troponina I máxima de 32,5ng/ml, sem recorrência de dor torácica durante o internamento e sem registo de disritmias ventriculares complexas. O ecocardiograma transtorácico mostrou uma função sistólica global ligeiramente diminuída com hipocinésia dos segmentos basais e médios do septo inferior e parede inferior.
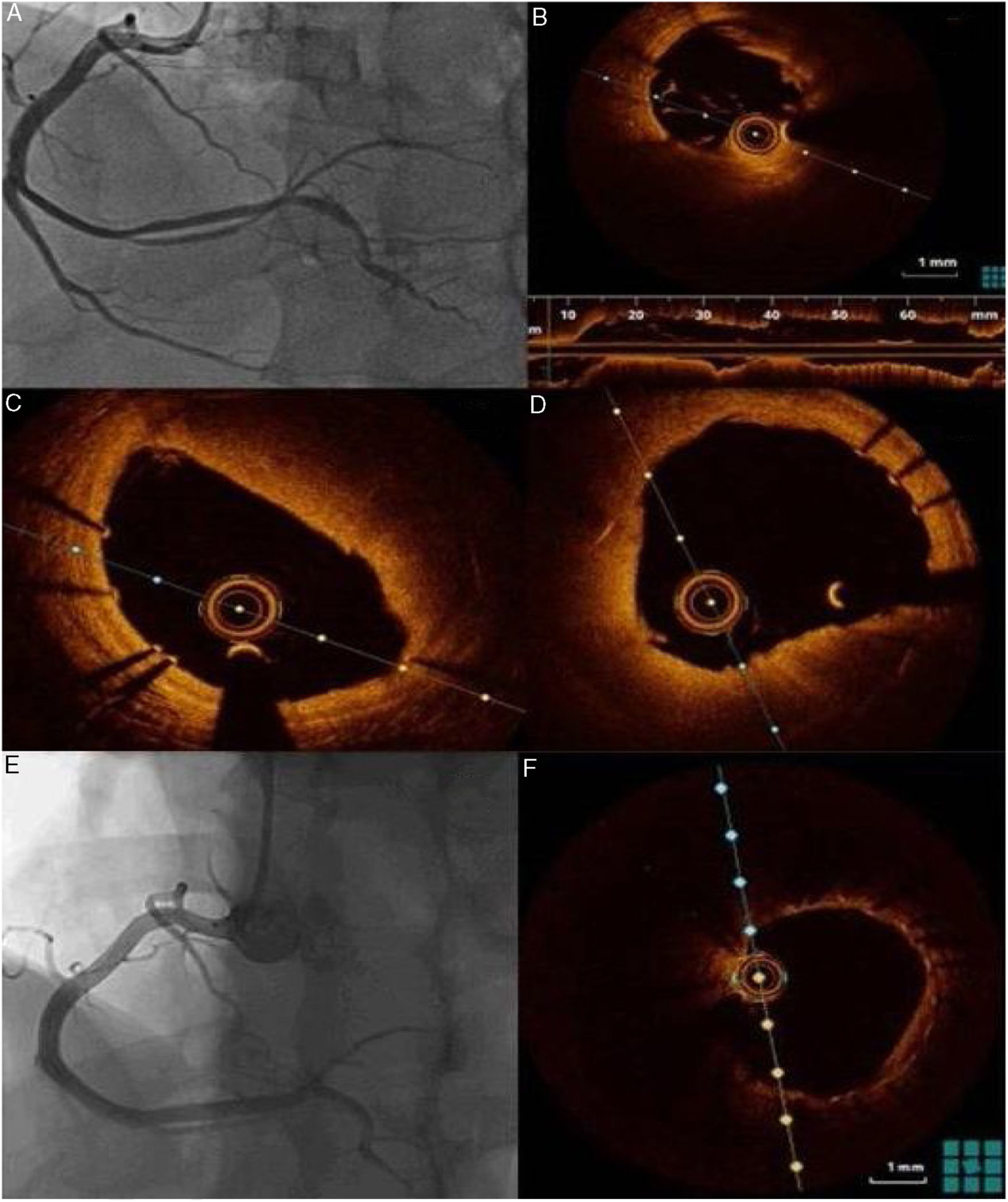
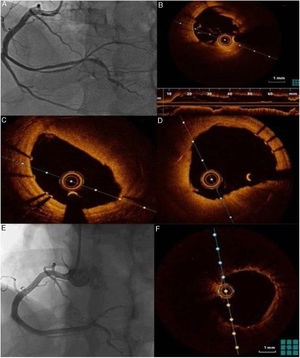
Uma semana após o evento agudo, foi repetida coronariografia e realizada tomografia de coerência ótica (OCT), que confirmou uma boa aposição e expansão dos stents previamente implantados e a presença de trombo vermelho intrastent mais evidente na porção médio‐distal do vaso, sem condicionar, no entanto, uma obstrução significativa do lúmen (Figura 2).
O doente teve alta ao sétimo dia de internamento sob estratégia antitrombótica tripla com a apixabano 2,5mg bid; clopidogrel 75mg id e AAS 100mg id, suspendendo o apixabano aos três meses após o evento. Aos seis meses após o episódio agudo, o doente mantém‐se assintomático, sem recrudescência anginosa, mostrando o follow‐up angiográfico com imagem intracoronária aos seis meses stents bem apostos, desaparecimento do trombo vermelho e fluxo TIMI 3.
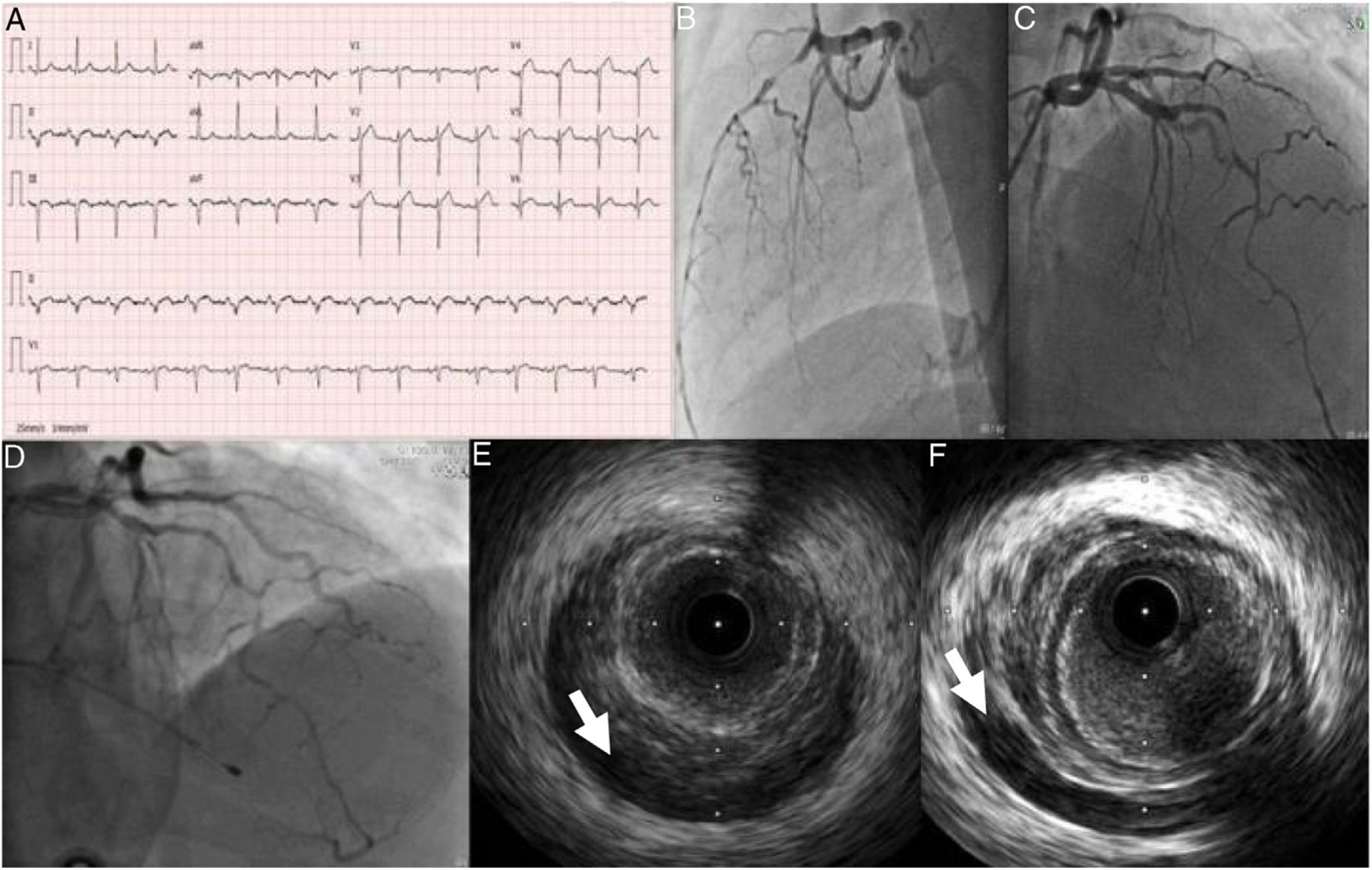
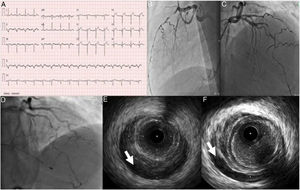
Caso clínico 2Doente do sexo masculino, 53 anos, previamente saudável, praticante regular de desporto, sem fatores de risco cardiovasculares conhecidos, nem antecedentes patológicos ou familiares relevantes e sem medicação crónica. Recorre ao serviço de urgência por dor torácica de características opressivas com início três dias antes da ida ao SU com progressivo aumento de intensidade. À admissão apresentava‐se hemodinamicamente estável, sem alterações relevantes ao exame físico, nomeadamente à auscultação cárdio‐pulmonar. Realizou ECG que mostrava ritmo sinusal 93/min, supradesnivelamento ST na parede anterior e ondas Q patológicas na parede inferior e anterior (Figura 3). O doente foi submetido a cateterismo cardíaco urgente, que revelou disseção coronária espontânea da descendente anterior, na qual, apesar de não ser de todo evidente a presença de um flap, era evidente a presença de hematoma intramural desde o segmento médio, estendendo‐se até ao segmento distal condicionando fluxo TIMI 2 (Figura 3).
A: Eletrocardiograma da admissão. B e C: Coronariografia evidenciando artéria descendente anterior (DA) com disseção espontânea ocupando todo o segmento médio e distal estendendo‐se até ao ramo póstero‐lateral. D: Coronariografia realizada após paragem cardiorrespiratória 30h após admissão, evidenciando aparente progressão proximal da disseção D e F: Imagem de IVUS a evidenciar hematoma intramural desde a DA proximal (seta).
Uma vez que o doente se encontrava hemodinâmica e eletricamente estável, apenas com uma dor residual, e com fluxo coronário TIMI 2, optou‐se por uma estratégia watchfullwaiting, sendo admitido na UCIC para vigilância e monitoração, sob terapêutica antitrombótica tripla com aspirina, clopidogrel e enoxaparina sc em doses terapêuticas.
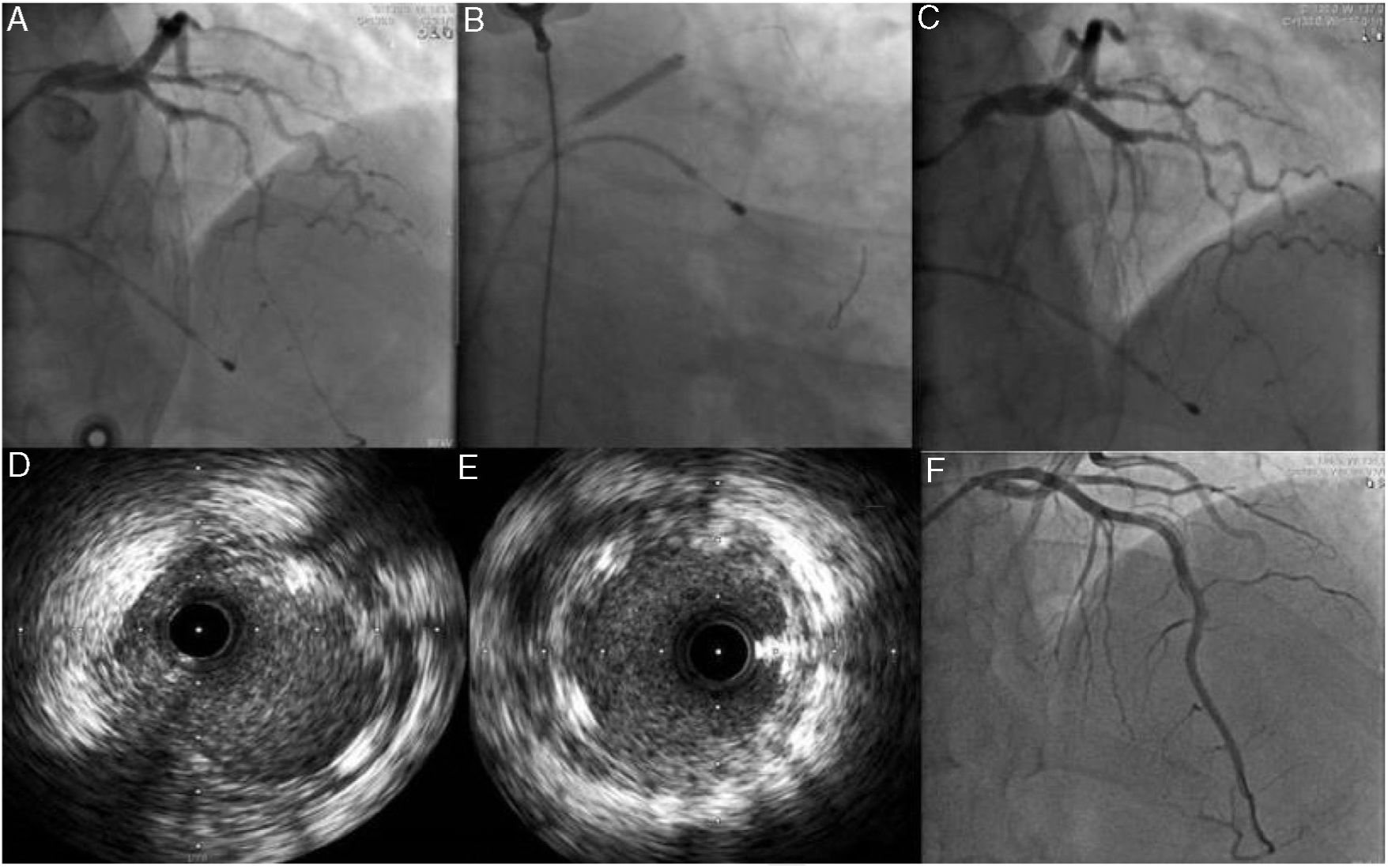
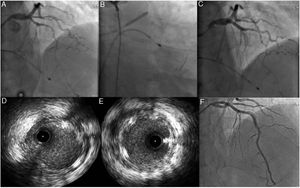
No 1° dia de internamento, o doente fez paragem cárdiorrespiratória em assistolia precedida de bradicardia grave, recuperada no fim de dois ciclos de suporte avançado de vida, tendo‐se optado pela colocação de sistema pacemaker provisório e nova angiografia coronária. Dada a instabilidade hemodinâmica e elétrica optou‐se, após nova coronariografia com apoio de imagem por IVUS – que após confirmar a presença do fio guia no verdadeiro lúmen mostrou aparente progressão da disseção da DA para o 1/3 proximal – pela angioplastia da descendente anterior com colocação de scaffold Absorb® 3.50mm/23mm no segmento proximal e sobredilatação com balão NC 4,0mm/20mm, mantendo o vaso distal fluxo TIMI 2 (Figura 4). O ecocardiograma realizado ainda no primeiro dia mostrou uma função sistólica global moderadamente diminuída – FEVE ∼45% com o ápex e segmentos apicais acinéticos e hipocinésia do segmento médio do SIV e da parede anterior. No terceiro dia de internamento, por não apresentar novos episódios de instabilidade elétrica, retirou‐se o pacemaker provisório. Apesar da estabilidade hemodinâmica, elétrica e clínica, analiticamente não apresentou uma diminuição sustentada dos marcadores de necrose miocardíaca, apresentando oscilações durante o internamento, pelo que ao sexto dia de internamento, após discussão multisdisciplinar, optou‐se pela angioplastia do segmento médio e distal com pré‐dilatação com balão 2,5/30mm, seguido de colocação de dois scaffolds Absorb® 3mm/28mm e 2,5mm/23mm. Tratando‐se de uma zona de bridging, implantou‐se um stent com fármaco mais distal (Xience Alpine® 2,5mm/38mm) em overlap com os scaffolds com bom resultado final (Figura 4).
A: Passagem de guia floppy até DA distal B e C: implantação de scaffold Absorb 3,50mm/23mm. D e E: Imagem de IVUS após implantação de scaffold Absorb mostrando scaffold bem aposto e expandido, selando a entrada proximal da disseção F: Implantação em D6 de internamento de dois scaffold Absorb 3mm/28mm e 2,5mm/23mm e de um stent com fármaco (Xience Alpine 2.5mm/38mm) com bom resultado angiográfico final.
O doente teve alta ao nono dia de internamento sob estratégia antitrombótica tripla com a apixabano 2,5mg bid; clopidogrel 75mg id e AAS 100mg id. Após um mês de follow‐up, o doente permanece assintomático e sem recrudescência anginosa, estando agendado follow‐up angiográfico com imagem intracoronária aos seis meses após o evento agudo.
DiscussãoEstes dois casos ilustram os desafios diagnósticos e terapêuticos da disseção coronária espontânea (DSAC).
A DSAC define‐se como uma separação não traumática e não iatrogénica da parede arterial coronária, criando um falso lúmen.1
Embora a incidência e a prevalência não estejam bem determinadas, dado o subdiagnóstico da doença, estima‐se que represente cerca de 3% das síndromes coronárias agudas e esteja associada a uma recorrência de 15% aos 2 anos.1–6
Com etiologia multifatorial, envolve com maior frequência a artéria descendente anterior (34‐42% dos casos) e associa‐se em 72 a 86% dos casos à displasia fibromuscular.1
Apesar de historicamente associada ao peripartum, esta tendência tem sido cada vez menos observada nos registos mais recentes, nos quais a DSAC relacionada com a gravidez representa menos de 5% dos casos. São várias as doenças inflamatórias sistémicas crónicas e doenças do tecido conjuntivo descritas associadas à DSAC, destacando‐se a síndrome de Marfan e a síndrome de Ehler‐Danlos.7,8
Tendo por base um substrato genético e anatómico há normalmente um fator desencadeante. Condições que aumentem a pressão toracoabdominal ou o nível catecolaminérgico levam ao aumento das forças de cizelhamento cardiocirculatório podendo precipitar o evento agudo. O stress emocional, atividades físicas com esforço isométrico, drogas ou atividades associadas à manobra de Valsava, como o parto, a tosse ou o vómito são fatores desencadeantes da DSAC.9–12,
Existem várias formas de apresentação clínica, sendo a síndrome coronária aguda a mais comum. Uma vez que a coronariografia é a abordagem gold standard nos doentes com SCA, esta se apresenta como o método diagnóstico mais comum na DSAC.1
Métodos de imagem intracoronária, como a tomografia de coerência ótica (OCT) e a ecografia intravascular (IVUS), surgem como ferramentas importantes na DSAC, fornecendo informações complementares no diagnóstico. Se por um lado o OCT se mostra superior na qualidade de imagem permitindo uma melhor visualização das disseções da íntima, trombos intraluminais, falsos lúmen e hematoma intramural, o IVUS proporciona uma visualização mais profunda do vaso devido à sua maior capacidade de penetração, permitindo uma melhor apreciação da extensão do hematoma intramural. Existem ainda assim riscos potenciais com a imagem intracoronária com OCT nestes doentes, como a extensão da disseção com a injeção de contraste.13,14
Permanece indeterminada a melhor abordagem de doentes com DSAC, uma vez que nenhum ensaio aleatorizado comparou a terapêutica médica com a estratégia de revascularização. No entanto, ecom base em dados observacionais, os resultados clínicos parecem melhores quando se opta por uma estratégia conservadora, discutindo‐se, no entanto, qual a terapêutica farmacológica ideal nestes doentes.1
Tendo em conta a evidência histórica da aspirina na síndrome coronária aguda e na prevenção secundária de eventos cardiovasculares, associada ao seu baixo perfil de efeitos secundários, é globalmente aceite no tratamento agudo e em longo prazo da DSAC. Apesar de não haver evidência no uso do clopidogrel nos doentes com DSAC sem intervenção coronária percutânea, a dupla antiagregação plaquetar com aspirina e clopidogrel entre um mês a um ano parece aconselhada de forma a reduzir o ambiente pró‐trombótico. 1,15
O papel dos novos antagonistas de P2Y12 (ticagrelor e prasugrel) não está definido. Relativamente à anticoagulação existe igualmente controvérsia, pois se por um lado existe um risco potencial de extensão da disseção com a anticoagulação, por outro lado há o potencial benefício de resolver o trombo formado pela estase no falso lúmen e melhorar a permeabilidade do verdadeiro lúmen. 1
Enquanto se aguarda pelo resultado do estudo aleatorizado (SAFER‐SCAD), os IECAS devem ser administrados apenas a doentes com disfunção ventricular.1,9
A estratégia conservadora é apoiada não apenas pelo facto de que DSAC comummente culmina na cicatrização angiográfica espontânea, mas também pelo facto de que a maior parte da DSAC recorrente envolve outros vasos que não o originalmente envolvido. Num registo recente, o autor relatou que apenas 17% (seis de 35 doentes) do grupo de revascularização desenvolveram DSAC recorrente no vaso originalmente tratado com intervenção coronária percutânea, enquanto nenhum dos doentes no grupo da abordagem conservadora desenvolveu DSAC no vaso originalmente envolvido (p = 0,002).1,16
Há, no entanto, um subgrupo de doentes para os quais a estratégia deve ser a revascularização percutânea ou cirúrgica e inclui os doentes com isquemia recorrente, instabilidade hemodinâmica ou elétrica e os doentes com disseção do tronco comum.1,5–9
A intervenção coronária percutânea tem que ser realizada cautelosamente com técnicas meticulosas, mas pode ainda assim produzir resultados subótimos. A extensão do hematoma intramural é frequentemente subestimada pela angiografia, podendo assim ocorrer uma perda imprevista de fluxo após a colocação do stent.
Além disso, a presença e a subvalorização da extensão do hematoma intramural pode resultar em subdimensionamento do stent, com o risco associado de tromboses tardias por mau aposição após a reabsorção do hematoma.1,6
Apesar da pouca evidência do uso de BVS no tratamento da SCAD, a idade jovem do doente num vaso sem evidência de cálcio tem sido fator decisor já descrito que foi tido em conta para o uso de scaffolds em detrimento dos stents farmacológicos, com os resultados em longo prazo a mostrarem ser promissores, tal como descrito por Basavarajaiah et al. e Watt et al.17–19
Tendo em conta a associação com a displasia fibromuscular, é sugerida por alguns autores a exclusão de disseção dos vasos ilíacos, renais e dos grandes vasos do pescoço através de um exame de imagem.1
ConclusãoA disseção coronária espontânea surge como um desafio terapêutico, no qual é essencial a abordagem selecionada baseada na apresentação clínica e anatomia coronária. A abordagem conservadora deve prevalecer como estratégia inicial, reservando‐se a revascularização para os doentes com isquemia recorrente, instabilidade hemodinâmica ou elétrica ou disseção do tronco comum.
Conflitos de interesseOs autores declaram não haver conflito de interesses.