Os non‐vitamin K antagonist oral anticoagulants (NOAC) foram recentemente comparticipados para a fibrilhação auricular não‐valvular (FA), sendo relevante determinar o seu custo‐efetividade para a realidade portuguesa.
MétodosFoi especificado um modelo Markov para simular a progressão dos doentes com FA no decurso da sua vida. Os dados de efetividade relativa para os eventos acidente vascular cerebral (isquémico e hemorrágico), hemorragia (intracraniana, outras hemorragias major e hemorragias não‐major clinicamente relevantes), enfarte agudo do miocárdio e descontinuação do tratamento foram obtidos por comparações indiretas entre o apixabano, o dabigatrano e o rivaroxabano (comparador comum: varfarina). As fontes dos dados de consumo de recursos de saúde foram a base de dados dos grupos de diagnóstico homogéneo e painel de peritos. Estimou‐se os anos de vida ganhos, anos de vida ajustados pela qualidade (QALY), custos diretos e rácios de custo‐efetividade incremental (ICER).
ResultadosOs anos de vida ganhos e os QALY foram maiores com apixabano, com um ICER versus varfarina e dabigatrano de 5529€/QALY e 9163€/QALY, respetivamente. O apixabano foi dominante versus o rivaroxabano (maiores ganhos em saúde e menores custos). Estes resultados foram robustos nas análises de sensibilidade realizadas, tendo o apixabano uma probabilidade de 70% de ser custo‐efetivo (threshold: 20000€/QALY) versus o conjunto das restantes opções terapêuticas.
ConclusõesA utilização de apixabano em doentes com FA na prática clínica portuguesa é custo‐efetiva versus varfarina e dabigatrano e dominante versus rivaroxabano na perspetiva do SNS. Estas conclusões baseiam‐se em comparações indiretas. Apesar desta limitação, esta informação é relevante para os diferentes decisores em saúde.
Recently, three novel non‐vitamin K antagonist oral anticoagulants received approval for reimbursement in Portugal for patients with non‐valvular atrial fibrillation (AF). It is therefore important to evaluate the relative cost‐effectiveness of these new oral anticoagulants in Portuguese AF patients.
MethodsA Markov model was used to analyze disease progression over a lifetime horizon. Relative efficacy data for stroke (ischemic and hemorrhagic), bleeding (intracranial, other major bleeding and clinically relevant non‐major bleeding), myocardial infarction and treatment discontinuation were obtained by pairwise indirect comparisons between apixaban, dabigatran and rivaroxaban using warfarin as a common comparator. Data on resource use were obtained from the database of diagnosis‐related groups and an expert panel. Model outputs included life years gained, quality‐adjusted life years (QALYs), direct healthcare costs and incremental cost‐effectiveness ratios (ICERs).
ResultsApixaban provided the most life years gained and QALYs. The ICERs of apixaban compared to warfarin and dabigatran were €5529/QALY and €9163/QALY, respectively. Apixaban was dominant over rivaroxaban (greater health gains and lower costs). The results were robust over a wide range of inputs in sensitivity analyses. Apixaban had a 70% probability of being cost‐effective (at a threshold of €20 000/QALY) compared to all the other therapeutic options.
ConclusionsApixaban is a cost‐effective alternative to warfarin and dabigatran and is dominant over rivaroxaban in AF patients from the perspective of the Portuguese national healthcare system. These conclusions are based on indirect comparisons, but despite this limitation, the information is useful for healthcare decision‐makers.
Intervalo de Confiança a 95%
Acidente Vascular Cerebral
Centro Hospitalar Lisboa Central, EPE
Center's median time in therapeutic range
Cardiovascular
Enfarte Agudo do Miocárdio
Embolismo Sistémico
Fibrilhação Auricular não‐valvular
Grupos de Diagnóstico Homogéneos
Gastrointestinal
Hemorragias Clinicamente Relevantes (Não‐Major)
Hospital Fernando da Fonseca, EPE
Hemorragia Intracraniana
Hemorragias Major
Hazard Ratio
Intracraniana
Incremental cost‐effectiveness ratio
Instituto Nacional de Estatística
Rácio normalizado internacional ‐ International normalized ratio
Comparação indireta frequencista ‐ Indirect treatment comparison
Meios complementares de diagnóstico e terapêutica
Escala Rankin modificada
Network Meta‐Analysis
Non‐Vitamin K Antagonist Oral Anticoagulants
Odds Ratio
Proporção de Tempo no Alvo Terapêutico
Quality‐Adjusted Life Years
Risco Relativo
Serviço Nacional de Saúde
95% Confidence Interval
Stroke
Centro Hospitalar Lisboa Central, EPE
Center's median time in therapeutic range
Cardiovascular
Acute Myocardial Infarction
Systemic Embolism
Non valvular atrial fibrillation
Diagnosis Related Groups
Gastrointestinal
Clinically Relevant Non‐Major Bleeding
Hospital Fernando da Fonseca, EPE
Intracranial Bleeding
Major Bleeding
Hazard Ratio
Intracranial
Incremental cost‐effectiveness ratio
National Institute of Statistics
International normalized ratio
Indirect Treatment Comparison
Complementary means of diagnosis and therapeutic
Modified Rankin scale
Network Meta‐Analysis
Non‐Vitamin K Antagonist Oral Anticoagulants
Odds Ratio
Time proportion within therapeutic range
Quality‐Adjusted Life Years
Relative Risk
National Health Service
A fibrilhação auricular (FA) é a arritmia persistente mais prevalente na prática clínica. Em Portugal estima‐se que 2,5% dos indivíduos com mais de 40 anos tenham FA, sendo a prevalência superior a 10% nos indivíduos com mais de 80 anos1. Uma vez que a FA pode ser assintomática e permanecer sem diagnóstico até que ocorra uma complicação (acidente vascular cerebral [AVC] isquémico ou embolia periférica sistémica)2,3, está atualmente recomendado o seu rastreio clínico em todos os doentes com mais de 65 anos. O conhecimento desta condição é essencial para estratificar o risco tromboembólico e decidir sobre a instituição de medicação profilática das complicações tromboembólicas associadas. A anticoagulação oral com antagonistas da vitamina K é a principal intervenção farmacológica utilizada com este objetivo, estando associada a uma redução superior a 50% do risco de AVC em doentes com FA4. Apesar da eficácia verificada em ensaios clínicos, a utilização destes fármacos tem sido consistentemente reportada como subótima5.
Mais recentemente, surgiram novas opções farmacológicas com os mesmos objetivos terapêuticos, nomeadamente os designados novos anticoagulantes orais – non‐vitamin K antagonist oral anticoagulants (NOAC). A sua eficácia é considerada, pelo menos, similar aos antagonistas da vitamina K6, com menor risco de hemorragia intracraniana7 e sem necessidade de controlo laboratorial da hemostase do international normalized ratio (INR). Até à data, foram comparticipados para a FA em Portugal três destes NOAC: apixabano, dabigatrano e rivaroxabano. Estes fármacos são distintos, com mecanismos de ação, características farmacocinéticas e regimes posológicos diferentes que influenciam a opção terapêutica entre eles perante o doente individual, como sejam o grau de disfunção renal, a idade, o risco hemorrágico, a história prévia de doença coronária ou arterial periférica e o risco de AVC.
Apesar do impacto orçamental associado a estes novos medicamentos, os estudos já publicados sobre o custo‐efetividade de dabigatrano e rivaroxabano versus varfarina na FA para a realidade portuguesa indicam que a utilização destas intervenções na prática clínica portuguesa é custo‐efetiva8,9. Desde um de agosto de 2014, estes NOAC foram comparticipados pelo Serviço Nacional de Saúde (SNS) para a prevenção de eventos tromboembólicos em doentes com FA não‐valvular. Neste contexto, é relevante, para os diferentes decisores, conhecer os ganhos em saúde e os custos associados aos diferentes NOAC. O objetivo deste trabalho foi, portanto, estimar o custo‐efetividade dos NOAC, em particular do apixabano (o mais recente NOAC a obter autorização de introdução no mercado) comparativamente a varfarina, dabigatrano e rivaroxabano.
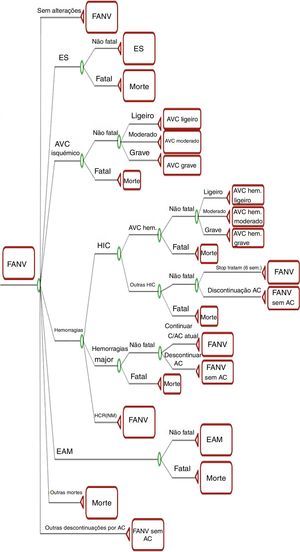
MétodosEstrutura do modeloO modelo de custo‐efetividade e custo‐utilidade é um modelo de Markov, com ciclos de seis semanas (duração mínima expectável em que pode ocorrer alteração dos sintomas ou da patologia) que segue uma coorte de 1000 doentes no horizonte temporal coincidente com o tempo de vida (lifetime). O modelo é programado em Excel com Visual Basic for Applications (Figura 1) e os seus detalhes foram recentemente (2014) publicados por Lip et al.10.
Modelo de Markov: árvore de decisão.
AC: anticoagulantes; AVC: acidente vascular cerebral; EAM: enfarte agudo do miocárdio; ES: embolismo sistémico; FANV: fibrilhação auricular não valvular; FANV sem AC: fibrilhação auricular não valvular; HCR (NM): hemorragias clinicamente relevantes (não‐major); HIC: hemorragia intracraniana. Reproduzido de Lip et al.10.
No modelo, a história natural da doença foi representada de forma simplificada em 11 estadios de saúde mutuamente exclusivos: FA não‐valvular; AVC isquémico não‐fatal ligeiro, moderado e grave; AVC hemorrágico não‐fatal ligeiro, moderado e grave; embolismo sistémico (ES); enfarte agudo do miocárdio (EAM); FA não‐valvular em que foi descontinuada a anticoagulação inicial; e morte. Após um intervalo de seis semanas, um doente poderá transitar para outro estádio de acordo com a respetiva probabilidade de transição. A cada estádio está associada uma probabilidade de ocorrer um evento no intervalo de tempo considerado. O risco de AVC isquémico depende do score CHADS211 – modelo de estratificação de risco tromboembólico utilizado à data da realização dos ensaios clínicos – e do nível de adequabilidade da hipocoagulação para os doentes tratados com varfarina, determinado pela mediana do tempo em que os valores do INR se encontram dentro do intervalo terapêutico. As probabilidades de ocorrência de AVC, EAM, outras hemorragias intracranianas e outras hemorragias major e não‐major aumentam com a idade, refletindo o risco acrescido de ocorrência destes eventos ao longo da vida. O modelo considera também o impacto a longo prazo do EAM e do ES na mortalidade (hazard ratio [HR] mais altos). Caso o doente se encontre no estádio FA não‐valvular, em que se suspendeu a anticoagulação inicial, a estrutura do modelo não se altera, mas as probabilidades de transição variam.
No cenário de ocorrência de um AVC (isquémico ou hemorrágico), a distribuição da gravidade do AVC é feita segundo a escala Rankin modificada (mRS)12: AVC não‐fatal ligeiro (mRS: 0‐2), moderado (mRS: 3‐4) ou grave (mRS: 5) e AVC fatal (mRS: 6). Todos os doentes com AVC fatal transitam para o estádio morte no ciclo seguinte, enquanto os AVC não‐fatais estão modelizados como um estádio «túnel», ou seja, estes doentes podem apenas ter uma recorrência de AVC ou morrer. O modelo permite que cada doente tenha apenas um AVC recorrente. Neste caso, o doente transita para o estádio correspondente ao AVC com gravidade igual ou superior ao primeiro AVC. O modelo não considera possível a recorrência de EAM ou de ES. Nestes casos, o doente poderá apenas manter‐se nesse estádio ou transitar para o estádio morte.
No final de cada intervalo são estimados os custos da doença, os anos de vida ajustados pela qualidade (quality‐adjusted life years [QALY]) e os anos de vida acrescidos. Os níveis de qualidade de vida relacionada com a saúde (utilidades), outcomes clínicos e as taxas de mortalidade variam consoante o grau de gravidade do AVC. Conforme estipulado nas Orientações Metodológicas para Estudos de Avaliação Económica de Medicamentos do Infarmed13, os custos e efetividades foram atualizados à taxa de 5%.
PopulaçãoNo cenário base, a população considerada no modelo corresponde às características dos doentes incluídos nos ensaios com apixabano, mais concretamente no ensaio ARISTOTLE14, em termos de idade média (70 anos), género (64,7% homens) e distribuição dos scores CHADS2 (score 1‐2: 69%; score 3‐4: 27% e score 5‐6: 4%).
ComparadoresNeste estudo, os resultados do tratamento com apixabano 2,5‐5mg, duas vezes por dia, são comparados aos resultados obtidos com: 1) dabigatrano, na dose de 150mg até os 80 anos e na dose de 110mg após os 80 anos, em doentes com risco hemorrágico elevado e nos tratados com verapamilo, ambas dosagens duas vezes por dia. Este grupo será designado como dabigatrano; 2) rivaroxabano 15‐20mg, uma vez por dia.
Efetividade relativa dos non‐vitamin K antagonist oral anticoagulants: comparações indiretasOs estudos de avaliação económica de novas tecnologias em saúde (por exemplo, medicamentos) dependem da efetividade dessas tecnologias e dos custos associados às mesmas, comparativamente às opções existentes. Neste contexto, a estimativa da efetividade relativa dos NOAC é um dos aspetos centrais neste estudo. Até à data, não existem comparações diretas entre os NOAC (ensaios head‐to‐head), pelo que as efetividades na FA têm de ser estimadas com análise de comparação indireta, utilizando um comparador comum (neste caso, a varfarina).
Neste contexto, torna‐se fundamental avaliar a consistência das estimativas da efetividade utilizadas no modelo económico. Para tal, realizámos uma revisão sistemática da literatura para identificar as comparações indiretas publicadas entre os NOAC que disponibilizassem dados de efetividade relativa na FA. Utilizámos os termos meta‐analysis, indirect comparison, bayesian, network, apixaban, dabigatran, rivaroxaban e atrial fibrillation, nas bases de dados MEDLINE e Cochrane Library (setembro de 2014). Identificámos dez comparações indiretas: seis do tipo frequencista10,15–19 e quatro do tipo bayesiano (meta‐análises em rede)6,20–22.
A Tabela 1 mostra as características sumárias de cada uma destas comparações indiretas. Conforme se pode verificar na Figura 2, as estimativas destas publicações para os vários resultados (outcomes) que o modelo considera são consistentes entre si e semelhantes às utilizadas no caso base no modelo económico (Lip et al.10). Dado o objetivo do presente estudo, os dados reportados por Lip et al.10 (comparação indireta frequencista pelo método de Bucher23) e por Mitchell et al.20 (meta‐análise em rede do tipo bayesiano) correspondem provavelmente às melhores estimativas das efetividades relativas entre os três NOAC na FA, por utilizarem apenas os dados dos ensaios clínicos de fase III destes NOAC e por estabelecerem associações utilizando o HR, que tem em conta o fator temporal e respeita a análise estatística primária de cada ensaio. A Figura 3; Suplementar (Anexo) mostra a rede de evidência utilizada por estas duas comparações indiretas.
Características das comparações indiretas publicadas entre os NOAC na FA
| Estudos | Medida de associação | Ensaios clínicos incluídos |
|---|---|---|
| Comparações indiretas frequencistas | ||
| Lip et al.10, 2014 | HR | RE‐LY, ROCKET AF, ARISTOTLE |
| Testa et al.17, 2012 | OR | RE‐LY, ROCKET AF, ARISTOTLE |
| Harenberg et al.16, 2012 | OR | RE‐LY, ROCKET AF, ARISTOTLE |
| Baker et al.15, 2012 | RR | RE‐LY, ROCKET AF, ARISTOTLE, PETRO |
| Lip et al.18, 2012 | HR | RE‐LY, ROCKET AF, ARISTOTLE |
| Meta‐análise em rede (bayesiano) | ||
| Mitchell et al.20, 2013 | HR | RE‐LY, ROCKET AF, ARISTOTLE |
| Assiri et al.22, 2013 | RR | RE‐LY, ROCKET AF, ARISTOTLE, 18 outros RCT |
| Dogliotti et al.6, 2014 | OR | RE‐LY, ROCKET AF, ARISTOTLE, AVERROES, ACTIVE‐W, ACTIVE‐A11 comparações versus placebo |
| Cameron et al.21, 2014 | OR | RE‐LY, ROCKET AF, ARISTOTLE, ARISTOTLE J, ENGAGE AFAVERROES, ACTIVE‐W, ACTIVE‐Acomparações versus placebo |
HR: hazard ratio; OR: odds ratio; RR: risco relativo.
Estimativas de efetividade do apixabano versus outros NOAC nas comparações indiretas publicadas.
A: apixabano; B: meta‐análise em rede bayesiana; D: dabigatrano; ITC: comparação indireta frequencista; R: rivaroxabano. *O estudo RE‐LY apresenta apenas resultados para hemoragias minor, que foram utilizadas como proxy de hemorragias clinicamente relevantes (não‐major).
As taxas de eventos consideradas no cenário base do modelo são aquelas resultantes dos HR reportadas por Lip et al.10 (Tabela 2). A distribuição dos eventos de AVC por gravidade é apresentada no Anexo (Tabela 3; Suplementar).
Hazard ratios (IC 95%): apixabano versus varfarina e outros NOAC
| Apixabano | Varfarina | Dabigatrano 110mg | Dabigatrano 150mg | Rivaroxabano | |
|---|---|---|---|---|---|
| AVC isquémico | 1,00 | 1,09 (0,89; 1,35) | 1,20 (0,88; 1,64) | 0,82 (0,60; 1,14) | 0,98 (0,72; 1,33) |
| Hemorragia intracranianaa | 1,00 | 2,38 (1,72; 3,33) | 0,73 (0,43; 1,26) | 1,02 (0,62; 1,68) | 1,73 (1,08; 2,77) |
| ES | 1,00 | 1,00 (0,90; 1,10)b | 1,00 (0,90; 1,10)b | 1,00 (0,90; 1,10)b | 1,00 (0,90; 1,10)b |
| Outras hemorragias major | 1,00 | 1,27 (1,08; 1,47) | 1,21 (0,97; 1,50) | 1,37 (1,10; 1,71) | 1,44 (1,15; 1,79) |
| Hemorragias clinicamente relevantes (não‐major) | 1,00 | 1,43 (1,24; 1,66) | 1,16 (0,99; 1,35) | 1,30 (1,11; 1,53) | 1,49 (1,26; 1,76) |
| EAM | 1,00 | 1,14 (0,86; 1,52) | 1,47 (0,96; 2,27) | 1,46 (0,95; 2,24) | 0,94 (0,64; 1,38) |
| Outras hospitalizações CV | 1,00 | 1,00 (0,90; 1,10)c | 1,00 (0,90; 1,10)c | 1,00 (0,90; 1,10)c | 1,00 (0,90; 1,10)c |
A hemorragia intracraniana inclui o AVC hemorrágico e outros tipos de hemorragias intracranianas. A proporção de AVC hemorrágico foi de 77, 64, 64, 41 e 57% para apixabano, varfarina, dabigatrano 110mg, dabigatrano 150mg e rivaroxabano, respetivamente, de acordo com a literatura (análise secundária do estudo ARISTOTLE; RE‐LY; ROCKET AF).
Assume‐se igual à apixabano.
AVC: acidente vascular cerebral; EAM: enfarte agudo do miocárdio; ES: embolismo sistémico.
Fonte: Lip et al.10, 2014.
Como mencionado anteriormente, o risco de AVC isquémico e de eventos hemorrágicos associados ao uso de varfarina depende do nível de adequabilidade da hipocoagulação (controlo dos valores de INR) (Tabela 4; Suplementar). O modelo distribui os doentes em quatro categorias, de acordo com vários cut‐offs para o center's median time in therapeutic range (cTTR), conforme resultados obtidos nos vários centros que participaram no ensaio ARISTOTLE. Esta distribuição é uniforme, ou seja, 25% dos doentes em cada categoria.
Para parametrizar o modelo de acordo com a realidade portuguesa, em termos do nível de adequabilidade da hipocoagulação, utilizámos os dados de uma amostra de conveniência proveniente da Consulta de Hipocoagulação do Centro Hospitalar Lisboa Central, EPE (CHLC) e do Hospital Fernando da Fonseca, EPE (HFF). Estes dados referem‐se ao período entre 2011‐2012 e incluem todos os doentes com, pelo menos, dez registos de INR, no total 39630 medições de INR respeitantes a 2850 doentes. Com base nestes dados, foi calculada a mediana da proporção de tempo em que os valores de INR de um doente se encontravam no alvo terapêutico (proporção de tempo no alvo terapêutico [PTAT]). Dado que a informação é limitada a dois hospitais, não é possível estimar a mediana do tempo no alvo terapêutico de vários centros (cTTR), mas apenas a mediana da PTAT dos doentes avaliados nestes dois hospitais. Esta medida foi considerada uma aproximação do cTTR definido no modelo. A robustez dos resultados obtidos a partir desta amostra de base hospitalar foi verificada contra uma amostra com avaliações de INR em unidades de base ambulatória, que incluiu 4470 medições de INR respeitantes a 233 doentes, não tendo sido detetadas diferenças estatisticamente significativas.
Com base nestes dados, verifica‐se que o nível de adequabilidade da hipocoagulação na amostra portuguesa é inferior à considerada no modelo, uma vez que 44,5% dos doentes portugueses têm uma PTAT≥52,38% e no modelo é considerado que 75% dos doentes tinham um cTTR≥52,38% (Tabela 5; Suplementar).
As taxas de descontinuação de tratamento por 100 pessoas/ano devido a causas não vasculares foram obtidas a partir de uma análise secundária dos dados do ensaio ARISTOTLE (13,2% com apixabano e 14,4% com varfarina). Assumiu‐se que as taxas foram constantes ao longo do tempo. A Tabela 6; Suplementar mostra os HR de descontinuação de tratamento por causas não devidas aos eventos vasculares. A segunda linha de tratamento considerada foi ácido acetilsalicílico. Os riscos absolutos associados aos eventos por 100 pessoas/ano são resumidos na Tabela 7; Suplementar.
CustosO estudo adota a perspetiva do SNS. Por conseguinte, não estão incluídos na análise os custos indiretos. Deste modo, o modelo identifica três fontes principais de custos: custos gerados pela ocorrência dos eventos vasculares, custos da terapêutica anticoagulante e custos das consultas de monitorização e/ou de rotina. O custeio baseou‐se: 1) na Portaria n.° 20/2014 de 29 de janeiro24 para efeitos dos preços unitários das consultas, dos meios complementares de diagnóstico e terapêutica (MCDT) e dos grupos de diagnóstico homogéneos (GDH); 2) na análise da base de dados dos internamentos (GDH) no SNS em 201325; 3) na base de dados de medicamentos do Infarmed (Infomed), que disponibiliza informação relativa aos preços dos medicamentos (consultada em dois de janeiro de 2015)26; e 4) nos resultados da consulta de um painel de peritos de várias especialidades com representatividade geográfica, que estimaram os consumos de recursos de saúde em ambulatório. Para os estádios de saúde AVC isquémico e hemorrágico não‐fatais, EAM e ES, os custos foram estimados distinguindo duas fases: aguda e de manutenção a longo prazo. Os consumos imputados à fase aguda incluem as duas primeiras semanas de internamento e a reabilitação ao longo dos primeiros três meses. O modelo assume que a fase de manutenção dura até à morte. De acordo com o painel de peritos, a fase de manutenção inclui custos associados a consultas, episódios de urgência e deslocações, MCDT, medicação e ajudas técnicas. Não foi possível estimar de forma consistente o custo dos AVC em função da sua gravidade (ligeiro, moderado e grave), uma vez que não existem dados de custo por mRS em Portugal. Para os restantes estádios de saúde foram imputados apenas os custos de internamento (fase aguda).
Os resultados dos custos globais por evento, dos custos da terapêutica e dos custos de monitorização e rotina são reportados na Tabela 8.
Custos gerados pela ocorrência dos eventos vasculares, terapêutica anticoagulante e consultas de rotina/monitorização
| Custos | ||
|---|---|---|
| Eventos | Agudos (por episódio) | Longo prazo (por mês) |
| AVC isquémico não fatal (média ponderada) | 8653,26€ | 44,57€ |
| AVC isquémico fatal | 6381,20€ | ‐ |
| AVC hemorrágico não fatal (média ponderada) | 13779,62€ | 41,07€ |
| AVC hemorrágico fatal | 10419,64€ | |
| Outras hemorragias intracranianas | 7932,21€ | ‐ |
| Hemorragias GI | 2798,64€ | ‐ |
| Hemorragias não‐IC e não‐GI | 2090,04€ | ‐ |
| Hemorragias clinicamente relevantes não‐major | 2514,98€ | 42,32€ |
| ES | 3937,93€ | ‐ |
| EAM | 4560,10€ | 53,61€ |
| Outros internamentos por evento cardiovascular | 2081,64€ | ‐ |
| Consulta de rotina/monitorização | |||
|---|---|---|---|
| Medicação | Custo médio diário* | Frequência mensal | Valorb |
| Varfarina | 0,08€ | 0,92a | 31,00€ |
| Apixabano | 2,41€ | 0,33c | 31,00€ |
| Dabigatrano 110mg | 2,36€ | 0,33c | 31,00€ |
| Dabigatrano 150mg | 2,46€ | 0,33c | 31,00€ |
| Rivaroxabano | 2,47€ | 0,33c | 31,00€ |
AVC: acidente vascular cerebral; CHLC: Centro Hospitalar Lisboa Central, EPE; EAM: enfarte agudo do miocárdio; ES: embolismo sistémico; IC: intracranianas; GI: gastrointestinais; HFF: Hospital Fernando da Fonseca, EPE.
Fonte: a base de dados CHLC e HFF; b Portaria GDH 20/201424; c painel de peritos.
As probabilidades de morte associadas aos eventos vasculares considerados no modelo foram aquelas observadas nos ensaios, com exceção da taxa de letalidade do EAM, a qual foi obtida a partir de Scarborough et al.27. O modelo assume que estas probabilidades são independentes do tratamento. Para o período que corresponde à duração do ensaio ARISTOTLE, a taxa de mortalidade por outras causas, que não pelos eventos vasculares considerados no modelo, assumiu‐se igual para todos os NOAC, utilizando‐se o valor do ensaio ARISTOTLE (3,08% para o apixabano e 3,34% para a varfarina). A mortalidade após o período avaliado nos ensaios clínicos foi modelizada com base nas tábuas de mortalidade portuguesas28 e multiplicada pelo HR associado à população com FA estimado por Friberg et al. com o objetivo de ter em conta o risco acrescido da população considerada29. Em particular, foram estimados os parâmetros duma função de sobrevivência Gompertz por faixa etária (<75 anos ou ≥75 anos) e por sexo. O modelo considera fatores de ajustamento do risco de mortalidade para incluir na análise os aumentos das taxas de mortalidade associadas à FA e AVC por grau de gravidade (Tabela 9; Suplementar).
Ponderadores de qualidade de vida relacionada com a saúde – utilidadesOs valores médios de utilidade da população e os decrementos associados aos vários estádios da doença foram considerados iguais aos valores britânicos estimados por Sullivan et al.30 Existem também decrementos de utilidade associados à terapêutica com varfarina31 (contrariamente à terapêutica com NOAC) e à ocorrência de outros eventos vasculares. O modelo assume que estes decrementos podem ser aplicados aditivamente. A Tabela 10 resume as utilidades consideradas e os seus decrementos.
Utilidades médias da população considerada no modelo e os seus decrementos
| Utilidade considerada no modelo para cada estadio da doençaa | |
| FA (utilidade de base) | 0,7270 |
| AVC (isquémicos e hemorrágicos) | |
| Ligeiro | 0,6151 |
| Moderado | 0,5646 |
| Grave | 0,5142 |
| ES | 0,6265 |
| EAM | 0,6098 |
| Decremento da utilidade associado à terapêutica com anticoagulantes e à ocorrência de outros eventos vasculares (duração) | |
| Anticoagulantes | |
| Varfarinab | 0,0130* |
| NOAC | 0,0000* |
| Eventos | |
| Outras hemorragias intracranianas (excluindo AVC hemorrágico) | 0,1511 (seis semanas) |
| Outras hemorragias major (excluindo hemorragias intracranianas) | 0,1511 (14 dias) |
| Hemorragias não‐major clinicamente relevantes | 0,0582 (dois dias) |
| Outros internamentos CV | 0,1276 (seis dias) |
AVC: acidente vascular cerebral; CV: cardiovascular; EAM: enfarte agudo do miocárdio; ES: embolismo sistémico; FA: fibrilhação auricular; NOAC: non‐vitamin K antagonist oral anticoagulants.
Foram realizadas análises de sensibilidade univariadas para verificar a robustez dos resultados em relação aos seguintes parâmetros: 1) utilização dos HR estimados por Mitchell et al.20 (meta‐análise em rede do tipo bayesiano), em vez dos estimados por Lip et al.10; 2) níveis de adequabilidade do controlo de hipocoagulação como verificado nos ensaios, em vez dos valores obtidos em doentes portugueses; 3) duração da fase aguda dos episódios de internamento de seis semanas, em vez de duas semanas; 4) custos de AVC diferentes dependentes do seu nível de gravidade com ponderação calculada a partir das estimativas inglesas, em vez do custo uniforme de AVC para qualquer nível de gravidade; 5) distribuição dos eventos de AVC por gravidade similar para todos os NOAC (assumindo a distribuição do apixabano); 6) taxas de descontinuação do tratamento por outras causas (que não pelos eventos vasculares) igual à do apixabano (13,2%/ano) para todos os comparadores desde o início do tratamento, em vez das taxas de descontinuação reportadas nos ensaios; 7) taxas de mortalidade após o período avaliado no ensaio, iguais às da população em geral, com consequente subestimativas das taxas de mortalidade; 8) utilização de diferentes utilidades associadas a cada estádio (como estimadas na publicação precedente de Sullivan et al.,46 e utilizadas noutros estudos de custo‐efetividade de NOAC32–34); 9) taxa de atualização de custos e utilidades (0 ou 3%, em vez de 5%).
Foi também realizada uma análise probabilística de sensibilidade, utilizando simulações de Monte‐Carlo (2000 simulações) incorporando incerteza de segunda ordem35. Os resultados são apresentados como a probabilidade do apixabano ser custo‐efetivo versus outras opções terapêuticas utilizando um threshold de 20000€ por QALY, limiar habitualmente considerado como aceitável para o financiamento de novas tecnologias de saúde em Portugal.
ResultadosTaxa de eventos e custosA Tabela 11 resume o número de eventos vasculares com cada anticoagulante numa coorte de 100000 doentes conforme as taxas resultantes do modelo. De salientar que o número de eventos vasculares e óbitos relacionados com eventos clínicos é menor com apixabano, exceto no caso de AVC hemorrágico. Esta diferença no número de eventos versus as outras opções terapêuticas é de maior magnitude no caso do AVC isquémico, outras hemorragias major, hemorragias não‐major clinicamente relevantes e óbitos relacionados com eventos clínicos.
Número de eventos em cada opção terapêutica (taxa por 100000 doentes)
| Número de eventos (população total) | Apixabano | Varfarina | Dabigatrano | Rivaroxabano |
|---|---|---|---|---|
| AVC isquémico | ||||
| Não fatal | 19799 | 20703 | 20066 | 19649 |
| Fatal | 2932 | 2857 | 3392 | 3283 |
| Total | 22731 | 23560 | 23458 | 22931 |
| AVC hemorrágico | ||||
| Não fatal | 1602 | 2040 | 996 | 1879 |
| Fatal | 1007 | 2171 | 702 | 938 |
| Total | 2609 | 4212 | 1698 | 2818 |
| ES | ||||
| Não fatal | 2138 | 2175 | 2403 | 2263 |
| Fatal | 221 | 225 | 249 | 234 |
| Total | 2359 | 2400 | 2652 | 2497 |
| Outras hemorragias IC | ||||
| Não fatal | 1063 | 2255 | 1521 | 1901 |
| Fatal | 159 | 337 | 227 | 284 |
| Total | 1221 | 2591 | 1748 | 2185 |
| Outras hemorragias major | ||||
| Hemorragias não fatais GI | 5055 | 5713 | 7501 | 8338 |
| Hemorragias não fatais não‐ IC e não GI | 8137 | 10123 | 8984 | 10802 |
| Fatal | 269 | 326 | 336 | 391 |
| Total | 13461 | 16159 | 16822 | 19530 |
| Hemorragias não‐major clinicamente relevantes | 25248 | 30700 | 29914 | 33367 |
| EAM | ||||
| Não fatal | 7179 | 7345 | 8366 | 7182 |
| Fatal | 1043 | 1067 | 1214 | 1044 |
| Total | 8222 | 8412 | 9579 | 8226 |
| Outras hospitalizações CV | 116048 | 112390 | 117558 | 116738 |
| Outros motivos de descontinuação do tratamento | 63406 | 62408 | 72720 | 66616 |
| Óbitos | ||||
| Relacionados com o evento clínico (agudo) | 5940 | 7332 | 6364 | 6480 |
| Relacionados com o evento clínico (morte devida a AVC, EAM, embolismo sistémico) | 30524 | 32066 | 31694 | 30779 |
| Outros | 63536 | 60602 | 61942 | 62741 |
| Total | 100000 | 100000 | 100000 | 100000 |
AVC: acidente vascular cerebral; CV: cardiovascular; EAM: enfarte agudo do miocárdio; ES: embolismo sistémico; IC: intracranianas; GI: gastrointestinais.
A Tabela 12 e a Figura 4 resumem os custos associados às diferentes opções e a sua estrutura. A terapêutica com varfarina é a opção com menor custo total médio por doente e a terapêutica com rivaroxabano a mais dispendiosa. O custo total médio por doente com apixabano – considerando o horizonte temporal da análise (lifetime) – situa‐se neste intervalo. O apixabano é a opção com menores custos clínicos (dado estar associado a uma menor taxa de eventos vasculares) e com menores custos relacionados com monitorização e cuidados de rotina. Os custos da terapêutica com apixabano ao longo da vida são maiores dada a maior duração de tratamento, a qual, por sua vez, é devida à menor descontinuação da terapêutica. Assim, apesar do custo diário do apixabano ser inferior ao de dabigatrano e rivaroxabano, os custos da terapêutica com apixabano são maiores quando se considera o horizonte temporal coincidente com o tempo de vida.
Custo total médio por doente, com cada opção terapêutica no horizonte temporal coincidente com o tempo de vida (lifetime)
| Custos | Varfarina | Apixabano | Dabigatrano | Rivaroxabano |
|---|---|---|---|---|
| Eventos clínicos | 5467,29€ | 4989,03€ | 5244,03€ | 5386,30€ |
| Terapêutica | 214,42€ | 3754,35€ | 3015,69€ | 3463,96€ |
| Monitorização e cuidados de rotina | 3252,29€ | 1254,77€ | 1311,27€ | 1278,31€ |
| Total | 8934,16€ | 9998,14€ | 9570,99€ | 10128,56€ |
A Tabela 13 e a Figura 5 mostram os resultados da análise de custo‐efetividade de apixabano versus as outras opções terapêuticas. Como sugerido na literatura36,37, no caso das comparações múltiplas, apresentam‐se os resultados num gráfico onde as abcissas representam a diferença de QALY e as ordenadas a diferença de custo entre os comparadores e uma terapêutica de referência (i.e. varfarina). A linha vermelha que une os pontos do gráfico representa a fronteira de eficiência. A fronteira é caracterizada por três traços: a sua inclinação é de 4367€/QALY quando une os pontos representantes da varfarina e de dabigatrano; de 9163€/QALY quando une os pontos de dabigatrano e do apixabano, e é vertical a partir do apixabano porque não existe tecnologia mais efetiva. O rivaroxabano é dominado porque se encontra à esquerda da fronteira de custo‐efetividade (apresentando mais custos e menos QALY que as combinações das alternativas terapêuticas na fronteira). O rivaroxabano é, aliás, dominado pelo apixabano considerado isoladamente.
Resultados de custo‐efetividade no cenário de base: apixabano versus varfarina e outros NOAC
| Apixabano versus | |||
|---|---|---|---|
| Varfarina | Dabigatrano | Rivaroxabano | |
| Custos incrementais | 1063,98€ | 427,15€ | −130,42€ |
| Anos de vida ganhos | 0,19 | 0,05 | 0,04 |
| QALY incrementais | 0,19 | 0,05 | 0,03 |
| ICER | |||
| Custo por ano de vida ganho | 5708,44€ | 7926,91€ | Dominante |
| Custo por QALY ganho | 5529,05€ | 9162,77€ | Dominante |
ICER: rácio de custo‐efetividade incremental; QALY: quality‐adjusted life years.
Efetividade (QALY) e custos incrementais dos NOAC relativamente à varfarina.
NOAC: non‐vitamin K antagonist oral anticoagulants; QALY: quality‐adjusted life years; ICER: incremental cost‐effectiveness ratio.
Este gráfico compara a efetividade (QALY) e os custos incrementais dos NOAC relativamente à varfarina (representada na coordenada 0,0). A linha vermelha representa a fronteira de custo‐efetividade. A sua inclinação em cada segmento corresponde ao ICER entre os pontos definindo esse segmento. Os NOAC com menos QALY incrementais localizam‐se mais à esquerda e os NOAC com maiores custos incrementais localizam‐se mais acima. O apixabano constitui uma opção terapêutica com custos incrementais de 1064€ face aos da varfarina, mas apresenta a maior efetividade comparativamente a todas as alternativas terapêuticas. Os pontos à esquerda da linha são dominados por combinações de terapêuticas mais efectivas que na fronteira. Neste caso, o rivaroxabano é estritamente dominado pelo apixabano, apresentando menos QALY e mais custos.
Os resultados da análise de sensibilidade univariada e probabilística suportam a robustez dos resultados obtidos. Na análise unidimensional para os nove parâmetros antes mencionados, e que refletem um conjunto de cenários alternativos, o apixabano é sempre dominante relativamente ao rivaroxabano. Comparativamente às restantes opções, em oito dos nove cenários considerados, o apixabano apresenta ICER muito inferiores a 20000€/QALY, variando entre 4909 e 6741€/QALY versus varfarina e entre 5162 e 12016€/QALY versus dabigatrano. Quando se assume que as taxas de descontinuação por outras causas são iguais desde o início do tratamento, o apixabano induz custos menores relativamente ao rivaroxabano e ao dabigatrano. Neste cenário, o apixabano é dominante versus rivaroxabano e, para um threshold de 20000 €/QALY, é custo‐efetivo versus varfarina e dabigatrano. Os resultados das análises de sensibilidade são resumidos na Tabela 14; Suplementar).
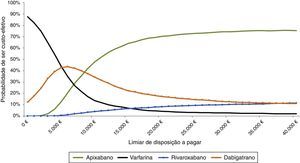
No caso da análise de sensibilidade probabilística, a probabilidade do apixabano ser custo‐efetivo, para um threshold de 20000€/QALY, é de 96, 87 e 95% versus varfarina, dabigatrano e rivaroxabano, respetivamente. Se todos os comparadores forem considerados simultaneamente (Figura 6), o apixabano é a melhor alternativa a partir de um threshold de 8000€/QALY. Neste cenário, para uma disposição a pagar de 20000€/QALY, a probabilidade do apixabano ser custo‐efetivo é de 70%.
Curvas de aceitabilidade.
Este gráfico refere‐se à curva de aceitabilidade, onde para cada valor da disposição a pagar se mostra a percentagem das simulações que são custo‐efetivas para cada tratamento, permitindo uma comparação simultânea entre todas as opções terapêuticas. O apixabano é a melhor alternativa a partir dos 8000€/QALY. Para uma disposição a pagar de 20000€/QALY, a probabilidade do apixabano ser custo‐efetivo face ao conjunto de todas as alternativas é de 70%.
A FA é a arritmia cardíaca persistente mais prevalente1 com um importante impacto social devido à mortalidade e morbilidade geradas, podendo atribuir‐se à FA 3,8% do total das mortes ocorridas em Portugal. Em termos de carga e custos da doença atribuível à FA para a realidade portuguesa, estima‐se que esta seja responsável por cerca de 23000 anos de vida perdidos ajustados pela incapacidade e por custos globais de cerca de 140 milhões de euros (M€), aproximadamente 0,08% do produto interno bruto38. É expectável que este cenário venha a assumir ainda maior importância no futuro, com o aumento da incidência e prevalência da FA devido ao envelhecimento da população e ao aumento da prevalência de doenças cardíacas crónicas, entre outros fatores39. Também o aumento do uso de monitorização eletrocardiográfica ambulatória, traduzindo‐se em mais diagnósticos, contribui para que, neste contexto e no futuro, a FA constitua uma área onde se podem obter ganhos de saúde significativos.
A terapêutica antitrombótica, nomeadamente a anticoagulação, reduz significativamente o risco de eventos clínicos tromboembólicos relacionados com a FA, nomeadamente o de AVC4. Durante várias décadas, existiram poucas opções terapêuticas em termos de anticoagulação destes doentes, sendo a varfarina a terapêutica de referência. Mais recentemente, surgiram no mercado novos anticoagulantes (NOAC). Desde a sua comparticipação pelo SNS, verificou‐se um aumento muito significativo do número de doentes medicados com os NOAC, sendo expectável que a atual fração dos encargos do SNS com medicamentos de ambulatório atribuível aos anticoagulantes (4,5%, que corresponde a uma despesa estimada superior a 50M€ em 2014) venha a aumentar40. Neste contexto, e com o intuito de informar os vários decisores em saúde, é relevante estimar o custo‐efetividade relativo dos NOAC recentemente comparticipados para a prevenção do AVC na FA.
Foram publicados vários estudos de custo‐efetividade onde cada um dos NOAC foi individualmente comparado com varfarina. Sem exceção, os resultados destes estudos, realizados em diferentes realidades, desde Europa aos EUA, mostraram que os NOAC são custo‐efetivos versus varfarina41. No entanto, os resultados de custo‐efetividade destes estudos não podem ser comparados de forma indireta e naïve para avaliar o custo‐efetividade entre NOAC e, certamente, não refletem a realidade portuguesa. Neste contexto, realizámos um estudo de avaliação com base num modelo económico previamente publicado10 que comparou os NOAC entre si, o qual foi parametrizado para a realidade portuguesa.
De acordo com os resultados do presente estudo, o apixabano é custo‐efetivo versus varfarina e dabigatrano (ICER de 5529€/QALY e 9163€/QALY, respetivamente) e dominante versus rivaroxabano. A probabilidade de ser custo‐efetivo, quando comparado simultaneamente com o conjunto das restantes alternativas terapêuticas, é de 70% considerando um threshold de 20000€/QALY. Estes resultados são concordantes com os de outros estudos para outras realidades europeias, como a Bélgica42, a Holanda32, o Reino Unido10,43 e a França44, em que o apixabano foi também custo‐efetivo versus varfarina e custo‐efetivo, ou mesmo dominante, versus dabigatrano e rivaroxabano. O facto do apixabano se apresentar como o NOAC mais custo‐efetivo nestes estudos, deve‐se possivelmente ao melhor perfil de efetividade do apixabano relativamente aos restantes NOAC, o qual poderá ser atribuível a um menor número de eventos vasculares comparativamente às restantes opções terapêuticas, nomeadamente de AVC isquémico10,44,45, hemorragias major20 e mortes relacionadas com eventos vasculares10,20. Uma consequência lógica é que o apixabano apresenta um menor número de descontinuações por eventos vasculares, com os doentes a permanecerem mais tempo em tratamento (com os benefícios associados em termos de prevenção de eventos tromboembólicos). Por outro lado, a menor taxa de descontinuação do tratamento justifica o aumento relativo dos custos totais da terapêutica com apixabano ao longo da vida face aos outros NOAC.
Foram, no entanto, recentemente publicados outros estudos, para a realidade norueguesa33 e para o Reino Unido32,34, cujos resultados diferem dos presentes, no sentido em que dabigatrano foi considerado custo‐efetivo versus apixabano (ambos superiores ao rivaroxabano). Nestes estudos, os QALY incrementais foram 0,2 a 1,3% superiores com dabigatrano versus apixabano, apesar do número de eventos vasculares ser determinado a partir dos mesmos ensaios clínicos considerados no presente estudo.
Vários aspetos metodológicos podem justificar estas diferenças: 1) diferenças na modelização; 2) utilização de diferentes taxas de descontinuação por outras causas; 3) modelização da mortalidade após o período do ensaio; 4) utilização de diferentes valores de utilidade associados a cada estádio (no presente estudo foram estimados com base em Sullivan et al. em 201130, enquanto nos outros estudos foram utilizados os valores reportados pelo mesmo autor em 200646); 5) taxas de atualização diferentes.
Todas as diferenças referidas anteriormente, à exceção da primeira, foram alvo da análise de sensibilidade univariada, a qual confirmou a robustez dos resultados de base obtidos neste estudo. Logo, não é por via de qualquer um destes parâmetros que se podem explicar as diferenças nos resultados. Fica a hipótese de as diferenças entre os estudos assentarem em modelizações distintas.
As diferenças na modelização abarcam várias dimensões, incluindo a especificação de diferentes estádios nos modelos Markov, diferente duração dos ciclos e a especificação de apenas um nível de gravidade para os AVC isquémicos ou hemorrágicos. Outras diferenças nos estudos podem ter origem nos custos. As estimativas destes são influenciadas pelos recursos e especificidades dos cuidados de saúde de cada país, bem como por eventuais diferenças internacionais nos preços dos medicamentos. Averiguar quantitativamente estas questões fica para lá do âmbito do presente estudo.
Alguns estudos sugerem que o custo‐efetividade dos NOAC está dependente do nível de controlo da hipocoagulação, sendo que estas intervenções tenderão a ser mais custo‐efetivas num contexto de pior controlo de hipocoagulação. Em particular, foi estimado que a efetividade de dabigatrano será menor em doentes que se encontram bem controlados47,48. No entanto, nas análises de sensibilidade realizadas para este parâmetro, os resultados não se alteraram marcadamente.
Este estudo apresenta algumas limitações ao nível dos dados utilizados, particularmente os relativos ao número de eventos, uma vez que estes foram retirados de ensaios clínicos com tempos de seguimento curtos (2‐3 anos) e podem não refletir os resultados reais de efetividade de cada anticoagulante. Além disso, na ausência de comparações head‐to‐head entre os NOAC, as efetividades foram estimadas de forma indireta, utilizando a varfarina como comparador comum, não possibilitando, deste modo, o controlo das diferenças nas características de base do doente, no desenho do ensaio clínico, no nível de adequabilidade do controlo da hipocoagulação, ou nos perfis de risco determinados pelo score CHADS2 (apesar de se ter verificado que os resultados de efetividade do apixabano são consistentes na sub‐população com valores médios mais elevados de CHADS2)49. De acordo com a revisão da literatura realizada pelos autores, as estimativas de efetividade utilizadas no estudo são consistentes com os resultados das várias comparações indiretas publicadas, não se tendo verificado alterações nos resultados quando se consideraram outras estimativas de efetividade obtidas por métodos bayesianos20.
ConclusãoNesta análise de custo‐efetividade, baseada em comparações indiretas, o apixabano revelou‐se custo‐efetivo versus a varfarina e dabigatrano, e dominante versus rivaroxabano, em doentes com FA não‐valvular. Estes resultados foram robustos em todas as análises de sensibilidade realizadas. Esta informação é relevante para os diferentes decisores em saúde, de forma a justificar a escolha da opção terapêutica mais adequada perante o doente individual.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
FinanciamentoEste estudo foi financiado pela Bristol‐Myers Squibb Farmacêutica Portuguesa, SA e pelos Laboratórios Pfizer Lda. O financiamento foi concedido independentemente dos resultados a obter. Mónica Inês é colaboradora dos Laboratórios Pfizer Lda.
Conflito de interessesOs autores declaram não haver conflito de interesses.















 AVC: acidente vascular cerebral;
AVC: acidente vascular cerebral;  ITC: comparação indireta frequencista; R: rivaroxabano. *O estudo RE‐LY apresenta apenas resultados para hemoragias minor, que foram utilizadas como proxy de hemorragias clinicamente relevantes (não‐major).'/>
ITC: comparação indireta frequencista; R: rivaroxabano. *O estudo RE‐LY apresenta apenas resultados para hemoragias minor, que foram utilizadas como proxy de hemorragias clinicamente relevantes (não‐major).'/>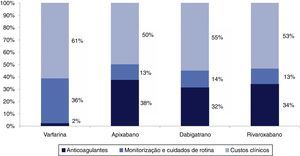
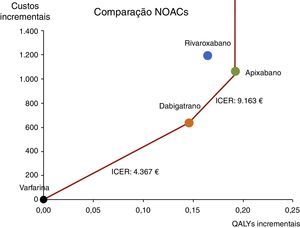 ICER: incremental cost‐effectiveness ratio. Este gráfico compara a efetividade (QALY) e os custos incrementais dos NOAC relativamente à varfarina (representada na coordenada 0,0). A linha vermelha representa a fronteira de custo‐efetividade. A sua inclinação em cada segmento corresponde ao
ICER: incremental cost‐effectiveness ratio. Este gráfico compara a efetividade (QALY) e os custos incrementais dos NOAC relativamente à varfarina (representada na coordenada 0,0). A linha vermelha representa a fronteira de custo‐efetividade. A sua inclinação em cada segmento corresponde ao