A terapêutica antiretroviral (TARV) alterou o paradigma da infeção pelo vírus da imunodeficiência humana (VIH), conhecendo‐se o risco aumentado de doença coronária nestes doentes.
Apresenta‐se o caso de um homem de 57 anos, melanodérmico, com coinfecção VIH‐2/vírus hepatite B, com controlo adequado; diabetes mellitus tipo 2, insulino‐tratado e dislipidemia. Internado por enfarte agudo do miocárdio, sem supradesnivelamento ST. Realizou cateterismo ao 4.° dia de internamento, documentando‐se doença de dois vasos (segmento médio da coronária direita [CD] [90% estenose] e 1.ª obtusa marginal [OM1] com estenose de 95%). Colocaram‐se dois stents revestidos, sem intercorrências. Teve alta sob dupla antiagregação (ácido acetilsalicílico 100mg/dia e clopidogrel 75mg/dia) e restante terapêutica dirigida à doença coronária. Recorreu ao serviço de urgência quatro horas após a alta por pré‐cordialgia com irradiação ao membro superior esquerdo, tendo‐se diagnosticado enfarte agudo do miocárdio com supradesnivelamento do segmento ST nas derivações inferiores. Realizou coronariografia uma hora após o início da dor, que revelou oclusão de ambos os stents. A tomografia de coerência ótica (OCT) revelou boa aposição do stent na CD, trombos intra‐stent e dissecção com início na margem distal do stent. Realizou‐se angioplastia de ambas as artérias, com sucesso.
A trombose aguda dos stents pode ser explicada pelo aumento do potencial trombótico conferido pelo VIH e pela diabetes. Não existem recomendações específicas relativas à TARV na prevenção secundária após síndrome coronário agudo. A abordagem multidisciplinar destes doentes é essencial para a sua orientação adequada.
Highly active antiretroviral therapy (HAART) has created a new paradigm for human immunodeficiency virus (HIV)‐infected patients, but their increased risk for coronary disease is well documented.
We present the case of a 57‐year‐old man, co‐infected with HIV‐2 and hepatitis B virus, adequately controlled and with insulin‐treated type 2 diabetes and dyslipidemia, who was admitted with non‐ST elevation acute myocardial infarction. Coronary angiography performed on day four of hospital stay documented two‐vessel disease (mid segment of the right coronary artery [RCA, 90% stenosis] and the first marginal). Two drug‐eluting stents were successfully implanted. The patient was discharged under dual antiplatelet therapy (aspirin 100 mg/day and clopidogrel 75 mg/day) and standard coronary artery disease medication. He was admitted to the emergency room four hours after discharge with chest pain radiating to the left arm and inferior ST‐segment elevation myocardial infarction was diagnosed. Coronary angiography was performed within one hour and documented thrombosis of both stents. Optical coherence tomography revealed good apposition of the stent in the RCA, with intrastent thrombus. Angioplasty was performed, with a good outcome.
The acute stent thrombosis might be explained by the thrombotic potential of HIV infection and diabetes. There are no specific guidelines regarding HAART in secondary prevention of acute coronary syndromes. A multidisciplinary approach is essential for optimal management of these patients.
A introdução da terapêutica antiretroviral (TARV) possibilitou um declínio exponencial na morbimortalidade dos doentes com infeção por vírus da imunodeficiência humana (VIH)1–4, com o consequente aumento da esperança média de vida destes doentes e da prevalência de doenças crónicas previamente não relacionados com o VIH. Entre estas, salientam‐se as doenças cardiovasculares, hepáticas e neoplasias5–7, pelo que o seu tratamento assume hoje maior relevo nestes doentes.
Está, com efeito, atualmente documentado o maior risco de doença arterial coronária nos doentes com infecção VIH, em comparação com a população geral3,8,9.
A mortalidade atribuída à doença cardiovascular em doentes VIH situa‐se em torno dos 7,9% (40% relativos a doença arterial coronária/enfarte agudo do miocárdio [EAM] e 18% a acidentes vasculares cerebrais), segundo o trabalho realizado pela Antiretroviral Therapy Cohort Collaboration6, que incluiu 39272 doentes de 13 cohorts de doentes medicados com TARV entre 1996‐2006, na Europa e Estados Unidos da América (EUA). O estudo D:A:D7, terminado posteriormente, e que incluiu 49731 doentes seguidos entre 1999‐2011 em clínicas situadas na Europa, EUA e Austrália, documentou uma taxa de mortalidade de 11% por doença cardiovascular.
Existem poucos dados relativos ao risco de eventos adversos cardiovasculares dos doentes com infecção VIH submetidos a intervenções coronárias percutâneas (ICP), no contexto de síndromas coronárias agudas (SCA), com stents revestidos por fármacos. Alguns estudos10–12 documentaram taxas similares em doentes infetados e não infetados.
Os autores reportam o caso de um doente com infecção VIH e diabético que apresentou trombose aguda de dois stents revestidos em duas artérias coronárias distintas, quatro horas após a alta hospitalar, manifestando‐se por EAM com supradesnivelamento do segmento ST.
Pretende‐se apresentar um caso pouco frequente de trombose aguda de stents num doente com infecção VIH, rever a literatura neste domínio e discutir hipóteses que expliquem esta apresentação atípica.
Caso clínicoDoente do sexo masculino, 57 anos, raça negra, natural da Guiné, residente em Portugal desde 1982, astrólogo. História pessoal conhecida de coinfecção VIH‐2/vírus hepatite B (VHB). A infecção VIH‐2 foi diagnosticada em 1997 (cerca de 19 anos antes do internamento), altura em que iniciou tratamento com TARV (desconhecendo‐se a contagem de linfócitos T CD4+ antes do início da terapêutica). O doente manteve seguimento regular e cumprimento da terapêutica. Desde o diagnóstico do VIH, esteve exposto a vários fármacos antiretrovirais, nomeadamente: lamivudina, estavudina, indinavir e abacavir.
A referir controlo habitual da carga viral e contagem de linfócitos T CD4+ desde o diagnóstico, com exceção de um período com duração de um ano (cerca de dois anos antes do internamento), em que apresentou aumento da carga viral (máximo 4500 cópias/mL; apresentando sempre linfócitos T CD4+ com valor controlado).
À data de internamento apresentava‐se medicado com TARV combinada, nomeadamente: tenofovir com emtricitabina (TDF/FTC) 300mg/200mg id; darunavir potenciado com ritonavir (DRV/r) 600mg/100mg bid e raltegravir (RAL) 400mg bid. Apresentava contagens adequadas de linfócitos T CD4+ e carga viral negativa. A infeção VHB foi diagnosticada em 2010 (cerca de seis anos antes do internamento), com seguimento regular e carga viral negativa, sob terapêutica com tenofovir.
Apresentava ainda história de diabetes mellitus tipo 2, diagnosticada 17 anos antes do internamento, insulino‐tratado, sem complicações microvasculares conhecidas e dislipidemia mista (com predomínio de hipertrigliceridemia) diagnosticada 10 anos antes do internamento – analiticamente, na altura do diagnóstico, apresentava doseamento de colesterol total de 205mg/dL, high density lipoprotein cholesterol (c‐HDL) 21mg/dL, low density lipoprotein cholesterol (c‐LDL) 90mg/dL, triglicéridos 265mg/dl, tendo iniciado medicação com fenofibrato 145mg/dia, o qual manteve desde então. Em consulta de seguimento, por persistência de valores elevados de colesterol total e c‐LDL, foi adicionada atorvastatina 20mg à restante terapêutica, cerca de quatro anos antes do internamento.
Não apresentava outros fatores de risco, nomeadamente hábitos tabágicos, consumo de cocaína, hipertensão arterial, obesidade ou história de morte súbita na família.
Encontrava‐se, assim, medicado em ambulatório, para além da TARV previamente descrita, com atorvastatina 20mg, fenofibrato 145mg, pantoprazol 20mg, linagliptina 5mg e insulina insulatard®.
O doente recorreu ao serviço de urgência (SU) por sintomas com início nessa manhã, logo após o levante de toracalgia direita com irradiação cervical, não associada ao esforço e sem fatores de alívio ou agravamento. Negou queixas respiratórias, gastrointestinais, febre ou história de traumatismo. No exame objetivo, na admissão no SU não se documentaram alterações de relevo.
Dos exames complementares destacou‐se: electrocardiograma (ECG) com ritmo sinusal, bloqueio de ramo direito, sem alterações do segmento ST. Analiticamente, salientou‐se: hemoglobina (Hb) 11,5g/dL, Na+ 134mmol/L, K 4,6mmol/L, Cl‐100mmol/L, ureia 56mg/dL, creatinina 1,46mg/dL (taxa de filtração glomerular estimada – segundo a equação da CKD‐EPI ‐ 61mL/min/1,73m2), aumento dos biomarcadores de necrose miocárdica (troponina I de alta sensibilidade foi de 348,5 ug/L na primeira avaliação e de 392,2 ug/L na segunda avaliação [variação 13%]).
Admitiu‐se EAM sem elevação do segmento ST, tendo sido medicado com dose de carga de dupla antiagregação (ácido acetilsalicílico [AAS] e clopidogrel) e decidido internamento. Não apresentou novos episódios de pré‐cordialgia. A destacar evolução descendente dos biomarcadores de necrose miocárdica (de 409,9 ug/L [maior valor] para 78,2 ug/L) e ausência de alterações eletrocardiográficas de novo.
Realizou cateterismo no 4.° dia de internamento, que documentou doença de dois vasos (segmento médio da coronária direita [CD] [90% estenose] e 1.ª obtusa marginal [OM1] com estenose de 95%), tendo sido colocados dois stents revestidos, sem intercorrências.
Manteve estabilidade hemodinâmica, tendo mantido a dupla antiagregação iniciada (AAS 100mg/dia e clopidogrel 75mg/dia) e estatina em alta dose (atorvastatina 40mg). Iniciou ainda bisoprolol e lisinopril durante o internamento. Neste período, foi também administrada toda a medicação antiretroviral com a qual o doente se apresentava medicado em ambulatório.
Do estudo analítico realizado no internamento destacou‐se mau controlo metabólico com hemoglobina glicada de 9,2% (três meses antes apresentava valor de 7,0%) e cargas virais de VHB e VIH‐2 não detetáveis. O perfil lipídico à data de admissão apresentava: colesterol total 142mg/dL, colesterol HDL 18mg/dL, colesterol LDL 52mg/dL (obtido por doseamento directo), triglicéridos 326mg/dL. Realizou‐se estudo de trombofilias, nomeadamente: doseamento da proteína S, proteína C, homocisteína, factor V de Leiden, antitrombina, fator de Von Willebrand. Todos estes parâmetros se encontravam dentro dos valores de referência; a pesquisa de anticorpos antinucleares e anticoagulante lúpico também se apresentou negativa.
O doente teve alta clínica no 11.° dia de internamento, com a medicação descrita, mantendo a terapêutica antiretroviral que cumpria na data de admissão, sem outras intercorrências.
Recorreu novamente ao SU, quatro horas após a alta hospitalar, por pré‐cordialgia com irradiação ao membro superior esquerdo.
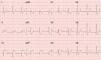
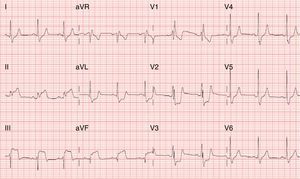
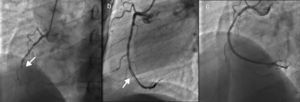
O ECG apresentava ritmo sinusal, bloqueio de ramo direito e supradesnivelamento do segmento ST nas derivações DII, DIII, aVF e infradesnivelamento do segmento ST nas derivações V1‐V3 (Figura 1).
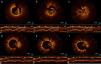
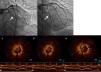
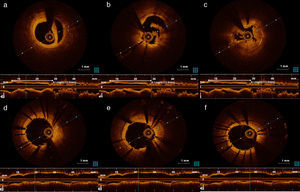
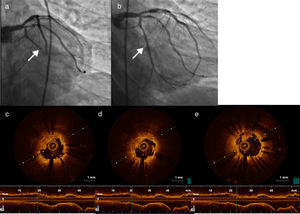
Foi realizada nova coronariografia na primeira hora após o início da dor, que revelou oclusão do stent na CD e do stent na OM1 (Figura 2 ‐ a e b). Para melhor esclarecimento, foi realizada tomografia de coerência ótica (OCT) nas duas artérias. Na CD, a OCT revelou boa aposição do stent, trombos intra‐stent e dissecção com início na margem distal do stent (Figura 3 ‐ a, b e c). Na OM1, a OCT revelou boa aposição do stent, trombos intra‐stent e ausência de dissecção (Figura 4 a, c, d e e). Procedeu‐se, de seguida, a angioplastia do segmento médio da CD, com implantação de stent após aspiração de trombos (Figura 3–d, e e f), e angioplastia de balão na OM1 após aspiração de trombos (Figura 4–b). O resultado final foi bom, tendo sido possível restabelecer o fluxo em ambas as artérias (fluxo TIMI 3). Foi administrada terapêutica com inibidores das glicoproteínas IIb/IIIa (abciximab), devido à elevada carga trombótica.
Após o procedimento, optou‐se por substituir clopidogrel por ticagrelor. Durante o restante internamento o doente não apresentou recorrência de dor ou novas alterações eletrocardiográficas. Teve alta, medicado com ácido acetilsalicílico 100mg id, ticagrelor 90mg bid, bisoprolol 5mg id e lisinopril 20mg id.
Na data de redação do presente caso clínico, o doente apresenta quatro meses de follow‐up, altura em que foi observado em consulta de cardiologia, sem registo de novas complicações isquémicas.
DiscussãoO aumento da esperança média de vida dos doentes com infecção VIH após a introdução da TARV cursou com um aumento da prevalência de alterações metabólicas nestes doentes, o que colocou novos problemas no seu tratamento.
Vírus da imunodeficiência humana e risco cardiovascular – fisiopatologiaNo âmbito da patologia cardiovascular, conhecem‐se vários fatores que contribuem para o aumento da sua incidência no doente com infecção VIH.
Por um lado, a elevada prevalência dos fatores de risco tradicionais nesta população13, destacando‐se, em especial, o tabagismo13,14, baixos níveis de colesterol HDL, hipertrigliceridemia e hipertensão arterial13. Alguns estudos15 reportaram uma incidência de diabetes mellitus em doente com infecção VIH com exposição a TARV, com valores quatro vezes superiores quando comparados com doentes sero‐negativos.
No entanto, contribuem também complexos mecanismos fisiopatológicos relacionados com o vírus, que têm como base a persistência de imunodeficiência, desregulação imune, ativação imune e inflamação associados ao vírus16, incluindo nos doentes medicados com TARV.
A disfunção endotelial, peça‐chave da aterogénese, é o culminar de vários processos que coexistem na presença do vírus VIH, nomeadamente: lesão endotelial direta ou indireta (por via imunológica ou fármacos), destruição de linfócitos T CD4+ (que cursa com aumento de partículas com capacidade para induzir disfunção endotelial) e maior expressão de moléculas de adesão (por estimulação citocínica ou efeito direto do vírus)17,18.
Por conseguinte, perpetua‐se nestes doentes uma cascata inflamatória que culmina no dano vascular e aterosclerose prematura19. Alguns estudos revelaram um aumento relevante de placas não calcificadas, que podem também estar associadas a eventos cardiovasculares20.
Está ainda documentado um risco aumentado de doença arterial coronária nos doentes com infecção VIH em comparação com a população geral, em idade mais precoce3 e com características mais agressivas (maior prevalência de EAM com supradesnivelamento ST e envolvimento multivaso)2.
Adicionalmente, a TARV causa também alterações metabólicas que conferem um risco adicional a estes doentes, nomeadamente síndroma metabólica, caracterizado por dislipidemia com predomínio de hipertrigliceridemia, insulinorresistência, frequentemente associada a distribuição da gordura e lipodistrofia21,22. A TARV contribui, assim, por um lado, para a diminuição do dano endotelial através do controlo da infeção VIH, por outro lado, para a ativação do endotélio através da interferência no metabolismo da glicose e lípidos23.
Analisar a relação entre a TARV e o risco cardiovascular afigura‐se uma tarefa complexa, uma vez que os regimes de TARV combinada recomendados atualmente incluem fármacos de várias classes, o que dificulta retirar conclusões fidedignas. Por outro lado, muitos doentes são medicados com múltiplos regimes ao longo do tempo, seja por falência terapêutica ou por efeitos adversos.
Os dados da coorte D:A:D24, que visou descrever a associação entre a TARV e o risco de EAM, mostraram que, da classe dos inibidores da protease (IP), apenas o indinavir e o lopinavir‐ritonavir apresentaram um aumento significativo do risco de EAM.
Na mesma coorte, entre os análogos não nucleósidos inibidores da transcriptase reversa (NNRTI), apenas o abacavir e a didanosina apresentaram associação significativa entre exposição e risco de EAM. Sobre o abacavir, em particular, incidiram múltiplos estudos, sem resultados consensuais. Alguns reportaram uma associação entre a presença de exposição corrente ou recente ao abacavir (e não cumulativa) e o aumento do risco do EAM25; outros reportaram não existir evidência entre a associação de abacavir e EAM26,27. Não existe, com efeito, nenhum mecanismo biológico confirmado para esta associação, embora vários estudos experimentais tenham sugeridos vários mecanismos potenciais, como a disfunção endotelial, a capacidade de o abacavir induzir inflamação da parede vascular, através do aumento da ligação dos leucócitos à parede vascular, e a potencial capacidade de conduzir à ativação plaquetária28.
Incidência de reenfartes/reestenoses no doente vírus da imunodeficiência humana na fase agudaO prognóstico dos doentes com infecção VIH na fase aguda de SCA foi alvo de análise num pequeno número de trabalhos.
Num estudo conduzido a nível nacional nos EUA entre 1997‐200629, documentou‐se uma taxa de mortalidade hospitalar superior nos doentes com infecção VIH internados por SCA (com e sem supradesnivelamento do segmento ST), embora neste estudo tenham ocorrido disparidades no tratamento oferecido aos diferentes grupos.
Alguns autores consideram que os doentes com infecção VIH submetidos a ICP podem, potencialmente, apresentar incidências elevadas de reenfartes, reestenoses e tromboses de stent, como resultado do estado pró‐trombótico2,30,31, embora poucos estudos o tenham demonstrado: Hsue et al.32 documentaram uma taxa de reestenose mais elevada após ICP (52 versus 14%, p=0,006) em relação ao grupo controlo.
Outros estudos10,11, pelo contrário, documentaram taxas de eventos adversos cardiovasculares similares, em doentes com e sem infeção pelo VIH, submetidos a ICP no contexto de SCA com stents revestidos por fármacos.
Atendendo ao perfil de risco pró‐trombótico aumentado destes doentes33,34, parece‐nos de extrema relevância investigar se existe, efetivamente, uma relação entre a infeção por VIH e o risco de trombose de stent. Da mesma forma, até à data, não existem estudos para avaliar o impacto de terapêuticas mais agressivas para o tratamento dos fatores de risco convencionais nos doentes com infecção VIH para reduzir o risco cardiovascular, o que poderia também ser alvo de estudo. São ainda necessários trabalhos científicos para aprofundar conhecimentos em áreas como a redução do processo de ativação imune, inflamação crónica, redução da viremia residual, avaliar a possível relação entre a terapêutica antiretroviral e a trombose de stents.
Particularidades do caso clínicoNo caso clínico descrito, em particular, apesar de se tratar de um doente com outros fatores de risco cardiovascular, a infeção por VIH parece‐nos preponderante na ocorrência de trombose de stent muito precoce após a alta hospitalar, num doente com a terapêutica de prevenção secundária otimizada.
Uma possível justificação para a trombose de stent na CD seria existir uma eventual dissecção da CD que não tivesse sido visualizada na primeira coronariografia e que, assim, tivesse contribuído para o evento trombótico (uma vez que a OCT revelou boa aposição do stent, trombos intra‐stent e dissecção com início na margem distal do mesmo). No entanto, esta hipótese afigura‐se como muito improvável, na medida em que não explica a trombose dos dois stents em coronárias distintas.
Os fatores encontrados para explicar a trombose aguda de dois stents são, assim, o aumento do potencial trombótico conferido pelo VIH e pela diabetes mellitus.
Relativamente aos fármacos antiplaquetários a utilizar, não existem também recomendações específicas, pelo que, neste caso, a opção de cessar o clopidogrel e iniciar o ticagrelor não foi suportada por evidência científica, mas apenas pela falência da terapêutica prévia. Seria interessante avaliar se os novos inibidores P2Y12 são mais eficazes na prevenção secundária de eventos cardiovasculares nos doentes VIH, permitindo a sua validação como primeira linha terapêutica.
ConclusãoA transição do VIH, de doença com elevada taxa de mortalidade a curto prazo para uma doença crónica, colocou novos e prementes problemas de investigação no âmbito do risco cardiovascular desta população, dado o conhecido perfil de risco que apresenta.
As estratégias atuais de diminuição do risco cardiovascular passam pelo início precoce da TARV e pelo controlo adequado dos fatores de risco cardiovascular tradicionais.
No entanto, este caso clínico alerta‐nos para o facto de que o controlo adequado da infeção VIH e dos fatores de risco tradicionais poderá nem sempre ser suficiente, o que coloca várias questões que carecem ainda de ampla investigação.
A referir, por fim, que a multidisciplinaridade na abordagem destes doentes auxiliará na escolha dos cuidados mais adequados, salientando‐se o papel do cardiologista, infecciologista e internista.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflito de interessesOs autores declaram não haver conflito de interesses.