A endocardite de sondas de pacemaker ocorre raramente após implantação de pacemaker, mas é uma complicação com altas taxas de morbilidade e mortalidade. Os autores descrevem o caso de uma doente de 68 anos, portadora de pacemaker de dupla câmara desde 2007, internada num serviço de medicina interna por espondilodiscite e bacteriemia por Staphylococcus aureus. Durante o internamento, apresentou um episódio de síncope; o eletrocardiograma de 12 derivações apresentava sinais de disfunção de pacemaker, com undersensing e falhas de captura ventricular. Foi submetida a ecocardiogramas transtorácico e transesofágico, que evidenciaram imagens compatíveis com vegetações nas sondas do pacemaker. Após antibioterapia dirigida, desenvolveu quadro de insuficiência renal aguda e posterior falência multiorgânica, acabando por falecer. Este caso alerta para a necessidade um alto índice de suspeição para se efetuar o diagnóstico precoce e o tratamento mais célere desta entidade.
Pacemaker lead endocarditis is an uncommon complication after pacemaker implantation, but is associated with high rates of morbidity and mortality. The authors describe the case of a 68‐year‐old woman with a double‐chamber pacemaker since 2007, admitted to an internal medicine department for spondylodiscitis and Staphylococcus aureus bacteremia. During hospitalization, she had an episode of syncope; the 12‐lead electrocardiogram showed pacemaker malfunction with ventricular undersensing and loss of capture. A transesophageal echocardiogram showed images compatible with vegetations on the pacemaker leads. After antimicrobial therapy, the patient developed acute renal failure with subsequent multiple organ failure and death. A high index of clinical suspicion is required for early diagnosis and appropriate treatment of cardiac device‐related infective endocarditis.
O uso de dispositivos eletrónicos cardiovasculares implantáveis (DECI) melhorou consideravelmente a qualidade e a sobrevida dos doentes1. O uso destes dispositivos aumentou nos últimos anos, devido essencialmente à expansão das suas funções e indicações1–4. Este aumento, juntamente com um número crescente de doentes idosos e com mais comorbilidades1, teve como consequência o aumento das taxas de infeção nos últimos anos5–8. A endocardite relacionada com as sondas de pacemaker é uma complicação infeciosa rara, mas grave9. A incidência descrita na literatura varia de 0,13‐19,9%9,10.
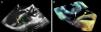
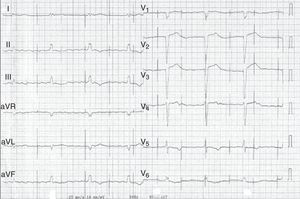
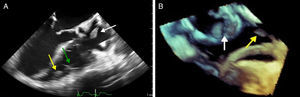
Descrição do casoApresentamos o caso de uma doente de 68 anos, com hipertensão arterial, diabetes mellitus tipo 2 e dislipidemia, admitida num serviço de medicina interna por espondilodiscite em L2/L3. Como antecedentes relevantes, apresentava mastectomia direita por neoplasia maligna há 32 anos, seguida de radioterapia (com pleurisia rádica crónica e duas cirurgias de reconstrução, a última em 2013, com necrose do enxerto e úlcera radiógena da parede anterior do hemitórax direito); enfarte do miocárdio em 2001, com depressão moderada a severa da função sistólica do ventrículo esquerdo e com doença de um vaso, tendo sido efetuada angioplastia da artéria coronária direita, mantendo‐se em classe Ida New York Heart Association; e implantação de pacemaker definitivo por bloqueio auriculoventricular completo, em 2007 (pacemaker de dupla câmara Identity DC, St. Jude Medical), implantado por veia cefálica direita, programado em modo DDD e com pacing ventricular>99%, mantendo‐se sempre em ritmo sinusal. Apresentava história de múltiplas recorrências ao serviço de urgência por lombalgia esquerda nos dois meses anteriores à admissão, com agravamento uma semana antes da admissão, apresentando impotência funcional da marcha, hipertermia (38,2°C) e parâmetros inflamatórios sistémicos elevados, com proteína C reativa de 299,4mg/L e leucocitose de 21400/μL, com 88,9% de neutrófilos. A tomografia axial computorizada da coluna lombar confirmou o diagnóstico de espondilodiscite. As hemoculturas foram positivas para Staphylococcus aureus (S. aureus) meticilino resistente, tendo iniciado antibioterapia com vancomicina e ceftazidima. No 11.° dia de internamento teve síncope atribuída à disfunção do pacemaker (Figura 1), com a impedância da sonda ventricular a manter‐se dentro dos valores normais (397Ω), sendo objetivado undersensing ventricular e falhas de captura ventricular por subida do limiar da sonda ventricular, sendo possível corrigir o sensing e assegurar captura ventricular aumentando a energia do impulso ventricular. O ecocardiograma transtorácico (ETT) mostrou acinesia apical e das paredes inferior e septal, com depressão severa da função sistólica do ventrículo esquerdo e depressão da função sistólica do ventrículo direito, visualizando‐se massas isoecóicas nas sondas do pacemaker; o ecocardiograma transesofágico (ETE) revelou massas móveis na sonda auricular, a maior com dimensões máximas de 20×7mm, compatíveis com vegetações, e massas na dependência da sonda ventricular, uma junto à entrada da veia cava inferior com dimensões de 13×8mm e outra na extremidade da sonda junto ao ápex do ventrículo direito com dimensões de 14×6mm (Figura 2‐A e 2‐B; vídeo 1, 2, 3 e 4), sem imagens sugestivas de vegetações valvulares. Dado o número e dimensão das vegetações, e após discussão com o centro de referência, foi considerado que a extração percutânea não seria exequível, tendo sido apresentado o caso à cirurgia cardíaca. Foi submetida a cateterismo cardíaco para avaliação pré‐operatória, visualizando‐se oclusão crónica, longa, no 1/3 proximal‐médio da artéria coronária direita. Enquanto aguardava cirurgia, a doente desenvolveu insuficiência renal aguda, sem melhoria clínica após ajuste e otimização terapêutica, vindo a falecer por falência multiorgânica.
A: ecocardiograma transesofágico 2D, em incidência de três câmaras (120°), a mostrar vegetações na sonda auricular (seta branca) e na extremidade (seta amarela) da sonda ventricular (seta verde). 2 B: ecocardiograma transesofágico em modo 3D Zoom, plano bicava (120°), a demonstrar múltiplas vegetações na sonda auricular (seta branca) e ventricular (seta amarela).
Este caso descreve uma endocardite de sondas de pacemaker, com provável ponto de partida na disseminação através da úlcera radiógena da parede anterior do hemitórax direito. A endocardite representa cerca de 10% de todas as infeções relacionadas com pacemaker1,11. É uma entidade rara, mas com elevadas taxas de morbilidade e mortalidade9,12.
Diversos estudos têm identificado fatores de risco associados a infeções dos DECI1,2,4,13–16. Entre os fatores relacionados com o doente, a insuficiência renal (definida como taxa de filtração glomerular<60mL/min) constitui a associação mais forte com a infeção destes dispositivos. Diabetes mellitus, insuficiência cardíaca, uso de anticoagulantes orais e utilização prolongada de corticoides são outros dos fatores identificados.
Além destes fatores, as características relacionadas com o procedimento também são importantes para o desenvolvimento de infeções relacionadas com os DECI, principalmente a presença de febre nas 24 horas anteriores ao procedimento, uso de pacemaker provisório e reintervenção precoce17. A experiência do operador é outro fator que está envolvido no risco de infeção.
A repetição de procedimentos cirúrgicos nos sistemas do pacemaker é considerado o principal fator de risco isolado para a endocardite da sonda de pacemaker12,13, embora os resultados de um estudo recente de grandes dimensões (REPLACE Registry)18 tenham demonstrado que a taxa de infeção grave é baixa (0,8%) neste tipo de procedimentos.
O diagnóstico precoce é essencial neste tipo de infeção. O quadro clínico de endocardite de sondas de pacemaker é caracterizado por uma bacteriemia persistente que se origina num foco infecioso localizado nas sondas de pacemaker, na válvula tricúspide ou numa área do endocárdio em contacto com as sondas de pacemaker. A presença de febre, sinais inflamatórios da loca de pacemaker e manifestações sistémicas (como manifestações respiratórias ou reumatológicas) são os sintomas mais comuns, mas a endocardite deve ser considerada em todos os doentes com pacemaker e presença de infeção inexplicável ou refratária ao tratamento inicial9,13. A disfunção do pacemaker, verificada neste caso, é uma manifestação rara desta entidade. Analiticamente, verifica‐se elevação dos parâmetros inflamatórios sistémicos, embora tal achado não seja específico. A apresentação pode ser aguda (até seis semanas após a implantação do pacemaker, o que pode facilitar o diagnóstico) ou crónica (após seis semanas de implantação).
Anteriormente, considerava‐se que a maioria deste tipo de infeção era causada por bactérias da espécie S. aureus na fase aguda e por Staphylococcus epidermidis na fase crónica9,13. As guidelines mais recentes sobre este tipo de infeção, consideram que não existem diferenças clínicas nos agentes patogénicos relativamente ao tempo após a implantação19.
O ETE é considerado a técnica de imagem de escolha quando a suspeita clínica da endocardite de sondas de pacemaker é elevada, uma vez que tem maior sensibilidade (cerca de 90%) em detetar vegetações nas sondas de pacemaker, quando comparado com o ETT, onde há maior dificuldade numa correta visualização da aurícula direita, da veia cava superior e das vegetações1,2,9,12,13. A ecocardiografia em três dimensões (3D) é capaz de demonstrar relações entre as várias estruturas anatómicas e melhor visualização de sondas endocavitárias, sendo menos suscetível aos artefactos associados ao ETE e ETT. A localização precisa das vegetações nos doentes portadores de DECI permite a decisão acerca do tratamento; no entanto, a ausência de vegetações na ecocardiografia 3D não permite excluir totalmente endocardite20. Vários fatores de prognóstico são melhor avaliados com ETT, como a presença de derrame pericárdico, disfunção ventricular e avaliação da pressão sistólica da artéria pulmonar1.
No caso descrito, as manifestações clínicas, juntamente com a presença de bacteriemia para S. aureus e a disfunção do pacemaker, fizeram suspeitar o diagnóstico, confirmado pela realização de um ETE, demonstrando diversas vegetações na sonda auricular e ventricular do pacemaker. A subida do valor do limiar de captura ventricular poderá corresponder à alteração da interface elétrodo/miocárdio, que pode ser atribuído à presença de vegetações, nomeadamente à vegetação localizada na extremidade da sonda ventricular.
Relativamente ao tratamento, a remoção não é necessária caso a infeção seja superficial e não houver envolvimento do DECI, sendo aceitável um ciclo de antibioterapia entre sete e dez dias1. A remoção completa do DECI é o tratamento recomendado quando há uma infeção estabelecida do DECI, independentemente do local da infeção, uma vez que a recorrência nos casos tratados apenas de forma conservadora é alta21–24, apesar de estarem descritos casos em que foi possível o tratamento apenas com tratamento conservador24.
Atualmente, levantam‐se questões acerca do tipo de abordagem para remoção do DECI. Com o desenvolvimento tecnológico dos últimos anos, a remoção percutânea tornou‐se o método de eleição de extração de eletrocateteres. Contudo, este tipo de procedimento só deve ser realizado em centros com vasta experiência e que tenham disponíveis cirurgia cardiotorácica, uma vez que envolve riscos e complicações (com uma ocorrência total estimada inferior a 2%)2, como tamponamento cardíaco, hemotórax ou embolia pulmonar. A toracotomia, como abordagem para remoção do DECI, está limitada aos casos em que não foi possível a remoção percutânea, ou quando há vegetações nas sondas>2cm1, devido ao risco da ocorrência de embolia pulmonar com a remoção percutânea. Neste caso, após apresentação e discussão com o centro de referência, foi excluída a possibilidade de extração do pacemaker e das sondas por via percutânea, sendo decidida a extração cirúrgica, não tendo sido efetuada devido ao desenvolvimento de falência multiorgânica.
A antibioterapia é considerada uma terapêutica adjuvante neste tipo de infeções, uma vez que a completa remoção do DECI não deve ser adiada. Como os agentes responsáveis por este tipo de infeções são, na maioria das vezes, espécies de Staphylococcus (estima‐se que cerca de metade dos doentes com bacteriemia com S. aureus, que têm um DECI, acabam por desenvolver infeção no dispositivo1), sugere‐se uma cobertura antibiótica empírica com vancomicina, devido à possibilidade da resistência à meticilina, até estarem disponíveis os exames microbiológicos1,2,4. Não existem dados para definir a melhor duração da antibioterapia. Os fatores que influenciam esta decisão incluem a extensão da infeção, o micro‐organismo envolvido, a presença e duração da bacteriemia (na presença de bacteriemia é aconselhado prolongar o tratamento antibiótico por via endovenosa durante duas semanas, após a remoção do DECI) e complicações associadas, como envolvimento valvular, trombose venosa ou osteomielite (com a duração da antibioterapia a ser de quatro a seis semanas, neste casos)1. Quando necessário, um novo DECI deve ser implantado no lado contralateral. No caso apresentado, aquando da implantação inicial do pacemaker e durante todo o seguimento, a doente manteve‐se sempre em ritmo sinusal. O ECG após a síncope mostrou flutter auricular com disfunção de pacemaker. Devido ao curto espaço de tempo desde o diagnóstico até ao falecimento da doente, não sabemos como a doente iria evoluir relativamente ao ritmo, mas temos como base uma alteração da condução elétrica, sendo, o mais provável, a implantação de novo pacemaker caso fosse efetuado o tratamento definido.
Apesar do timing ideal da implantação do novo dispositivo permanecer indefinido, é geralmente aceite que se deve aguardar que as hemoculturas sejam negativas, em doentes com hemoculturas previamente positivas, e que a infeção da loca esteja controlada. Alguns autores4 defendem três momentos para remoção do DECI: urgente (remoção imediata), precoce (após um curto período de antibioterapia) e adiada (após quatro a oito semanas de antibioterapia para tratar a infeção e reduzir o tamanho da vegetação, quando existe).
A taxa de mortalidade desta infeção é altamente variável, mas tende a ser mais alta nos doentes tratados de forma conservadora, embora não estejam disponíveis estimativas precisas, devido à heterogeneidade dos estudos11,25–27,22,28.
ConclusãoApesar da endocardite de sondas de pacemaker ser uma complicação rara, a ocorrência de febre e/ou de bacteriemia, num doente portador de pacemaker ou outros DECI, deverá levantar a suspeita e, desse modo, permitir um diagnóstico precoce. O ecocardiograma, preferencialmente transesofágico, é essencial para o diagnóstico de endocardite, sendo que a ecocardiografia 3D parece ter um valor adicional ao localizar, de forma mais precisa, as vegetações em dispositivos protésicos, com potencial determinante nas ações terapêuticas. Este caso, pela sua apresentação clínica, alerta‐nos para esta rara possibilidade diagnóstica. O tratamento deve consistir na remoção do pacemaker e das sondas, por via percutânea ou cirúrgica, e antibioterapia apropriada.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflito de interessesOs autores declaram não haver conflito de interesses.