A dissecção aórtica aguda é a síndrome aórtica aguda mais frequente, ocorrendo predominantemente no sexo masculino e em idosos, estando associada a uma elevada mortalidade. Existem vários fatores de risco, destacando a hipertensão arterial. O diagnóstico é feito com base na clínica, exames laboratoriais e imagiológicos. A terapêutica habitual baseia‐se na abordagem cirúrgica, existindo em alguns casos a alternativa do tratamento endovascular. O paraganglioma é um tumor neuroendócrino raro. A maioria produz catecolaminas e manifesta‐se frequentemente por crises hipertensivas, palpitações, cefaleias e hipersudorese. O diagnóstico deste tumor passa pelo doseamento de catecolaminas urinárias e séricas, e pela realização de TC toracoabdominopélvica, ressonância magnética ou cintigrafia com 123MIBG. O tratamento cirúrgico é o único tratamento potencialmente curativo. Neste artigo, descreve‐se um caso clínico de uma doente com uma dissecção aórtica do tipo A, associada a um paraganglioma. Esta associação é extremamente rara e a abordagem de ambas as patologias constitui um desafio.
Acute aortic dissection is the most common acute aortic syndrome. It is more prevalent in males and in the elderly, and has a high mortality. Hypertension is the main risk factor. Diagnosis is based on clinical features, laboratory tests and imaging exams. Treatment is usually surgical, although in some cases an endovascular approach is an alternative.
Paraganglioma is an uncommon neuroendocrine tumor. Most produce catecholamines, and so usually manifest with hypertensive crisis, palpitations, headache and sweating. This tumor is diagnosed by measurement of plasma or urinary catecholamines and by computed tomography, magnetic resonance imaging and 123I‐metaiodobenzylguanidine (MIBG) scintigraphy. Surgery is the only potentially curative treatment.
A dissecção aórtica aguda e o paraganglioma são ambas patologias raras. A dissecção aórtica aguda define‐se como uma laceração da camada íntima, ocorrendo a passagem de sangue do lúmen aórtico para a camada média formando um falso lúmen1. O paraganglioma é um tumor com origem nas células cromafins, de localização extra‐adrenal, produtores ou não de catecolaminas2. O paraganglioma é uma das causas secundárias de hipertensão arterial (HTA), fator de risco para a ocorrência de dissecção aórtica.
Expomos de seguida um caso clínico de uma doente com um paraganglioma e dissecção aórtica tipo A, salientando a importância desta associação rara.
Caso clínicoDoente de sexo feminino, 49 anos, raça negra, natural de África, residente em Portugal há 12 anos e com antecedentes pessoais de HTA e hipertiroidismo. Iniciou no dia 20 de maio de 2010 um quadro de cefaleias, tendo‐se automedicado com nebivolol e bioflavonoides. Posteriormente, iniciou um quadro de dor retrosternal sem fatores de alívio, pelo que se dirigiu ao serviço de urgência de outra instituição. Já no hospital, a doente refere dois episódios de vómitos e dois episódios de hemoptises. À observação, apresentava‐se vígil, colaborante e orientada no tempo e no espaço, hipertensa (200/140mmHg) e com frequência cardíaca (FC) de 87bpm. O restante exame objetivo não apresentava alterações significativas.
Laboratorialmente, destacou‐se anemia microcítica hipocrómica, leucocitose (leucócitos 16200Ul), trombocitopenia (plaquetas 141/L), aumento dos D‐dímeros (8,01ug/mL), LDH (1032U/L), AST (60U/L) e PCR (2,4mg/dL) e troponina I negativa (0,016ng/mL).
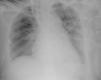
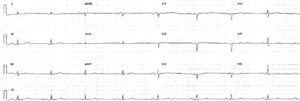
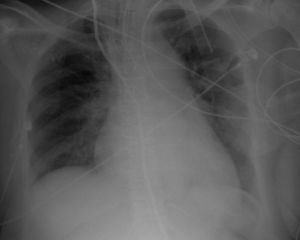
O eletrocardiograma (ECG) (Figura 1) não mostrou alterações significativas a radiografia do tórax (Figura 2) revelou reforço do retículo pulmonar, e alargamento da silhueta cardíaca e do mediastino.
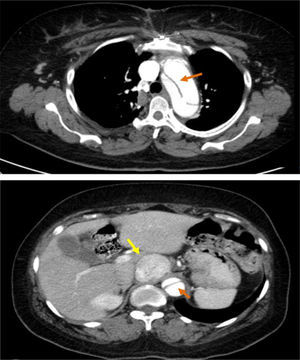
Tendo em conta estes achados, foi realizada angio tomografia computorizada (TC) toracoabdominal urgente que documentou disseção aneurismática da aorta, estendendo‐se desde a raiz até à ilíaca primitiva direita; densificação da gordura do mediastino, sem imagens sugestivas de hemorragia recente; formação nodular sólida heterogénea com cerca de 45mm de diâmetro em topografia latero‐aórtica direita, a nível da emergência do tronco celíaco e em íntimo contacto com a veia cava inferior, que desvia anteriormente a artéria hepática e desvia e comprime lateralmente a veia cava inferior; dilatação do segmento proximal da veia cava inferior com lúmen heterogéneo até à convergência das veias renais, em provável relação com trombose.
A doente foi posteriormente transferida para o serviço de cirurgia cardiotorácica da nossa instituição, tendo sido submetida a cirurgia urgente de substituição da aorta ascendente, com implantação de prótese vascular tubular Uni‐Graft 26mm. No pós‐operatório, apresentou crises hipertensivas paroxísticas, pelo que iniciou perfusão de labetalol e, posteriormente, α e β‐bloqueante oral. Para esclarecimento da situação clínica, realizou vários exames complementares de diagnóstico, nomeadamente:
- •
Análises laboratoriais, nas quais se destacou um aumento dos valores de noradrenalina (365,7ug/24h), normetanefrinas (4268,5ug/24h) e ácido vanilmandélico (19,9mg/24h) na urina de 24h, e valores normais de dopamina (178,1ug/24h), metanefrina (264,2ug/24h), ácido 5‐hidroxindolacético (3,3mg/24h) e ácido homovanílico (4,72mg/24h).
- •
Cintigrafia com metaiodobenzilguanidina (MIBG), que mostrou fixação do radiofármaco de grande intensidade no andar superior do abdómen, em situação mediana/paramediana direita, em localização correspondente à formação nodular identificada por TC.
- •
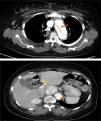
TC toracoabdominopélvica, que revelou disseção da aorta a jusante da prótese, que se estende para a aorta abdominal até à artéria ilíaca primitiva direita, sem envolvimento dos troncos supra‐aórticos e com perfusão simultânea do verdadeiro e falso lúmen; formação nodular sólida hipercaptante e ligeiramente heterogénea, bem circunscrita e com 4,5cm de maior diâmetro em topografia interaortocava e ao nível da emergência do tronco celíaco (Figura 3).
- •
Registo de Holter e monitorização ambulatória da pressão arterial, que não mostraram alterações relevantes.
- •
Ecocardiograma transtorácico, que evidenciou ventrículo esquerdo com hipertrofia concêntrica e função sistólica global conservada; prótese tubular na aorta ascendente; regurgitação aórtica ligeira.
Na sequência dos exames realizados, foi referenciada à cirurgia geral, tendo sido submetida a laparoscopia para excisão da lesão, sob anestesia geral. A cirurgia e o pós‐operatório decorreram sem intercorrências e com manutenção dos valores tensionais dentro da normalidade.
DiscussãoA doença cardiovascular é a principal causa de morte em todo o mundo1. As síndromes aórticas agudas, como a dissecção da aorta, úlcera aterosclerótica penetrante e o hematoma intramural, são situações emergentes que envolvem a aorta com características clínicas e tratamento semelhantes1,3–5. A dissecção aórtica aguda consiste numa laceração da camada íntima, com passagem de sangue do lúmen aórtico para a camada média e formação de um falso lúmen, podendo progredir no sentido anterógrado ou retrógrado, e envolver ramos colaterais. A presença de sangue entre a camada íntima e média causa uma resposta inflamatória, que pode evoluir para dilatação e rutura1,3–5.
A dissecção aórtica classifica‐se como aguda quando apresenta uma evolução até 14 dias, como subaguda entre 14‐90 dias e crónica quando se estabeleceu há mais de 90 dias4. Também podemos classificá‐la com base no envolvimento (tipo A) ou não (tipo B) da aorta ascendente através do sistema de Stanford, que veio substituir o sistema de DeBakey5,6.
Segundo o Oxford Vascular Study, a incidência da dissecção aórtica aguda é de 6/100000 pessoas por ano, com uma maior frequência de dissecção do tipo A em relação ao tipo B7. A incidência é maior no sexo masculino do que no sexo feminino (1,5:1) e aumenta com a idade7. Também se verificou um maior número de casos durante os meses de inverno5. O prognóstico é pior nas mulheres por terem apresentações atípicas, o que leva a um atraso no diagnóstico4.
Esta patologia está associada a uma elevada morbilidade e mortalidade. Nos doentes não tratados, a taxa de mortalidade excede os 75% em duas semanas3. No Oxford Vascular Study, as taxas de mortalidade para a disseção aórtica aguda tipo A (73,0% aos 30 dias; 76,8% ao fim de cinco anos) foram maiores em comparação com a disseção aórtica aguda tipo B (13,3% aos 30 dias; 33,3% ao fim de cinco anos)7.
O principal fator de risco para dissecção aórtica é a HTA, estando presente em 65‐75% dos casos, a grande maioria não controlada4,6. Existem ainda outros fatores de risco, nomeadamente: a idade avançada (maior risco na 6.ª‐7.ª décadas de vida); sexo masculino; aterosclerose; tabagismo (presente em 61,5% dos casos)7; consumo de drogas endovenosas (cocaína, anfetaminas); realização da manobra de Valsava; cirurgia cardíaca prévia; traumatismo torácico agudo direto; gravidez, principalmente no terceiro trimestre, ou puerpério (por alterações do tecido conjuntivo de origem hormonal); doenças congénitas, tais como síndrome de Marfan, síndrome de Ehlers‐Danlos tipo IV, síndrome de Loeys‐Dietz, síndrome de Turner, síndrome de Noonan, coartação da aorta, válvula aórtica bicúspide ou doença renal poliquística; história familiar de doença aórtica; processos inflamatórios como a arterite de Takayasu, doença de Behçet, artrite reumatoide e arterite das células gigantes; e doenças neuroendócrinas ou autoimunes, nomeadamente feocromocitoma, lúpus eritematoso sistémico e espondilite anquilosante1,3–6.
Habitualmente, os doentes apresentam um quadro de dor súbita, muito intensa, tipo «facada», pulsátil e migratória que pode irradiar para o pescoço ou mandíbula, localizada na região torácica anterior em 80% dos casos, na região dorsal em 40% dos casos e na região abdominal em 25% dos casos4. Esta dor é muitas vezes confundida com uma síndrome coronária aguda, mas não alivia com a administração de nitratos ou de analgésicos não opioides6. Contudo, a apresentação clínica é muito variável, desde hipertensão ou hipotensão arterial, sopro de regurgitação aórtica, diminuição de pulsos, síncope por tamponamento cardíaco ou envolvimento dos vasos supra‐aórticos, até achados menos frequentes como ausência de sintomas em 4‐5% dos casos, dor abdominal, défices neurológicos, síndrome de Horner, paralisia das cordas vocais, insuficiência cardíaca, derrame pleural, insuficiência renal1–4,8.
O diagnóstico da disseção aórtica aguda é feito com base na história clínica, no exame objetivo e em exames complementares de diagnóstico.
O ECG apresenta, na grande maioria, alterações inespecíficas, enquanto a radiografia do tórax é anormal em 80% dos casos, apresentando alargamento do mediastino3,9.
O diagnóstico é confirmado através dos meios imagiológicos, nomeadamente, a TC, a ressonância magnética (RM), a ecocardiografia e, menos frequentemente, a aortografia1,6. A TC com contraste endovenoso é a técnica imagiológica mais usada, com uma sensibilidade de 95% e uma especificidade entre 85‐100% 1,4.
Relativamente à terapêutica, os doentes devem iniciar tratamento médico com o objetivo de controlar FC, a pressão arterial e os sintomas, e manter uma perfusão adequada dos órgãos. Os agentes de primeira linha são β‐bloqueantes e, em caso de intolerância ou contraindicação, podemos recorrer aos antagonistas dos canais de cálcio não‐dihidropiridínicos. Quando não se consegue atingir um controlo da pressão arterial com os β‐bloqueantes, recorre‐se aos vasodilatadores, tais como o nitroprussiato de sódio e nitroglicerina; no entanto, só devem ser administrados após o controlo da FC. É importante, ainda, controlar a dor com opiáceos e a ansiedade com benzodiazepinas1,3,6.
Nos casos de dissecção aórtica aguda do tipo A, o tratamento de eleição é cirúrgico, reduzindo a mortalidade no primeiro mês de 90 para 30%4.
Na disseção aórtica do tipo B não complicada, o doente pode ser estabilizado com segurança apenas com o tratamento médico. Nos casos complicados, o tratamento de eleição é a reparação endovascular da aorta torácica (TEVAR)3,4.
O seguimento destes doentes com disseção aórtica é fundamental e passa pelo controlo rigoroso da pressão arterial e realização de exames imagiológicos sete dias após a dissecção, e, posteriormente, às seis semanas, aos três meses, seis meses e 12 meses após a alta hospitalar. Após o primeiro ano, a monitorização é feita de 12 em 12 meses1,6.
O paraganglioma é um tumor neuroendócrino, com origem nas células cromafins dos gânglios simpáticos e parassimpáticos produtores de catecolaminas, e distingue‐se dos feocromocitomas pela sua localização extra‐adrenal. Cerca de 70% destes tumores localizam‐se na cabeça e pescoço, 20% na região abdominopélvica e 10% no tórax, envolvendo o mediastino posterior, os gânglios simpáticos para‐aórticos ou o coração, mais frequentemente a aurícula esquerda. Os paragangliomas são classificados como funcionantes ou não funcionantes com base no potencial de secreção de catecolaminas. Os tumores dos gânglios parassimpáticos encontram‐se quase exclusivamente no pescoço e base do crânio, a nível do corpo carotídeo, e geralmente são tumores não funcionantes. Os tumores com origem nos gânglios simpáticos encontram‐se a qualquer nível do tronco simpático, mas com predomínio intra‐abdominal e, na grande maioria, são produtores de catecolaminas2,10–14.
Este é um tumor raro, com uma incidência de 1/300000 pessoas por ano15,16 e uma prevalência de 2‐8 milhões de doentes por ano. A idade média de diagnóstico é 40 anos e cerca de 0,1‐0,6% têm HTA16,17.
A apresentação clínica é muito variável. Destacam‐se a HTA (90%), cefaleias (80%), hipersudorese (71%), palpitações (64%), palidez (42%), taquicardia e ansiedade. A tríade clássica de palpitações, cefaleias e hipersudorese associadas a HTA tem uma especificidade superior a 90%. A febre, náuseas e rubor são menos frequentes. Os paragangliomas não funcionantes apresentam‐se com manifestações clínicas devidas ao efeito de massa, nomeadamente massa cervical (29%), acufenos (23%), hipoacusia (21%) e disfonia (15%)12. O exame objetivo, para além da HTA, geralmente é normal11.
Em 75% dos doentes as crises hipertensivas paroxísticas ocorrem semanalmente, e podem ser precipitadas por anestesia, manipulação do tumor (durante cirurgia, palpação ou biópsia), realização de esforços, ingestão de certos alimentos e uso de medicamentos (nomeadamente corticosteroides, histaminas, metoclopramida, fenotiazida ou antidepressivos tricíclicos)11. Em 5‐30% dos casos são assintomáticos, sendo importante a realização de monitorização ambulatória da pressão arterial para excluir HTA. Os doentes com tumores produtores de dopamina podem ser normotensos ou apresentarem hipotensão ortostática10,11,13,16. Os paragangliomas podem ainda originar complicações potencialmente fatais, como insuficiência cardíaca, enfarte do miocárdio, disritmias ou acidente vascular cerebral17.
Para o diagnóstico de paraganglioma, inicialmente, é necessário realizar o doseamento de catecolaminas séricas e urinárias, ácido vanilmandélico urinário, e metanefrinas (produto O‐metilado) séricas e urinárias. A metanefrina sérica apresenta uma sensibilidade superior em relação aos outros testes (97 versus 74%), mas a especificidade é idêntica2,13,18.
Na presença de testes bioquímicos suspeitos, devem realizar‐se exames imagiológicos para confirmar o diagnóstico e localizar o tumor. A TC toracoabdominopélvica com ou sem contraste é o exame de primeira linha para a localização do tumor, com uma sensibilidade entre 88‐100%. A RM está indicada para doentes com doença metastática, deteção de paraganglioma da cabeça e pescoço, doentes com alergia ao contraste e para evitar a exposição à radiação. A ecografia não é recomendada pela sua baixa sensibilidade2,13.
Para aumentar a especificidade do diagnóstico, podemos recorrer a técnicas funcionais, nomeadamente à cintigrafia com 123‐MIBG (123MIBG), com uma sensibilidade e especificidade para o paraganglioma de 56‐75% e 84‐100%, respetivamente2. É útil na doença extra‐adrenal, tumores com dimensões superiores a 5cm, doença multifocal e em casos de malignidade13. Em doentes com doença metastática é preferível realizar uma tomografia por emissão de positrões (PET) com 18F‐fluorodesoxiglucose, comparativamente à cintigrafia com 123MIBG2, no entanto este exame não deve ser realizado para o diagnóstico inicial13. Outros compostos que poderão ser úteis para o diagnóstico são a 18F‐fluorodopamina, a 18F‐fluorodopa e a 11C‐hidroxiefedrina13.
O controlo da HTA é conseguido com a administração de bloqueadores α‐adrenérgicos e β‐adrenérgicos associados. Devem evitar‐se os β‐bloqueantes isolados, pelo risco de desencadear uma crise hipertensiva por agravamento da vasoconstrição. Os bloqueadores dos canais de cálcio são usados como segunda linha. Nos casos de HTA resistente ao tratamento convencional, pode ainda administrar‐se sulfato de magnésio11.
O tratamento cirúrgico é o único tratamento potencialmente curativo2,13,17,19. No entanto, a cirurgia estimula a secreção de catecolaminas, causando complicações que podem ser fatais13. Assim, para que esta seja segura, é necessário realizar um tratamento pré‐operatório que consiste na administração de bloqueador α‐adrenérgico durante 10‐14 dias e, após o bloqueio α adequado, β‐bloqueantes 2‐5 dias antes da cirurgia. Como esquema alternativo, temos os bloqueadores dos canais de cálcio ou labetalol (α e β‐bloqueante). O tratamento deve ainda incluir dieta rica em sódio e ingestão abundante de líquidos, para evitar hipotensão grave após a remoção do tumor2,11,13.
No pós‐operatório, as principais complicações são a hipotensão e a hipoglicemia. É importante reduzir lentamente os anti‐hipertensores, de forma a estabilizar os valores da pressão arterial2,17.
Em casos de doença incurável, como tumores muito grandes e doença metastática, as opções terapêuticas são a quimioterapia e radioterapia. A terapia molecular, com o sunitinib, inibidor da tirosina quinase, constitui uma opção terapêutica futura19.
Para avaliar se houve remoção completa do tumor, os testes bioquímicos devem ser repetidos 2‐4 semanas após a cirurgia2. Estes doentes devem ser acompanhados, indefinidamente, com a medição da pressão arterial e doseamento das catecolaminas urinárias e séricas2,13,17.
Uma das complicações graves do feocromocitoma/paraganglioma é a dissecção da aorta20,21. Este tumor, ao produzir catecolaminas, induz um aumento da pressão arterial e, consequentemente, aumenta o stress na parede da aorta, o que pode levar à dissecção aórtica aguda.
O caso relatado deste trabalho é bastante relevante pela raridade da associação de ambas as patologias. Existem poucos casos descritos na literatura. O primeiro caso de um doente com aneurisma dissecante da aorta e feocromocitoma foi relatado, em 1975, por Triplett e Atuk22. Azizi et al. também descreveram um caso concomitante de dissecção tipo A e feocromocitoma22. Existem outros casos de associação de feocromocitoma, aneurisma dissecante da aorta abdominal e dissecção da artéria carótida21.
Um dos principais problemas desta associação é o tratamento destas duas patologias. A dissecção aórtica é uma emergência cirúrgica, com uma elevada taxa de mortalidade se não tratada. No entanto, a presença concomitante de feocromocitoma/paraganglioma dificulta a indução anestésica e aumenta o risco cirúrgico. Assim, é importante que haja uma intervenção multidisciplinar nestes casos22.
No presente caso clínico, conseguiu‐se corrigir a disseção de uma forma muito rápida, sem consequências relacionadas com o paraganglioma, e posteriormente, após o bloqueio α e β, foi possível remover o tumor na ausência de complicações.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflito de interessesOs autores declaram não haver conflito de interesses.