O 5‐flurouracilo é um agente de primeira linha no tratamento de várias neoplasias. Associa‐se frequentemente a toxicidade cardíaca, particularmente em doentes com doença coronária. O caso apresentado ilustra uma síndrome coronária aguda presumivelmente precipitada por 5‐FU, num doente com doença coronária previamente assintomática e desconhecida e com risco estimado de eventos cardiovasculares de nível intermédio. A avaliação de risco pré‐quimioterapia e a melhor abordagem para a prevenção e manejo desse cenário clínico permanecem por definir.
5-Fluorouracil is a first‐line agent in several cancer‐therapy regimens. Cardiotoxicity is common, with coronary artery disease being an important risk factor. We report the case of an acute coronary syndrome presumably induced by 5‐FU, in a patient with previously unknown and asymptomatic coronary artery disease, with an estimated intermediate risk for cardiovascular events. Pre‐chemotherapy risk evaluation and optimal patient care are still not standardized in this clinical scenario.
As fluoropirimidinas incluem o 5‐fluorouracilo (5‐FU), de administração endovenosa, e a capecitabina, um pró‐fármaco de administração oral que é posteriormente metabolizado em 5‐FU. São antimetabolitos que inibem a timidilato sintase e impedem a síntese de nucleótidos essenciais para a sobrevivência celular, sobretudo em tecidos neoplásicos. Enquanto grupo, as fluoropirimidinas ocupam um lugar importante na terapêutica oncológica, é o terceiro grupo farmacológico mais usado1,2.
A prevalência de cardiotoxicidade associada ao 5‐FU reportada situa‐se entre 1,4% e 4% da população global tratada3,4 e entre 5% e 15% em doentes com doença coronária estabelecida5,6. Contudo, taxas de incidência de síndrome coronária aguda de 22% a 36% foram também descritas em estudos observacionais de menor dimensão1,7. A toxicidade cardíaca pode manifestar‐se sob a forma de síndrome coronária aguda, angina, disseção coronária, miocardiopatia, arritmias malignas e morte súbita8. A taxa de mortalidade associada à cardiotoxicidade não é negligenciável, varia consoante os autores entre 2,29 e 18%8, as taxas mais elevadas são observadas aquando da reexposição ao fármaco.
A avaliação do risco de candidatos a tratamento com 5‐FU, assim como a abordagem subsequente, não está padronizada. Apresenta‐se o caso de um doente com síndrome coronária aguda após início de tratamento com 5‐FU.
Relato de casoHomem de 60 anos, ex‐fumador (abstinência havia sete anos), hipertenso, com dislipidemia e antecedentes de adenocarcinoma do cólon havia sete anos. Atualmente com diagnóstico recente de adenocarcinoma do duodeno em estádio avançado. Medicado habitualmente com perindopril 5mg/dia, ácido acetilsalicílico 100mg/dia e pitavastatina 2mg/dia, em contexto de prevenção primária dada a ausência de antecedentes de patologia aterosclerótica documentada em qualquer território vascular. Iniciou 48h antes do internamento ciclo de quimioterapia com esquema Folfiri – 5‐flurouracilo (5‐FU), ácido folínico e irinotecan. Foi admitido por dor torácica retrosternal, tipo aperto, de inicio súbito em repouso, com irradiação para membro superior esquerdo e duração superior a 30 minutos. Negou sintomas cardiovasculares prévios. À data de admissão, estava ainda sob infusão de 5‐FU.
À observação inicial o doente apresentava‐se já sem dor, com pressão arterial de 124/74mmHg, frequência cardíaca de 72bpm e SaO2 de 95% em ar ambiente. O exame objetivo era inocente.
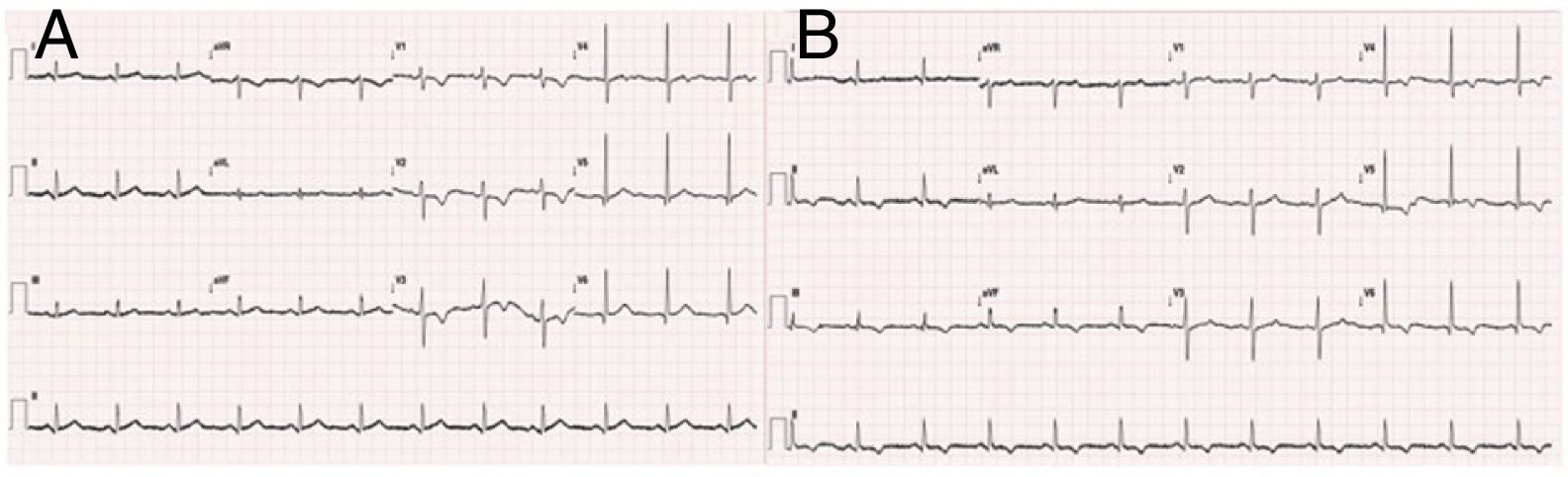
O eletrocardiograma (ECG) efetuado na triagem hospitalar (Figura 1) mostrou ritmo sinusal, com infradesnivelamento de ST inframilimétrico de V1‐V3 acompanhado de inversão de ondas T. O ECG feito 60 minutos após a admissão demonstrou alterações dinâmicas da repolarização ventricular com inversão da onda T de V4 a V6 e em DII, DIII e aVF (Figura 1).
Analiticamente salienta‐se elevação de troponina T de alta sensibilidade, colhida 1h após inicio de sintomas, de 16 ng/L (ref. 14 ng/L) compatível com síndrome coronária aguda em evolução. Sem outras alterações laboratoriais significativas.
O ecocardiograma demonstrou ventrículo esquerdo não dilatado nem hipertrofiado, com fração de ejeção preservada e sem alterações da contractilidade segmentar, parâmetros diastólicos dentro da normalidade e cavidades direitas não dilatadas com normal excursão longitudinal da parede livre do ventrículo direito.
Foi assumido enfarte agudo do miocárdio sem elevação do segmento ST e iniciada terapêutica antitrombótica. Suspendeu‐se de imediato a perfusão de 5‐FU.
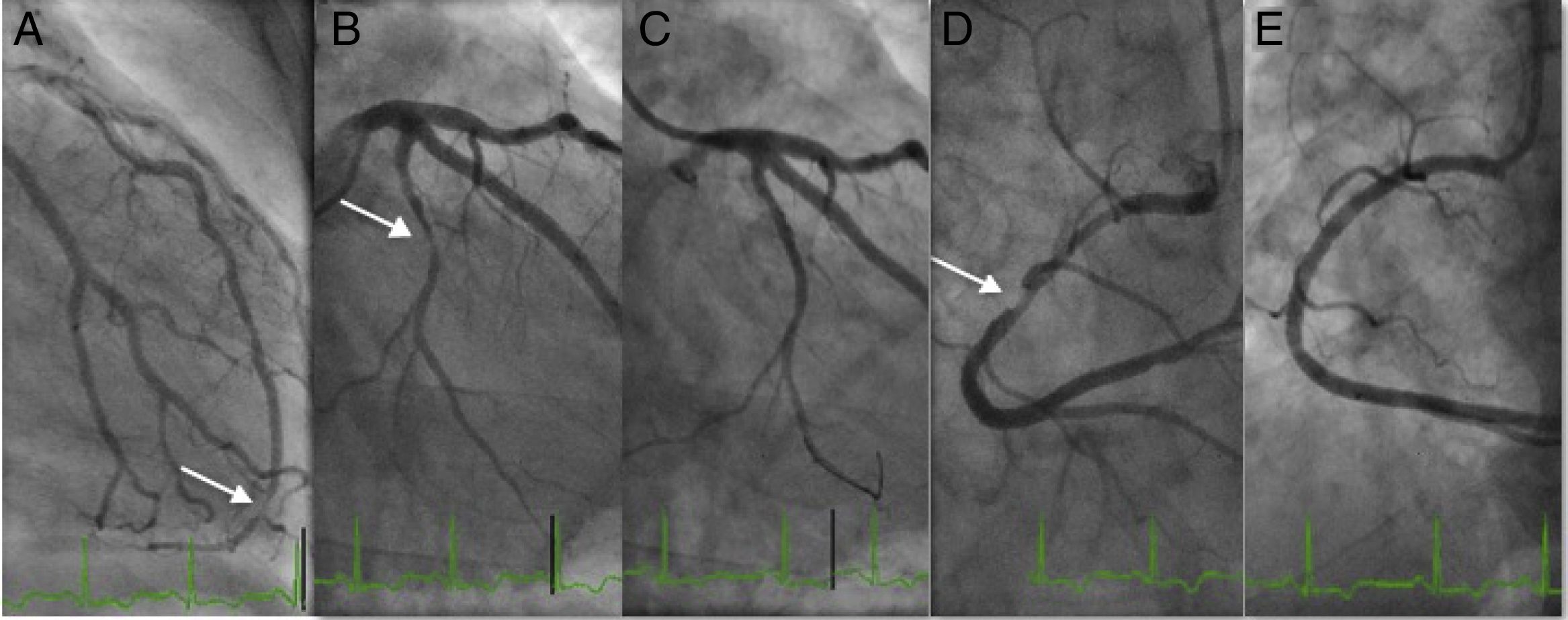
O doente evoluiu em classe Killip‐Kimball I, com pico de troponina 27 ng/L, o score Grace foi de 107. Fez estratificação invasiva de risco 36h após início de sintomas. A coronariografia (Figura 2) demonstrou descendente anterior com lesão muito distal focal de 80%, primeira e segunda diagonais com estenoses de 70%; circunflexa com estenose de 90% no segmento distal e coronária direita com doença difusa proximal e média condicionando estenose de 90% no segmento médio. Procedeu‐se com angioplastia da coronária direita e circunflexa com implantação de stents farmacológicos Xience® 3,0/38mm e Synergy® 2,24/20mm respetivamente, obteve‐se bom resultado angiográfico final.
DiscussãoO presente caso representa uma síndrome coronária aguda potencialmente precipitada pelo 5‐FU num doente com doença coronária previamente desconhecida. A cardiotoxicidade secundária ao 5‐FU está relativamente bem documentada7, no entanto são várias as questões em aberto relativamente à estratificação de risco pré‐quimioterapia e às atitudes terapêuticas após um evento de cardiotoxicidade. Como descrito anteriormente, a incidência de eventos isquémicos associados ao 5‐FU pode variar entre 1,4 e 36%, revela a heterogeneidade existentes entre estudos. A presença de patologia cardíaca associa‐se a maior gravidade dos eventos9, um achado transversal aos vários trabalhos pulicados nessa área.
O mecanismo fisiopatológico do 5‐FU na síndrome coronária aguda não está totalmente compreendido, contudo a hipótese mais estabelecida é a de lesão endotelial induzida pelo 5‐FU com consequente redução da vasodilatação dependente de NO e aumento de instabilidade de placa com trombose in situ8,10. Para além do enfarte, surgem alterações eletrocardiográficas compatíveis com isquemia silenciosa em 68% dos doentes seguidos prospectivamente11. O significado clínico dessas alterações não está esclarecido, pode refletir alterações do fluxo coronário e ser preditor de eventos clínicos12. O modo de administração está relacionado com a incidência de toxicidade cardíaca, o risco é superior com a administração sob infusão (7,6‐18%) comparativamente com administração em bólus (1,6‐3%)3,5. Embora existam mais dados relativos à cardiotoxicidade com o 5‐FU do que com a capecitabina, diversos estudos referem a ocorrência de reação cruzada com um nível de risco sobreponível entre compostos1,6.
Os fatores de risco cardiovascular tradicionais são encontrados com maior frequência em doentes que sofrem um evento isquémico agudo associado ao 5‐FU3. Atendendo aos fatores de risco presentes neste caso clínico, com base no Score – Systematic Coronary Risk Evaluation – European Low Risk Chart, o doente encontrava‐se num grupo de risco cardiovascular intermédio (ESC Score = 3)13, documentou‐se apenas a posteriori a pré‐existência de doença coronária. O facto de o doente estar completamente assintomático antes do evento e a relação temporal com o início e o modo de administração do 5‐FU sugere a possibilidade de uma relação causal entre ambos. A avaliação de doença coronária pré‐quimioterapia em doentes com fatores de risco cardiovascular, apesar de racional, não é mandatória nem está padronizada. Exames anatómicos não invasivos, como o Score de Agatston e a angio‐TC, poderiam ser úteis na triagem de doentes candidatos a terapêutica com 5‐FU para identificar aqueles com maior risco de eventos coronários se expostos ao fármaco.
Com incidências relatadas de até 36% e risco aumentado pela presença de doença coronária, a ocorrência de um evento isquémico não é negligenciável. Assim, doentes sob tratamento com 5‐FU devem manter vigilância sintomática apertada e eventual monitoração eletrocardiográfica contínua para documentação de isquemia silenciosa11, que caso se verifique poderá ser suficiente para levar à suspensão da terapêutica com 5‐FU. A presença de sintomas obriga a uma avaliação exaustiva através das alterações no ECG, subida de biomarcadores de necrose miocárdica, testes de isquémia não invasivos ou eventualmente coronariografia.
Após o diagnóstico de síndrome coronária aguda é fundamental a suspensão do 5‐FU. A taxa de recorrência com a reintrodução é de 82‐100%8. A mortalidade associada à reintrodução também é mais elevada, foram descritos valores de 18%7. O mecanismo principal é a ocorrência de vasoespasmo, bloqueadores de canais de cálcio e nitratos têm sido os fármacos preferencialmente usados, com sucesso demonstrado em estudos observacionais8. Todavia, os fármacos vasodilatadores são ineficazes na prevenção do vasoespasmo coronário após a reintrodução de 5‐FU5 e o seu papel na prevenção primária não está estabelecido. No restante, o tratamento da síndrome coronária aguda nesse contexto não difere do tratamento padrão, considera‐se sempre o impacto que a dupla antiagregação pode ter no manejo da doença oncológica e as potenciais interações medicamentosas.
A estreita colaboração entre a cardiologia e a oncologia é fundamental para a definição da melhor estratégia terapêutica em termos de segurança e eficácia. A decisão sobre a terapêutica oncológica é sempre complexa, depende do estádio do tumor e das características clínicas do doente, e a suspensão do 5‐FU acarreta vários problemas na definição do plano terapêutico. A capecitabina também é contraindicada após evento isquémico pela ocorrência de reação cruzada entre fármacos10. Estão descritos esquemas terapêuticos sem fluoropirimidinas, embora a sua eficácia possa não ser equivalente. Deboever et al. publicaram uma interessante revisão sobre opções aos esquemas com fluoropirimidinas em doentes com cardiotoxicidade documentada1.
Como a cardiotoxicidade pelo 5‐FU é comum, manifesta‐se frequentemente como síndrome coronária aguda ou isquemia silenciosa, especialmente em doentes com doença coronária estabelecida, é necessário padronizar a triagem, monitoração e tratamento desse grupo de doentes. Em doentes com fatores de risco cardiovascular, a avaliação não invasiva de doença coronária pelo Score de Agatston e angio‐TC poderá contribuir para uma melhor seleção de doentes, com potencial diminuição da morbimortalidade nesse contexto clínico.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.