As manifestações cardiovasculares da infeção pelo vírus da imunodeficiência humana (VIH) modificaram‐se significativamente com a introdução dos regimes de terapêutica antirretroviral de elevada potência (HAART). Por um lado, a HAART modificou o curso da doença VIH, com o prolongamento da sobrevivência dos doentes VIH‐infetados. Complicações cardiovasculares da infeção VIH, como a miocardite, foram reduzidas. Por outro lado, a HAART tem sido associada ao aumento da prevalência de doenças arteriais periféricas e coronárias. Com o aumento da longevidade dos indivíduos VIH‐infetados, efeitos a longo prazo, como a doença cardiovascular, estão a emergir como questões de saúde proeminentes nesta população. No presente artigo de revisão, discutiremos a patologia cardiovascular associada ao VIH, focando‐nos na epidemiologia, etiopatogénese, diagnóstico, prognóstico, abordagem e terapêutica. A importância do envolvimento cardiovascular em doentes não tratados pelas novas terapêuticas é ainda uma realidade em situações como o não cumprimento da terapêutica, o início tardio da terapêutica ou o acesso limitado à HAART nos países em desenvolvimento. Assim, descreveremos as consequências cardiovasculares nos doentes não tratados e o potencial efeito da terapêutica antirretroviral na sua regressão, e as consequências metabólicas e implicações cardiovasculares dos regimes HAART nas pessoas infetadas pelo VIH.
The cardiovascular manifestations of human immunodeficiency virus (HIV) infection have changed significantly following the introduction of highly active antiretroviral therapy (HAART) regimens. On one hand, HAART has altered the course of HIV disease, with longer survival of HIV‐infected patients, and cardiovascular complications of HIV infection such as myocarditis have been reduced. On the other hand, HAART is associated with an increase in the prevalence of both peripheral and coronary arterial disease. As longevity increases in HIV‐infected individuals, long‐term effects, such as cardiovascular disease, are emerging as leading health issues in this population. In the present review article, we discuss HIV‐associated cardiovascular disease, focusing on epidemiology, etiopathogenesis, diagnosis, prognosis, management and therapy. Cardiovascular involvement in treatment‐naive patients is still important in situations such as non‐adherence to treatment, late initiation of treatment, and/or limited access to HAART in developing countries. We therefore describe the cardiovascular consequences in treatment‐naive patients and the potential effect of antiretroviral treatment on their regression, as well as the metabolic and cardiovascular implications of HAART regimens in HIV‐infected individuals.
Bloqueador dos canais de cálcio
Doença cardíaca isquémica
Doença cardiovascular
Disfunção diastólica ventricular esquerda
Diabetes mellitus
Derrame pericárdico
Sociedade Clínica Europeia para a SIDA
Endocardite infeciosa
Enfarte do miocárdio
Ecocardiografia transtorácica
Estados Unidos da América
Terapêutica antirretroviral de elevada potência
Hipertensão da artéria pulmonar
Hipertensão da artéria pulmonar relacionada com o vírus da imunodeficiência humana
Hipertensão arterial
Insuficiência cardíaca
Insuficiência cardíaca congestiva
Sintetase do óxido nítrico induzida
Inibidor da protéase
Inibidor da transcriptase‐reversa análogo dos nucleósidos
Inibidor da transcriptase‐reversa não‐análogo dos nucleósidos
Lipodistrofia
Lipodistrofia associada ao vírus da imunodeficiência humana
Linfoma não‐Hodgkin
Staphylococcus aureus meticilino‐resistente
New York Heart Association
QT corrigido
Síndrome da imunodeficiência adquirida
Sarcoma de Kaposi
Terapêutica antirretroviral
Ventricular esquerda
Vírus da imunodeficiência humana
Acquired Immunodeficiency Syndrome
antiretroviral therapy
calcium channel blocker
congestive heart failure
cardiovascular disease
diabetes mellitus
European AIDS Clinical Society
Highly active antiretroviral therapy
Human Immunodeficiency Virus
heart failure
arterial hypertension
infectious endocarditis
ischemic heart disease
inducible nitric oxide synthase
Kaposi's sarcoma
lipodystrophy
Human Immunodeficiency Virus associated ‐ lipodystrophy
left ventricular
left ventricular diastolic dysfunction
myocardial infarction
Methicillin‐resistant Staphylococcus aureus
non‐Hodgkin lymphoma
non‐nucleoside reverse‐transcriptase inhibitors
nucleoside reverse‐transcriptase inhibitors
New York Heart Association
pulmonary arterial hypertension
Human Immunodeficiency Virus‐related pulmonary arterial hypertension
pericardial effusion
protease inhibitor
corrected QT
transthoracic echocardiography
United States of America
O vírus da imunodeficiência humana (VIH) é um retrovírus com tropismo para células expressadoras de CD4. Em 2012, os VIH‐seropositivos eram estimados em 35,3 milhões1.
A introdução da terapêutica antirretroviral de elevada potência (HAART) prolongou a sobrevivência dos VIH‐seropositivos, convertendo a síndrome da imunodeficiência adquirida (SIDA) numa patologia crónica.
A análise retrospetiva das causas de morte em 13 cohorts VIH‐1 na Europa e EUA, que começaram terapêutica antirretroviral (TAR) durante 1996‐2006, reportou diminuição da mortalidade por causas associadas à SIDA e aumento da mortalidade por causas associadas ao envelhecimento, incluindo neoplasias não associadas à SIDA e doença cardiovascular (DCV) (7,9% da mortalidade, da qual 40% por enfarte do miocárdio [EM]/doença cardíaca isquémica [DCI]), sugerindo que o processo de envelhecimento se tornará num fator dominante na mortalidade VIH‐1 na próxima década2.
As consequências cardiovasculares da infeção VIH são distintas consoante se consideram os períodos pré‐HAART e pós‐HAART. A introdução de HAART conduziu a uma modificação das manifestações cardiovasculares.
A importância do envolvimento cardiovascular em doentes não tratados é ainda atualmente uma realidade em indivíduos que não cumprem a terapêutica, indivíduos tratados tardiamente ou nos países onde a TAR não se encontra plenamente disponível. Assim, descreveremos as consequências cardiovasculares nos VIH‐seropositivos não tratados e o potencial efeito da terapêutica na sua regressão, seguindo‐se as manifestações resultantes da HAART.
Envolvimento cardiovascular pela infeção pelo vírus da imunodeficiência humanaMiocardiopatiaAs miocardiopatias associadas à infeção VIH são de quatro tipos: miocardite, miocardiopatia hipocinética (particularmente nos estádios avançados da infeção), miocardiopatia dilatada, disfunção sistólica ventricular esquerda (VE) limitada3.
Miocardite: estudos pré‐HAART reportaram elevadas prevalências de miocardite, atingindo até 52% dos doentes4. A miocardite aguda pode determinar insuficiência cardíaca congestiva (ICC) e arritmias. As miosites são comuns nesta população, sendo a mioglobina menos específica como marcador de lesão miocárdica5. Clínica, fatores de risco (drogas e/ou antirretrovirais) e exames complementares participam no diagnóstico. O gold standard no diagnóstico de miocardite é a biópsia endomiocárdica6.
Miocardiopatia dilatada: no período pré‐HAART, a incidência reportada de miocardiopatia dilatada VIH‐associada variava entre 8%7 e 35%8. Na era HAART foi reportada redução da prevalência de miocardiopatia nos países desenvolvidos9, possivelmente devido à diminuição da replicação viral, redução da incidência de miocardite e prevenção de infeções oportunistas. Nos países em desenvolvimento, com menor acesso à TAR, a miocardiopatia é um problema significativo; um estudo prospetivo no Ruanda reportou uma prevalência de miocardiopatia dilatada de 17,7%10.
Propõe‐se uma patogénese multifatorial, podendo estar associada a: infeção miocárdica pelo VIH7; imunodepressão3,10; défices nutricionais10; alterações difusas‐regressivas11; autoimunidade cardíaca12; endocardite infeciosa (EI); coinfeção com vírus cardiotrópicos7; ação de citocinas11; cardiotoxicidade de certos fármacos, como zidovudina13.
Clinicamente é frequentemente assintomática ou inespecífica, podendo os sintomas de insuficiência cardíaca (IC) ser mascarados por patologias concomitantes. O ecocardiograma é o método de eleição na avaliação da função ventricular.
A miocardiopatia está associada ao aumento de mortalidade, conduzindo a progressão da disfunção VE à IC. A importância da disfunção ventricular é demonstrada pela menor sobrevivência de doentes com miocardiopatia que faleciam por SIDA (era pré‐HAART), comparativamente a doentes com função cardíaca conservada num estádio similar de infeção (101 versus 472 dias)14.
Barbaro et al. estudaram a influência do desenvolvimento de encefalopatia no curso clínico da miocardiopatia associada ao VIH e observaram que doentes com encefalopatia tinham maior probabilidade de falecer de ICC15. O VIH pode persistir em células‐reservatório no miocárdio e córtex cerebral mesmo após TAR, as quais poderão libertar cronicamente citocinas citotóxicas, contribuindo para a lesão progressiva nestes órgãos. Antagonistas de citocinas ou de sintetase do óxido nítrico induzida (iNOS), ou inibidores da apoptose poderão ser úteis na redução da lesão celular induzida pela libertação crónica de citocinas citotóxicas e pela ativação de iNOS por essas células‐reservatório15. Contudo, são necessários mais estudos para avaliação da potencial aplicação destas terapêuticas.
Geralmente, são recomendados regimes de tratamento standard de IC para VIH‐seropositivos com miocardiopatia dilatada e ICC5. Inibidores da enzima conversora da angiotensina podem ser mal tolerados pela baixa resistência vascular sistémica associada a diarreia, infeção ou desidratação5. Digoxina pode ser adicionada à terapêutica de doentes com sintomas persistentes ou fibrilhação auricular com resposta ventricular rápida5. Num doente euvolémico, um beta‐bloqueante pode ser iniciado pelos efeitos benéficos nos níveis circulantes de citocinas16. Há pouca evidência de que a HAART possa ter efeito benéfico; a sua administração poderá reduzir a incidência de doença cardíaca ao prevenir infeções oportunistas.
Disfunção diastólicaForam reportadas elevadas prevalências de disfunção diastólica ventricular esquerda (DDVE) em VIH‐seropositivos3,17–19 (36%18 a 55,7%3), apesar de haver estudos contraditórios20.
Foram detetadas anomalias cardíacas subclínicas num estádio precoce da infeção VIH, independentemente da TAR, sugerindo que o VIH per se possa desempenhar um papel na génese da disfunção diastólica18. Fatores de risco tradicionais foram fortemente associados a anomalias do relaxamento diastólico17.
Frequentemente surge em indivíduos assintomáticos, paucisintomáticos ou nos quais os sintomas são enquadrados noutras patologias. A ecocardiografia permite uma avaliação fiável e não invasiva das funções sistólica e diastólica VE e o despiste dum atingimento miocárdico num estádio subclínico em VIH‐seropositivos3. Contudo, em assintomáticos, poderá ser prematuro recomendar rastreios de rotina19.
Não é claro se VIH‐seropositivos requerem terapêuticas específicas para controlar ou prevenir a disfunção cardíaca, podendo a redução da inflamação VIH‐associada com TAR ser uma opção razoável, apesar do benefício do tratamento na função cardíaca não estar provado19.
Endocardite infecciosaEstudos da era pré‐HAART reportaram aumento do risco de EI em VIH‐seropositivos. Foi reportado um decréscimo na sua incidência entre os períodos pré‐HAART e HAART, de 20,5 por 1000 pessoas‐ano para 6,6 por 1000 pessoas‐ano21.
Os fatores de risco mais fortemente associados a EI foram toxicodependência intravenosa21,22 e imunodepressão marcada21. Nalguns estudos, Staphylococcus aureus foi o agente mais frequente em VIH‐seropositivos21–23, com maior frequência de atingimento da válvula tricúspide23. Em VIH‐seropositivos com bacteriemia Staphylococcus aureus meticilino‐resistente (MRSA), o MRSA da comunidade foi significativamente associado a prevalência aumentada de EI24.
Doentes podem apresentar febre, perda ponderal, pneumonia e/ou meningite coexistentes. Ecocardiografia transtorácica (ETT), complementada pela ecocardiografia transesofágica, é fundamental para confirmação do diagnóstico e orientação terapêutica.
O envolvimento do coração esquerdo e a imunodepressão grave (CD4 <200/mm3) foram associados a maior mortalidade22,23. Gebo et al. reportaram recorrência e mortalidade elevadas no primeiro ano pós‐EI, recomendando um seguimento mais apertado, especialmente nos doentes acima dos 40 anos21.
A antibioterapia é frequentemente eficaz. A cirurgia é indicada em doentes selecionados.
Derrame pericárdicoO derrame pericárdico (DP) é relativamente comum nesta população. O tamponamento cardíaco é raro25. Na era pré‐HAART foi reportada uma incidência anual de DP de 11% em indivíduos com SIDA25. Na era HAART foi reportada uma incidência de 0,25% em VIH‐seropositivos26.
Possíveis etiologias do DP nesta população incluem: infeções oportunistas27, neoplasias como sarcoma de Kaposi (SK) e linfoma não‐Hodgkin (LNH)25, tuberculose, hipoalbuminemia25, idiopático, capillary leak syndrome nos estádios finais da doença25.
Estudos prévios reportaram que o envolvimento pericárdico era frequentemente um achado ecocardiográfico clinicamente não suspeitado e que a maioria dos DP eram pequenos8,25 e raramente progressivos25, não estando habitualmente indicada uma investigação exaustiva25. Grandes DP sintomáticos ocorrem, contudo, e podem requerer avaliação e terapêutica agressivas25. Dispneia, intolerância ao exercício ou edema devem conduzir à investigação por ETT26.
O DP pode ser um marcador de infeção VIH no estádio terminal25, mas raramente é causa de morte27. Contudo, foi associado a menor sobrevida8,25.
Hipertensão pulmonarA hipertensão da artéria pulmonar relacionada com VIH (HAP‐VIH) apresenta manifestações clínicas, laboratoriais, imagiológicas e patológicas semelhantes às da HAP idiopática28.
Na era pré‐HAART foram reportadas incidências de hipertensão pulmonar de 0,5% em VIH‐seropositivos29. Um estudo prospetivo da era HAART reportou uma prevalência de HAP de 0,46% em VIH‐seropositivos30. HAP‐VIH pode surgir em todos os estádios da doença VIH e todos os grupos em risco podem ser atingidos31. As principais características de VIH‐seropositivos diagnosticados com HAP apresentadas numa revisão sistemática recente28 foram: idade média dos doentes 35±9,6 anos; sexo masculino (59%); os principais fatores de risco para contrair infeção VIH foram uso de drogas injetáveis (49%) e relações sexuais entre indivíduos do sexo masculino (21%); contagem média de células CD4 no momento do diagnóstico de HAP 352±304 células/microlitro; diagnóstico de SIDA em 53%; hepatite B em 12%; hepatite C em 14%; tempo médio entre diagnóstico da infeção VIH e diagnóstico de HAP 4,3±4,0 anos.
A vasculopatia subjacente é uma doença angioproliferativa grave. A doença veno‐oclusiva pulmonar é relativamente rara29,31,32. O desenvolvimento da disfunção vascular pulmonar resulta provavelmente da ação de fatores de risco como infeções virais, autoimunidade, drogas ou toxinas, possivelmente atuando numa suscetibilidade genética subjacente32. A inflamação parece desempenhar um papel mais ativo na patogénese da HAP‐VIH que na HAP idiopática32.
O diagnóstico requer a confirmação da hipertensão pulmunar, da infeção VIH e a exclusão doutras causas de hipertensão pulmonar33. Deve ser evocado perante uma dispneia inexplicada30,31. Sintomas reportados à altura do diagnóstico por Janda et al. foram dispneia (93%), edema maleolar (18%), síncope (13%), fadiga (11%), tosse (8%) e toracalgia (6%)28. A ecocardiografia deve ser realizada em doentes com dispneia inexplicada para detetar complicações cardiovasculares associadas ao VIH34. O cateterismo do coração direito é o standard para diagnosticar HAP e para avaliar o estado hemodinâmico e a resposta ao tratamento35.
O desenvolvimento de HAP associa‐se a pior prognóstico. O prognóstico é especialmente desfavorável nas classes funcionais NYHA III‐IV com sobrevivência a três anos de 28%36. Doentes com HAP‐VIH frequentemente morrem de condições relacionadas com a HAP28,35,36. A complicação mais comum é a IC direita28.
Não existindo terapêutica curativa, o objetivo é melhorar a classe funcional do doente.
O tratamento convencional dirige‐se ao controlo das suas consequências e é similar para todas as formas de hipertensão pulmonar33. Na descompensação cardíaca direita, restrição hidrossalina e diuréticos devem ser utilizados cautelosamente para não diminuir excessivamente o volume intravascular. Utilizam‐se agentes inotrópicos em doentes que os requeiram e oxigénio domiciliário em doentes com hipoxemia crónica33. A anticoagulação não é rotineiramente recomendada pelo aumento do risco de hemorragia, questões de adesão à terapêutica e interações medicamentosas34. Bloqueadores dos canais de cálcio (BCC) não foram recomendados nestes indivíduos34.
Existem poucos estudos nesta população relativamente à terapêutica específica da HAP, sendo fundamental a realização futura de ensaios aleatorizados bem‐controlados, com maiores amostras populacionais. A administração de sildenafil é debatida por interagir com inibidores da protéase (IP). Segundo Galie et al., se for utilizado sildenafil, a dose deve ser ajustada se coadministrados ritonavir e saquinovir34.
Há dados contraditórios relativamente à eficácia da HAART no tratamento da HAP37–39.
A infeção VIH é geralmente considerada um critério de exclusão para transplante pulmonar, apesar de nalguns centros ter sido implementado um programa específico34.
Disfunção autonómicaFoi demonstrado o envolvimento do tónus autonómico cardiovascular na doença VIH avançada. Análise espectral da variabilidade do ritmo cardíaco revelou disfunção autonómica global grave em doentes com SIDA sem evidência clínica ou ecocardiográfica de doença cardíaca, tendo sido sugerido este processo como possível mecanismo de arritmogénese40. Observou‐se que VIH‐seropositivos sob TAR (durante mais de 44 meses) apresentavam frequência cardíaca aumentada em repouso e diminuição da variabilidade de curto prazo da frequência cardíaca, indicativo de disfunção parassimpática41. Contudo, um estudo prospetivo recente sugere que a TAR possa não contribuir para alterações a curto prazo na função autonómica em indivíduos saudáveis precocemente no curso da doença42.
Neoplasias cardíacasA introdução de HAART conduziu a reduções significativas nas incidências de SK e LNH43; no período pré‐HAART foi reportado um aumento de risco de SK e LNH em indivíduos com SIDA44. Ambas estas neoplasias têm potencial de afeção cardíaca.
SK: O envolvimento cardíaco num VIH‐seropositivo geralmente ocorre como parte de SK disseminado27. Os achados clínicos são pouco claros27. A pericardiocentese não é diagnóstica e é um procedimento de alto risco nestes doentes27. Quando há uma elevada suspeita de DP por SK, dever‐se‐á realizar uma janela pericárdica para descompressão e estabelecimento do diagnóstico patológico27.
LNH: O envolvimento cardíaco por LNH, habitualmente derivado de células B, é tipicamente de alto grau e frequentemente dissemina‐se precocemente nos doentes com SIDA27,45. Habitualmente são clinicamente silenciosos ou podem apresentar‐se como IC, arritmia e/ou DP46,47, e tamponamento cardíaco45. Ecocardiografia pode revelar massa intracardíaca ou lesões nodulares nas três túnicas cardíacas, mas em formas infiltrativas pode subestimar a extensão do envolvimento miocárdico45. Ressonância Magnética é uma ferramenta útil para compreender as características e potenciais complicações da neoplasia47.
Nos VIH‐seropositivos, a ocorrência de LNH não se correlaciona intimamente com um estado avançado de imunodepressão45. Apesar de o prognóstico ser desfavorável, os doentes poderão ter maior sobrevida com quimioterapia sistémica45.
VasculopatiaPraticamente todos os tipos de vasculites de pequenos, médios e grandes vasos foram observados nesta população48. Podem resultar de anomalias induzidas pelo VIH e/ou outros agentes. Diversas doenças vasculares inflamatórias podem desenvolver‐se, incluindo poliarterite nodosa‐like48, púrpura de Henoch‐Schönlein, vasculite de hipersensibilidade induzida por fármacos, síndrome Kawasaki‐like49 e arterite de Takayasu50.
Foram identificados os aneurismas associados ao VIH como uma entidade distinta caracterizada por predileção por jovens, multiplicidade, localização atípica e histopatologia distintiva; a maioria eram assintomáticos; 68% dos doentes apresentava doença VIH avançada51. A patogénese destes aneurismas permanece pouco clara51.
Foi reportado um tipo aparentemente único de doença arterial oclusiva em VIH‐seropositivos, mais frequente em jovens, geralmente com doença avançada e imunodepressão significativa52. Os doentes apresentam‐se frequentemente com necrose tecidual avançada que impede a preservação do membro52.
Vírus da imunodeficiência humana e doença coronáriaEvidência eletrocardiográfica de DCI assintomática foi reportada em 10,9% de indivíduos sem DCI conhecida, independentemente do tipo e duração de TAR53.
Foram descritas alterações do metabolismo lipídico em VIH‐seropositivos54,55.
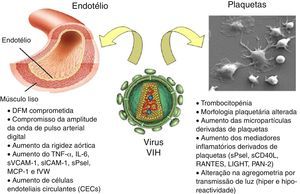
O papel do VIH como fator de risco per se para aterosclerose acelerada permanece controverso56–59. O VIH apresenta efeitos ativadores do endotélio e plaquetas (Figura 1)60. A disfunção endotelial ocorre precocemente no processo de aterogénese e contribui para a formação, progressão e complicações das placas ateroscleróticas60.
Representação esquemática das possíveis interações entre o vírus VIH e o endotélio e plaquetas. Reutilizado e traduzido pelos autores com permissão de Gresele et al.60.
DFM, dilatação fluxo‐mediada; sPsel, P‐selectina solúvel; sCD40L, CD40Ligando solúvel; PAN‐2, Péptido ativador de Neutrófilos 2; RANTES, Regulated upon Activation Normal T cell Expressed and presumably Secreted; LIGHT (TNFSF 14), superfamília de fator de necrose tumoral 14.
As alterações ateroscleróticas na parede arterial aumentam a sua rigidez. O aumento da rigidez arterial em VIH‐seropositivos não tratados foi reportado nalguns estudos58,61, mas não noutros62.
A infeção VIH crónica induz ativação imune e inflamação crónica, parcialmente corrigidas pela HAART60. A imunodepressão pode ter efeitos adversos nas propriedades vasculares59.
Prolongamento do intervalo QT corrigidoFoi reportado um aumento da prevalência do prolongamento do intervalo QT corrigido (QTc) em VIH‐seropositivos63–66, que pode estar associado a: fármacos administrados no tratamento doutras patologias; alterações eletrolíticas; maior duração da infeção VIH64,65; miocardiopatia, disfunção autonómica ou isquemia miocárdica64. Shavadia et al. reportaram um aumento significativo de risco de prolongamento do QTc em VIH‐seropositivos sob TAR, comparativamente a indivíduos não tratados63; outros estudos não identificaram uma associação significativa entre o prolongamento do intervalo QTc e TAR65,66. Reinsch et al. sugeriram a possível influência de fatores como género, diabetes mellitus (DM) e hipertensão arterial (HTA)66.
O uso de fármacos não‐cardíacos com efeito prolongador do QTc na população geral foi associado ao aumento de risco de morte súbita cardíaca67. É importante a monitorização do intervalo QTc em doentes sob TAR, particularmente quando TAR é combinada com fármacos com potencial para prolongar o intervalo QTc.
Consequências da infeção por vírus da imunodeficiência humana no sistema cardiovascular na era da terapêutica antirretroviral de elevada potênciaTerapêutica antirretroviral de elevada potênciaOs regimes iniciais de primeira linha recomendados pela Sociedade Clínica Europeia para a SIDA – European AIDS Clinical Society (SIDA' alt='Sociedade Clínica Europeia para a SIDA'>EACS
)68 são apresentados na Tabela 1.Regimes de combinação terapêutica inicial recomendados para doentes adultos seropositivos para o vírus da imunodeficiência humana sem exposição anterior a terapêutica antirretroviral
| A | B | Observações |
|---|---|---|
| ITRNN | ITRN | |
| EFV | ABC/3TC ou TDF/FTC | ABC/3TC coformulado |
| RPV | TDF/FTC coformulado | |
| EFV/TDF/FTC coformulado | ||
| RPV/TDF/FTC coformulado | ||
| IP potenciado com ritonavir | ||
| ATV/r | ABC/3TC ou TDF/FTC | ATV/r: 300/100mg 1x/dia |
| DRV/r | DRV/r: 800/100mg 1x/dia | |
| INSTI | ||
| EVG + COBI | TDF/FTC | TDF/FTC/EVG/COBI coformulados |
| DTG | ABC/3TC ou TDF/FTC | DTG 50mg 1x/dia |
| TDF/FTC coformulados | ||
| ABC/3TC/DTG coformulados | ||
| RAL | ABC/3TC ou TDF/FTC | RAL: 400mg 2x/dia |
Um fármaco da coluna A deve ser combinado com os fármacos listados na coluna B. ABC: abacavir; ATV: atazanavir; COBI: cobicistat; DRV: darunavir; DTG: dolutegravir; EFV: efavirenz; EVG: elvitegravir; FTC: emtricitabina; INSTI: inibidor da transferência de cadeia da integrase (integrase strand transfer inhibitor); IP: inibidor da protease; ITRN: inibidor da transcriptase reversa análogo dos nucleósidos; ITRNN: inibidor da transcriptase reversa não‐análogo dos nucleósidos; r: ritonavir; RAL: raltegravir; RPV: rilpivirina; TDF: tenofovir; 3TC: lamivudina.
Adaptado de: European AIDS Clinical Society Guidelines Version 7.1 – Novembro 201468. Traduzido pelos autores.
As recomendações de 2014 do International Antiviral Society‐USA Panel propõem iniciar TAR em todos os indivíduos que estejam dispostos e preparados para iniciar o tratamento, após a confirmação do diagnóstico da infeção VIH69. A TAR é recomendada para o tratamento da infeção VIH e para a prevenção da transmissão de VIH independentemente da contagem de CD4 (força da recomendação AIa‐BIII)69. Tais medidas sujeitarão os VIH‐seropositivos à exposição mais precoce à HAART e seus efeitos adversos. As recomendações de 2014 da SIDA' alt='Sociedade Clínica Europeia para a SIDA'>EACS
relativamente ao início de TAR em VIH‐seropositivos sem exposição prévia a TAR são hierarquizadas tendo em conta o grau de progressão da doença VIH e a presença/elevado risco de desenvolver vários tipos de comorbilidades, sendo TAR sempre recomendada em VIH‐seropositivos com contagens de CD4 <350cél/μL68. Para indivíduos com contagens superiores de células CD4, a decisão de iniciar TAR deverá ser considerada e individualizada68.Efeitos da terapêutica antirretroviral de elevada potênciaVários fatores de risco para DCV podem ser induzidos e/ou potenciados pela HAART. Fatores de risco tradicionais foram significativamente associados ao aumento do risco de EM em VIH‐seropositivos70,71.
Foi reportada uma incidência de DM em homens VIH‐seropositivos sob HAART superior a quatro vezes à de VIH‐seronegativos72. Fatores de risco tradicionais (idade, sexo masculino, obesidade, baixo HDL‐C, colesterol total elevado) desempenham um importante papel no aumento do risco de DM nesta população73–75; lipodistrofia (LD)73,76 e imunodepressão76 foram associadas ao aumento de risco de DM em VIH‐seropositivos; papel da coinfecção por vírus da hepatite C é controverso74–76. A TAR não é unanimemente reconhecida como fator associado à DM. Contudo, vários estudos reportaram aumento do risco de DM com alguns antirretrovirais73,74,77 e com o aumento da duração da exposição a TAR73,78. As terapêuticas principalmente associadas ao risco de desenvolvimento de DM foram IP74,77 e alguns inibidores da transcriptase‐reversa análogos dos nucleósidos (ITRN)73,74,77.
Alguns IP foram associados a um perfil dislipidémico55,79,80. Inibidores da transcriptase‐reversa não‐análogos dos nucleósidos (ITRNN) estão geralmente associados a perfis lipídicos mais favoráveis que IP80. Contudo, estudos recentes apontam um risco significativo de dislipidemia induzida pelo efavirenz54,81. Dos ITRN, tenofovir parece estar associado a perfis lipídicos menos deletérios82,83. Foi sugerido que regimes baseados em inibidores da transferência de cadeia da integrase poderão ser uma boa opção para doentes com dislipidemia pré‐existente69.
A lipodistrofia associada ao VIH (LD‐VIH) é sobretudo considerada um efeito adverso da HAART, tendo sido reportada uma prevalência média de aproximadamente 42% em VIH‐seropositivos sob HAART incorporando IP84. O termo «síndrome lipodistrófica» é utilizado por alguns autores para englobar eventos morfológicos e metabólicos, mas não é claro se resultam do mesmo mecanismo. Nem todos os doentes apresentam todas as características dessa síndrome. Dislipidemia foi reportada em cerca de 70% e DM em 8‐10% destes doentes85.
Hipertensão arterialAlguns estudos sugerem um aumento da prevalência de HTA em VIH‐seropositivos sob TAR86,87, não confirmada por outros88.
O papel de VIH ou TAR na patogenia da HTA não é claro. Possíveis mecanismos são representados na Figura 2. Num estudo prospetivo em VIH‐seropositivos a iniciar HAART foi reportado um aumento da pressão arterial após 48 semanas86. Em VIH‐seropositivos a iniciar o seu primeiro regime HAART, o tratamento com lopinavir/ritonavir foi associado a aumento da pressão arterial89; doentes sob atazanavir, efavirenz, nelfinavir ou indinavir apresentaram menos probabilidade de desenvolver pressão arterial elevada89.
Terapêutica antirretroviral de elevada potência e doença coronáriaMendes et al. reportaram a deteção de anomalias de deformação miocárdica através da avaliação do strain e strain rate numa população de VIH‐seropositivos relativamente saudável sem DCV estabelecida ou fatores de risco20.
Foi demonstrado que infeção VIH e HAART são fatores de risco independentes para aterosclerose carotídea precoce56. Em oposição, Kaplan et al. reportaram que o uso de antirretrovirais não apresentou uma associação consistente com a aterosclerose59. A evidência sobre os efeitos da TAR na rigidez arterial é contraditória61,62.
VIH‐seropositivos, sobretudo os sob TAR, estão em maior risco de DCV (particularmente EM e doença coronária) comparativamente aos VIH‐seronegativos57,70,90,91. Diversos estudos predizem uma maior frequência de eventos vasculares em adultos VIH‐infetados sob TAR em relação aos não tratados90,92,93, apesar de haver estudos contraditórios94. Foi sugerido que a reconstituição imune pode em parte contribuir para o excesso de risco de DCI90.
Contudo, os benefícios da TAR continuam a ultrapassar o risco cardiovascular aumentado associado a esta terapêutica e as preocupações em relação ao risco coronário não devem impossibilitar o uso de TAR nos VIH‐seropositivos.
Terapêutica antiretroviral e enfarte do miocárdio: vários estudos demonstraram aumento da frequência de EM com o aumento da duração da administração de certos antirretrovirais70,71,95. Contudo, Obel et al. não observaram um aumento progressivo do risco ao longo dos oito anos de seguimento após iniciação da HAART90. Num estudo de duração inferior, TAR foi independentemente associada ao aumento de 26% da taxa de EM por cada ano de exposição, nos primeiros quatro a seis anos de uso70. Foi demonstrado um aumento do risco relativo de EM por cada ano de exposição a IP, não se tendo verificado uma associação significativa entre o risco de EM e ITRNN71. Indinavir, lopinavir‐ritonavir, didanosina e abacavir foram associados ao aumento do risco de EM95. Outros autores não encontraram associação entre exposição a abacavir e aumento do risco de EM96. Em indivíduos em elevado risco de DCV poder‐se‐á considerar evitar abacavir, lopinavir/ritonavir e fosamprenavir/ritonavir porque estes regimes foram associados a risco aumentado de eventos cardiovasculares nalguns estudos69.
Avaliação do risco cardiovascularDever‐se‐á proceder à avaliação e monitorização do risco cardiovascular para identificar indivíduos de alto risco e implementar medidas preventivas (Figura 3).
Avaliação do risco cardiovascular em VIH‐seropositivos. Adaptado de: European AIDS Clinical Society Guidelines Version 7.1 – Novembro 201468. Traduzido pelos autores.
Observações:A. Pode‐se utilizar a equação de risco de Framingham. Esta avaliação e as considerações descritas na figura devem ser repetidas anualmente em todos os doentes sob tratamento.
B. Dos fatores de risco descritos, o tratamento medicamentoso está reservado para determinados subgrupos nos quais os benefícios ultrapassem os potenciais riscos.
C. Os valores alvo são indicadores e não definitivos (expressos em mmol/L com mg/dL entre parêntesis).
D. A evidência do benefício quando utilizado em pessoas sem antecedentes de DCV (incluindo diabéticos) é menos convincente. A pressão arterial deve estar razoavelmente controlada antes do uso de aspirina neste contexto.
VIH‐seropositivos apresentam diversos fatores de risco para DCV, englobando fatores de risco tradicionais e fatores de risco relacionados com a infeção VIH (infeção per se, duração da infeção, carga viral, terapêutica, resposta imunitária alterada).
A equação de risco de Framingham pode subestimar o risco nesta população58. Foram recentemente desenvolvidas: uma equação de risco cardiovascular a partir de VIH‐seropositivos incorporando parâmetros de risco cardiovascular de rotina e exposição a antirretrovirais97; uma equação para prever o risco a curto prazo de aparecimento de DM de novo em VIH‐seropositivos, proposta no seguimento destes doentes76.
RecomendaçõesSão recomendadas intervenções comportamentais ou terapêuticas direcionadas à redução do risco cardiovascular em VIH‐seropositivos sob TAR. Doentes sob TAR devem ser aconselhados a dieta, perda ponderal, cessação tabágica e exercício físico. Foi reportada uma relação independente entre aumento de ingestão salina e aumento da rigidez aórtica98.
Lima et al. analisaram o efeito dum programa de prevenção (medidas não farmacológicas e, quando apropriado, terapêutica farmacológica) sobre o risco cardiovascular em VIH‐seropositivos e, após um seguimento de seis meses, observaram alterações significativas nos triglicéridos, colesterol total e colesterol‐LDL e uma redução significativa na frequência de indivíduos com elevado risco cardiovascular99.
A SIDA' alt='Sociedade Clínica Europeia para a SIDA'>EACS
apresentou recomendações no âmbito do tratamento da dislipidemia, DM e HTA em VIH‐seropositivos68.Se a modificação do estilo de vida e substituição de TAR não forem eficazes, deve‐se considerar terapêutica antidislipidémica68. Dos fármacos utilizados para baixar colesterol‐LDL, a estatina é terapêutica de primeira linha preferida68. Estatinas deveriam ser usadas em doentes com doença vascular estabelecida e nos doentes com DM tipo 2 ou em elevado risco de DCV, independentemente dos níveis lipídicos68. Contudo, as interações entre estatinas e antirretrovirais são comuns. Os IP podem interagir com o metabolismo das estatinas via citocromo CYP3A4, alterando o grau de exposição às mesmas. A sinvastatina é contraindicada com o uso de IP54. Num pequeno estudo piloto, a terapêutica com rosuvastatina durante 24 semanas foi eficaz na abordagem da hiperlipidemia em doentes sob IP e foi associada a um perfil de tolerabilidade favorável100.
Os objetivos e características do tratamento da DM tipo 2 recomendados pela SIDA' alt='Sociedade Clínica Europeia para a SIDA'>EACS68 estão representados na Figura 4.
Abordagem da Diabetes mellitus tipo 2 nos VIH‐seropositivos. Adaptado de: European AIDS Clinical Society Guidelines Version 7.1 – Novembro 201468. Traduzido pelos autores.
Observações: A. Existe informação muito limitada em relação a agentes antidiabéticos orais no âmbito da prevenção de doença cardiovascular e não há informação em indivíduos VIH‐seropositivos.
No tratamento da HTA, o objetivo é atingir pressão arterial inferior a 140/90mmHg. As recomendações da SIDA' alt='Sociedade Clínica Europeia para a SIDA'>EACS relativamente à terapêutica farmacológica da HTA68 apresentam‐se na Figura 5. BCC devem ser utilizados cautelosamente, pois podem interagir com IP. Comorbilidades associadas devem ser consideradas na escolha dos fármacos.
Escolha dos medicamentos para os doentes VIH com hipertensão arterial recentemente diagnosticada. Adaptado de: European AIDS Clinical Society Guidelines Version 7.1 – Novembro 201468. Traduzido pelos autores.
Observações:
‐ iECA ou ARA de baixo custo: Inibidor da Enzima Conversora da Angiotensina (exemplo: Perindopril, Lisinopril ou Ramipril) ou antagonista dos recetores da angiotensina de baixo custo (exemplo: Losartan, Candesartan).
‐ BCC dihidropiridínico: bloqueador dos canais de cálcio dihidropiridínico (exemplo: Amlodipina).
‐ Diurético tipo tiazida: diurético como por exemplo indapamida ou clortalidona; as tiazidas (exemplo: hidroclorotiazida, bendroflumetiazida) são excluídas.
ARA: antagonista dos recetores da angiotensina; BCC: bloqueador dos canais de cálcio; HTA: hipertensão arterial; iECA: Inibidor da Enzima Conversora da Angiotensina.
Os autores declaram não haver conflito de interesses.








 VIH e o endotélio e plaquetas. Reutilizado e traduzido pelos autores com permissão de Gresele et al.60. DFM, dilatação fluxo‐mediada; sPsel, P‐selectina solúvel; sCD40L, CD40Ligando solúvel; PAN‐2, Péptido ativador de Neutrófilos 2; RANTES, Regulated upon Activation Normal T cell Expressed and presumably Secreted; LIGHT (TNFSF 14), superfamília de fator de necrose tumoral 14.'/>
VIH e o endotélio e plaquetas. Reutilizado e traduzido pelos autores com permissão de Gresele et al.60. DFM, dilatação fluxo‐mediada; sPsel, P‐selectina solúvel; sCD40L, CD40Ligando solúvel; PAN‐2, Péptido ativador de Neutrófilos 2; RANTES, Regulated upon Activation Normal T cell Expressed and presumably Secreted; LIGHT (TNFSF 14), superfamília de fator de necrose tumoral 14.'/>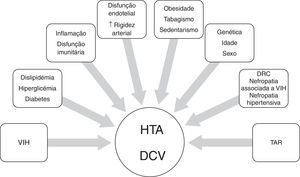 HTA,
HTA, 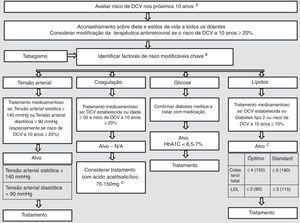 VIH‐seropositivos. Adaptado de: European
VIH‐seropositivos. Adaptado de: European 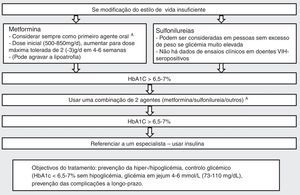 VIH‐seropositivos. Adaptado de: European
VIH‐seropositivos. Adaptado de: European 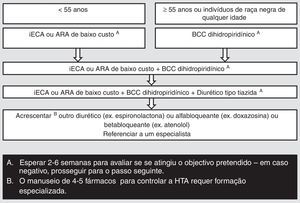 VIH com hipertensão arterial recentemente diagnosticada. Adaptado de: European
VIH com hipertensão arterial recentemente diagnosticada. Adaptado de: European 

