A oxigenação por membrana extracorporal (ECMO) permite o suporte mecânico em doentes com falência cardiovascular e/ou pulmonar. Neste estudo pretendemos descrever as indicações, características clínicas, complicações e mortalidade associadas ao uso de ECMO num hospital terciário.
MétodosFoi realizado um estudo de coorte retrospetivo e observacional de todos os doentes que implantaram ECMO, em duas unidades de cuidados intensivos (polivalente e cardíaca), desde o primeiro doente canulado em abril/2011 até outubro/2016.
ResultadosQuarenta e oito doentes colocaram ECMO: 29 ECMO venoarterial (ECMO‐VA) e 19 ECMO venovenoso (ECMO‐VV). No ECMO‐VA, o enfarte agudo do miocárdio foi a principal indicação para a sua implantação. A complicação mais frequente foi a isquemia do membro inferior e a disfunção de órgão associada mais comum foi a renal. No ECMO‐VV, a síndrome de dificuldade respiratória aguda secundária a infeção viral foi o motivo dominante para a utilização do dispositivo. A hemorragia pelo local de acesso e a disfunção hematológica foram, respetivamente, a complicação e a disfunção de órgão mais prevalentes. Foram descanulados com sucesso quase 70% dos doentes, em ambos os grupos. Os doentes em ECMO‐VA tiveram sobrevivência hospitalar de 37,9% e os em ECMO‐VV 63,2%. O número de agentes inotrópicos foi preditor de mortalidade no ECMO‐VA.
ConclusãoOs doentes que colocaram ECMO após falência respiratória tiveram sobrevivência superior aos que colocaram após falência cardíaca. No ECMO‐VA, a necessidade de mais fármacos inotrópicos foi preditor de mortalidade. Este é o primeiro registo publicado com a experiência global com ECMO num hospital terciário, em Portugal.
Extracorporeal membrane oxygenation (ECMO) provides mechanical pulmonary and circulatory support for patients with shock refractory to conventional medical therapy. In this study we aim to describe the indications, clinical characteristics, complications and mortality associated with use of ECMO in a single tertiary hospital.
MethodsWe conducted a retrospective observational cohort study of all patients supported with ECMO in two different intensive care units (general and cardiac), from the first patient cannulated in April 2011 up to October 2016.
ResultsOverall, 48 patients underwent ECMO: 29 venoarterial ECMO (VA‐ECMO) and 19 venovenous ECMO (VV‐ECMO). In VA‐ECMO, acute myocardial infarction was the main reason for placement. The most frequent complication was lower limb ischemia and the most common organ dysfunction was acute renal failure. In VV‐ECMO, acute respiratory distress syndrome after viral infection was the leading reason for device placement. Access site bleeding and hematologic dysfunction were the most prevalent complication and organ dysfunction, respectively. Almost 70% of ECMO episodes were successfully weaned in each group. Survival to discharge was 37.9% for VA‐ECMO and 63.2% for VV‐ECMO. In VA‐ECMO, the number of inotropic agents was a predictor of mortality.
ConclusionPatients with respiratory indications for ECMO experienced better survival than cardiac patients. The need for more inotropic drugs was a predictor of mortality in VA‐ECMO. This is the first published record of the overall experience with ECMO in a Portuguese tertiary hospital.
A oxigenação por membrana extracorporal (ECMO) é um dispositivo de resgate para suportar doentes com disfunção cardíaca e/ou pulmonar grave refratários à terapêutica convencional. Em adultos, a sua primeira aplicação bem‐sucedida foi há mais de 40 anos. No entanto, só recentemente a sua utilização se generalizou, com a melhoria tecnológica dos dispositivos disponíveis e o acumular de evidência científica que a sustenta1,2.
Fazem parte essencial de um circuito de ECMO duas cânulas (inflow/outflow), uma bomba centrífuga e um oxigenador. O oxigenador é um dispositivo de troca de gases que usa uma membrana semipermeável para separar um compartimento sanguíneo e um gasoso. O sangue desoxigenado é drenado pela força da bomba externa, atravessa o oxigenador (onde se processa a troca de dióxido de carbono por oxigénio) e é devolvido ao doente. Quando o sangue é drenado e entregue apenas por veias, o circuito denomina‐se de ECMO‐venovenoso (VV), permitindo apenas suporte pulmonar. Quando é drenado por uma veia e entregue numa artéria o circuito é apelidado de ECMO‐venoarterial (VA), garantindo suporte pulmonar e cardíaco2. O ECMO é um dispositivo portátil e leve, permitindo a mobilização relativamente fácil de doentes e o seu transporte intra e inter‐hospital. Pode ser colocado por via percutânea ou por via central, dependendo das circunstâncias clínicas, sendo inclusivamente possível a sua utilização em situações de paragem cardiorrespiratória (PCR). Apesar de ser um suporte temporário e com naturais limitações, a sua versatilidade torna‐o um dispositivo útil em diversos cenários clínicos, desde a estabilização clínica para a recuperação total, até situações em que funciona como ponte para a decisão terapêutica, quer esta passe por um upgrade para suporte ventricular de longa duração, transplante ou, inclusivamente, a própria suspensão do suporte3. Nas últimas recomendações da Sociedade Europeia de Cardiologia, o ECMO‐VA é recomendado para doentes em Intermacs 1 e 24.
Neste trabalho, temos como objetivo descrever as características demográficas, a indicação, as comorbilidades, as variáveis fisiológicas pré‐ECMO, o tratamento (duração, modo, complicações) e a mortalidade (em ECMO e intra‐hospitalar) de uma população de doentes onde foi utilizado o ECMO (num hospital terciário). Iremos, ainda, avaliar a existência de preditores de mortalidade nesta população.
MétodosEste é um estudo de coorte, observacional e retrospetivo, onde estão incluídos todos os doentes que colocaram ECMO em duas unidades diferentes: unidade de cuidados intensivos cardíacos (UCIC) e unidade de cuidados intensivos polivalente (UCIP), num hospital terciário, desde o primeiro doente canulado em abril de 2011 até outubro de 2016. Foram excluídos desta análise os doentes em que o dispositivo foi colocado após cardiotomia, já que estes foram tratados segundo protocolos de implantação e seguimento distintos.
Durante este período, foram colocados 48 ECMO nestas unidades: 29 por falência cardíaca e 19 por falência pulmonar.
Realizou‐se uma seleção de variáveis relevantes, tendo em conta a literatura publicada, e foram colhidos os dados (demográficos, comorbilidades, indicação para ECMO) pela análise do processo eletrónico. Nos fatores pré‐ECMO foram considerados os piores resultados nas primeiras 24h de admissão na unidade. Foi utilizada a fórmula Modification of Diet in Renal Disease (MDRD) para estimar a taxa de filtração glomerular (TFG). Foram registadas as complicações relacionadas com a técnica, assim como o tempo de ECMO e de internamento. As complicações relacionadas com a técnica foram divididas em hemorrágicas (do acesso, gastrointestinal ou cerebral), isquémicas e relacionadas com o acesso (trombose, disseção, aneurisma, pseudoaneurisma, fístula). A lesão renal aguda foi definida utilizando o score RIFLE. Considerou‐se disfunção hematológica a contagem de plaquetas<100000uL ou hematócrito<35% e disfunção hepática, um nível de transaminases três vezes superior ao limite superior da normalidade (LSN). Colheram‐se os dados referentes à mortalidade em ECMO, pós‐ECMO e intra‐hospitalar. Foi considerada descanulação com sucesso quando realizada com a intenção de sobrevivência ou como ponte para outro suporte. Foram feitas análises entre os grupos: ECMO‐VA e ECMO‐VV e entre os sobreviventes e não sobreviventes dentro de cada um dos grupos. Para previsão de sobrevivência após ECMO‐VA utilizou‐se o Survival After Veno‐arterial ECMO – score (SAVE‐score). Este score utiliza um sistema de pontuação (‐35 a 17) que tem em linha de conta o diagnóstico, a idade, peso, outras disfunções agudas ou crónicas, parâmetros de ventilação e tempo prévio de intubação orotraqueal, PCR prévia e parâmetros hemodinâmicos. Os doentes são estratificados em cinco classes de risco, estando associada a cada classe a sobrevivência esperada: classe I (SAVE‐score>5) 75% de sobrevivência, classe II (SAVE‐score 1 a 5) 58%; classe III (SAVE‐score ‐4 a 0) 42%; classe IV (SAVE‐score ‐9 a ‐5) 30% e classe V (≤‐10) 18%5.
Todos os dispositivos foram colocados por via percutânea, quer na própria unidade quer no laboratório de hemodinâmica, por uma equipa multidisciplinar composta por intensivistas, cardiologistas, perfusionistas e enfermeiros. Todos, à exceção de um doente, utilizaram o sistema CARDIOHELP da Maquet, Hirrlingen, Alemanha. No caso do ECMO‐VA, foram maioritariamente utilizados os acessos femorais e para o ECMO‐VV um acesso femoral e um jugular. A cânula de reperfusão distal foi utilizada por rotina quando o motivo do ECMO era o enfarte agudo do miocárdio (EAM). Nas restantes indicações foi colocada quando havia evidência clínica de má perfusão distal, sempre com controlo ecográfico. Quanto à hipocoagulação, foi realizado um bólus de heparina não fracionada (HNF) na altura da canulação (50‐100U/Kg, máximo de 5000U), seguido por uma perfusão ajustada para um tempo de tromboplastina parcial ativada (APTT) alvo de 1,5 vezes o LSN.
A assistência ventricular cirúrgica foi utilizada quando havia falência farmacológica e mecânica no venting do ventrículo esquerdo (VE). A referenciação para transplante cardíaco (não disponível no nosso centro) foi realizada sempre que a etiologia ou evolução do doente demonstravam uma baixa probabilidade de recuperação da função ventricular esquerda. Recentemente, foi estabelecido um protocolo de referenciação com um dos centros nacionais de maior volume.
A análise estatística foi realizada utilizando o IBM SPSS, versão 19. As variáveis contínuas são apresentadas como média com desvio‐padrão e comparadas através do teste T Student ou teste Mann‐Whitney U, conforme a normalidade. As variáveis categóricas são apresentadas segundo percentagens e a comparação entre elas foi realizada utilizando o teste do quiquadrado ou de Fisher, como apropriado. Todos os resultados são 2‐sided e um valor de p<0,05 foi considerado estatisticamente significativo.
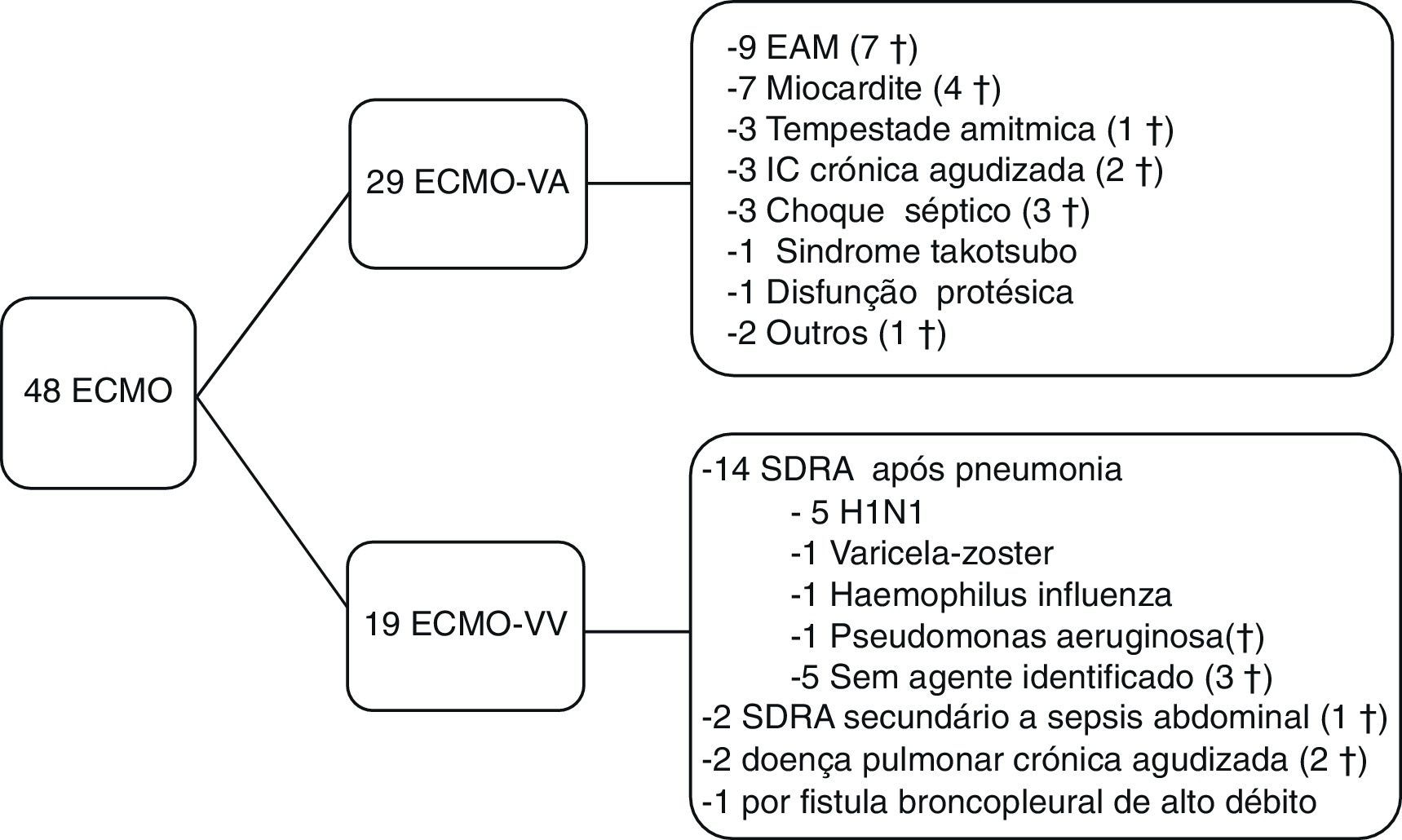
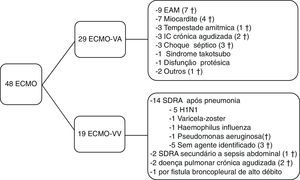
ResultadosCaracterização da populaçãoEntre abril de 2011 e outubro de 2016, 48 doentes colocaram ECMO: 29 ECMO‐VA e 19 ECMO‐VV. A indicação mais comum para colocação de ECMO‐VA foi o EAM com evolução em choque cardiogénico. A síndrome de dificuldade respiratória aguda (SDRA), secundária a infeção viral, foi a causa mais comum de colocação de ECMO‐VV. As restantes indicações estão expostas na Figura 1.
Indicação primária para a colocação da oxigenação por membrana extracorporal e mortalidade, † ‐ morte. ECMO: oxigenação por membrana extracorporal; ECMO‐VV: oxigenação por membrana extracorporal venovenoso; ECMO‐VA: oxigenação por membrana extracorporal venoarterial; EAM: enfarte agudo do miocárdio; IC: insuficiência cardíaca; SDRA: síndrome de dificuldade respiratória aguda.
Dos doentes que colocaram ECMO‐VA, 26 estavam internados na UCIC e três na UCIP. Estes últimos eram doentes com falência cardiovascular secundária a infeção respiratória grave.
A idade média era de 51,9±11,6 anos e 51,7% eram do sexo masculino. Cerca de metade dos doentes que colocaram ECMO‐VA foram transferidos de outro hospital em choque cardiogénico. O tempo médio entre o diagnóstico e a colocação do dispositivo foi de 51h, sendo que 12 doentes foram ventilados e canulados na mesma altura (41%). Treze doentes tiveram PCR intra‐hospitalar pré‐colocação de dispositivo e o tempo médio de retorno de circulação espontânea (RCE) foi de 8,5min. Em três destes doentes o ECMO foi colocado em PCR. O SAVE‐score médio foi de ‐4,2±4,9 e a mediana foi de ‐4,5 (IQR ‐0,25/‐8). Foram utilizados dispositivos de venting em oito doentes (cinco balões intra‐aórticos [BIA] e três Impella CP®). Num dos doentes foi necessário implantar uma segunda cânula venosa jugular para otimização da oxigenação coronária e cerebral – ECMO V‐A‐V
Oxigenação por membrana extracorporal venovenosaDos doentes com ECMO‐VV, 17 estavam internados na UCIP e dois na UCIC (estes últimos colocados por pneumonia grave com ARDS secundário).
A idade média era de 48,5±13,1 anos e 52,6% eram do sexo masculino. O tempo médio entre o diagnóstico e a colocação do dispositivo foi de 9,5 dias. Na altura de colocação de ECMO, todos os doentes já estavam ventilados, sendo o tempo médio entre o início de ventilação e a colocação do dispositivo de 4,6 dias. Dos 16 doentes que colocaram ECMO‐VV por SDRA, em dez foi utilizada a técnica de prone pré‐ECMO e todos, à exceção de um doente, fizeram bloqueio neuromuscular. Todos os doentes tinham score de Murray>3.
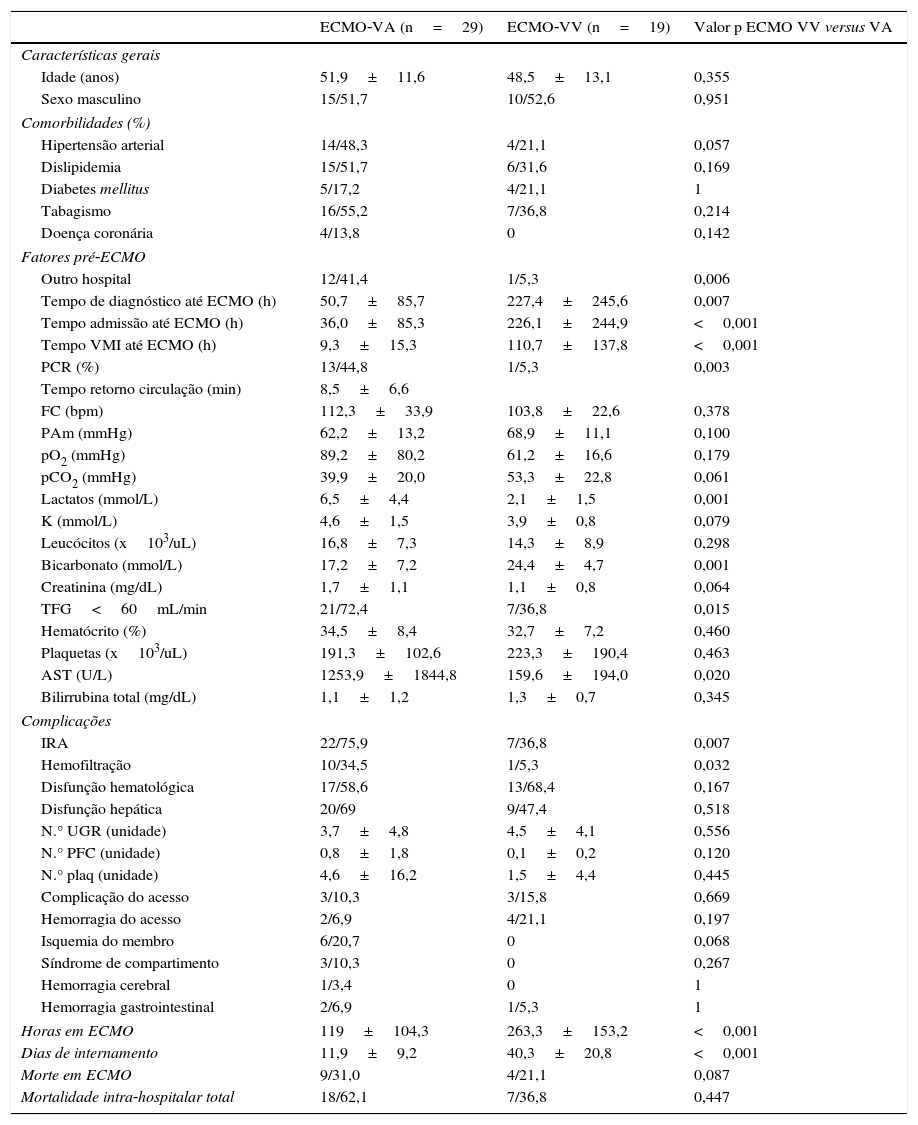
Oxigenação por membrana extracorporal venoarterial vs venovenosaNa análise comparativa entre as duas modalidades de ECMO, os doentes com ECMO‐VA foram mais frequentemente transferidos de outro hospital (41,4 versus 5,3%, p=0,006), tinham menor tempo entre o diagnóstico e a colocação do dispositivo (50,7 versus 227,4h, p=0,007) e menor tempo de ventilação mecânica invasiva (VMI) prévia (9,3 versus 110,7h, p<0,001). O contexto de PCR pré‐implante do dispositivo foi mais frequente nos ECMO‐VA (44,8 versus 5,3%, p=0,003). Nas primeiras 24h de permanência na unidade de cuidados intensivos, os doentes em ECMO‐VA tinham: nível médio de lactato sérico (6,5 versus 2,1mmol/L, p=0,001) e AST (1253,9 versus 159,6 u/L, p=0,02) superiores aos dos doentes em ECMO‐VV, disfunção renal moderada a grave mais frequente (72,4 versus 36,8%, p=0,015), assim como valor médio de bicarbonato sérico inferior (17,2 versus 24,4mmol/L, p=0,001).
Na Tabela 1 encontram‐se os restantes dados que caraterizam esta população.
Características e comparação entre os doentes que realizaram oxigenação por membrana extracorporal venoarterial (ECMO‐VA) e venovenosa (ECMO‐VV)
| ECMO‐VA (n=29) | ECMO‐VV (n=19) | Valor p ECMO VV versus VA | |
|---|---|---|---|
| Características gerais | |||
| Idade (anos) | 51,9±11,6 | 48,5±13,1 | 0,355 |
| Sexo masculino | 15/51,7 | 10/52,6 | 0,951 |
| Comorbilidades (%) | |||
| Hipertensão arterial | 14/48,3 | 4/21,1 | 0,057 |
| Dislipidemia | 15/51,7 | 6/31,6 | 0,169 |
| Diabetes mellitus | 5/17,2 | 4/21,1 | 1 |
| Tabagismo | 16/55,2 | 7/36,8 | 0,214 |
| Doença coronária | 4/13,8 | 0 | 0,142 |
| Fatores pré‐ECMO | |||
| Outro hospital | 12/41,4 | 1/5,3 | 0,006 |
| Tempo de diagnóstico até ECMO (h) | 50,7±85,7 | 227,4±245,6 | 0,007 |
| Tempo admissão até ECMO (h) | 36,0±85,3 | 226,1±244,9 | <0,001 |
| Tempo VMI até ECMO (h) | 9,3±15,3 | 110,7±137,8 | <0,001 |
| PCR (%) | 13/44,8 | 1/5,3 | 0,003 |
| Tempo retorno circulação (min) | 8,5±6,6 | ||
| FC (bpm) | 112,3±33,9 | 103,8±22,6 | 0,378 |
| PAm (mmHg) | 62,2±13,2 | 68,9±11,1 | 0,100 |
| pO2 (mmHg) | 89,2±80,2 | 61,2±16,6 | 0,179 |
| pCO2 (mmHg) | 39,9±20,0 | 53,3±22,8 | 0,061 |
| Lactatos (mmol/L) | 6,5±4,4 | 2,1±1,5 | 0,001 |
| K (mmol/L) | 4,6±1,5 | 3,9±0,8 | 0,079 |
| Leucócitos (x103/uL) | 16,8±7,3 | 14,3±8,9 | 0,298 |
| Bicarbonato (mmol/L) | 17,2±7,2 | 24,4±4,7 | 0,001 |
| Creatinina (mg/dL) | 1,7±1,1 | 1,1±0,8 | 0,064 |
| TFG<60mL/min | 21/72,4 | 7/36,8 | 0,015 |
| Hematócrito (%) | 34,5±8,4 | 32,7±7,2 | 0,460 |
| Plaquetas (x103/uL) | 191,3±102,6 | 223,3±190,4 | 0,463 |
| AST (U/L) | 1253,9±1844,8 | 159,6±194,0 | 0,020 |
| Bilirrubina total (mg/dL) | 1,1±1,2 | 1,3±0,7 | 0,345 |
| Complicações | |||
| IRA | 22/75,9 | 7/36,8 | 0,007 |
| Hemofiltração | 10/34,5 | 1/5,3 | 0,032 |
| Disfunção hematológica | 17/58,6 | 13/68,4 | 0,167 |
| Disfunção hepática | 20/69 | 9/47,4 | 0,518 |
| N.° UGR (unidade) | 3,7±4,8 | 4,5±4,1 | 0,556 |
| N.° PFC (unidade) | 0,8±1,8 | 0,1±0,2 | 0,120 |
| N.° plaq (unidade) | 4,6±16,2 | 1,5±4,4 | 0,445 |
| Complicação do acesso | 3/10,3 | 3/15,8 | 0,669 |
| Hemorragia do acesso | 2/6,9 | 4/21,1 | 0,197 |
| Isquemia do membro | 6/20,7 | 0 | 0,068 |
| Síndrome de compartimento | 3/10,3 | 0 | 0,267 |
| Hemorragia cerebral | 1/3,4 | 0 | 1 |
| Hemorragia gastrointestinal | 2/6,9 | 1/5,3 | 1 |
| Horas em ECMO | 119±104,3 | 263,3±153,2 | <0,001 |
| Dias de internamento | 11,9±9,2 | 40,3±20,8 | <0,001 |
| Morte em ECMO | 9/31,0 | 4/21,1 | 0,087 |
| Mortalidade intra‐hospitalar total | 18/62,1 | 7/36,8 | 0,447 |
As variáveis categóricas estão apresentadas como número total (n) e percentagem (%), e as variáveis contínuas como média±desvio‐padrão. AST: aspartato aminotransferase; FC: frequência cardíaca; h: horas; IRA: insuficiência renal aguda; K: potássio; NA: não aplicável; PAm: pressão arterial média; pCO2: pressão parcial de dióxido de carbono; PCR: paragem cardiorrespiratória; PFC: plasma fresco congelado; Plaq: plaquetas; pO2: pressão parcial de oxigénio; TFG: taxa de filtração glomerular; UGR: unidade de glóbulos rubros; VMI: ventilação mecânica invasiva.
A complicação mais frequente no grupo ECMO‐VA foi a isquemia do membro inferior, com uma prevalência de 20,7% (seis doentes). Três destes necessitaram de fasciotomia urgente, por síndrome de compartimento, e um doente realizou amputação infracondiliana do membro inferior por isquemia irreversível.
No ECMO‐VV foram mais frequentes as complicações relacionadas com o acesso: 21,1% de hemorragias pelo local de acesso e 15,8% de complicações relacionadas com o vaso (um doente com trombo detetado na cânula durante a remoção, um doente com provável síndrome da veia cava superior e um doente com fístula entre a veia e a artéria femoral de baixo débito). Nesta população, houve apenas uma complicação hemorrágica major (hemorragia digestiva alta por úlcera gástrica de stresse complicada) com necessidade de intervenção cirúrgica.
Apesar da maior frequência de complicações hemorrágicas no grupo ECMO‐VV, não houve diferenças estatisticamente significativas quanto à necessidade de transfusão de hemoderivados. Houve apenas um caso de trombocitopenia induzida pela heparina, resolvida com o recurso a lepirudina e um caso de coagulação intravascular disseminada (morte). A disfunção renal aguda e a necessidade de técnica de substituição renal (TSR) foram significativamente mais frequentes nos doentes em ECMO‐VA (insuficiência renal aguda [IRA]: 75,9 versus 36,8%, p=0,007; e TSR: 34,5 versus 5,3%, p=0,032).
A disfunção hematológica foi a mais frequente no ECMO‐VV, ocorrendo em 68,4% dos doentes.
Destino/mortalidadeO ECMO foi utilizado como ponte para transplante ou para dispositivo de suporte ventricular de longa duração em 12 doentes. No ECMO‐VA, nove doentes foram referenciados para transplante cardíaco: três doentes foram transplantados (apenas um sobreviveu), dois doentes colocaram Berlin‐Heart (morte) e os restantes faleceram a aguardar transplante. No ECMO‐VV, três doentes foram referenciados para transplante pulmonar: dois faleceram em lista de espera e um doente foi recusado, sendo retirado o suporte. Os dois doentes que faleceram a aguardar transplante estavam sem sedação e em ventilação espontânea, cumprindo programa de reabilitação ativa na UCIP.
Foram descanulados com sucesso 69% dos doentes em ECMO‐VA e 78,9% dos doentes em ECMO‐VV. O tempo médio de ECMO foi significativamente inferior nos doentes em ECMO‐VA em relação aos em ECMO‐VV (119,0±104,3 versus 263,3±153,2h, p<0,001), assim como os dias de internamento (11,9±9,2 versus 40,3±20,8 dias, p<0,001).
Tiveram alta hospitalar 37,9% dos doentes em ECMO‐VA e 63,2% dos em ECMO‐VV. Importa referir que a mortalidade em ambos os grupos está influenciada pela inclusão de doentes que esperavam órgão para transplante.
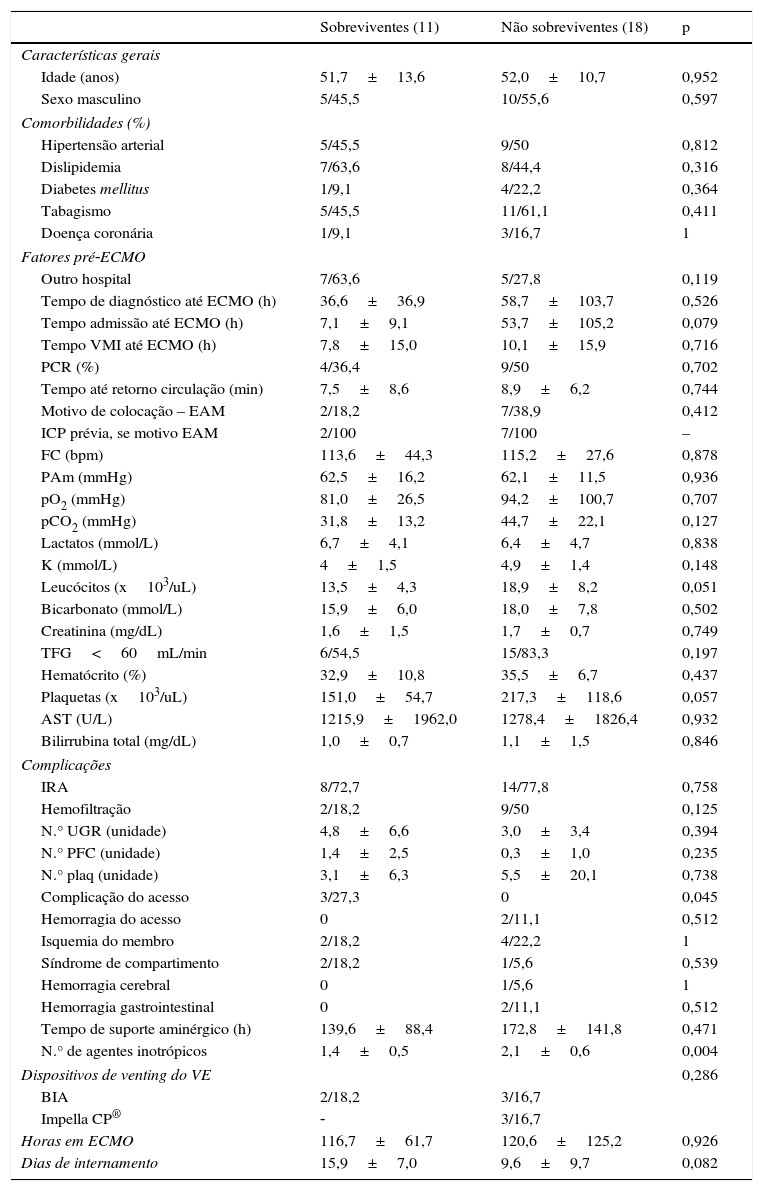
Preditores de mortalidadeNo ECMO‐VA, na análise univariada, verificamos que o único preditor de mortalidade foi o número médio de agentes inotrópicos (1,4±0,5 versus 2,1±0,6, p=0,004). Verificou‐se, ainda, uma tendência para os sobreviventes apresentarem leucócitos mais baixo à admissão (13,5±4,3 versus 18,9±8,2×10^3/uL, p=0,051) e maior tempo médio de internamento (15,9±7,0 versus 9,6±9,7 dias, p=0,082).
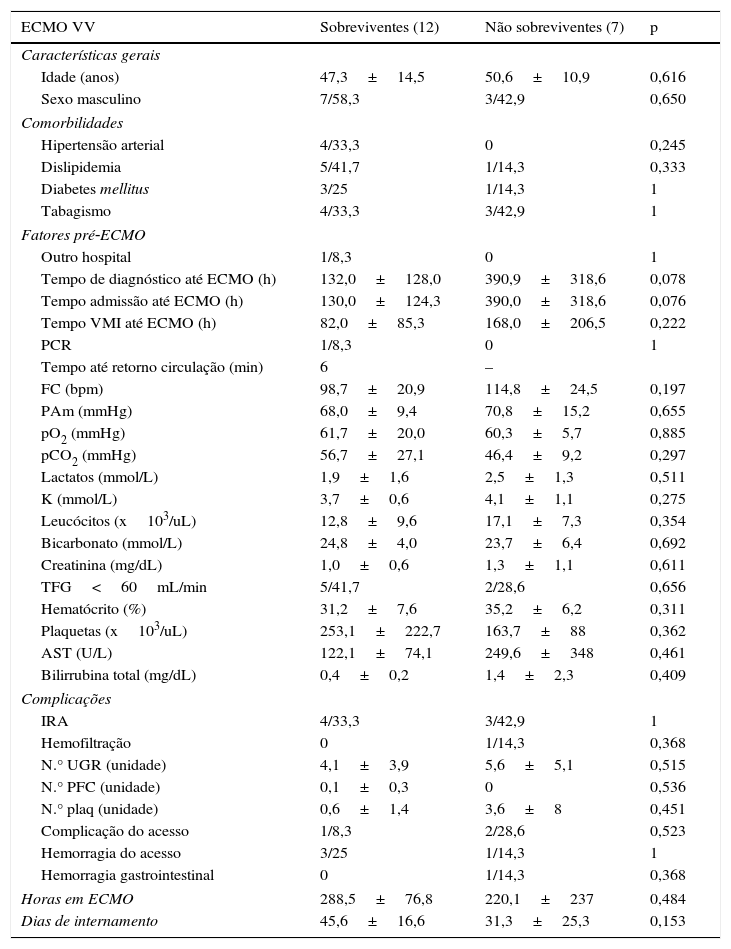
Os sobreviventes no ECMO‐VV apresentaram, tendencialmente, tempo médio entre o diagnóstico e a colocação do dispositivo inferior (132,0±128,0 versus 390,9±318,6h, p=0,078) (ver Tabelas 2 e 3).
Comparação entre os sobreviventes e não sobreviventes na oxigenação por membrana extracorporal venoarterial (ECMO VA)
| Sobreviventes (11) | Não sobreviventes (18) | p | |
|---|---|---|---|
| Características gerais | |||
| Idade (anos) | 51,7±13,6 | 52,0±10,7 | 0,952 |
| Sexo masculino | 5/45,5 | 10/55,6 | 0,597 |
| Comorbilidades (%) | |||
| Hipertensão arterial | 5/45,5 | 9/50 | 0,812 |
| Dislipidemia | 7/63,6 | 8/44,4 | 0,316 |
| Diabetes mellitus | 1/9,1 | 4/22,2 | 0,364 |
| Tabagismo | 5/45,5 | 11/61,1 | 0,411 |
| Doença coronária | 1/9,1 | 3/16,7 | 1 |
| Fatores pré‐ECMO | |||
| Outro hospital | 7/63,6 | 5/27,8 | 0,119 |
| Tempo de diagnóstico até ECMO (h) | 36,6±36,9 | 58,7±103,7 | 0,526 |
| Tempo admissão até ECMO (h) | 7,1±9,1 | 53,7±105,2 | 0,079 |
| Tempo VMI até ECMO (h) | 7,8±15,0 | 10,1±15,9 | 0,716 |
| PCR (%) | 4/36,4 | 9/50 | 0,702 |
| Tempo até retorno circulação (min) | 7,5±8,6 | 8,9±6,2 | 0,744 |
| Motivo de colocação – EAM | 2/18,2 | 7/38,9 | 0,412 |
| ICP prévia, se motivo EAM | 2/100 | 7/100 | – |
| FC (bpm) | 113,6±44,3 | 115,2±27,6 | 0,878 |
| PAm (mmHg) | 62,5±16,2 | 62,1±11,5 | 0,936 |
| pO2 (mmHg) | 81,0±26,5 | 94,2±100,7 | 0,707 |
| pCO2 (mmHg) | 31,8±13,2 | 44,7±22,1 | 0,127 |
| Lactatos (mmol/L) | 6,7±4,1 | 6,4±4,7 | 0,838 |
| K (mmol/L) | 4±1,5 | 4,9±1,4 | 0,148 |
| Leucócitos (x103/uL) | 13,5±4,3 | 18,9±8,2 | 0,051 |
| Bicarbonato (mmol/L) | 15,9±6,0 | 18,0±7,8 | 0,502 |
| Creatinina (mg/dL) | 1,6±1,5 | 1,7±0,7 | 0,749 |
| TFG<60mL/min | 6/54,5 | 15/83,3 | 0,197 |
| Hematócrito (%) | 32,9±10,8 | 35,5±6,7 | 0,437 |
| Plaquetas (x103/uL) | 151,0±54,7 | 217,3±118,6 | 0,057 |
| AST (U/L) | 1215,9±1962,0 | 1278,4±1826,4 | 0,932 |
| Bilirrubina total (mg/dL) | 1,0±0,7 | 1,1±1,5 | 0,846 |
| Complicações | |||
| IRA | 8/72,7 | 14/77,8 | 0,758 |
| Hemofiltração | 2/18,2 | 9/50 | 0,125 |
| N.° UGR (unidade) | 4,8±6,6 | 3,0±3,4 | 0,394 |
| N.° PFC (unidade) | 1,4±2,5 | 0,3±1,0 | 0,235 |
| N.° plaq (unidade) | 3,1±6,3 | 5,5±20,1 | 0,738 |
| Complicação do acesso | 3/27,3 | 0 | 0,045 |
| Hemorragia do acesso | 0 | 2/11,1 | 0,512 |
| Isquemia do membro | 2/18,2 | 4/22,2 | 1 |
| Síndrome de compartimento | 2/18,2 | 1/5,6 | 0,539 |
| Hemorragia cerebral | 0 | 1/5,6 | 1 |
| Hemorragia gastrointestinal | 0 | 2/11,1 | 0,512 |
| Tempo de suporte aminérgico (h) | 139,6±88,4 | 172,8±141,8 | 0,471 |
| N.° de agentes inotrópicos | 1,4±0,5 | 2,1±0,6 | 0,004 |
| Dispositivos de venting do VE | 0,286 | ||
| BIA | 2/18,2 | 3/16,7 | |
| Impella CP® | ‐ | 3/16,7 | |
| Horas em ECMO | 116,7±61,7 | 120,6±125,2 | 0,926 |
| Dias de internamento | 15,9±7,0 | 9,6±9,7 | 0,082 |
As variáveis categóricas estão apresentadas como percentagem e as contínuas como média±desvio‐padrão. AST: aspartato aminotransferase; BIA: balão intra‐aórtico; EAM: enfarte agudo do miocárdio; FC: frequência cardíaca; h: horas; ICP: intervenção coronária percutânea; IRA: insuficiência renal aguda; K: potássio; N.°: número; PAm: pressão arterial média; pCO2: pressão parcial de dióxido de carbono; PCR: paragem cardiorrespiratória; PFC: plasma fresco congelado; Plaq: plaquetas; pO2: pressão parcial de oxigénio; TFG: taxa de filtração glomerular; UGR: unidade de glóbulos rubros; VE: ventrículo esquerdo; VMI: ventilação mecânica invasiva.
Comparação entre os sobreviventes e não sobreviventes na oxigenação por membrana extracorporal venovenosa (ECMO VV)
| ECMO VV | Sobreviventes (12) | Não sobreviventes (7) | p |
|---|---|---|---|
| Características gerais | |||
| Idade (anos) | 47,3±14,5 | 50,6±10,9 | 0,616 |
| Sexo masculino | 7/58,3 | 3/42,9 | 0,650 |
| Comorbilidades | |||
| Hipertensão arterial | 4/33,3 | 0 | 0,245 |
| Dislipidemia | 5/41,7 | 1/14,3 | 0,333 |
| Diabetes mellitus | 3/25 | 1/14,3 | 1 |
| Tabagismo | 4/33,3 | 3/42,9 | 1 |
| Fatores pré‐ECMO | |||
| Outro hospital | 1/8,3 | 0 | 1 |
| Tempo de diagnóstico até ECMO (h) | 132,0±128,0 | 390,9±318,6 | 0,078 |
| Tempo admissão até ECMO (h) | 130,0±124,3 | 390,0±318,6 | 0,076 |
| Tempo VMI até ECMO (h) | 82,0±85,3 | 168,0±206,5 | 0,222 |
| PCR | 1/8,3 | 0 | 1 |
| Tempo até retorno circulação (min) | 6 | – | |
| FC (bpm) | 98,7±20,9 | 114,8±24,5 | 0,197 |
| PAm (mmHg) | 68,0±9,4 | 70,8±15,2 | 0,655 |
| pO2 (mmHg) | 61,7±20,0 | 60,3±5,7 | 0,885 |
| pCO2 (mmHg) | 56,7±27,1 | 46,4±9,2 | 0,297 |
| Lactatos (mmol/L) | 1,9±1,6 | 2,5±1,3 | 0,511 |
| K (mmol/L) | 3,7±0,6 | 4,1±1,1 | 0,275 |
| Leucócitos (x103/uL) | 12,8±9,6 | 17,1±7,3 | 0,354 |
| Bicarbonato (mmol/L) | 24,8±4,0 | 23,7±6,4 | 0,692 |
| Creatinina (mg/dL) | 1,0±0,6 | 1,3±1,1 | 0,611 |
| TFG<60mL/min | 5/41,7 | 2/28,6 | 0,656 |
| Hematócrito (%) | 31,2±7,6 | 35,2±6,2 | 0,311 |
| Plaquetas (x103/uL) | 253,1±222,7 | 163,7±88 | 0,362 |
| AST (U/L) | 122,1±74,1 | 249,6±348 | 0,461 |
| Bilirrubina total (mg/dL) | 0,4±0,2 | 1,4±2,3 | 0,409 |
| Complicações | |||
| IRA | 4/33,3 | 3/42,9 | 1 |
| Hemofiltração | 0 | 1/14,3 | 0,368 |
| N.° UGR (unidade) | 4,1±3,9 | 5,6±5,1 | 0,515 |
| N.° PFC (unidade) | 0,1±0,3 | 0 | 0,536 |
| N.° plaq (unidade) | 0,6±1,4 | 3,6±8 | 0,451 |
| Complicação do acesso | 1/8,3 | 2/28,6 | 0,523 |
| Hemorragia do acesso | 3/25 | 1/14,3 | 1 |
| Hemorragia gastrointestinal | 0 | 1/14,3 | 0,368 |
| Horas em ECMO | 288,5±76,8 | 220,1±237 | 0,484 |
| Dias de internamento | 45,6±16,6 | 31,3±25,3 | 0,153 |
As variáveis categóricas estão apresentadas como percentagem e as contínuas como média±desvio‐padrão. AST: aspartato aminotransferase; FC: frequência cardíaca; h: horas; IRA: insuficiência renal aguda; K: potássio; PAm: pressão arterial média; pCO2: pressão parcial de dióxido de carbono; PCR: paragem cardiorrespiratória; PFC: plasma fresco congelado; Plaq: plaquetas; pO2: pressão parcial de oxigénio; TFG: taxa de filtração glomerular; UGR: unidade de glóbulos rubros; VMI: ventilação mecânica invasiva.
Ao longo de cinco anos, foram colocados em ECMO 48 doentes: 29 por falência cardiovascular e 19 por falência respiratória. Pela análise da Tabela 1, verificamos que os doentes em ECMO‐VA têm, pelo menos inicialmente, marcadores de doença mais grave: valores de lactato sérico e AST mais elevados, maior prevalência de disfunção renal moderada a grave, assim como bicarbonato sérico mais baixo. O menor tempo entre o diagnóstico e a colocação do ECMO, assim como de VMI prévia, é explicado pela maior gravidade de apresentação clínica. Quase metade dos doentes em ECMO‐VA foi transferida em choque cardiogénico de outro hospital; estes são doentes que provavelmente apresentam maior tempo de evolução do choque, o que condiciona maior progressão nas disfunções de órgão associadas.
Na nossa coorte foram utilizadas técnicas percutâneas de descompressão do VE em cerca de 30% dos doentes. Outras medidas, como a redução da pós‐carga, o uso de vasodilatadores arteriais, de inotrópicos, a restrição de fluidos e a hemofiltração, podem ajudar a prevenir esta complicação e foram utilizadas de forma sistemática em todos os casos6–8. Está descrito que a distensão do VE, que compromete a recuperação e leva a edema pulmonar, pode ocorrer em 10‐60% dos doentes com ECMO‐VA, sendo mais comum em recém‐nascidos e crianças7.
A hipocoagulação continua a ser desafiante nestes doentes, tendo em conta que o contacto entre o sangue e o circuito extracorporal gera ativação e consumo de fatores pró e anticoagulantes, dificultando o equilíbrio e controlo da díade trombose/hemorragia9. O agente anticoagulante recomendado é a HNF9,10. Na nossa população, todos os doentes fizeram perfusão contínua de heparina, havendo apenas um doente com diagnóstico de trombocitopenia induzida pela heparina. Neste caso, houve necessidade de alterar a hipocoagulação, tendo sido utilizada a lepirudina.
Apesar do ECMO ser uma ferramenta cada vez mais utilizada para suporte de doente com falência cardíaca ou respiratória, o seu uso está associado a complicações frequentes, tendo algumas delas impacto significativo na qualidade de vida dos sobreviventes6. Neste estudo ocorreram complicações hemorrágicas em dez doentes (21%). O local mais frequente de hemorragia foi no local de inserção das cânulas. Na nossa coorte, a hemorragia e o maior número de hemoderivados transfundidos não foram preditores de mortalidade, apesar do que existe referenciado na literatura3,11–13. Este facto será provavelmente explicado pela reduzida dimensão da amostra, que não permite atingir significado estatístico. Na nossa série, as complicações neurológicas foram raras, apenas documentadas num doente, com hemorragia intracerebral espontânea. Na literatura, a incidência de complicações neurológicas varia entre 15‐37%14,15. A baixa taxa de deteção deve‐se, provavelmente, à subutilização da tomografia computorizada cerebral e à ausência de investigação anátomo‐patológica post‐mortem.
A isquemia aguda do membro inferior ocorreu exclusivamente em doentes com ECMO‐VA (6/29 doentes). A utilização da cânula de reperfusão distal e o uso contralateral da cânula venosa são essenciais para a diminuição da incidência desta complicação16,17. Três doentes necessitaram de fasciotomia urgente (10,3% dos em ECMO‐VA) e um doente de amputação do membro inferior. Estes resultados são semelhantes a outros já publicados, onde a isquemia do membro inferior atinge os 10‐30% e a síndrome de compartimento os 8‐14%8,12,16,18–20.
Tal como na meta‐análise de Cheng et al., a IRA foi a complicação mais frequentemente associada a este suporte, atingido na nossa série mais de 75% dos doentes em ECMO‐VA e quase 40% em ECMO‐VV20. A velocidade da bomba e a amplitude de distribuição de glóbulos rubros foram recentemente identificados como preditores do desenvolvimento de IRA21. Dez doentes com ECMO‐VA e um doente com ECMO‐VV necessitaram de TSR. Apesar da necessidade de TSR refletir a inadequada perfusão do rim e/ou a sua lesão direta pelo suporte (hemólise, transfusões, rabdomiólise), na nossa coorte, o uso de TSR não se associou, significativamente, a maior mortalidade em nenhum dos grupos. A dimensão da amostra poderá explicar este facto, uma vez que diversas séries já demonstraram que a IRA e o uso de TSR são preditores independentes de mortalidade nos indivíduos em ECMO6,11,19,22,23. O grupo ECMO‐VV teve mortalidade hospitalar de 36,8% e o grupo ECMO‐VA 62,1%. Estes resultados são consistentes com os observados pelo registo internacional do ELSO, onde os indivíduos adultos tiveram uma mortalidade hospitalar de 42% no ECMO‐VV e de 59% no ECMO‐VA24. Importa referir que 69% dos doentes em ECMO‐VA e 78,9% dos em ECMO‐VV foram descanulados com sucesso.
Na área do ECMO‐VV, o CESAR trial foi o primeiro estudo aleatorizado a mostrar claros benefícios do ECMO‐VV. Este estudo de 180 doentes com insuficiência respiratória grave aleatorizou doentes para estratégia conservadora ou para transferência para um centro com ECMO, 63% destes (contra 47% no controlo) sobreviveram25. Foi em 2009, com a pandemia do H1N1, que a maioria dos centros melhorou a sua experiência com o ECMO26. No nosso centro, dos cinco doentes com SDRA secundária a infeção por H1N1 todos sobreviveram.
Na análise univariada, verificamos que no ECMO‐VV não foram encontrados preditores de mortalidade; noutras séries já publicadas a existência de patologia pulmonar prévia, a idade avançada, a existência prévia de barotrauma e o número de dias em VMI prévia ao ECMO são preditores independentes de mortalidade13,27,28.
No ECMO‐VA, o número superior de agentes inotrópicos utilizados durante o internamento foi preditor de mortalidade. Noutras séries já publicadas, são preditores independentes de mortalidade: a idade avançada, sexo feminino, índice de massa corporal elevado, diabetes mellitus, lactato sérico elevado, número de unidades de GR transfundidas e colocação do ECMO em PCR3,6,18,23,29,32.
Quando se avalia a mortalidade, tendo em conta o motivo de colocação de dispositivo, verifica‐se que o choque cardiogénico pós‐EAM e o choque pós‐cardiotomia têm a mortalidade mais elevada, reportando a maioria das séries valores de 40‐75%18,29–32. Na nossa amostra, estes doentes tiveram uma mortalidade de 77%. Nestas séries, a colocação do ECMO neste contexto ocorreu maioritariamente antes ou durante o procedimento de revascularização percutânea, enquanto, no nosso caso, só foi colocado o suporte ventricular, quando, após a intervenção percutânea bem‐sucedida, o doente mantinha choque cardiogénico refratário, refletindo, neste caso, falência de bomba, e provavelmente menor potencial de recuperação.
Tendo em conta os custos elevados deste suporte e a alta mortalidade a curto‐prazo, é vital a seleção criteriosa de doentes. Shmidt et al. publicaram em 2015 o SAVE‐score, que tem como objetivo prever a sobrevivência após ECMO‐VA5. Na nossa amostra, o SAVE‐score médio foi de ‐4,2±4,9 e a mediana foi de ‐4,5 (IQR ‐0,25/‐8). Assim, a maioria dos nossos doentes estaria na classe de risco III a IV, com sobrevivências estimadas de 30‐42%, o que corresponde de facto à sobrevivência observada de 37,9%. Este score carece ainda de validação, mas poderá ser uma ferramenta muito útil no futuro5.
LimitaçõesAs limitações do nosso trabalho devem ser vistas no contexto do seu design. É um estudo de coorte, retrospetivo e sem utilização de grupo de controlo. O tamanho da amostra e a inclusão de algumas variáveis que os autores consideraram importantes foi impossibilitada pelo registo insuficiente de alguns dados. Poderão, assim, existir vieses que podem ter influenciado os resultados apresentados. Por outro lado, este é um registo de um único centro e, portanto, a generalização dos resultados é limitada.
Apesar disto, este é um estudo que mostra os resultados do mundo real, de um hospital terciário na utilização do ECMO.
ConclusãoOs doentes com falência cardiovascular, que colocam ECMO‐VA, têm mortalidade muito superior à dos doentes com falência respiratória, que colocam ECMO‐VV. No ECMO‐VV a implantação mais tardia do dispositivo parece associar‐se a pior prognóstico.
As complicações foram relativamente comuns, particularmente as vasculares. Associadas à disfunção hematológica e ao difícil equilíbrio na hemóstase, as estratégicas que visam minimizar as suas consequências são prioritárias no manejo destes doentes.
No ECMO‐VA, a necessidade de mais fármacos inotrópicos foi preditor de mortalidade.
Podemos concluir que, apesar da pequena amostra apresentada, os resultados alcançados são semelhantes aos publicados pela maioria das séries. Este é o primeiro registo publicado que demonstra os resultados globais da experiência com ECMO num hospital terciário, em Portugal.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflito de interessesOs autores declaram não haver conflito de interesses.