A hipercolesterolemia resulta de uma alteração do metabolismo das lipoproteínas e pode ter uma origem ambiental ou genética, como é o caso da hipercolesterolemia familiar. A evidência de que a hipercolesterolemia se associa ao processo aterosclerótico desde a idade pediátrica justifica o rastreio obrigatório em todas as crianças de risco e a instituição de terapêutica individualizada desde a idade pré-escolar.
ObjetivoAvaliar as crianças referenciadas por hipercolesterolemia à consulta de Pediatria.
MétodoForam incluídas as crianças e adolescentes referenciados à consulta de Pediatria por hipercolesterolemia. Procedeu-se à avaliação da história familiar e de parâmetros antropométricos, clínicos e bioquímicos e, quando justificado, ao estudo molecular.
ResultadosForam avaliadas 168 crianças. Apresentavam fenótipo de hipercolesterolemia familiar 46 crianças e, em 22 destas, foi identificada uma mutação no gene do recetor das lipoproteínas de baixa densidade. O perfil lipídico revelou valores significativamente superiores de colesterol total e colesterol n-HDL no grupo com mutação relativamente ao sem mutação (colesterol total 316,5±75,9mg/dL versus 260,9±42,0mg/dL; colesterol n-HDL 268,3±72,6mg/dL versus 203,5±43,9mg/dL; p<0,05). Do total das crianças, 55 efetuaram terapêutica farmacológica, as restantes apenas intervenção comportamental. Registou-se maior redução do c-LDL nos indivíduos com intervenção farmacológica relativamente aos sujeitos apenas a alterações comportamentais (30,3 versus 18,1%). Os efeitos laterais dos fármacos foram desprezíveis.
ConclusãoÉ possível manter um perfil lipídico sustentado em valores normais na maioria dos indivíduos com hipercolesterolemia familiar, de forma a reduzir o risco de evolução precoce do processo aterosclerótico, comprovadamente associado a graves complicações cardiovasculares logo desde a idade pediátrica.
Hypercholesterolemia results from an alteration, genetic or acquired, in lipoprotein metabolism. Evidence that hypercholesterolemia is associated with the atherosclerotic process from childhood justifies the screening of high-risk children and initiation of therapy at preschool ages.
ObjectiveTo assess children referred for pediatric consultations due to hypercholesterolemia.
MethodsChildren and adolescents referred for pediatric consultations with a diagnosis of hypercholesterolemia were enrolled. Information on family history and clinical, anthropometric and biochemical parameters was recorded and, when appropriate, molecular study was performed.
ResultsA total of 168 children were assessed. Forty-six presented a familial hypercholesterolemia phenotype and in 22 of these, a mutation in the low-density lipoprotein (LDL) receptor gene was identified. The lipid profile of the group with mutations showed significantly higher values of total and non-high-density lipoprotein (HDL) cholesterol compared to the group without mutations (total cholesterol 316.5±75.9 mg/dl vs. 260.9±42,0 mg/dl; non-HDL cholesterol 268.3±72.6 mg/dl vs. 203.5±43.9 mg/dl; p<0.05). Of the total, 55 were prescribed pharmacological therapy and the others underwent diet and exercise interventions only. A greater reduction in LDL cholesterol was observed in individuals under pharmacological therapy compared to those prescribed diet and exercise only (30.3% vs. 18.1%). Drug side effects were insignificant.
ConclusionIt is possible to maintain a normal lipid profile in most individuals with familial hypercholesterolemia in order to reduce the risk of early onset of atherosclerosis, which is associated with serious cardiovascular complications from childhood.
A doença cardiovascular constitui a principal causa de mortalidade e morbilidade nos países mais industrializados1,2.
Estudos como o PDAY (Pethobiological Determinants of Atherosclerosis in Youth) e o Bogalusa Heart Study demonstraram que o processo aterosclerótico se desenvolve desde a idade pediátrica, para ele contribuindo quer fatores genéticos quer fatores ambientais, nomeadamente os hábitos alimentares e a atividade física2–6.
Os principais fatores de risco de doença cardiovascular do adulto incluem o elevado valor de colesterol das lipoproteínas de baixa densidade (c-LDL), o baixo valor de colesterol das lipoproteínas de alta densidade (c-HDL), a hipertensão arterial (HTA), a diabetes mellitus tipo 1 e 2, o tabagismo e a obesidade1–3. A manifestação precoce de muitos destes fatores de risco, já desde a idade pediátrica, justifica a intervenção do pediatra na prevenção da doença cardiovascular, logo desde os primeiros anos de vida1–3.
A hipercolesterolemia resulta de uma alteração do metabolismo das lipoproteínas, condicionando uma elevação do colesterol total, da fração c-LDL ou dos triglicerídeos e/ou uma redução do c- HDL. A maior parte das crianças com dislipidemia apresenta uma forma idiopática (poligénica, associada a fatores de risco ou multifatorial), sendo minoritárias as dislipidemias monogénicas, como a hipercolesterolemia familiar (FH), e as dislipidemias secundárias7.
A FH é uma doença autossómica dominante, com uma frequência de 1/500 nas populações europeias, que resulta de uma alteração num dos três genes conhecidos: LDLR, APOB e PCSK9. Caracteriza-se por valores elevados de colesterol LDL no plasma que se vai depositando nas artérias, levando ao desenvolvimento prematuro de aterosclerose e doenças cardiovasculares8.
Os níveis séricos de lípidos e lipoproteínas aumentam progressivamente durante a primeira infância, atingindo valores próximos dos da idade adulta pelos 2 anos de idade. Posteriormente, o desenvolvimento pubertário é acompanhado de um decréscimo destes valores, para depois se assistir de novo a um aumento até aos valores de adulto2,7. Estes factos têm implicações no rastreio da hipercolesterolemia, sendo recomendado o seu rastreio em crianças de risco após os 2 anos de idade2.
A evidência de que a hipercolesterolemia se associa ao processo aterosclerótico desde a idade pediátrica, e o aumento da prevalência dos fatores de risco para doença cardiovascular desde a idade pediátrica, nomeadamente a obesidade e a síndrome metabólica, justificam não só o rastreio da dislipidemia nas crianças, como também a instituição de terapêutica individualizada desde a idade pré-escolar3,9.
Constitui objetivo deste trabalho a avaliação clínica e laboratorial das crianças referenciadas por hipercolesterolemia à consulta de Pediatria.
Material e métodosForam avaliadas as crianças e adolescentes referenciadas à consulta externa de Pediatria e Nutrição de um hospital terciário por suspeita de hipercolesterolemia.
Foi efetuada recolha de informação relativa aos antecedentes familiares (história de doença cardiovascular, valores séricos de colesterol total, c-LDL, triglicerídeos), à avaliação antropométrica em todas as consultas (peso, estatura, índice da massa corporal (IMC) e percentagem de massa gorda), ao perfil lipídico do doente avaliado após um jejum mínimo de 12 h (colesterol total, c-LDL, c-HDL, triglicerídeos, apolipoproteínas A1 e B (Apo A1 e Apo B) e lipoproteína (a) (Lp[a]). Nas crianças com fenótipo de FH foi realizado o estudo molecular. Foi analisada a terapêutica efetuada, nomeadamente a intervenção comportamental e a farmacológica (fármaco utilizado, eficácia e efeitos colaterais). Foram valorizados os efeitos colaterais de acordo com o recomendado.
A percentagem de massa gorda foi avaliada nos doentes com idade igual ou superior a 6 anos através de bioimpedância.
A seleção dos casos sugestivos de FH baseou-se em critérios adaptados de Simon Broome Heart Research Trust (Tabela 1)10.
Critérios de FH adaptados de «Simon Broome Heart Research Trust»
| Definição de hipercolesterolemia familiar confirmada: |
| • Caso-índex: Criança menor de 16 anos com colesterol total acima de 260mg/dL (6,7mmol/L) ou colesterol LDL acima de 155mg/dL (4,0mmol/L);Caso-índex: Adulto com colesterol total acima de 290mg/dL (7,5mmol/L) oucolesterol LDL acima de 190mg/dL (4,9mmol/L),e• Xantomas tendinosos no caso-índex ou familiar (pais, filhos, avós, irmãos, tios)ou• Evidência genética de mutação no gene recetor de LDL ou ApoB |
| Definição de hipercolesterolemia familiar possível: |
| • Caso-índex: Criança menor de 16 anos com colesterol total acima de 260mg/dL (6,7mmol/L) ou colesterol LDL acima de 155mg/dL (4,0mmol/L);Caso-índex: Adulto com colesterol total acima de 290mg/dL (7,5mmol/L) oucolesterol LDL acima de 190mg/dL (4,9mmol/L),e• História familiar de enfarte do miocárdio antes dos 50 anos em avós e tios ou antes dos 60 anos nos pais, irmãos e filhos e/ou história familiar de níveis elevados de colesterol (> 290mg/dL) nos pais, irmãos ou filhos; ou colesterol total acima de 290mg/dL (7,5mmol/L) nos avós e/ou tios. |
ApoB: apolipoproteína B; Colesterol LDL: colesterol das lipoproteínas de baixa densidade.
O estudo molecular foi realizado através da referenciação para o Estudo Português de Hipercolesterolemia Familiar e envolveu o caso índex, progenitores e outros familiares, sendo faseado em três etapas. O estudo genético efetuado incluiu a pesquisa de mutações nos genes que codificam para o recetor das LDL (LDLR) e para a apolipoproteína B (APOB), a pesquisa de grandes rearranjos no gene LDLR e, para os doentes nos quais não foi identificada qualquer mutação nos genes anteriormente descritos, a pesquisa de mutações pontuais no gene Proprotein convertase subtilisin/kexin type 9 (PCSK9)11–14. A simples presença de uma mutação no gene LDLR não implica que seja causa de doença. Foram realizados estudos familiares para confirmar a cossegregação da mutação encontrada com a hipercolesterolemia na família de modo a poder comprovar a patogenicidade da alteração. Foi ainda determinada a frequência alélica do polimorfismo no gene da apolipoproteína E (APOE).
Os dados foram analisados através do software SPSS (versão 19.0). Foi utilizado o teste t e, para variáveis não paramétricas, o teste Kruskal-Wallis.
ResultadosForam avaliadas 168 crianças e adolescentes, com igual distribuição entre os sexos (sexo feminino 51,1%) e uma média de idades na primeira consulta de 8,7 anos (mediana de 9,0 anos), sendo que a idade mínima aquando da referenciação para a consulta foi de 2,5 anos.
A avaliação antropométrica da população total na primeira consulta revelou um IMC Z-Score médio de 1,6±1,0.
O perfil lipídico da população total revelou um colesterol total médio de 242,2±60,1mg/dL (variável entre 124,0 e 552,0mg/dL) e um n-HDL médio de 191,8±60,3mg/dL (variável entre 94,0 e 472,3mg/dL).
Das crianças e adolescentes estudados, 46 apresentaram fenótipo compatível com FH e, em 22 destes, foi identificada uma mutação no gene LDLR. Não foram identificadas mutações nos genes APOB e PCSK9. A pesquisa de polimorfismos no gene APOE revelou uma frequência do alelo ε2 de 3,7%, do alelo ε3 de 78,0% e do alelo ε4 de 18,3%. A frequência do alelo ε4 foi inferior nos indivíduos portadores de uma mutação no gene LDLR (23,9 versus 45,0%) (p=0,153).
A comparação do estado de nutrição observado na primeira consulta dos doentes com fenótipo de FH, não revelou diferenças significativas entre os grupos de doentes com e sem mutação (IMC Z-Score médio de 0,73±1,56 versus 1,43±2,34, p=0,265 (Tabelas 2 e 3).
Avaliação do IMC e do perfil lipídico (média±desvio padrão) dos doentes com e sem fenótipo de hipercolesterolémia familiar
| Fenótipo de FH (n=46) | Sem fenótipo de FH (n=122) | |
| IMC Z-Score | 1,31±0,51 | 1,78±3,32 |
| CT (mg/dL) | 288,02±66,44 | 225,65±48,16 |
| LDL-c (mg/dL) | 204,60±62,98 | 145,18±34,16 |
| HDL-c (mg/dL) | 53,90±14,67 | 50,63±13,20 |
| n-HDL (mg/dL) | 235,13±67,03 | 175,19±48,44 |
| TG (mg/dL) | 106,13±57,31 | 187,08±41 |
CT: colesterol total; HDL-c: colesterol das lipoproteínas de alta densidade; IMC: índice de massa corporal; LDL-c: colesterol das lipoproteínas de baixa densidade; n-HDL: colesterol total, exceto o das lipoproteínas de alta densidade; TG: triglicerídeos.
Avaliação do IMC e do perfil lipídico (média±desvio padrão) dos doentes com fenótipo de hipercolesterolemia familiar, com e sem mutação identificada
| Mutação identificada (n=22) | Sem mutação identificada (n=24) | p | |
| IMC Z-Score | 0,91±0,07 | 1,58±0,50 | 0,265 |
| CT (mg/dL) | 316,48±75,86 | 260,86±42,04 | < 0,05 |
| LDL-c (mg/dL) | 234,26±73,05 | 174,95±30,91 | < 0,05 |
| HDL-c (mg/dL) | 51,94±14,78 | 55,76±14,68 | 0,638 |
| n-HDL (mg/dL) | 268,27±72,61 | 203,57±42,81 | < 0,05 |
| TG (mg/dL) | 115,24±63,42 | 96,05±49,42 | 0,353 |
CT: colesterol total; HDL-c: colesterol das lipoproteínas de alta densidade; IMC: índice de massa corporal; LDL-c: colesterol das lipoproteínas de baixa densidade; n-HDL: colesterol total, exceto o das lipoproteínas de alta densidade; TG: triglicerídeos.
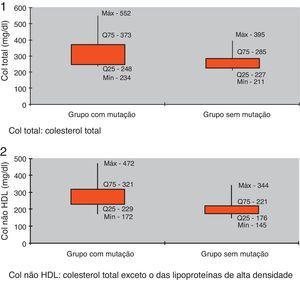
O perfil lipídico revelou valores significativamente superiores no grupo com mutação relativamente ao sem mutação mas com fenótipo de FH (colesterol total 316,5±75,9mg/dL versus 260,9±42,0mg/dL; Colesterol n-HDL 268,3±72,6mg/dL versus 203,5±43,9mg/dL; p<0,05) (Tabela 3, Figuras 1 e 2).
Das 168 crianças e adolescentes avaliadas, em 113 foi efetuada apenas intervenção comportamental, que incluiu medidas dietéticas com vista à redução da ingesta total de gorduras, da quantidade de gorduras saturadas e de colesterol, bem como promoção da atividade física. Nos restantes 55 doentes, para além da intervenção comportamental, foi necessária a introdução de terapêutica farmacológica.
Foi necessário recorrer à terapêutica farmacológica em 73,9% dos doentes com fenótipo de FH, o que contrapõe com os 16,4% de doentes sem fenótipo que utilizaram terapêutica farmacológica. Dos doentes com fenótipo de FH, foi necessária intervenção farmacológica em 90,9% daqueles com mutação e em 58,3% daqueles sem mutação identificada.
Nos indivíduos portadores do alelo ε4 no gene APOE foi constatada uma resposta mais eficaz à intervenção comportamental. Cerca de 57,1% destes necessitaram de terapêutica farmacológica, enquanto entre os doentes sem alelo ε4, em 74,1% foi imperativa a terapêutica farmacológica (p<0,05).
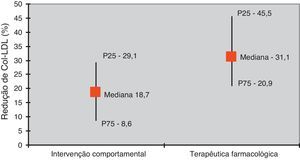
Registou-se maior redução do c-LDL nos indivíduos com intervenção farmacológica relativamente aos sujeitos apenas a alterações comportamentais (31,1 versus 18,7%) (Figura 3) (p<0,05).
A terapêutica farmacológica incluiu o uso de resinas em 37 doentes, estatinas em 23 adolescentes e ezetimiba em 20. Treze dos doentes fizeram terapêutica combinada com estatinas e ezetimiba. A estatina utilizada nos doentes desta consulta foi a pravastatina.
A terapêutica com resinas esteve associada a sintomas gastrointestinais, tais como a obstipação e flatulência, e a dificuldades na adesão terapêutica condicionadas pelo paladar e consistência granulosa. Os efeitos laterais condicionaram a suspensão da terapêutica com estatinas num adolescente, no qual foi observada uma elevação dos valores das enzimas musculares, essencialmente da enzima creatinoquinase até um máximo de 3588 U/L, mantendo-se o doente assintomático.
A avaliação antropométrica da população total na primeira consulta revelou um IMC Z-Score médio de 1,6±1,0. A comparação do estado de nutrição observado na primeira consulta dos doentes com fenótipo de hipercolesterolemia familiar não revelou diferenças significativas entre os grupos de doentes com e sem mutação (IMC Z-Score médio de 0,73±1,56 versus 1,43±2,34, p<0,265).
DiscussãoA hipercolesterolemia constitui um fator de risco para o desenvolvimento do processo aterosclerótico precoce, constituindo uma preocupação desde a infância3,9.
Não existem atualmente recomendações consensuais das diferentes sociedades pediátricas quanto ao rastreio da hipercolesterolemia na infância. Não obstante, parece reunir maior consenso o rastreio seletivo de crianças com história familiar de doença cardiovascular precoce (considerada antes dos 55 anos no sexo masculino e antes dos 65 no sexo feminino) ou de alterações do perfil lipídico, história familiar desconhecida e de crianças com outros fatores de risco, nomeadamente obesidade, hipertensão e diabetes mellitus2,3,5,7,15. De realçar que o rastreio seletivo não permite identificar a totalidade das crianças com hipercolesterolemia5,7. Este rastreio não deverá ter lugar antes dos 2 anos de idade, já que uma intervenção dietética restritiva numa fase tão precoce de infância poderá condicionar progressivamente o período de rápido crescimento e desenvolvimento psicomotor, característicos dos primeiros 2 anos de vida2,6,7. Refira-se uma publicação de dezembro de 2011, refletindo a posição atual da Academia Americana de Pediatria que recomenda o rastreio universal aos 9 anos, mas realçando a necessidade de uma avaliação a partir do terceiro ano de vida nas crianças de risco16.
Na população estudada, a idade mínima aquando da referenciação para a consulta foi de 2 anos e 6 meses.
Das crianças e adolescentes estudados, 46 apresentaram fenótipo compatível com FH, uma condição transmitida, na grande maioria dos casos, de forma autossómica dominante e que condiciona um défice de recetores das LDL, resultando numa diminuição da clearance das LDL da circulação.
O diagnóstico pode ser equacionado pela suspeita clínica perante uma fração LDL do colesterol superior ao percentil 95, para o sexo e idade, e uma história familiar de alterações semelhantes no perfil lipídico ou de doença cardiovascular precoce3. Os valores de corte de definição de normalidade para o colesterol total, colesterol das LDL e colesterol das HDL são estabelecidos internacionalmente pelos percentis do National Cholesterol Education Programme (NCEP), permanecendo inalterados desde a sua publicação em 199217 até à mais recente revisão em 201116 (Tabela 4).
Valores de corte para o colesterol total e colesterol das LDL para crianças e adolescentes
| Categoria | Percentil | Colesterol total (mg/dL) | Colesterol-LDL (mg/dL) |
| Aceitável | < P75 | < 170 | < 110 |
| Borderline | P75-P95 | 170-199 | 110-129 |
| Elevado | > P95 | > 200 | > 130 |
Colesterol LDL: colesterol das lipoproteínas de baixa densidade.
Adaptado do: National Cholesterol Education Program (NCEP).
O estudo genético estabelece a certeza do diagnóstico, embora nem sempre acessível de uma forma generalizada3,6,11,18. No estudo genético são identificadas mutações no gene LDLR e, mais raramente, mutações no gene APOB (5% dos casos) ou no gene PCSK9 (cerca de 2% dos doentes)18–20.
Dos doentes com fenótipo de FH foi identificada uma mutação no gene LDLR em cerca de 50% dos casos, resultados concordantes com o referido na literatura19. Não foram identificadas mutações nos genes APOB e PCSK9.
O perfil lipídico revelou valores significativamente superiores no grupo com mutação identificada relativamente ao sem mutação (colesterol total 316,5±75,9mg/dL versus 260,9±42,0mg/dL; p<0 05; colesterol n-HDL 268,3±72,6mg/dL versus 203,5±43,9mg/dL; p<0,05), tal como descrito noutros estudos já publicados13,14,20. A pesquisa de polimorfismos no gene APOE revelou uma frequência do alelo ε2 de 3,7%, do alelo ε3 de 78,0% e do alelo ε4 de 18,3%. O alelo ε4 tem sido descrito como associado a maior risco de doença coronária21. Tal como descrito em diversos artigos, na população estudada, nos indivíduos portadores do alelo ε4 foi constatada uma resposta mais eficaz à intervenção comportamental. Estes aspetos justificaram que, no âmbito do presente trabalho, se tenha procedido à avaliação dos polimorfismos do gene APOE. Não parece haver relação entre o polimorfismo do gene APOE e a eficácia da terapêutica farmacológica21.
A frequência do alelo ε4 foi inferior nos indivíduos portadores de uma mutação no gene do recetor das LDL (23,9 versus 45,0%). Diversos estudos realizados não têm encontrado relação entre o polimorfismo do gene APOE e as mutações do gene LDLR21, pelo que a relação encontrada neste trabalho poderá dever-se à limitada dimensão da amostra.
Das 168 crianças e adolescentes avaliadas, em 113 foi apenas instituída intervenção comportamental, baseada num regime alimentar hipocolesterolemizante, bem como na promoção da atividade física. Nos restantes 55 doentes, apesar da intervenção comportamental, foi necessária a conjugação com terapêutica farmacológica para a redução da fração LDL do colesterol para valores considerados aceitáveis, de acordo com as últimas recomendações da Academia Americana de Pediatria16.
Foram os doentes com fenótipo de FH (73,9 versus 16,4%) e, entre estes, os com mutação identificada (90,9 versus 58,3%), aqueles em que se verificou maior necessidade de intervenção farmacológica. Tal poderá explicar-se pelos valores médios mais elevados de colesterol total e de colesterol n-HDL e eventualmente, por uma menor resposta à intervenção dietética nos doentes com fenótipo de FH.
As alterações dos hábitos alimentares têm em vista à redução do suprimento total de gorduras, particularmente da quantidade de ácidos gordos saturados para 7% do total de calorias e a redução do colesterol da dieta para 200mg/d; os ácidos gordos trans devem constituir menos de 1% do total de calorias2,6,15,22,23. O aumento do consumo de fibras e a suplementação de alguns produtos dietéticos com esteroides vegetais têm sido também associados a uma melhoria, embora modesta, do perfil lipídico2,3,5,22,23. A atividade física reflete-se sobretudo no aumento da fração HDL do colesterol e na diminuição dos triglicerídeos, embora uma redução da fração LDL também tenha já sido documentada2,3,24.
De acordo com a literatura, a redução do colesterol LDL condicionado pela intervenção dietética é de cerca de 10-20%, sendo a terapêutica farmacológica habitualmente associada a um decréscimo superior: 10-20% para as resinas, 20-50% para as estatinas, 20% para o ezetimiba2,3,7,23. Em concordância com os estudos publicados, no grupo de doentes estudados, a correção do perfil lipídico foi mais notória naqueles submetidos a terapêutica farmacológica associada a alterações dietéticas do que naqueles apenas com intervenção comportamental.
A terapêutica farmacológica disponível para o tratamento da dislipidemia na idade pediátrica inclui principalmente três grupos de fármacos: as resinas, atuando através da inibição da reabsorção dos ácidos biliares a nível do trato gastrointestinal; as estatinas, capazes de diminuir a produção hepática de colesterol por inibição da 3-hidroxi-3metilglutaril coenzima A redutase (responsável pela produção endógena do colesterol), o que, consequentemente, aumenta a expressão dos recetores das LDL, promovendo, assim, a clearence das LDL da circulação; o ezetimiba, responsável pela diminuição da absorção de colesterol da dieta a nível intestinal2,3,6,25,26.
Poder-se-á referir ainda os fibratos, o ácido nicotínico e os óleos de peixe, se bem que a sua utilização em pediatria seja limitada. Os fibratos não estão aprovados para a idade pediátrica e não são utilizados nas situações de HF na criança16. A niacina (ou ácido nicotínico) é também efetiva na redução do colesterol das LDL e dos triglicerídeos, pela diminuição da produção hepática das VLDL, no entanto, os seus efeitos adversos (flushing em 3/4 dos casos, falência hepática com alteração dos enzimas hepáticos em cerca de 1/4 dos casos, miopatia, intolerância à glicose e hiperuricemia) desaconselham o seu uso em idade pediátrica2,27. Os ácidos gordos de cadeia longa da série ω-3 veiculados pelo óleo de peixe (que atuam particularmente na diminuição da síntese hepática de triglicerídeos e promovem a degradação/oxidação dos ácidos gordos; aumentam o teor de colesterol das HDL, mas também das LDL), estão aprovados para a idade adulta, não havendo nenhum ensaio clínico em crianças com HF, pelo que, na generalidade, não é considerada a sua utilização na idade pediátrica16.
Estudos recentes permitiram estabelecer a eficácia e segurança dos agentes farmacológicos disponíveis, nomeadamente o seu uso em crianças pré-pubertárias3,23,28. A terapêutica farmacológica em crianças menores de 8 anos só está preconizada perante elevações marcadas da fração LDL do colesterol (> 500mg/dL), habitualmente encontradas na forma homozigótica da FH2. Crianças e adolescentes com diabetes, doença renal, patologia cardíaca congénita, doenças do tecido conjuntivo ou patologia oncológica exigem uma terapêutica mais agressiva2.
As resinas, usadas, no geral, em idades inferiores aos 8 anos estão habitualmente associadas a baixa compliance pela forma granulosa e relativamente insolúvel de apresentação e pelo desconforto gastrointestinal resultante, como a flatulência e obstipação2,3,5,7,15, o que se pode comprovar no presente estudo. Mais recentemente, tem sido promovido o uso do colesevelam, uma resina de segunda geração com maior capacidade de ligação aos ácidos biliares a nível intestinal e maior tolerabilidade, mas é ainda reduzida a experiência na idade pediátrica e, mesmo essa, limitada a indivíduos acima dos 10 anos de idade3,5,29. Os efeitos laterais habitualmente associados às estatinas prendem-se com as mialgias e elevação das enzimas hepáticas e musculares, raramente associadas a episódios de rabdomiólise, pelo que a monitorização clínica e analítica é obrigatória2,3,5,7,15,28. A preocupação com a teratogenicidade torna as estatinas contraindicadas na gravidez e amamentação5. Os padrões de segurança observados em estudos recentes tornam as estatinas indicadas após os 8 anos de idade, independentemente do estádio pubertário, por vezes até como terapêutica de primeira linha2,8,15,28,30. O ezetimiba está apenas associado a efeitos gastrointestinais, pelo que constitui uma importante droga para a idade pediátrica2,15,25.
Nos doentes avaliados, os efeitos laterais dos fármacos foram desprezíveis, havendo apenas a referir a baixa compliance às resinas motivada pela formulação granulosa em crianças em idade pré-escolar ou escolar, bem como a elevação das enzimas musculares num doente que, embora inferior a 10 vezes o valor normal e mantendo-se o doente assintomático, motivou a suspensão da pravastatina por prudência. Os valores das enzimas musculares normalizaram rapidamente após suspensão das estatinas.
Nesta consulta de nutrição pediátrica, a pravastatina é a única estatina utilizada. De facto, trata-se da estatina com maior utilização na Europa e a única que está aprovada pela US FDA para crianças a partir dos 8 anos2, ao contrário das outras estatinas (lovastatin,… androsuvastatin) que estão aprovadas apenas a partir dos 10 anos31. Na realidade, a maioria dos estudos com utilização de estatinas na idade pediátrica inclui a pravastaina e a lovastatina. Os estudos com pravastatina são os que tiveram a maior duração (até 4 anos e meio), claramente superior aos registados com simvastatina (máximo 12 meses), rosuvastatina (máximo 40 semanas) e atorvastatina (único estudo com a duração de 26 semanas)16, revelando-se, em todos os estudos, uma droga segura16,31,32. Estes são dados da maior importância, tendo em conta que estamos a falar de uma intervenção sustentada ao longo da vida a partir de uma idade em que o indivíduo se encontra ainda numa fase de crescimento e de maturação, sendo, por isso, naturais as reservas levantadas relativamente a potenciais efeitos adversos a médio e longo prazos, já que, a curto prazo, as estatinas se têm revelado seguras. De referir ainda um importante estudo com pravastatina que incidiu não apenas sobre a sua ação sobre o perfil lipídico (o habitualmente avaliado nestes estudos), mas também sobre a evolução da espessura da íntima e média carotídea (diminuição da espessura), relevante marcador de risco aterosclerótico33.
Sendo a dislipidemia uma patologia que acompanha muitas vezes a criança no seu percurso até e pela vida adulta, representando um importante fator de risco cardiovascular, é fundamental assegurar uma avaliação e intervenção adequadas e sustentada ao longo do ciclo de vida pediátrico, particularmente nas crianças de risco1.
ConclusõesA hipercolesterolemia constitui um fator de risco para o desenvolvimento do processo aterosclerótico precoce.
Dos doentes com fenótipo de FH, foi identificada uma mutação do gene no recetor das LDL em cerca de 50% dos casos, resultados concordantes com o referido na literatura. Os doentes com mutação apresentaram valores mais elevados de colesterol total e colesterol n-HDL.
Os indivíduos portadores do alelo ε4 no gene da APOE tiveram melhor resposta à intervenção comportamental do que aqueles sem o alelo ε4.
A correção do perfil lipídico foi mais notória nos doentes com terapêutica farmacológica associada a alterações dietéticas do que naqueles apenas com intervenção comportamental, tendo sido desprezíveis os efeitos laterais dos fármacos.
É possível manter um perfil lipídico sustentadamente em valores normais na maioria dos indivíduos portadores de FH. Só assim se pode, nesses indivíduos, reduzir o risco de evolução precoce do processo aterosclerótico comprovadamente associado a graves complicações cardiovasculares, logo desde idades precoces.
É desejável o rastreio sistemático de todas as crianças de risco a partir do terceiro ano de vida, devendo os restantes ser rastreados a partir dos 9 anos de idade, de acordo com as recomendações mais recentes, uma vez que a maioria dos casos está por diagnosticar, com graves consequências em termos de saúde cardiovascular.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos de seu centro de trabalho acerca da publicação dos dados de pacientes e que todos os pacientes incluídos no estudo receberam informações suficientes e deram o seu consentimento informado por escrito para participar nesse estudo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflito de interessesAC Alves foi financiada por uma bolsa de doutoramento da Fundação para a Ciência e Tecnologia (SFRH/BD/27990/2006) e AM Medeiros e o Estudo Português de Hipercolesterolemia Familiar por uma bolsa da Sociedade Portuguesa de Cardiologia.
AC Alves foi financiada por uma bolsa de doutoramento da Fundação para a Ciência e Tecnologia (SFRH/BD/27990/2006) e AM Medeiros e o Estudo Português de Hipercolesterolemia Familiar por uma bolsa da Sociedade Portuguesa de Cardiologia.
AC Alves foi financiada por uma bolsa de doutoramento da Fundação para a Ciência e Tecnologia (SFRH/BD/27990/2006) e AM Medeiros e o Estudo Português de Hipercolesterolemia Familiar por uma bolsa da Sociedade Portuguesa de Cardiologia.