Os autores apresentam o caso de uma doente com os diagnósticos de miocardiopatia hipertrófica e estenose aórtica, na qual foi identificada a presença de um gradiente elevado ao nível do trato de saída do ventrículo esquerdo. O reconhecimento da patologia responsável pela sintomatologia foi desafiante, com envolvimento de várias técnicas de imagem, tendo sido fundamental a contribuição do ecocardiograma transesofágico. O diagnóstico final de estenose aórtica severa conduziu à referenciação para cirurgia de substituição valvular, com sucesso. A presença destas duas patologias em simultâneo num mesmo doente é conhecida, embora incomum. A sua combinação cria importantes desafios diagnósticos e terapêuticos, os quais serão objeto de discussão neste artigo.
The authors report the case of a patient diagnosed with both hypertrophic cardiomyopathy and aortic stenosis. Due to clinical deterioration, additional investigation was performed, and a high left ventricular outflow tract gradient was identified. Correct identification of the condition causing the symptoms was challenging, and involved several imaging techniques, the contribution of transesophageal echocardiography being crucial. The final diagnosis of severe aortic stenosis led to successful valve replacement surgery. The presence of these two conditions in the same patient has been documented, although it is uncommon. This association poses particular diagnostic and therapeutic challenges, which are discussed in this paper.
A estenose aórtica (EAo) e a miocardiopatia hipertrófica (MCH) são duas patologias que podem condicionar gradientes hemodinâmicos no trato de saída do ventrículo esquerdo (TSVE)1. Em ambos os casos, a presença de obstrução significativa tem um impacto clínico, terapêutico e prognóstico1–3.
A presença destas duas patologias no mesmo doente está descrita, embora seja incomum4. A sua combinação cria importantes desafios diagnósticos e terapêuticos4. É necessária uma avaliação ecocardiográfica meticulosa para a correta identificação da patologia responsável pela obstrução5, contudo, esta reveste‐se de particularidades. O resultado desta avaliação pode levar a opções terapêuticas distintas6,7.
Este caso clínico pretende discutir a complexidade destas situações.
Caso clínicoMulher de 68 anos, com antecedentes de hipertensão arterial, dislipidemia, obesidade e neoplasia da mama (submetida a mastectomia esquerda, quimioterapia e radioterapia adjuvantes em 1998). Referenciada à consulta de cardiologia em 04/2011 para estudo de dor torácica, sem outra sintomatologia do foro cardiovascular. Ao exame objetivo auscultava‐se sopro sistólico grau III/VI, audível no 2.° espaço intercostal direito, em crescendo‐decrescendo, com irradiação carotídea, verificando‐se redução da intensidade com manobra de Valsalva e ortostatismo súbito, e aumento desta com o agachamento.
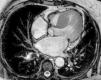
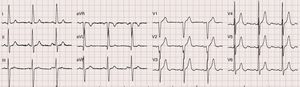
Era portadora do seguinte estudo complementar: eletrocardiograma em ritmo sinusal com critérios de voltagem de hipertrofia ventricular esquerda, sem sobrecarga (Figura 1); ecocardiograma transtorácico (EcoTT) – descrito como «tecnicamente muito difícil» ‐, ventrículo esquerdo (VE) com hipertrofia concêntrica, sem alterações da cinética segmentar e com função sistólica global preservada; válvula aórtica (VAo) calcificada com estenose moderada (gradiente VE/Ao médio 21mmHg).
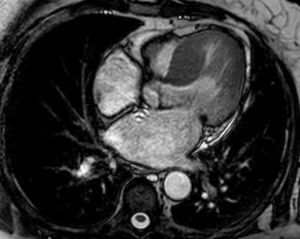
Por baixa probabilidade pré‐teste de doença coronária foi realizada angioTC coronária, que identificou calcificação coronária ligeira (score de cálcio por método de Agatston: 54), sem lesões com compromisso endoluminal significativo; como achado complementar detetou aumento da espessura do septo interventricular (SIV, 22mm). Por suspeita de MCH foi realizada ressonância magnética (RM) que confirmou o diagnóstico de MCH assimétrica (hipertrofia do SIV basal e médio – 22mm, restantes paredes de espessura normal), VE não dilatado, com fração de ejeção de 69% e massa indexada de 78g/m2; aurícula esquerda moderadamente dilatada (área 33cm2); sem realce tardio no estudo com gadolínio (Figura 2). A doente não apresentava critérios de risco reconhecidos para morte súbita. O estudo genético para a doença de Anderson‐Fabry foi negativo. A pesquisa de mutações clássicas nos genes codificadores das proteínas do sarcómero encontra‐se em curso.
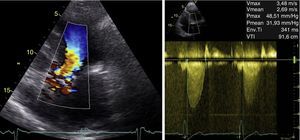
Aos 18 meses de seguimento a doente apresentou agravamento da capacidade funcional por dispneia para esforços moderados (NYHA II). Foi repetido EcoTT: VE com hipertrofia acentuada do SIV basal e boa função sistólica global; VAo aparentemente tricúspide, calcificada, com abertura reduzida, sem possibilidade de realizar planimetria; válvula mitral calcificada com movimento sistólico anterior (SAM). O estudo Doppler revelou aceleração do fluxo com início no TSVE (Figura 3), com pico de velocidade mesossistólico, gradiente VE/Ao máximo 49mmHg e médio 32mmHg, favorecendo a hipótese de obstrução fixa (Figura 3). Não foi visualizado pico de velocidade sistólico tardio, com e sem manobra de Valsalva.
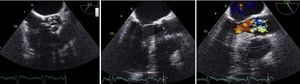
Dadas as limitações do EcoTT, a doente realizou ecocardiograma transesofágico (EcoTE). Este revelou VAo dismórfica, com calcificação acentuada e fusão da cúspide não coronária e coronária esquerda, com área estimada por planimetria de 0,6cm2 (0,27cm2/m2, Figura 4). O estudo com Doppler cor permitiu a diferenciação clara de um fluxo laminar a nível do TSVE e de um fluxo turbulento a nível da VAo, durante toda a sístole, confirmando a suspeita de obstrução apenas a nível valvular (Figura 4).
O estudo hemodinâmico invasivo revelou um gradiente VE/Ao pico a pico de 52mmHg; sem gradiente intraventricular. Excluída doença coronária significativa.
A doente foi submetida a cirurgia com implantação de prótese mecânica Medtronic Hall n.° 22 em posição aórtica. Aos seis meses de seguimento apresenta melhoria da capacidade funcional. O EcoTT revela prótese aórtica normofuncionante.
DiscussãoEste caso clínico pretende alertar para as dificuldades inerentes ao estudo de um doente com MCH e EAo, nomeadamente na avaliação da gravidade de cada uma das patologias e na identificação da que é funcionalmente mais relevante. A atribuição do gradiente elevado à EAo conduziu à orientação da doente para cirurgia de substituição valvular, com resolução da obstrução e melhoria sintomática.
O estudo destes doentes baseia‐se numa meticulosa avaliação ecocardiográfica da região do TSVE4,5. O Doppler cor e pulsado são essenciais para localizar o nível a que ocorre aceleração do fluxo8, contudo, nem sempre o EcoTT permite uma conclusão definitiva.
O Doppler contínuo permite a quantificação da obstrução e a morfologia da curva é especialmente útil na diferenciação entre obstrução fixa e dinâmica9,10. A MCH obstrutiva caracteriza‐se pela presença de um gradiente ao nível do TSVE, ou menos frequentemente mesoventricular11, sensível a variações da pré‐carga, pós‐carga ou contratilidade12. Dado o carácter predominantemente dinâmico, o gradiente desenvolve‐se na telessístole e a curva de velocidades de fluxo adquire um padrão assimétrico em dagger shape. Pelo contrário, a EAo comporta‐se como uma obstrução fixa do fluxo à saída do VE, presente durante toda a sístole e com pico de velocidade máxima mesossistólico, pelo que a curva adquire um contorno arredondado e simétrico (bell shape)5,9,10.
Neste caso clínico, o estudo com Doppler contínuo indiciava a presença de uma obstrução fixa; contudo, a existência de SAM e de hipertrofia septal importante faziam suspeitar da presença de obstrução subaórtica dinâmica. Na avaliação destes doentes a interpretação da curva do Doppler deve ser cuidadosa, dado que os dois perfis de velocidades podem sobrepor‐se e a presença de um segundo gradiente pode não ser reconhecida4. Na presença de um elevado nível de suspeição e no caso do estudo por EcoTT ser subótimo, deve recorrer‐se ao EcoTE4,13.
O EcoTE tem ainda um papel importante na pesquisa de outras patologias que podem condicionar uma obstrução fixa no TSVE: a própria MCH (por reação fibrótica provocada pelo contacto da válvula mitral com o SIV), presença de tecido mitral acessório, membrana subvalvular ou estenose subaórtica em túnel12. Neste caso, o EcoTE foi fundamental na identificação da aceleração de fluxo a nível valvular e na exclusão destas patologias.
A utilização da RM cardíaca na determinação de velocidades no TSVE já foi descrita, contudo, a sua avaliação por estudo Doppler no EcoTT está mais validada13. Por vezes, apenas a abordagem invasiva permite uma correta avaliação hemodinâmica14.
A avaliação da gravidade da EAo em doentes com suspeita de MCH obstrutiva reveste‐se de algumas particularidades, existindo pouca informação sistematizada sobre o tema5,9,14. A determinação do gradiente transvalvular usando a equação modificada de Bernoulli (ΔP=4Vmax2) obedece a um conjunto de pressupostos que impossibilitam a sua utilização em doentes com estenoses em série14. Quando a velocidade proximal à estenose é superior a 1,0m/s o gradiente máximo pode ser estimado através da fórmula ΔP=4Vmax2 ‐ 4Vproximal2; contudo, o cálculo do gradiente médio é mais complexo e sua abordagem é de difícil aplicação na prática clínica9. A avaliação correta de gradientes pode ser apenas possível através do estudo hemodinâmico invasivo14.
A equação de continuidade para avaliação da área valvular não é válida na presença de obstrução no TSVE9. A planimetria é o método recomendado, idealmente com recurso ao EcoTE13. Neste caso, a presença de uma válvula dismórfica, com calcificação acentuada e com área valvular anatómica em 0,6cm2 conduziu ao diagnóstico de EAo severa.
O diagnóstico de MCH na presença de EAo significativa também não é linear. Este baseia‐se na presença de hipertrofia ventricular esquerda, frequentemente assimétrica com envolvimento do SIV, na ausência de outra etiologia8,11,13,15. A EAo associa‐se habitualmente a um padrão de hipertrofia uniforme com distribuição concêntrica16, contudo, em cerca de 10% dos casos é descrito um padrão de hipertrofia assimétrica septal4,16,17, o que gera dificuldades diagnósticas: resposta adaptativa ou MCH concomitante? No caso clínico descrito, a presença de hipertrofia septal marcada e SAM favoreceram o diagnóstico de MCH concomitante. O estudo genético, assim como a avaliação da evolução da hipertrofia ventricular após cirurgia valvular, pode apoiar o diagnóstico. Outras características que corroboram o diagnóstico de MCH sugeridas em alguns estudos são: a presença de outras anomalias da válvula mitral (alongamento do folheto anterior), dos músculos papilares (hipertrofia, carácter bífido ou deslocamento anteroapical) e a história familiar4,8,14. A RM pode ter um papel importante na avaliação de algumas destas características14.
ConclusõesEste artigo pretende realçar a complexidade do estudo de doentes com MCH e EAo severa, sintomáticos e com gradientes elevados ao nível do TSVE. O estudo ecocardiográfico é desafiante. A sua avaliação cuidadosa revela‐se muito importante pelo impacto direto que tem na escolha da estratégia terapêutica e, assim, no prognóstico do doente.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflito de interessesOs autores declaram não haver conflito de interesses.