O diagnóstico de cardiopatia congénita é estabelecido habitualmente em idade precoce, logo, a endocardite infecciosa é uma forma de apresentação rara desta patologia.
Descreve-se um caso clínico de um adolescente com febre intermitente com uma semana de evolução e perda ponderal não quantificada. A observação detetou um sopro holossistólico rude e um sopro diastólico, associados a um frémito na região precordial. Analiticamente, apresentava sinais sugestivos de um processo infeccioso ativo. A investigação etiológica revelou a presença de uma comunicação interventricular perimembranosa restritiva, bicuspidia aórtica com regurgitação aórtica e vegetações a nível da válvula mitral e aórtica. Perante o diagnóstico de endocardite mitroaórtica, iniciou antibioterapia endovenosa associada a terapêutica anticongestiva. Após melhoria clínica inicial, desenvolveu quadro de insuficiência cardíaca congestiva. Repetiu o ecocardiograma, que mostrou abcesso paravalvular aórtico e mitral extenso. A antibioterapia foi substituída e a terapêutica anticongestiva foi intensificada. Foi posteriormente submetido a cirurgia cardíaca. A evolução tem sido favorável, mantendo-se assintomático sob terapêutica anticongestiva.
A diagnosis of congenital heart disease is usually established at an early age, so infective endocarditis is a rare form of presentation.
The authors describe the case of a male adolescent with a week-long history of intermittent fever and unquantified weight loss. Physical examination detected pansystolic and diastolic murmurs, and an associated precordial thrill. Laboratory tests showed evidence of an active infection. Etiological investigation revealed a perimembranous ventricular septal defect, aortic regurgitation, and aortic and mitral valve vegetations. A diagnosis of mitral-aortic infective endocarditis was made and he was started on intravenous antibiotics and anticongestive therapy. After initial clinical improvement, he developed symptoms and signs of congestive heart failure. Repeat echocardiography showed an extensive mitral-aortic paravalvular abscess. The antibiotics were changed and anticongestive therapy was intensified, and he subsequently underwent surgery. The outcome has been generally favorable, and at present he is asymptomatic under anticongestive therapy.
A endocardite infecciosa (EI) é responsável por cerca de 0,5-1 de cada 1000 admissões hospitalares (excluindo a endocardite pós-operatória). Aproximadamente 70% dos casos de EI em pediatria ocorrem em crianças com cardiopatia congénita1, especialmente naquelas com comunicação interventricular (CIV)2.
Descreve-se um caso clínico de um adolescente, aparentemente previamente saudável, com diagnóstico tardio de cardiopatia congénita, sendo a primeira manifestação da doença um processo de endocardite infecciosa.
Caso clínicoOs autores descrevem um caso clínico de um adolescente de 12 anos, de etnia cigana e contexto socioeconómico desfavorável, com antecedentes pessoais patológicos desconhecidos (sem registo de consultas de vigilância infantil prévias) e sem qualquer diagnóstico prévio de uma eventual patologia cardíaca. Recorreu ao serviço de urgência do Hospital da Área de Residência no sétimo dia de um quadro caracterizado por febre intermitente, tosse por acessos e perda ponderal não quantificada, sem outras queixas associadas. A auscultação cardíaca revelou um sopro holossistólico rude no bordo esquerdo do esterno e um sopro diastólico no segundo espaço intercostal direito, associados a um frémito na região précordial. O exame objetivo, evidenciou ainda múltiplas cáries não tratadas. Sem outras alterações relevantes, nomeadamente sinais de insuficiência cardíaca congestiva (ICC). Analiticamente, destacava-se a presença de um processo infeccioso ativo (leucocitose neutrofílica – 24×103/μl com 20×103/μl neutrófilos e proteína C reativa de 5,6mg/dl). Realizou um ecocardiograma transtorácico (ETT) com estudo Doppler, por telemedicina com o nosso Serviço, identificando-se uma pequena CIV perimembranossa restritiva e bicuspidia da válvula aórtica associada, sem estenose valvular mas com regurgitação moderada (grau iii/vi); observou-se ainda a presença de vegetações aórtico-mitrais. A função ventricular esquerda estava conservada.
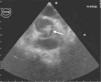
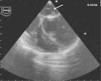
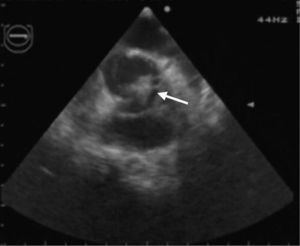
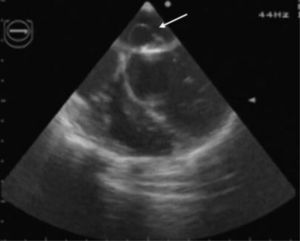
Perante o diagnóstico de endocardite mitroaórtica, iniciou tratamento antibiótico endovenoso empírico com vancomicina (30mg/kg/d) e gentamicina (5mg/kg/d). Iniciou também terapêutica anticongestiva oral com diuréticos (furosemida 1mg/kg/dose 12/12h e espironolactona 25mg 12/12h) e inibidores da enzima de conversão da angiotensina (captopril 1mg/kg/dose 8/8h). Posteriormente, isolou-se nas hemoculturas colhidas previamente ao início da antibioticoterapia, um Streptococcus mitis, sensível à antibioticoterapia previamente instituída. Teve uma evolução clínica inicial favorável com atingimento da apirexia no sexto dia de tratamento. Contudo, na segunda semana após a admissão hospitalar, houve reaparecimento da febre, associada a sinais e sintomas de ICC. Perante este agravamento clínico, a antibioticoterapia foi substituída por ceftriaxone (60mg/kg/d) e teicoplanina (10mg/kg/d), em associação à intensificação da terapêutica diurética, com aumento da dose de furosemida para 1mg/kg/dose 6/6h e administrada de forma endovenosa, mantendo a restante terapêutica nas doses e forma de administração previamente instituídas. As hemoculturas colhidas antes da substituição da antibioticoterapia vieram a revelar-se negativas. Nesta fase, realizou também um ecocardiograma transesofágico, que revelou vegetações em ambas as válvulas mitral e aórtica (Figuras 1 e 2), assim como um abcesso paravalvular miroaórtico. A função ventricular esquerda, nesta altura, apresentava-se ligeiramente comprometida.
Foi adicionada rifampicina (15mg/kg/d) ao esquema terapêutico antibiótico.
Apesar da optimização da terapêutica anticongestiva, manteve-se sempre clinicamente instável e em classe funcional ii-iii/iv da New York Heart Association, com sinais de baixo débito cardíaco carecendo de apoio inotrópico. Foi então referenciado, 4d depois deste agravamento clínico, para um centro cirúrgico e a cirúrgica preconizada incluiu a substituição da válvula aórtica por um homoenxerto aórtico, remoção das vegetações da válvula mitral, com reconstrução do folheto anterior desta válvula com pericárdio bovino e encerramento direto da CIV. O período pós-operatório decorreu sem complicações relevantes e o adolescente manteve o segundo esquema antibiótico instituído por mais 4 semanas pós-cirurgia, que corresponde a um esquema terapêutico de 6 semanas no total (9d sob vancomicina e gentamicina e 5 semanas sob ceftriaxone, teicoplanina e rifampicina).
Durante o follow-up houve uma melhoria ecocardiográfica evidente. Atualmente, 3 anos após a EI, o adolescente encontra-se clinicamente estável sob terapêutica anticongestiva. O último ETT realizado evidencia apenas uma regurgitação mitral ligeira a moderada (i-ii/iv), com função biventricular normal. Contudo, a aurícula esquerda (AE) ainda continua dilatada (diâmetro diastólico da AE = 41mm, que corresponde a um Z-score de +3,21 e relação em Doppler modo M AE/aorta=1,4), associado a pressões pulmonares estimadas na artéria pulmonar de 40-45mmHg, que traduz hipertensão pulmonar ligeira.
DiscussãoA EI é rara, mas potencialmente fatal na população pediátrica. A mortalidade intra-hospitalar ronda os 20%, mas aumenta exponencialmente nos casos complicados3.
Aproximadamente 70% dos casos de EI em pediatria ocorrem em crianças com cardiopatia congénita (CC)1. A frequência desta patologia em idade pediátrica parece estar a aumentar, devido, em parte, ao aumento de crianças sobreviventes após correção cirúrgica de CC complexas4. Esta associação entre CC e EI permanece como um fator de risco para o resto da vida. Todas as CC, com exceção da comunicação intra-auricular tipo ostium secundum, predispõem para EI. Os defeitos mais frequentemente implicados incluem tetralogia de Fallot, comunicação interventricular (CIV), doença valvular aórtica, transposição das grandes artérias e shunt sistémico-pulmonar4.
O adolescente descrito neste caso clínico apresentava uma CIV e bicuspidia da válvula aórtica, ambas não diagnosticadas previamente. Numa série publicada, a incidência de EI em crianças com CIV foi de 1-2,4 por 1000 crianças5.
O Staphylococcus aureus é o microrganismo mais frequentemente envolvido na EI aguda nos países desenvolvidos. A infeção por Streptococcus do grupo viridans ou α-hemolíticos (que inclui o Streptococcus mitis) também é frequente, especialmente em crianças com patologia dentária, causando doença subaguda6, conforme evidenciado no nosso caso. Mais recentemente, é notório um aumento da incidência de EI causada por fungos ou microrganismos do grupo HACEK (Haemophilus, Actinobacillus, Cardiobacterium, Eikenella e Kingella), associados a recém-nascidos e doentes imunocomprometidos4.
Dois fatores são importantes na patogénese da EI: uma área de lesão endotelial e a presença de bacteriémia, mesmo que transitória. Os pacientes têm algum grau de alteração hemodinâmica subjacente, nomeadamente a presença de um gradiente de pressão ou um fluxo turbulento entre duas cavidades cardíacas ou entre os grandes vasos7. Estas particularidades hemodinâmicas produzem lesão endotelial, que, por um lado, pode ser diretamente invadido por microrganismos virulentos, ou, por outro lado, induzir à formação de trombos e posterior adesão bacteriana, com eventual formação de vegetações. À semelhança do nosso caso, uma causa desta bacteriémia transitória está relacionada com má higiene oral e cáries dentárias não tratadas, associadas ou não a procedimentos dentários.
Os critérios modificados de Duke são, atualmente, os mais utilizados para efetuar o diagnóstico de EI. Eles contemplam aspetos da anamnese, exame físico e exames complementares de diagnóstico (presença de duas ou mais hemoculturas positivas a microrganismos típicos de EI e dados ecocardiográficos que comprovem o envolvimento, de novo, do endocárdio)8.
O tratamento empírico inicial engloba a utilização de uma penicilina antiestafilocócica associada a um aminoglicosídeo. Deste modo, os microrganismos mais frequentes (S.viridans, S. aureus e gram-negativos) estão cobertos. A seleção final da antibioticoterapia é direcionada após os resultados do teste de sensibilidade. A duração do tratamento depende do agente etiológico isolado, mas, em média, varia entre 4 e 8 semanas de antibioticoterapia endovenosa. Esta longa duração é essencial para assegurar concentrações bactericidas e, assim, poder atingir os microrganismos com baixo nível metabólico presentes nas vegetações, abrigados da atividade fagocítica.
A cirurgia desempenha um papel muito importante nos casos mais desfavoráveis, nomeadamente na presença clínica de ICC refratária ao tratamento médico ou secundária a insuficiência valvular, presença de abcesso perivalvular ou vegetações de tamanho superior a um cm, e casos de infeção fúngica ou por Pseudomonas4. Historicamente, o dogma aceite era o de evitar a cirurgia durante a fase ativa da doença, devido à friabilidade dos tecidos, o que tornava a cirurgia difícil e conduzia a elevada mortalidade pós-operatória e a elevado risco de disfunção valvular. Contudo, atualmente, esta conduta foi abandonada e deve evitar-se o atraso no recurso à cirurgia9.
No nosso caso, o adolescente foi encaminhado para um centro cirúrgico após agravamento clínico secundário a diversas complicações, que são critérios para cirurgia urgente, isto é, em poucos dias10. As indicações para cirurgia urgente incluem: 1. Presença de insuficiência cardíaca congestiva com compromisso da função ventricular esquerda (recomendação Ib). 2. Doença não controlada devido à presença de infeção local, como o abcesso paravalvular aórtico (recomendação Ib) ou a persistência de febre (recomendação Ib). 3. Prevenção de embolismo sistémico em casos associados a grandes vegetações aórticas e/ou mitrais (recomendação Ic)10.
A opção cirúrgica escolhida inicial recaia sobre o procedimento de Ross. No entanto, a substituição da válvula aórtica por um homoenxerto aórtico foi necessária, uma vez que o procedimento de Ross estava contraindicado nesta situação, já que o abcesso aórtico se estendia anteriormente até à parede da artéria pulmonar, tornando-a friável e, por isso, de utilização impossível em posição sistémica.
Para finalizar, tão importante quanto o diagnóstico e o tratamento da EI é a sua prevenção. Manter uma boa higiene dentária e consultas dentárias periódicas são as mais importantes atitudes para a prevenção da EI. As mais recentes linhas orientadoras preconizam um uso mais racional da antibioticoterapia profilática, tendo restringido o seu uso a grupos específicos de cardiopatias8.
ConclusãoA EI em idade pediátrica está, na grande maioria das situações, associada a cardiopatia congénita. O diagnóstico é essencialmente clínico em associação a alterações ecocardiográficas de novo e hemoculturas positivas a microrganismos típicos.
A antibioticoterapia é uma pedra basilar no tratamento desta patologia, que requer uma duração prolongada, entre quatro e oito semanas de antibióticos administrados por via endovenosa. No entanto, a medida mais importante é a prevenção, adquirindo hábitos de higiene oral adequados e profilaxia antibiótica a anteceder procedimentos invasivos de risco.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflito de interessesOs autores declaram não haver conflito de interesses.