A miocardiopatia dilatada é a forma mais comum de miocardiopatia e a principal causa de transplante cardíaco em idade pediátrica e em adultos. Os lactentes e as crianças apresentam etiologias de espectro mais alargado, embora a sua identificação seja mais difícil. A manifestação inicial mais frequente da miocardiopatia dilatada é a insuficiência cardíaca sintomática, em esforço ou repouso (embora muitos pacientes sejam assintomáticos). Como algumas das causas da miocardiopatia dilatada são potencialmente reversíveis, a investigação deve ser cuidadosamente planeada e feita imediatamente após o diagnóstico. Na maioria das crianças não é identificada uma causa, o que limita a abordagem terapêutica dirigida e, portanto, a eficácia do tratamento implantado.
Os autores apresentam um caso de miocardiopatia dilatada secundária a hipertensão arterial renovascular, diagnosticada numa lactente de 3,5 meses, e destacam a investigação etiológica, o tratamento instituído e a sua evolução.
Os autores salientam que o diagnóstico de hipertensão arterial no lactente nem sempre é fácil e questionam as atuais recomendações para início da medição da pressão arterial. Postulamos que a avaliação da pressão arterial em recém‐nascidos pode detetar hipertensão arterial renovascular precoce (e mesmo outras doenças cardiovasculares) e ajudar a prevenir o desenvolvimento de efeitos deletérios, inclusive episódios fatais.
Dilated cardiomyopathy is the most common form of cardiomyopathy and the main cause of cardiac transplantation in children and in adults. Infants and children have a wider spectrum of etiologies, hampering their identification. The most frequent initial manifestation of dilated cardiomyopathy is symptomatic heart failure during exercise or at rest (although many patients are asymptomatic). Some causes are potentially reversible, therefore the investigation should be carefully planned and immediately performed after diagnosis. In most children no cause is identified, which limits the targeted therapeutic approach and therefore the effectiveness of the treatment.
The authors present a case of dilated cardiomyopathy secondary to renovascular hypertension diagnosed in an infant with 3.5 month‐old, highlighting the etiological investigation, treatment and evolution.
The authors present this case emphasising the fact that the arterial hypertension diagnose in infants is not always easy, questioning the current recommendations relating to an initial evaluation on blood pressure. We postulate that the assessment of blood pressure in newborns can detect early renovascular hypertension (and even other cardiovascular diseases) and help prevent the development of deleterious effects, including fatal episodes.
A miocardiopatia dilatada (MCD) é a forma mais comum de miocardiopatia e a principal causa de transplante cardíaco em idade pediátrica e em adultos1. A MCD abrange um grupo heterogéneo de doenças que tem um fenótipo comum: a dilatação das cavidades cardíacas e a disfunção miocárdica. Embora esse fenótipo seja partilhado por adultos e crianças, as etiologias subjacentes, assim como o prognóstico, são diferentes consoante o grupo etário2. Nos adultos, a etiologia mais frequente é a doença coronária, estão também descritos casos associados a distúrbios inflamatórios, toxinas (medicação, álcool, drogas ilícitas) e defeitos genéticos. Os lactentes e crianças apresentam etiologias de espectro mais alargado, embora a sua identificação seja mais difícil3. Em 66% das situações é idiopática e das causas identificadas mais comuns salientam‐se a miocardite (46%) e as doenças neuromusculares (26%)3. No primeiro ano de vida incluem‐se também os erros inatos do metabolismo e as síndromes malformativas4.
Um estudo americano3 reporta que, em idade pediátrica, a incidência anual é de 0,57 casos/100 000, é mais frequente no sexo masculino (0,66 versus 0,47/100 000) e em lactentes comparativamente com crianças mais velhas (4,40 versus 0,34/100 000). Previamente, um estudo finlandês demonstrou que nesse país a incidência de MCD em crianças é de 0,4 casos/100 000 e a prevalência de 2,6 casos/100 0005. No Reino Unido, a incidência é de 0,87/100 000 em indivíduos > 16 anos6.
A manifestação inicial mais frequente de uma criança com MCD é a insuficiência cardíaca sintomática, em esforço ou repouso (embora muitos pacientes sejam assintomáticos)4,7. Podem também surgir arritmias ventriculares e bloqueio auriculoventricular, síncope e morte súbita4.
Como algumas das causas da MCD são potencialmente reversíveis, a investigação deve ser cuidadosamente planeada e feita imediatamente após o diagnóstico1. Contudo, na maioria das crianças não é identificada uma causa, o que limita a abordagem terapêutica dirigida à patologia primária e, portanto, a eficácia do tratamento implantado3.
Descrição do caso clínicoLactente, sexo feminino, sem antecedentes pessoais relevantes com exceção da descida de percentil na evolução ponderal desde o primeiro mês de idade (P50 para P15). Os pais referiram aparecimento de sudorese e palidez labial durante a alimentação, de agravamento progressivo, aos três meses de idade.
Aos 3,5 meses foi levada ao serviço de urgência por episódio de hipotonia e gemido, interpretado como Brief Resolved Unexplained Event (BRUE). Negada febre ou intercorrência infecciosa recente. Sem história familiar de cardiopatia ou morte súbita. Ao exame objetivo, salientou‐se bom estado geral, TA 112/81mmHg (P > 99), saturação periférica de oxigénio 99%, sopro sistólico grau II/VI, pulsos femorais simétricos, sem organomegalias ou edemas periféricos. Posteriormente confirmada TA elevada nos quatro membros, sem diferencial significativo. Analiticamente, hemograma sem alterações, bioquímica com transaminases, função renal e função tiroideia sem alterações; salientou‐se doseamento de BNP elevado (2686.7pg/mL).
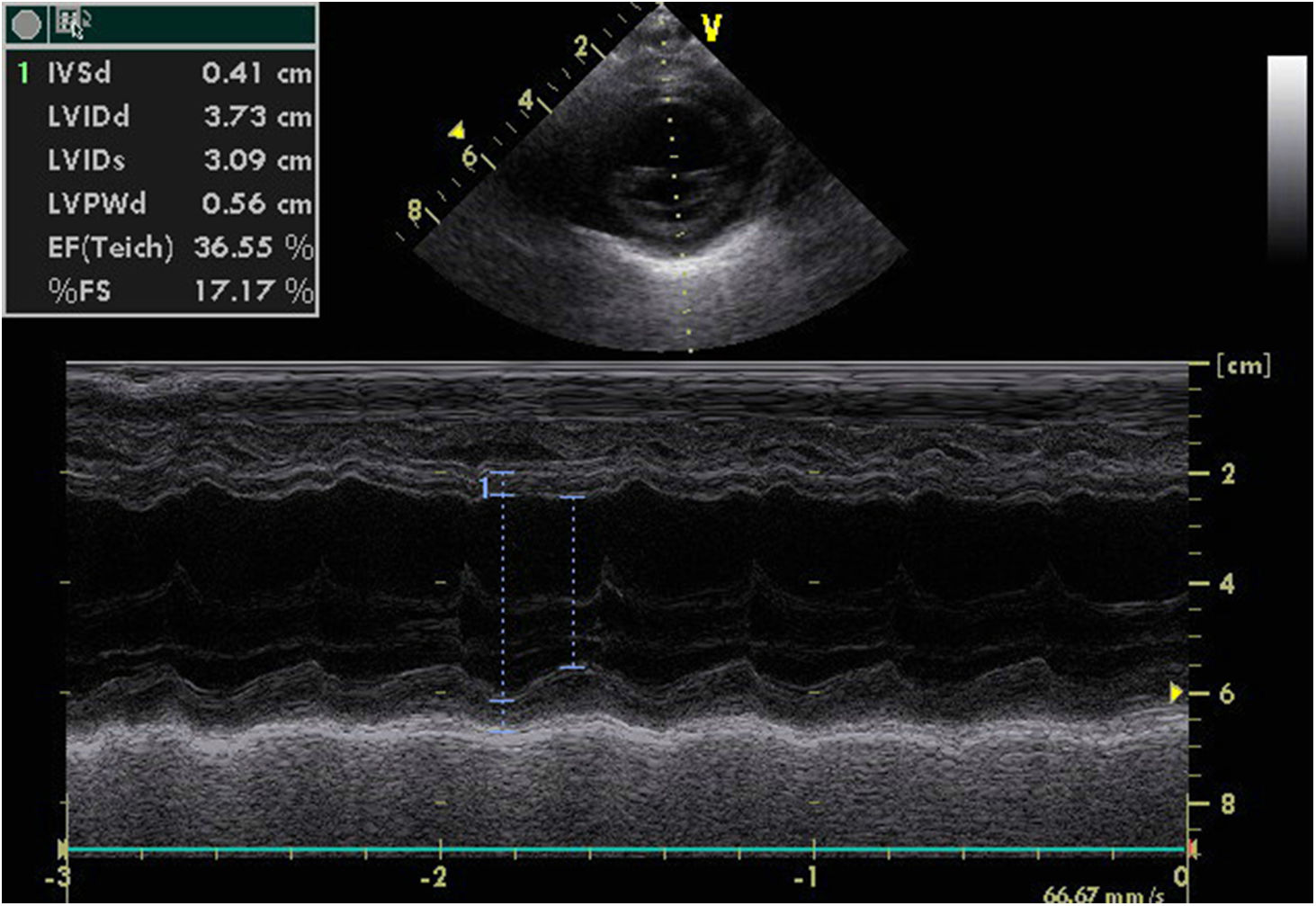
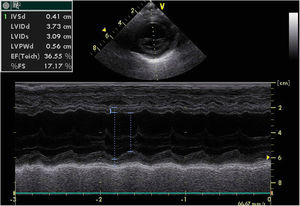
Fez radiografia torácica que mostrou cardiomegalia, sem congestão pulmonar. No eletrocardiograma verificou‐se: ritmo sinusal, eixo QRS normal, ausência de ondas Q patológicas e onda T invertida em DI, DII e DIII. O ecocardiograma revelou dilatação das cavidades esquerdas com disfunção ventricular esquerda global, FEVE 36% e FSVE 17% e insuficiência mitral moderada, com artérias coronárias aparentemente de origem normal (Figura 1).
Assim, a lactente apresentava MCD com insuficiência cardíaca e hipertensão arterial (HTA). Nesse momento foi internada para estudo etiológico e iniciou tratamento com captopril e furosemida.
No internamento, efetuou estudo analítico e imagiológico amplo com o objetivo de excluir patologias do foro metabólico (detetado aumento ligeiro do lobo direito hepático sem citólise hepática e alteração inespecífica da acilcarnitina), infeccioso (serologias negativas de citomegalovírus, vírus herpes 1 e 2, vírus Epstein‐Barr, parvovírus B19 e toxoplasmos; PCR negativa para enterovírus e adenovírus) e imunológico (doseamento de imunogloblulinas, frações C1q, C3c e C4 do complemento e haptoglobina normais; doseamento negativo de anticorpos antinucleares, anticitoplasmas do neutrófilo, anticardiolipina, anti‐ENA e anti‐Ds DNA). A fundoscopia ocular não mostrou alterações.
Do ponto de vista renal, apresentava função renal normal, aldosterona aumentada (> 150ng/dL) e o doseamento de renina foi impossível de efetuar por razões teóricas. A ecografia renal evidenciou assimetria renal por rim esquerdo de maiores dimensões e hiperecogenicidade do parênquima.
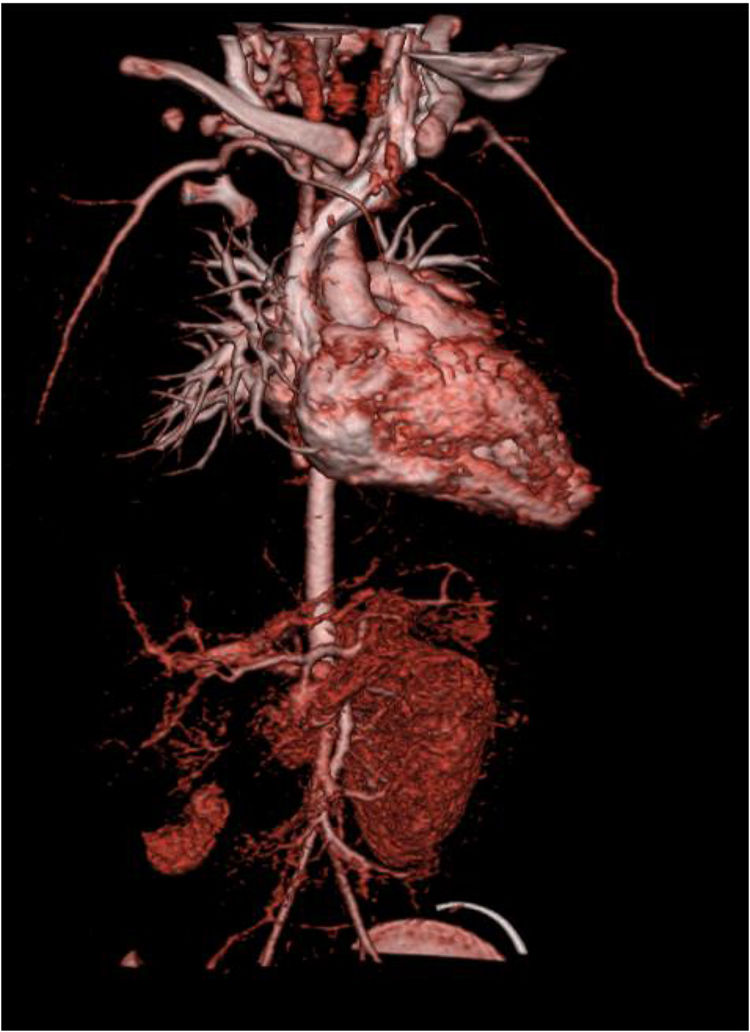
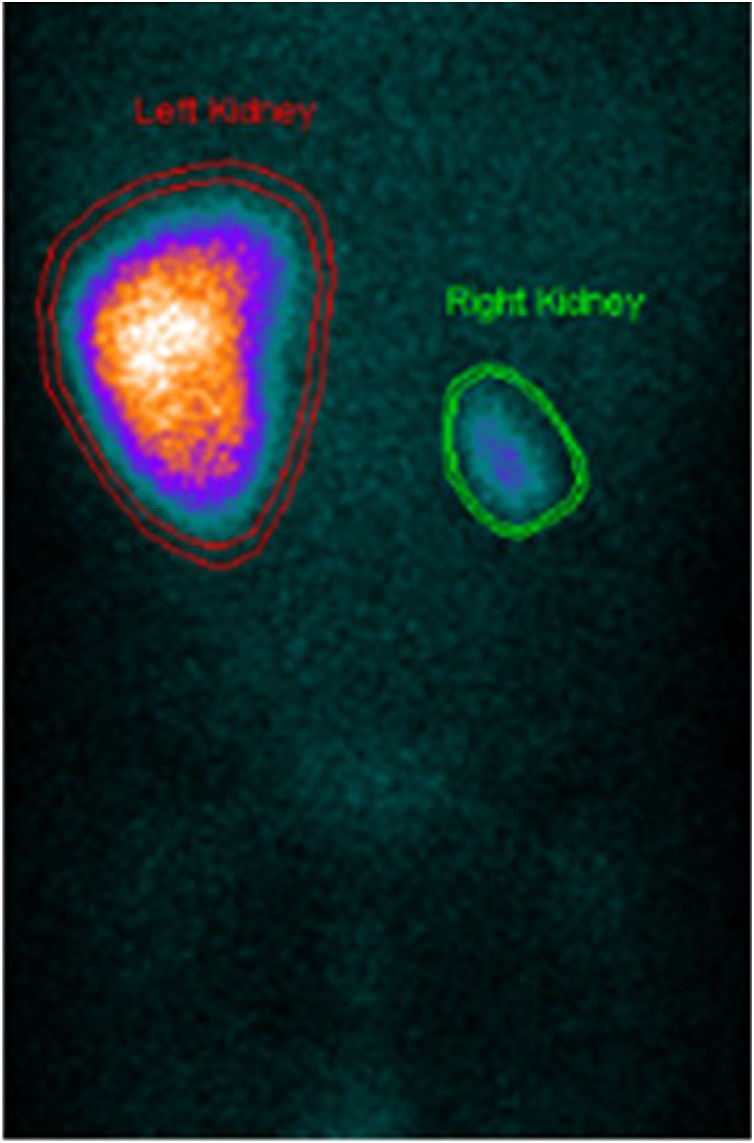
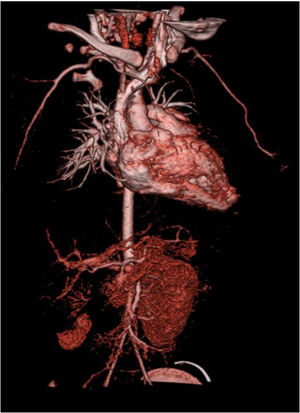
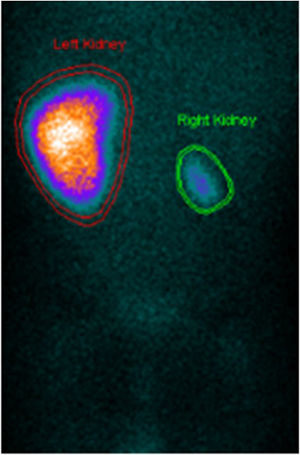
Para melhor caracterização da árvore vascular fez angiotomografia computorizada que revelou «estenose difusa da artéria renal direita na sua porção inicial, com calibre reduzido no nível distal. Rim direito com dimensões reduzidas comparativamente com o esquerdo, associada a redução da espessura do parênquima e marcado atraso na captação do produto de contraste. Calibre reduzido da aorta abdominal inferior (3,5mm), bem como das artérias ilíacas comuns (2mm)» (Figura 2). Posteriormente fez cintigrafia renal com ácido dimercaptosuccínico (DMSA) que confirmou rim direito de dimensões reduzidas e em quase exclusão funcional (4,5%) (Figura 3).
Após discussão com cirurgia vascular e radiologia de intervenção e dada a impossibilidade de correção cirúrgica ou endovascular da estenose da artéria renal, foi ponderada nefrectomia, idealmente após estabilização da função cardíaca.
Teve alta clínica, após 19 dias de internamento, assintomática e com pressão arterial (PA) controlada, medicada com furosemida (1mg/kg/dia), espironolactona (2mg/kg/dia), nifedipina (1,9mg/kg/dia) e carvedilol (0,08mg/kg/dia).
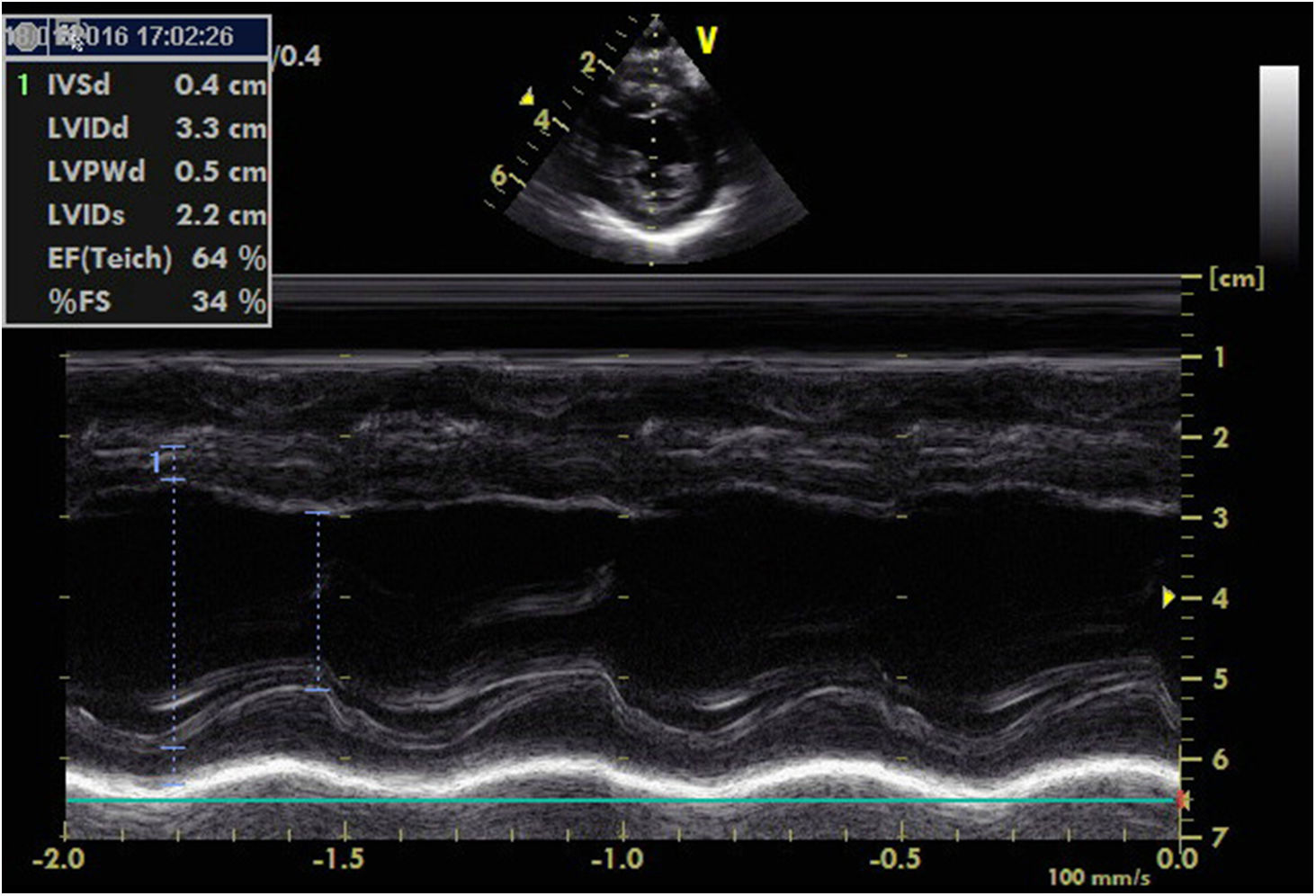
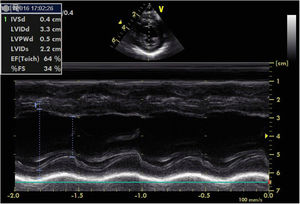
Nos seis meses seguintes, a PA manteve‐se estável, sem necessidade de adição de novos fármacos, e a evolução ecocardiográfica foi favorável, com melhoria progressiva da função ventricular esquerda. Aos 10 meses foi submetida a nefrectomia direita, sem intercorrências. Desde então foi possível efetuar desmame progressivo dos vários fármacos. Aos 11 meses, verificou‐se recuperação da função ventricular (FEVE 64%, FSVE 34%), manteve muito discreta dilatação do ventrículo esquerdo (Figura 4).
Com 13 meses, fez antirressonância magnética abdominal que demonstrou «aorta abdominal infrarrenal e as artérias ilíacas comuns mantêm um calibre algo reduzido, mas sem defeitos de preenchimento». Atualmente, com 20 meses, mantém‐se assintomática e com PA normal, está medicada apenas com carvedilol em baixa dosagem (em desmame, 0,016mg/kg/dia). Mantém vigilância clínica em consultas de nefrologia e cardiologia pediátricas.
Discussão e conclusãoOs autores salientam que o diagnóstico de HTA no lactente nem sempre é fácil, por dificuldades inerentes à própria medição da pressão arterial e à interpretação dos resultados, muitas vezes atribuem‐se os valores elevados à agitação do paciente. A HTA em lactentes apresenta‐se habitualmente com sintomas inespecíficos como apneia, taquipneia, prostração, irritabilidade, dificuldades na alimentação, sintomas cardiovasculares ou neurológicos8.
Do ponto de vista cardiovascular, ao contrário das crianças mais velhas e dos adultos que desenvolvem hipertrofia ventricular esquerda secundária à HTA, os recém‐nascidos e lactentes desenvolvem mais frequentemente insuficiência cardíaca congestiva no contexto de MCD. Está igualmente descrita a melhoria ou resolução da MCD associada à correção da HTA, tal como aconteceu com a nossa paciente9.
Desse modo, o diagnóstico de HTA e MCD no lactente deve desencadear uma investigação etiológica cuidadosa, dado que algumas causas são potencialmente tratáveis, melhoram significativamente o prognóstico.
A HTA renovascular causa 5‐10% dos casos de HTA em idade pediátrica e, na altura do diagnóstico, os pacientes apresentam frequentemente evidência de lesão dos órgãos‐alvo10. O tratamento engloba uma vertente médica (anti‐hipertensores) e uma cirúrgica (tratamento endovascular, revascularização cirúrgica ou nefrectomia)11,12. Neste caso a idade da paciente, a exclusão funcional do rim e a atrofia parenquimatosa renal não permitiram outra intervenção que não a nefrectomia.
Por último, este caso levou os autores a questionar as atuais recomendações para início da medição da pressão arterial em crianças saudáveis aos dois anos. É opinião dos autores que a medição da pressão arterial em recém‐nascidos permitiria detetar precocemente HTA, eventualmente outras doenças cardiovasculares, e prevenir a deterioração clínica nesses casos, por vezes associada a acontecimentos graves ou mesmo fatais.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.