O crescente uso de antraciclinas, aliado ao aumento da sobrevida dos doentes oncológicos, motiva a necessidade de monitorizar os efeitos tóxicos destes fármacos. Para que a sua cardiotoxicidade possa ser detetada, prevenida ou atenuada, torna‐se essencial que todos os doentes sejam, do ponto de vista cardiovascular, submetidos a uma rigorosa avaliação inicial e a um estreito acompanhamento. Diversos ensaios clínicos comprovaram o efeito cardioprotetor produzido por medidas não farmacológicas como o exercício físico, a adoção de um estilo de vida saudável, o controlo de fatores de risco e o tratamento de comorbilidades; foi também verificado um efeito cardioprotetor com estratégias farmacológicas como o uso de bloqueadores‐beta, inibidores da enzima de conversão da angiotensina, antagonistas do recetor da angiotensina, estatinas, dexrazoxane ou derivados lipossomais. No entanto, atualmente não existe qualquer diretriz científica que oriente as estratégias de prevenção nestes doentes. Com esta revisão propomo‐nos abordar o estado da arte relativo à avaliação, monitorização e, principalmente, à prevenção da cardiotoxicidade provocada pelas antraciclinas.
The increasing use of anthracyclines, together with the longer survival of cancer patients, means the toxic effects of these drugs need to be monitored. In order to detect, prevent or mitigate anthracycline‐induced cardiomyopathy, it is essential that all patients undergo a rigorous initial cardiovascular assessment, followed by close monitoring. Several clinical trials have shown the cardioprotective effect of non‐pharmacological measures such as exercise, healthy lifestyles, control of risk factors and treatment of comorbidities; a cardioprotective effect has also been observed with pharmacological measures such as beta‐blockers, angiotensin‐converting enzyme inhibitors, angiotensin receptor antagonists, statins, dexrazoxane and liposomal formulations. However, there are currently no guidelines for managing prevention in these patients. In this review the authors discuss the state of the art of the assessment, monitoring, and, above all, the prevention of anthracycline‐induced cardiotoxicity.
Segundo os dados da Organização Mundial de Saúde, as patologias do foro oncológico constituem, na atualidade, a segunda maior causa de morte no mundo1. Os enormes e contínuos desenvolvimentos verificados a nível terapêutico nas últimas décadas permitiram um aumento da sobrevida destes doentes; todavia, os efeitos adversos causados pelos quimioterápicos, nomeadamente a nível cardíaco, passaram a constituir uma importante causa de morbimortalidade. Estima‐se que a taxa de mortalidade entre doentes oncológicos que desenvolvem cardiotoxicidade seja elevada, com valores superiores a 60% a dois anos2; no entanto, o prognóstico pode ser positivamente alterado se houver uma prevenção e uma deteção precoce.
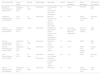
As antraciclinas como a doxorrubicina, daunorrubicina, epirrubicina, mitoxantrona e idarrubicina são os quimioterápicos mais usados na terapêutica farmacológica do cancro e constituem uma reconhecida causa de cardiotoxicidade (Tabela 1). Os efeitos agudos ou subagudos que se podem manifestar sob a forma de alterações eletrocardiográficas, arritmias ventriculares e supraventriculares, perturbação da condução cardíaca (bloqueios auriculoventriculares ou bloqueios de ramo), disfunção ventricular, aumento do peptídeo natriurético cerebral (BNP) (marcador do aumento da pré‐carga e de insuficiência cardíaca [IC]), miocardite e pericardite, podem ocorrer desde o início do tratamento até duas semanas após o término do mesmo. Estes eventos são relativamente incomuns e, na sua maioria, revertem uma semana após a suspensão do tratamento. Já a cardiotoxicidade crónica pode ser de início precoce, se decorrer no período de um ano após o término da quimioterapia, ou de início tardio, se ocorrer depois deste período. Em qualquer um dos casos, pode verificar‐se disfunção ventricular sistólica ou diastólica (Tabela 2), que poderá evoluir para cardiomiopatia grave e, inclusivamente, ser causa de morte3. Embora alguns estudos sugiram a possibilidade de, através das lesões agudas no miocárdio4, se prever o risco de desenvolvimento e gravidade de disfunção ventricular, ainda não está esclarecida a relação entre a toxicidade aguda e a crónica. A questão do diagnóstico de disfunção cardíaca relacionada com a terapêutica oncológica, que tem sido abordada em algumas publicações3,5, baseia‐se, sobretudo, na avaliação de: sintomatologia de IC, exame físico e parâmetros de função ventricular esquerda; uma dessas publicações5 poderá ser considerada referência nesta área.
Cardiotoxicidade, farmacocinética e utilização terapêutica das antraciclinas
| Mecanismos de cardiotoxicidade | Mecanismos de ação | Antraciclinas | Utilização terapêutica | Cardiotoxicidade |
|---|---|---|---|---|
| Principais mecanismos: ‐ topoisomerase II beta ‐ peroxidação lipídica ‐ stress oxidativo ‐ apoptose e necrose das células cardíacas Comprometimento da síntese de DNA, RNA e proteínas, e de fatores de transcrição envolvidos na regulação de genes específicos do coração Balanço negativo das proteínas sarcoméricas, nas células cardíacas provocado pela diminuição da expressão proteica e pelo aumento da degradação de miofilamentos. Utilização de terapêuticas combinadas potencia a redução miofilamentar Lesões no DNA e alteração da bioenergética ao nível mitocondrial. Desequilíbrio na regulação dinâmica da função cardíaca, com alterações na atividade adrenérgica, na adenilcíclase e na homeostasia do cálcio. | A formação de um complexo com DNA por conjugação dos anéis planos com pares de bases de nucleótidos provoca inibição dos ácidos nucleicos (DNA e RNA) e a síntese de proteínas. Esta conjugação desencadeia a clivagem do DNA pela topoisomerase II, resultando em atividade citotóxica Inibem a atividade da helicase impedindo a clivagem enzimática da cadeia dupla de DNA, interferindo, assim, com a sua replicação e transcrição Estão envolvidas em reações de oxidação/redução através da formação de radicais livres citotóxicos | Doxorrubicina | Ca avançado do estômago Ca bexiga Ca mama Ca ovários Ca pequenas células do pulmão Ca tiroide Doença de Hodgkin Leucemia aguda Linfoma não‐Hodgkin Neuroblastoma Sarcoma Tumor de Wilms | Aguda: hipotensão Arritmias Taquicardia Tromboembolismo Subaguda: pericardite Miocardite Crónica: cardiomiopatia dilatada Disfunção contrátil Insuficiência cardíaca congestiva |
| Daunorrubicina | Leucemia linfoblástica aguda Leucemia mieloide aguda | Agudas: taquicardia sinusal Taquiarritmias Extrassístoles ventriculares Bloqueio AV Crónica: cardiomiopatia dilatada Disfunção contrátil Insuficiência cardíaca congestiva | ||
| Epirrubicina | Ca avançado do ovário Ca estômago Ca mama Ca pulmão | Aguda: taquicardia ventricular Bloqueio auriculoventricular Bloqueio de ramo Bradicardia Tromboembolismo Crónica: cardiomiopatia dilatada Disfunção contrátil Insuficiência cardíaca congestiva | ||
| Idarrubicina | Leucemia linfocítica aguda Leucemia mieloide aguda | Aguda: arritmias Fibrilação auricular Enfarte agudo do miocárdio Tromboembolismo Crónica: cardiomiopatia dilatada Disfunção contrátil Insuficiência cardíaca congestiva | ||
| Mitoxantrona | Ca avançado da mama Leucemia mieloide aguda em adultos Linfomas não‐Hodgkin | Aguda: arritmias Miocardite Hipertensão arterial Isquemia miocárdica Crónica: cardiomiopatia dilatada Disfunção contrátil Insuficiência cardíaca congestiva |
Critérios utilizados para confirmar ou classificar um diagnóstico preliminar de disfunção cardíaca, definidos pelo Comité de Avaliação e Revisão Cardíaca
| A presença de um dos critérios apresentados é suficiente para que se estabeleça o diagnóstico de cardiotoxicidade |
| Presença de cardiomiopatia com redução da FEVE, com compromisso global ou com alterações segmentares mais evidentes na região septal; |
| Sintomatologia associada a IC; |
| Deteção de galope S3, taquicardia, ou ambos; |
| Redução da FEVE de, pelo menos, 5% para níveis inferiores a 55%, com sinais ou sintomas de IC, ou uma queda na FEVE de, pelo menos, 10% para níveis inferiores a 55%, na ausência de sinais ou sintomas, comparativamente com os valores basais do indivíduo |
Existe uma proposta de classificação para a cardiomiopatia associada ao uso de quimioterápicos, que divide os agentes antineoplásicos em dois tipos: o tipo I, onde se encontram inseridos fármacos, como as antraciclinas, que provocam essencialmente lesões irreversíveis dependentes da dose utilizada, e o tipo II, que abrange agentes como o trastuzumab, que não se encontra dependente da dose utilizada e que é, habitualmente, reversível após a descontinuação do tratamento6. Este segundo tipo não será objeto de abordagem neste artigo.
Neste trabalho, propomo‐nos a abordar possíveis estratégias a aplicar em doentes submetidos a tratamento com antraciclinas, para prevenir ou minorar os seus principais efeitos adversos a nível do cardíaco.
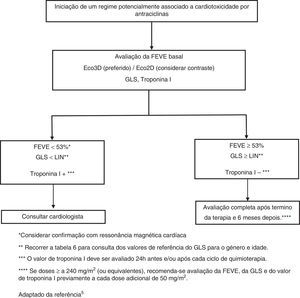
Avaliação inicialDada a cardiotoxicidade das antraciclinas, todos os doentes candidatos à instituição de um tratamento quimioterápico devem ser avaliados do ponto de vista cardíaco para estabelecer um padrão basal cardiovascular, que permita a comparação durante o regime terapêutico. Esta avaliação deve incluir: elaboração de história clínica e exame físico; realização de um eletrocardiograma (avaliação do ritmo cardíaco e deteção de sinais de isquemia); exame de imagem cardíaca, habitualmente ecocardiograma transtorácico com estudo Doppler completo (Tabelas 3 e 4). Nos casos em que o ecocardiograma não seja esclarecedor, recomenda‐se a realização de ressonância magnética cardíaca (RMC). Os níveis basais de troponinas também devem ser obtidos para futuras comparações5.
Recomendações para o protocolo ecocardiográfico cardio‐oncológico
| Ecocardiografia transtorácica padrão |
| • De acordo com as guidelines ASE/EAE e IAC‐Echo |
| Aquisição de imagem 2D strain |
| • Incidência apical: três, quatro e duas câmaras |
| • Obter ≥3 ciclos cardíacos |
| • Imagens obtidas simultaneamente mantendo o mesmo frame rate e profundidade |
| *Frame rate entre 40‐90 frames/segundo ou ≥40% da frequência cardíaca |
| • Integral velocidade‐tempo aórtico (tempo/período de ejeção aórtico) |
| Análise da imagem 2D strain |
| • Quantificar a strain segmentar e global (GLS) |
| • Mostrar as curvas de strain segmentar na incidência apical num formato quadrangular |
| • Mostrar o strain global em perspetiva bull's‐eye |
| Artefactos da imagem 2D strain |
| • Ectopia |
| • Respiração |
| Aquisição de imagem 3D |
| • Apical de quatro câmaras, volume total, para avaliar o volume ventricular esquerdo e calcular a FEVE |
| • Resolução espacial e temporal otimizadas para batimentos únicos ou múltiplos |
| Relatório |
| • Momento da ecocardiografia em relação à infusão IV (número de dias antes ou depois) |
| • Sinais vitais (FC, PA) |
| • 3D FEVE/2D método de Simpson biplano |
| • GLS (ecocardiógrafo, software e versão utilizadas) |
| • Na ausência de GLS, medição do MAPSE medial e lateral |
| • Ventrículo direito: TAPSE |
Adaptado de Plana et al.5.
ASE: American Society of Echocardiography; EAE: European Association of Echocardiography; FC: frequência cardíaca; FEVE: fração de ejeção do ventrículo esquerdo; GLS: global longitudinal strain; IAC‐Echo: Intersocietal Accreditation Commission Echocardiography; MAPSE: excursão sistólica do plano do anel mitral; PA: pressão arterial; TAPSE: excursão sistólica do plano do anel tricúspide.
Avaliação ecocardiográfica da função sistólica e diastólica num doente com cancro
| Função sistólica ventricular esquerda |
| • O ecocardiograma é o método de eleição para a avaliação dos doentes antes, durante e após tratamento oncológico |
| • Devem ser realizados cálculos precisos da FEVE através do melhor método disponível no laboratório de ecocardiografia (idealmente Eco3D) |
| • Quando utilizado o Eco2D, o método biplano de Simpson modificado deve ser a técnica de escolha |
| • A FEVE deve ser combinada com o cálculo do wall motion score índex |
| • Na ausência do GLS por speckle‐tracking, é recomendado quantificar a função longitudinal do VE usando a excursão sistólica do plano do anel mitral e/ou o pico de velocidade sistólica (s’) do anel mitral por Doppler tecidular pulsado |
| • A FEVE calculada por Eco2D falha frequentemente na deteção de pequenas alterações da contratilidade do VE |
| Função diastólica |
| • Apesar dos parâmetros diastólicos não terem valor prognóstico comprovado na cardiomiopatia induzida por terapêutica com antraciclinas, a avaliação convencional da função diastólica VE, incluindo a estimativa não invasiva das pressões de enchimento do VE, deve ser acrescentada à avaliação da função sistólica VE, segundo as recomendações da ASE/EAE para avaliação da função diastólica com ecocardiografia |
Adaptado de Plana et al.5.
ASE: American Society of Echocardiography; EAE: European Association of Echocardiography; Eco2D: ecocardiograma 2D; Eco3D: ecocardiograma 3D; FEVE: fração de ejeção do ventrículo esquerdo; VE: ventrículo esquerdo.
Durante os regimes terapêuticos é importante monitorizar os sinais e sintomas de cardiotoxicidade (Tabela 5). O eletrocardiograma de 12 derivações pode ser rotineiramente utilizado na monitorização de arritmias cardíacas decorrentes do efeito tóxico das antraciclinas. No que diz respeito ao acompanhamento e esclarecimento da etiologia de síncopes, que se presumem decorrentes de arritmias ou de bloqueios auriculoventriculares avançados, o recurso ao registo de Holter clássico (24h) ou ao registo de eventos poderá ser útil7. A monitorização da função cardíaca, nomeadamente com ecocardiograma, é aconselhada nos doentes que se encontram a cumprir regimes com antraciclinas. O global longitudinal strain (GLS), obtido através da metodologia 2D strain‐speckle tracking, tem‐se revelado um preditor mais sensível de IC do que a fração de ejeção do ventrículo esquerdo (FEVE)8, uma vez que, durante o tratamento com antraciclinas, a alteração do primeiro precede a diminuição do segundo5. Não obstante, na prática clínica a fração de encurtamento e a FEVE têm sido os parâmetros mais amplamente utilizados9; no entanto, pela sua «fragilidade», a fração de encurtamento tem vindo a ser menos validada neste contexto. Estas medidas, por se encontrarem dependentes da pré e pós‐carga, não são tão sensíveis na deteção precoce da doença cardíaca pré‐clínica. Diversos estudos sugerem que a avaliação da função diastólica por eco‐Doppler pode constituir um método de deteção precoce de cardiotoxicidade10,11. Na presença de uma FEVE <53% e GLS abaixo do limite do normal (Tabela 6), e/ou níveis aumentados de troponinas, é aconselhável o encaminhamento para consulta de Cardiologia, para que seja efetuada uma avaliação conjunta do risco versus benefício do tratamento antineoplásico5. No decorrer do regime terapêutico com antraciclinas, considera‐se que uma diminuição da FEVE em relação ao valor basal se encontra associada ao aumento do risco de eventos cardíacos. Já no que diz respeito ao GLS, apesar de uma redução, relativa ao valor basal, de ‐8% parecer desprovida de significado, uma redução superior a ‐15% é, muito provavelmente, sinónimo de cardiotoxicidade5. No entanto, para comprovar o diagnóstico, torna‐se essencial a sua confirmação, por repetição do estudo duas a três semanas após primeira deteção. Com o uso da RMC é possível detetar alterações miocárdicas subtis e aumento do volume extracelular, achados consistentes com edema ou fibrose difusa. Apesar de este ser um método bastante sensível e reprodutível para a medição da função cardíaca e caraterização do tecido miocárdico, tem disponibilidade limitada e custo elevado12. Já a angiografia com radionuclídeos é um método disponível e reprodutível mas, como expõe os doentes a radiações ionizantes, contribuindo para um aumento da dose cumulativa de radiação, especialmente quando a medição periódica é requerida, e fornece informação limitada da função diastólica e da morfologia valvular, não deverá ser o método de eleição12. A biópsia endomiocárdica surge como o exame de maior sensibilidade e especificidade na deteção e monitorização dos efeitos adversos provocados pelas antraciclinas5. Com este método é possível visualizar‐se a perda de miofibrilas, a vacuolização do citoplasma, dilatação do retículo sarcoplasmático, aumento do número de lisossomas e edema das mitocôndrias12. No entanto, o caráter invasivo deste procedimento limita o seu uso na prática clínica. Os biomarcadores têm sido validados em diversos estudos, uma vez que constituem não só métodos específicos de deteção de dano cardiovascular, mas também permitem a determinação da extensão e reversibilidade do mesmo. Assim, enquanto o aumento dos níveis de troponina T e I é um indicador de lesão nos cardiomiócitos, os níveis de BNP e de porção N‐terminal do proBNP (NT‐proBNP) podem refletir um aumento do stress miocárdio13,14. Daí que, segundo a literatura, a elevação das troponinas pode ser considerada uma medida precoce de deteção de cardiotoxicidade, ao passo que o BNP parece ser menos consistente. Por último, refere‐se que, no caso de a dose de antraciclinas administradas exceder os 240mg/m2, é aconselhável a realização de avaliações cardíacas antes da administração de ciclos adicionais (Figura 1).
Vantagens e desvantagens dos exames auxiliares de diagnóstico na avaliação da cardiotoxicidade por antraciclinas
| Exames auxiliares de diagnóstico | Vantagens | Desvantagens |
|---|---|---|
| Eletrocardiograma | Não invasivo; Baixo custo; Permite a avaliação do intervalo QT; o seu prolongamento é um reconhecido marcador de cardiotoxicidade; | Não avalia a FEVE; Variabilidade intra e interobservador na avaliação do intervalo QT; |
| Ecocardiograma/Doppler | Não invasivo; Baixo custo; Permite a avaliação funcional e morfológica de parâmetros diastólicos (padrão do fluxo venoso pulmonar, razão E/A, tempo de relaxamento isovolumétrico), sistólicos (espessamento da parede durante a sístole, FEVE, fração de encurtamento do VE) e a avaliação da estrutura valvular e do pericárdio; | Variabilidade inter e intraobservador; Avaliação da FEVE sujeita a variabilidade e é dependente da qualidade de imagem; Valor preditivo pouco claro na deteção precoce de lesões subclínicas; |
| Doppler tecidular | Excelente resolução temporal; Permite deteção precoce de lesões subclínicas (através da combinação com marcadores inflamatórios/stress oxidativo); Permite a avaliação funcional das pressões de enchimento (razão E/e’), velocidades, deformação (strain) e taxa de deformação das paredes ventriculares (strain rate) na sístole e na diástole; Permite a deteção de disfunção diastólica isolada; | Tempo de análise superior; |
| 2D strain/speckle tracking – GLS | Superioridade em relação à FEVE na previsão de mortalidade cardiovascular na população geral; Melhor estratificação de risco em pacientes com IC; Capacidade de reconhecer disfunção VE precoce em doentes submetidos a terapêutica cardiotóxica Reprodutível quando realizado por operador experiente; | Grande dependência da qualidade de imagem do Eco2D; Carência de ensaios clínicos a longo prazo que avaliem a capacidade do GLS prever decréscimos persistentes da FEVE ou IC sintomática; |
| Ecocardiograma de stress | Permite a avaliação da reserva contrátil do miocárdio; | Semi‐invasivo; Dados controversos e limitados na deteção precoce de cardiotoxicidade; |
| Angiografia de radionuclídeos | Alta reprodutibilidade; Baixa variabilidade interobservador e intraobservador; Validado na determinação da fração de ejeção; | Exposição a radiação; Baixa resolução espacial e temporal; Volumes ventriculares subestimados; FEVE é sobrestimada em ventrículos com dimensões mais pequenas (crianças e mulheres); Não avalia a função valvular; Informações parcas sobre a função diastólica; Valor preditivo limitado na deteção precoce de lesões subclínicas e de alterações na FEVE; |
| Ressonância magnética | Reprodutível; Ausência de exposição a radiação; Permite a avaliação da perfusão e função miocárdica, pericárdio e deteção de massas miocárdicas; Útil em doentes com má janela ecocardiográfica; Gold standard para o cálculo dos volumes do VE e da FEVE; Sequência T2: sensível a aumentos segmentares ou globais do teor de água miocárdico resultante de inflamação, lesão microvascular e dos miócitos; Sequencia T1: fornece informação relativa à lesão miocárdica e fibrose; Contraste (gadolínio) sequência T1: deteção de alterações histopatológicas (vacuolização intracelular), que permitem prever redução da FEVE subsequente; Realce tardio (gadolínio): deteção de fibrose miocárdica associada a prognóstico adverso em doentes com DAC, cardiomiopatia hipertrófica e doenças infiltrativas; | Custo elevado; Disponibilidade limitada; Contraindicado em doentes com dispositivos não compatíveis com ressonância (pacemakers, dispositivos de ressincronização cardíaca e desfibrilhadores implantáveis); Risco de nefrotoxicidade do contraste em doentes com insuficiência renal (TFG <30ml/min) |
| Tomografia computorizada | Imagem com boa acuidade; Permite identificar calcificação ou espessamento pericárdico em doentes submetidos a radiação ou cirurgia; Permite visualização das artérias coronárias e avaliação da sua calcificação. | Exposição a radiação; Presença de calcificação coronária prévia ao tratamento antineoplásico não se mostrou preditora de risco CV nos doentes submetidos a quimioterapia Pouco utilizado para seguimento e deteção de alterações subclínicas da função CV |
| Cintigrafia | Não invasiva; Permite a avaliação funcional e estrutural; | Exposição a radiação; Disponibilidade limitada; Baixa resolução temporal; Natureza dos dados limitada; |
| Biomarcadores | Não invasivo; Baixa variabilidade interobservador; Permite a avaliação da função cardiovascular e de potenciais sinais de lesão cardíaca; Promissores marcadores na deteção precoce de lesão miocárdica; | Valor preditivo indefinido; |
| Biópsia endomiocárdica | Permite detetar evidências histológicas de lesão cardíaca: perda de miofibrilas, vacuolização do citoplasma, dilatação do retículo sarcoplasmático, aumento do número de lisossomas e edema das mitocôndrias; | Invasivo; Interpretação histológica requer especialista; Não fornece informação funcional; Limitação dos resultados pela quantidade e qualidade da amostra recolhida; |
| Despiste lesão endotelial | Avaliação alternativa da toxicidade cardiovascular através parâmetros alternativos como as citocinas, as moléculas de adesão e a relação íntima/média da artéria carótida | Valor preditivo desconhecido; |
| Análise genética | Minimamente invasiva; Permite a avaliação da suscetibilidade individual à cardiotoxicidade | Valor preditivo desconhecido |
Variação do GLS em função do género, da idade e do ecógrafo
| Idade | |||||||
|---|---|---|---|---|---|---|---|
| 0‐19 | 20‐29 | 30‐39 | 40‐49 | 50‐59 | ≥65 | p | |
| V1 | |||||||
| Global | ‐22,1±2,4 | ‐21,2±1,9 | ‐21,1±2,1 | ‐21,4±2,0 | ‐21,0±2,2 | ‐20,3±1,9 | 0,0218 |
| Homem | ‐21,7±3,1 | ‐20,9±1,9 | ‐20,6±1,9 | ‐20,9±1,8 | ‐21,0±1,9 | ‐19,7±1,4 | 0,1982 |
| Mulher | ‐22,4±1,6 | ‐22,3±1,6 | ‐22,8±1,8 | ‐22,6±2,1 | ‐23,3±1,9 | ‐20,9±2,1 | 0,0348 |
| p (homem vs. mulher) | 0,4292 | 0,0316 | <0,0001 | 0,0178 | 0,0029 | 0,1381 | |
| V2 | |||||||
| Global | ‐19,9±2,5 | ‐19,0±2,1 | ‐19,5±2,2 | ‐18,2±2,5 | ‐17,6±2,5 | ‐16,7±2,1 | <0,0001 |
| Homem | ‐19,4±2,7 | ‐18,8±2,0 | ‐19,1±2,3 | ‐17,9±2,8 | ‐16,9±2,3 | ‐15,8±1,4 | 0,0019 |
| Mulher | ‐20,5±2,2 | ‐20,6±2,3 | ‐20,2±2,0 | ‐19,3±0,9 | ‐20,4±1,5 | ‐17,3±2,3 | 0,0002 |
| p (homem vs. mulher) | 0,1349 | 0.0248 | 0,1083 | 0.4316 | 0,0294 | 0.0928 | |
| V3 | |||||||
| Global | ‐21,4±1,7 | ‐20,2±2,1 | ‐20,4±2,3 | ‐19,4±2,2 | ‐18,5±2,6 | ‐17,8±2,8 | <0,0001 |
| Homem | ‐21,6±2,0 | ‐20,2±2,0 | ‐20,4±2,2 | ‐19,8±2,3 | ‐18,7±2,6 | ‐16,3±3,1 | <0,0001 |
| Mulher | ‐21,2±1,5 | ‐20,2±2,4 | ‐20,4±2,8 | ‐18,7±1,8 | ‐18,3±2,8 | ‐18,6±2,3 | 0,0141 |
| p (homem vs. mulher) | 0,6076 | 0,9787 | 0,9201 | 0,1415 | 0,7374 | 0,0668 | |
Adaptado de Takigiku et al.62.
V1: Vivid 7 ou Vivid E9 (GE Healthcare); V2: iE33 (Philips Medical Systems); V3: Artida ou Aplio (Toshiba Medical Systems).
A redução da cardiotoxicidade das antraciclinas associada à manutenção da eficácia terapêutica pode ser obtida através de medidas de prevenção não farmacológicas e farmacológicas.
Prevenção não farmacológicaOs fatores de risco cardiovascular devem ser detetados e adequadamente tratados aquando do diagnóstico de doença neoplásica. Os doentes devem ser incentivados a adotar um estilo de vida saudável, composto por uma dieta com baixo teor em gorduras saturadas e com restrição salina até 2,5g de sódio por dia, a evitar o consumo de agentes tóxicos como álcool e tabaco, e a manter o índice de massa corporal em valores próximos dos 25kg/m2. A prática de atividade física, de alta ou baixa intensidade, durante o tratamento com antraciclinas aumenta a reserva cardiovascular15. Estudos, em modelos animais, têm demonstrado que o exercício pode reduzir a cardiotoxicidade destes agentes16. Embora o exercício físico se tenha mostrado promissor na melhoria da função cardiopulmonar em sobreviventes de cancro da mama17,18, ainda não existem ensaios clínicos no homem que comprovem o seu papel cardioprotetor. Outra estratégia envolve reduzir, ou mesmo evitar, o uso de fármacos que provocam prolongamento do intervalo QT, nomeadamente antagonistas da 5‐hidroxitriptamina (frequentemente utilizados na prevenção de efeitos adversos da quimioterapia como náuseas ou vómitos), e de anti‐histamínicos19,20. Salienta‐se, também, a importância de minimizar a exposição à radiação, da correção de distúrbios hidroeletrolíticos e do tratamento de comorbilidades (Tabela 7)21.
Fatores de risco de cardiotoxicidade com antraciclinas
| Doses cumulativas excedentes | Doses máximas recomendadas (mg/m2)* | |
|---|---|---|
| Doxorrubicina | 400‐550 | |
| Daunorrubicina | 550‐800 | |
| Epirrubicina | 900‐1000 | |
| Idarrubicina | 150‐225 | |
| Mitoxantrona | 100‐140 | |
| Doenças CV pré‐existentes | Diabetes | |
| Doença vascular periférica | ||
| Doença arterial coronária | ||
| Hipertensão arterial | ||
| Predisposição genética: sexo feminino, raça negra | ||
| Terapêutica com irradiação mediastínica prévia ou concomitante | ||
| Administração intravenosa em bólus | ||
| Combinação com outros agentes, tais como: ciclofosfamida, trastuzumab e paclitaxel | ||
| Período de tempo decorrido desde a conclusão da quimioterapia | ||
| Distúrbios eletrolíticos: hipocalcemia e hipomagnesemia | ||
| Hemocromatose (mutação C282Y) | ||
| Hipertermia | ||
| Hepatopatia | ||
A diminuição da dose de antraciclinas administrada é uma das formas de reduzir a incidência de disfunção sistólica ventricular esquerda (DSVE), como comprovam os resultados obtidos pelo estudo realizado com doses de doxorrubicina de 400, 500 e 550mg/m2, onde se verificaram incidências de 5, 16 e 26%, respetivamente22. Apesar de as antraciclinas parecerem ter um efeito cardiotóxico independente da dose administrada, vários estudos comprovam que a administração de doses inferiores, e de forma contínua, durante 24‐92h23, reduz o risco de lesões cardíacas, sendo inclusivamente descrita como a medida mais efetiva24. O aumento do tempo de duração da infusão reduz a cardiotoxicidade sem comprometer a eficácia do tratamento oncológico25, mas uma infusão com duração superior a 96h está associada a maior incidência de estomatite. A única exceção, onde a infusão contínua de doxorrubicina parece não ter um efeito cardioprotetor comparativamente com a dose intravenosa rápida, verifica‐se em crianças com leucemia linfoblástica aguda (LLA)26. Outros ensaios clínicos avaliaram, através de biópsia endomiocárdica, os danos provocados pela administração de antraciclinas em diferentes esquemas e concluíram que a perfusão contínua provocava danos muito menos significativos, quando comparada com a administração intravenosa rápida27. Estes ensaios clínicos mostraram, também, que os doentes que receberam doses contínuas tiveram maior tolerância para doses cumulativas superiores de doxorrubicina. Embora estudos em modelos animais tenham demonstrado que as concentrações de antraciclinas em tecidos tumorais eram as mesmas, independentemente do método de administração, contínua ou intravenosa rápida, o mesmo não se verificava no tecido cardíaco, onde a infusão rápida atingia concentrações superiores, provocando maior toxicidade28.
Prevenção farmacológicaAntioxidantesApesar de os antioxidantes terem a capacidade de neutralizar a formação de radicais livres provocada pelas antraciclinas e, teoricamente, reduzirem ou prevenirem a cardiotoxicidade, ensaios clínicos com N‐acetilcisteína, coezima Q, L‐carnitina, feniletilamina, amifostina e combinação de vitamina E, vitamina C e N‐acetilcisteína não foram capazes de comprovar o efeito cardioprotetor29. Já a eritropoetina e o iloprost30 mostraram, in vitro, ser protetoras contra os efeitos cardiotóxicos da doxorrubicina, sem afetar a sua eficácia antitumoral. Será, no entanto, necessário documentar o seu papel cardioprotetor in vivo.
Derivados lipossomaisUma das opções para a redução dos efeitos adversos cardíacos das antraciclinas é a alteração da apresentação do fármaco ou a associação com outras substâncias, como, por exemplo, os derivados lipossomais31. Em estudos que compararam a eficácia da doxorrubicina com a doxorrubicina encapsulada em lisossomas, apesar de não se observarem diferenças na taxa de resposta tumoral, na sobrevida global ou no tempo livre de progressão, verificou‐se que a incidência de IC e de DSVE era inferior nos doentes tratados com a formulação lisossomal. Para além disso, este grupo apresentava menor incidência de outros efeitos adversos, nomeadamente de neutropenia, náuseas, vómitos e diarreia32. Dado o seu elevado custo, estes fármacos não são utilizados com frequência e a Food and Drug Administration (FDA) aprovou a sua administração apenas para o cancro do ovário, sarcoma de Kaposi associado à síndrome da imunodeficiência adquirida e mieloma múltiplo após um ano de tratamento não responsivo a outros fármacos33.
DexrazoxaneA administração concomitante de dexrazoxane nos regimes terapêuticos antitumorais manifesta‐se como um mecanismo cardioprotetor, prevenindo o aumento das troponinas e reduzindo a incidência de IC34. Alguns autores atribuíam o efeito cardioprotetor deste quelante do ferro à redução da quantidade de ferro intracelular, o que poderia reduzir a formação de radicais livres induzida pela administração de antraciclinas34. No entanto, estudos efetuados com outros quelantes do ferro não se demostraram eficazes na cardioproteção35,36. Tem, também, sido sugerido que o efeito cardioprotetor do dexrazoxane se deve, não só à antagonização da formação do complexo de clivagem da topoisomerase II, como também à rápida degradação da topoisomerase II beta, sugerindo o envolvimento desta enzima na cardiotoxicidade induzida pela doxorrubicina37. Quando se avaliou a eficácia da dexrazoxane num estudo com mais 200 crianças com LLA, verificou‐se que limitava a elevação da troponina T em ambos os sexos38, e que tinha efeito atenuador na redução da fração de encurtamento do VE e na manutenção do rácio espessura‐dimensão do VE a cinco anos, mas apenas em crianças do sexo feminino39. Mais recentemente, foram reportados três casos de adultos que realizavam tratamento antineoplásico para o cancro da mama em combinação com dexrazoxane e que desenvolveram leucemia mieloide aguda. No entanto, dois estudos comparativos, placebo versus dexrazoxane, em crianças com LLA seguidas durante cinco e dez anos, não revelaram diferenças na incidência de malignidade secundária40,41. Apesar disso, e tendo por base os efeitos adversos detetados, a FDA e a European Medicines Agency restringiram o uso de dexrazoxane a adultos do sexo feminino, com cancro da mama metastático, tratados com doses cumulativas de doxorrubicina superiores a 300mg/m2 e que beneficiariam de tratamento adicional com antraciclinas42.
Bloqueadores‐betaA cardioproteção conferida pelos bloqueadores‐beta (BB) sobre a toxicidade da quimioterapia parece advir do seu efeito antioxidante e das suas propriedades antiapoptóticas, sendo um exemplo de destaque o carvedilol43. Este fármaco tem mostrado resultados promissores na diminuição da incidência de cardiomiopatia induzida por antraciclinas, preservando a função sistólica e diastólica. Em crianças, o carvedilol limitou a elevação da troponina I e aumentou, quer a fração de encurtamento quer o pico sistólico de strain rate global44. Segundo alguns estudos, os BB e os inibidores da enzima de conversão da angiotensina (IECA), dos quais falaremos de seguida, poderiam prevenir a remodelação verificada na IC através da redução da resposta adrenérgica45,46. Contudo, não foram observados efeitos cardioprotetores, quer no tratamento com metoprolol quer no tratamento com enalapril47.
Inibidores da enzima de conversão da angiotensina e antagonistas do recetor da angiotensinaOs IECA e os antagonistas do recetor da angiotensina (ARA) têm mostrado propriedades cardioprotetoras, através de mecanismos potenciais, como a redução do stress oxidativo, a limitação da remodelação do ventrículo esquerdo (VE) e a diminuição da apoptose48. Em crianças, e quando administrado por pelo menos dois anos após o término do regime antineoplásico, o enalapril não demonstrou benefícios na limitação do stress telessistólico da parede ventricular esquerda, nem na diminuição da fração de encurtamento em crianças com DSVE provocada por antraciclinas49. Contrariamente, em adultos tratados com altas doses de antraciclinas, este fármaco revelou eficácia na prevenção da IC e na prevenção do declínio de parâmetros de avaliação da função cardíaca como a FEVE50. Estudos em ratos knock‐out para o gene do recetor tipo I da angiotensina tipo II evidenciaram que a doxorrubicina não provoca cardiotoxicidade neste animais e que a administração de ARA em ratos pode prevenir a cardiomiopatia induzida pela daunorrubicina48. Apesar de só serem conhecidos dois estudos aleatorizados abordando a função dos ARA, foi demonstrado que o valsartan é capaz de prevenir o prolongamento agudo do intervalo QT corrigido, a dilatação diastólica do VE e a elevação do BNP, durante uma semana de quimioterapia, embora sem efeitos na FEVE51 e que o telmisartan é capaz de prevenir a diminuição do pico de strain rate durante a administração de altas doses de antraciclinas52. No entanto, são necessários mais estudos, com tempo de seguimento superior, para que essa eficácia seja comprovada.
EstatinasAs estatinas têm mostrado propriedades antioxidantes e anti‐inflamatórias53. Estudos em modelos animais revelaram que a fluvastatina é capaz de atenuar o efeito cardiotóxico induzido pelas antraciclinas, reduzindo o stress oxidativo, aumentando a expressão da enzima antioxidante mitocondrial superóxido dismutase 2, contribuindo, assim, para menor inflamação cardíaca53. Num ensaio clínico, onde foi avaliada a eficácia do tratamento contínuo com estatinas em doentes com cancro da mama, em tratamento com antraciclinas, verificou‐se que a incidência de IC era inferior com o uso desses fármacos54. Noutro estudo efetuado em doentes com FEVE previamente normal, que foram submetidos a tratamento antineoplásico com antraciclinas, observou‐se, após seis meses, que a FEVE se mantinha inalterada nos doentes tratados com atorvastatina, em comparação com redução de 8% no grupo controlo55.
Deve, e como ideia final, ser salientado que a evidência da eficácia da prevenção farmacológica é, atualmente, ainda pouco consistente, pelo que a principal estratégia preventiva continua a residir na adequada avaliação prévia dos doentes e na monitorização, seleção e adaptação da dose da terapêutica antioncológica.
Tratamento de insuficiência cardíacaApós o desenvolvimento de sinais ou sintomas de IC ou da diminuição da FEVE, decorrentes da cardiotoxicidade, o tratamento deve ser feito com base nas guidelines das sociedades científicas56. Apesar da seleção do tratamento a ser aplicado nestas circunstâncias ser importante, um estudo demostrou que o fator preponderante no sucesso diz respeito ao intervalo de tempo decorrido entre o tratamento antineoplásico e o início da instituição da terapêutica para a IC, uma vez que, se este intervalo for superior a seis meses, parece não se verificar recuperação completa da FEVE57.
Perspetivas futurasEncontram‐se, atualmente, em curso diversos estudos com o objetivo de avaliar o grau de proteção conferido por determinadas estratégias terapêuticas, farmacológicas ou não, na prevenção da toxicidade induzida por antraciclinas (Tabela 8). Será necessário, no entanto, um período de alguns anos para que sejam conhecidos os respetivos resultados. Torna‐se, ainda, premente a criação de guidelines, cientificamente reconhecidas, que orientem na avaliação e monitorização clínica destes doentes.
Ensaios clínicos em curso
| Autor (referências) | Tipo de estudo | Doença | Quimioterápico | Intervenção | Número | Período de seguimento | Dados preliminares | Data prevista de conclusão |
|---|---|---|---|---|---|---|---|---|
| Mavrudis D ClinicalTrials.gov NCT01120171 | Distribuição aleatória fase 2 | Ca mama | Antraciclinas | Ciclofosfamida versus doxorrubicina lipossomal encapsulada | 48 | 4 anos | TC e RM | Maio 2015 |
| Campbell k ClinicalTrials.gov NCT02006979 | Cego fase 2 | Ca mama | Antraciclinas | Prática de exercício físico agudo 24h antes da infusão de antraciclinas | 24 | 1 ano | Global longitudinal strain | Dezembro 2015 |
| Cipolla C ClinicalTrials.gov NCT01968200 | Distribuição aleatória fase 3 | Cancro | Antraciclinas | Enalapril após aparecimento de lesão cardíaca versus enalapril concomitante à quimioterapia | 268 | Até um ano após o término tratamento antineoplásico | Níveis de troponinas cardíacas | Julho 2016 |
| Virani S ClinicalTrials.gov NCT01708798 | Duplamente cego fase 2, 3 | Ca mama | Antraciclinas | Eplerenona versus placebo | 78 | 6 meses | FDVE | Maio 2015 |
| Bocchi E ClinicalTrials.gov NCT01724450 | Duplamente cego fase 3 | Ca mama | Antraciclinas | Carvedilol versus placebo | 200 | 2 anos | DSVE (10% redução FEVE) | Outubro 2016 |
| Livi L ClinicalTrials.gov NCT02236806 | Cego fase 3 | Ca mama | Antraciclinas e Trastuzumab | Bisoprolol versus ramipril Bisoprolol versus placebo Ramipril versus placebo | 480 | 1 ano | FEVE | Novembro 2017 |
| Smith K ClinicalTrials.gov NCT02096588 | Distribuição aleatória fase 2 | Ca mama | Antraciclinas | Sinvastatina | 90 | 5 anos | Global longitudinal strain | Abril 2021 |
Ca: cancro; DSVE: disfunção sistólica ventricular esquerda; FDVE: função diastólica do ventrículo esquerdo; FEVE: fração de ejeção do ventrículo esquerdo; RM: ressonância magnética; TC: tomografia computorizada.
O aumento da sobrevida dos doentes submetidos a tratamentos antineoplásicos e o consequente incremento da incidência de cardiotoxicidade induzida pelas antraciclinas estimulam a necessidade de investigar e comprovar os exatos mecanismos que levam a efeitos adversos verificados a nível cardíaco, para que estes sejam evitados. A investigação adicional permitirá que planos de prevenção, específicos e validados, sejam estabelecidos.
Conflito de interessesOs autores declaram não haver conflito de interesses.