Avaliar a eficácia e segurança do sistema de navegação magnética por controlo remoto Niobe II (Stereotaxis) na ablação de taquicardia ventricular ou extrassístoles ventriculares da câmara de saída do ventrículo direito e esquerdo.
MétodosEstudaram-se 32 doentes consecutivos, idade média 43±11 anos, 24 mulheres referenciados para ablação. O mapeamento da arritmia foi efetuado com o sistema CARTO RMT, orientado por controlo remoto. A ablação foi realizada com radiofrequência no local de ativação mais precoce com pacemapping de pelo menos 11/12. O sucesso foi definido como a supressão da arritmia e a sua não inducibilidade sob isoprenalina.
Após um seguimento mínimo de três meses avaliámos o sucesso clínico, definido como a ausência de sintomas e a supressão de arritmias no Holter, definido como <50 extrassístoles ventriculares/24 h.
ResultadosEm 28 doentes, a arritmia originava-se na câmara de saída do ventrículo direito (88%), em três no esquerdo, e noutro no epicárdio. O sucesso agudo foi obtido em 26 doentes (81%). Dois doentes efetuaram um segundo procedimento com sucesso, um deles por abordagem epicárdica. O sucesso final, após dois procedimentos em dois doentes, foi de 88%. Não ocorreram complicações. Durante um período de seguimento de 307±204 d, ocorreram dois recorrências.
ConclusõesO sistema de navegação magnética por controlo remoto mostrou-se eficaz e seguro para mapeamento e ablação de arritmias das câmaras de saída ventricular, permitindo um mapeamento preciso com uma elevada taxa de sucesso e sem complicações.
The aim of this study was to assess the efficacy and potential complications of a remote-controlled magnetic navigation system (Niobe II, Stereotaxis) for mapping and ablation of right or left ventricular outflow tract ventricular tachycardia or premature ventricular contractions.
MethodsWe studied 32 consecutive patients, mean age 43±11 years, 24 female. Mapping of the arrhythmia was performed using the CARTO RMT mapping system, remotely guided by the Niobe II. Radiofrequency ablation was performed at the site of earliest ventricular activation with pacemapping of at least 11/12 leads.
Acute success was defined as suppression and non-inducibility of the arrhythmia after stimulation with isoprenaline. After a minimum 3-month follow-up, we assessed clinical success (absence of symptoms and suppression of the arrhythmia on Holter recording), defined as less than 50 premature ventricular contractions/24 hours.
ResultsThe origin of the arrhythmia was in the right ventricular outflow tract in 28 patients (88%), in the left in three, and in the epicardium in one. Acute success was achieved in 26 patients (81%). Two patients underwent a second successful procedure, in one of which an epicardial approach was necessary. The overall clinical success rate, after two repeat procedures, was 88%. No complications occurred.
There were two recurrences during a mean follow-up of 307±204 days.
ConclusionThe Niobe II remote control system for mapping and ablation of ventricular outflow tract arrhythmias is effective and safe, and provides precise mapping and a high success rate, with no complications.
Lista de abreviaturas
TV- taquicardia ventricular
ESV- extra-sístoles ventriculares
CSVD- câmara de saída do ventrículo direito
CSVE- câmara de saída do ventrículo esquerdo
SNM- sistema de navegação magnética
LAP- local de ativação mais precoce
RF- radiofrequência
IntroduçãoA taquicardia ventricular (TV) e as extrassístoles ventriculares (ESV) idiopáticas da câmara de saída do ventrículo direito e ventrículo esquerdo (CSVD e CSVE) são arritmias comuns e constituem cerca de 10% de todas as formas de arritmias ventriculares1.
A natureza focal deste tipo de arritmias facilita a eficácia da ablação com taxas de sucesso entre 81 e 100%2,3.
A técnica habitual de localização da origem da arritmia consiste na obtenção de um mapa de ativação durante a TV/ESV em conjugação com o pacemapping na zona de maior precocidade3.
No entanto, a manipulação dos cateteres convencionais na câmara de saída ventricular é um procedimento moroso, dificultado pela rigidez dos cateteres, não sendo, além disso, um procedimento isento de risco de perfuração, cuja ocorrência está descrita entre 1 a 5% dos casos4,5.
Recentemente, foram desenvolvidos dois sistemas de navegação por controlo remoto com o objetivo de melhorar a manipulação dos cateteres, reduzindo a exposição ao raios X, o sistema de navegação magnética Niobe (Stereotaxis)6 (SNM) e o sistema de navegação robótica Hansen (Sensei)7. A experiência clínica na ablação de TV com este último é reduzida8. A experiência inicial com o sistema de navegação magnética na ablação de TV/ESV mostra-se promissora, mas ainda é limitada. Os trabalhos prévios são de pequena dimensão, com um número reduzido de doentes, apenas 13 doentes e oito doentes respetivamente9,10 ou casos clínicos11.
Estudos mais recentes incluíram um número maior de doentes, mas sem referir dados relativos ao seguimento12,13.
O objetivo deste estudo foi avaliar a eficácia e segurança do SNM na ablação de TV/ESV com origem na CSVD ou CSVE, incluindo um número maior de doentes com um período de seguimento maior.
MétodosSeleção de doentesEntre julho de 2008 e junho de 2011, 32 doentes consecutivos foram submetidos a estudo eletrofisiológico e ablação de TV ou ESV sintomáticas com origem provável na câmara de saída ventricular na nossa instituição.
Nenhum doente apresentava contraindicação para navegação magnética. Todos os doentes assinaram o consentimento informado.
Estudo eletrofisiológicoOs doentes foram estudados após 6 h de jejum e sem sedação. Todos os medicamentos antiarrítmicos foram suspensos durante pelo menos cinco semividas antes do estudo eletrofisiológico; nenhum doente estava medicado com amiodarona.
O eletrocardiograma de superfície e os eletrogramas intracavitários foram registados no sistema AXIOM Sensis (Siemens Systems). A estimulação programada foi efetuada com o estimulador UHS 3000 (Biotronik). Os cateteres foram posicionados através da veia femoral sob fluoroscopia no feixe de His e na grande veia cardíaca através do seio coronário. A isoprenalina foi utilizada em perfusão titulada até uma dose que induzisse a TV/ESV. O protocolo de estimulação incluía estimulação ventricular no ápex e CSVD com ciclo básico de 600/500/400 ms e S4 até período refratário e estimulação ventricular e auricular contínua.
Navegação magnéticaTodos os procedimentos foram efetuados com o sistema de fluoroscopia AXIOM Artis (Siemens).
O SNM já foi previamente descrito6: resumidamente, consiste em dois magnetos controlados por computador posicionados em ambos os lados da mesa de fluoroscopia. Estes magnetos originam um campo magnético (0,1T). A posição dos magnetos é controlada por uma consola, a estação de trabalho Navigant, que origina as variações na orientação do campo magnético de acordo com os vetores escolhidos pelo operador. O cateter de ablação tem 3 magnetos na sua porção distal, que o orientam de forma paralela ao campo magnético criado. As alterações na orientação do campo magnético levam à deflexão da ponta do cateter que, por sua vez, é avançado remotamente com o auxílio de um motor na extremidade proximal do cateter, o Cardiodrive (Stereotaxis). O vetor relativo a cada campo magnético pode ser guardado permitindo a posterior navegação do cateter para locais prévios de forma automática.
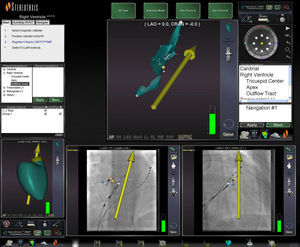
Mapeamento e ablaçãoO SNM encontra-se integrado com o sistema de mapeamento eletroanatómico CARTO XP RMT (Biosense Webster), recebendo informação em tempo real sobre a posição da ponta do cateter de mapeamento e sua orientação. Esta informação é apresentada nas imagens fluoroscópicas exibidas na estação de trabalho Navigant, permitindo monitorização em tempo real da posição do cateter sem fluoroscopia (Figura 1).
Imagens fluoroscópicas de referência no ecrã do Navigant em OAE e OAD, mostrando em tempo real a posição do cateter de ablação (estrela preta) sem recurso à fluoroscopia; o vetor automático do SNM apontando à CSVD (vetor amarelo) e feixe de His marcado (pontos amarelos).
CSVD: câmara de saída do ventrículo direito; OAD: oblíqua anterior direita; OAE: oblíqua anterior esquerda; SNM: sistema de navegação magnética.
O mapeamento foi efetuado durante a TV ou em ritmo sinusal em doentes com ESV. Utilizou-se um cateter de 4mm específico, com três magnetos na ponta, Navistar RMT (Biosense Webster), até estar disponível o cateter magnético irrigado, Navistar RMT Thermocool (Biosense Webster), o qual foi utilizado em todos os casos desde essa altura. O cateter de ablação foi introduzido através da veia femoral com progressão manual até à aurícula direita e por controlo remoto até ao feixe de His e CSVD. A localização do feixe de His e da válvula pulmonar foram marcados.
Tanto em ritmo sinusal no mapeamento das ESV como nos doentes em TV, foi efetuado mapeamento detalhado da ativação ventricular.
Os tempos de ativação bipolar foram revistos manualmente e os mapas de ativação foram apresentados em modo automático, considerando-se o isócrono mais precoce como o local de ativação mais precoce (LAP). Após efetuar as reconstruções isocronais da CSVD ou CSVE, foi efetuado pacemapping em múltiplos locais endocárdicos perto do LAP. A estimulação ventricular para obter o pacemapping foi efetuada com ciclo idêntico ao da TV ou com intervalo de acoplamento da ESV. Foi aplicada energia de radiofrequência (RF) no LAP exibindo um padrão QS no sinal unipolar e um pacemapping ótimo de 11/12 ou 12/12. Quando no mapeamento da CSVD não se encontrou um local que exibisse estes critérios, foi efetuado mapeamento da CSVE, introduzindo-se o cateter de ablação no ventrículo esquerdo por abordagem retrógrada através da artéria femoral, administrando-se heparina endovenosa após punção arterial.
A aplicação de energia de RF foi efetuada com um gerador EP Shutle RF (Stockert) entre o elétrodo distal do cateter de ablação e uma placa cutânea, até 120 s com um limite de potência de 55 W e temperatura máxima de 55°C no caso do cateter de 4mm e limite de potência de 35W e temperatura de 43°C quando se utilizou o cateter irrigado. Nos casos em que a aplicação de RF foi ineficaz, foram efetuadas aplicações adicionais em locais adjacentes ao LAP exibindo um bom pacemapping. Durante a aplicação de RF, foi efetuada sedação ligeira com midazolam, (bólus) ou remifentanilo (perfusão), quando necessário.
Foram registados o tempo de procedimento e de fluoroscopia, o número de aplicações e o tempo de aplicação de RF. O tempo de procedimento foi definido como o intervalo desde a punção venosa até à remoção dos introdutores.
O sucesso foi definido como eliminação das ESV ou não inducibilidade da TV sob isoprenalina até 30 min após a ablação.
Todos os doentes permaneceram no hospital monitorizados durante 24 h após o procedimento.
SeguimentoO seguimento foi efetuado em consulta. Os doentes foram avaliados clinicamente e por registo de Holter de 24 h no primeiro mês, aos três meses após ablação e regularmente cada seis meses depois disso.
O sucesso clínico no seguimento foi definido como a ausência de sintomas e a supressão de arritmias no Holter, definido como < 50 ESV/24 h.
Análise estatísticaOs dados são apresentados como média e desvio padrão para as variáveis contínuas e como frequência para variáveis discretas.
ResultadosPopulaçãoTrinta e dois doentes com idade média de 43±11 anos, 24 mulheres, foram submetidos a ablação de TV ou ESV frequentes. Seis doentes tinham TV documentada e 26 doentes tinham ESV frequentes no Holter de 24 h (mínimo de 10 000/24 h) sintomáticas e refratárias à terapêutica. Todos os doentes foram estudados por ecocardiografia e nenhum doente apresentava alterações morfológicas do ventrículo direito ou do ventrículo esquerdo. Quatro doentes tinham hipertensão arterial. Em quatro dos seis doentes com TV documentada não foi possível induzir TV mantida. Em dois doentes induziu-se TV sob perfusão de isoprenalina, bem tolerada e com ciclos de 388 ms e de 400 ms.
Mapeamento e ablaçãoA CSVD foi identificada como o local de origem da arritmia em 28 doentes, com uma localização septal em 20 e na parede livre em oito doentes. Em três doentes, a origem localizava-se no ventrículo esquerdo, um na cúspide coronária direita e dois na CSVE. Num doente foi efetuado mapeamento à direita e à esquerda, não tendo sido possível encontrar um local com um tempo de ativação suficientemente precoce, tendo sido posta a hipótese de uma origem epicárdica.
O mapeamento foi efetuado em TV em dois doentes e em ritmo sinusal com mapeamento das ESV nos restantes. No local de aplicação de RF, o eletrograma ventricular precedia o início do QRS em pelo menos 30 ms com um pacemapping de 11/12 ou 12/12.
Nos três doentes em que a arritmia se localizava no ventrículo esquerdo, foi efetuada coronariografia antes da ablação. O mapeamento da CSVD e da CSVE foi efetuado por controlo remoto com o SNM em todos os procedimentos; foi utilizado um cateter de 4mm nos primeiros três procedimentos e um cateter irrigado nos restantes 31 procedimentos.
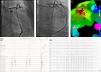
Durante os primeiros segundos de aplicação de RF nos locais com sucesso, verificou-se a ocorrência de runs de TV de morfologia semelhante à arritmia clínica. Nos doentes em que a ablação foi efetuada em TV, ocorreu supressão da TV durante a aplicação. A ablação foi efetuada com sucesso em 26 doentes (81%). Em seis doentes não foi obtido sucesso, num doente o LAP encontrava-se a menos de 5mm do ostium da coronária direita (Figura 2) e, noutro doente, a origem da arritmia era epicárdica.
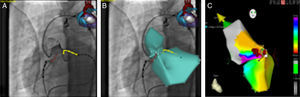
Dois doentes repetiram o procedimento, no doente com o foco epicárdico a abordagem foi realizada por via transpericárdica. O cateter de ablação irrigado foi introduzido no espaço pericárdico através de uma bainha longa e o mapeamento epicárdico foi efetuado com o SNM. O LAP foi identificado na face anterior da CSVE junto à veia interventricular anterior. O eletrograma epicárdico no local de ablação precedia o QRS em 42 ms com um pacemapping de 12/12. Antes da aplicação de RF, foi efetuada coronariografia. A aplicação de RF nesse local eliminou as ESV (Figura 3). O outro doente com LAP na CSVD repetiu a ablação 11 meses após o primeiro procedimento com sucesso. O sucesso final, após dois procedimentos em dois doentes, foi de 88%. O tempo de procedimento foi de 208±79min e o tempo de fluoroscopia de 10±7,8min. Foram efetuadas em média 9±7 aplicações por doente e o tempo médio de aplicação de RF foi 460±290 s.
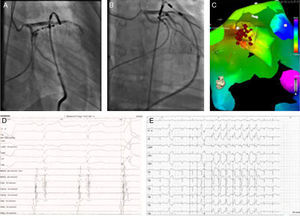
Ablação epicárdica, cateter de ablação no local de ablação em OAD (A) e OAE (B). Mapa de ativação (C), mostrando o LAP na face anterior da CSVE junto à veia interventricular anterior (pontos vermelhos). Eletrograma e pacemapping com uma concordância 12/12 no local de ablação com sucesso (D e E).
OAD: oblíqua anterior direita; OAE: oblíqua anterior esquerda.
Não foram observadas complicações relacionadas com o mapeamento por controlo remoto ou com a ablação. Durante um tempo de seguimento médio de 307±204 d, dois doentes apresentaram recidiva das ESV no registo de Holter. Um doente encontrava-se assintomático e as ESV reduziram-se de 24 000/24h antes da ablação para 5000/24h após ablação; o outro doente referia sintomas, mas recusou um novo procedimento.
DiscussãoPara alcançar a CSVD, os cateteres convencionais têm de efetuar dois curvaturas, uma entre a aurícula direita e a câmara de entrada do ventrículo direito e a segunda entre a câmara de entrada e câmara de saída. Esta dupla curvatura imposta ao cateter de ablação torna a sua manipulação difícil, o que impede um mapeamento rápido e preciso.
O sistema de navegação por controlo remoto SNM (Stereotaxis) possibilita que o cateter de ablação ultrapasse várias curvas dentro das câmaras cardíacas e, ainda assim, manter a capacidade de mover a sua ponta em qualquer direção escolhida, permitindo uma precisão e facilidade de mapeamento impossível com um cateter convencional14. Com o SNM, o cateter de ablação pode ser facilmente colocado em qualquer local da CSVD ou CSVE sem o auxílio de bainhas longas e com uma melhor estabilidade, conforme previamente demonstrado15.
As opções de mapeamento automático (Auto-Map) na estação de trabalho Navigant e a possibilidade de renavegar o cateter para locais previamente mapeados, com o auxílio dos vetores magnéticos anteriormente guardados sem necessidade de fluoroscopia, permite reduzir o tempo de fluoroscopia. O tempo de fluoroscopia de 10±7,8min obtido com este método é muito inferior ao obtido noutros estudos com ablação convencional utilizando sistemas de mapeamento tridimensional (45,9±17,9min)16 ou mapeamento com cateteres multielétrodo (49,7±26,3min)17. Um estudo comparativo entre a ablação convencional e a ablação com SNM de vários tipos de arritmia, incluindo ablação de TV, mostrou uma redução significativa do tempo de fluoroscopia com o SNM (30±20 versus 35±25min, p<0,01)13.
Um estudo prévio de ablação de TV com SNM reportou um tempo de fluoroscopia inferior ao da nossa série, (7,5±4,3min); no entanto, esse estudo não incluiu ablação na CSVE ou ablação epicárdica9.
A manipulação de cateteres em estruturas como a CSVE ou CSVE acarreta um risco de perfuração cardiaca4,5. A flexibilidade do cateter do SNM, aliada à sua ponta mole, leva a uma redução da força aplicada ao endocárdio quando comparado com o cateter convencional18, o que pode justificar a ausência de complicações reportada no nosso estudo e em estudos prévios9–13.
LimitaçõesO presente estudo é um estudo não aleatorizado e incluiu um número reduzido de doentes. Não foram comparados os tempos de procedimento e de fluoroscopia ou a eficácia do procedimento com a ablação convencional.
ConclusãoNo nosso grupo de doentes, o mapeamento e a ablação das arritmias com origem nas câmaras de saída foi eficaz e segura com tempos de fluoroscopia reduzidos e sem complicações.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos de seu centro de trabalho acerca da publicação dos dados de pacientes e que todos os pacientes incluídos no estudo receberam informações suficientes e deram o seu consentimento informado por escrito para participar nesse estudo.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesNão existem conflitos de interesses.