Nos anos 1980 assistiu‐se a uma evolução profunda do conhecimento sobre a fisiopatologia da insuficiência cardíaca (IC): outrora considerada uma síndrome clínica de origem fundamentalmente estrutural, a IC começou a ser vista como a consequência de um desequilíbrio de forças hormonais opostas. Foi, de facto, nesta década que surgiram os estudos basilares sobre o impacto dos sistemas neuro‐hormonais na IC. E destes destacam‐se oito: quatro de natureza vasoconstritora e antinatriurética (o sistema nervoso simpático [SNS], o sistema da renina‐angiotensina‐aldosterona [SRAA], o sistema da vasopressina arginina e a endotelina) e quatro de natureza vasodilatadora e natriurética (o sistema das protaglandinas [PGs], do óxido nítrico [NO], o sistema dopaminérgico e o sistema dos péptidos natriuréticos [NPS]). Fortemente interligados entre si e com um sistema de regulação intrincado, estes sistemas funcionam habitualmente numa homeostasia delicada, cuja disrupção é sinal característico da IC. Nesta revisão é explorado o desenvolvimento histórico do conhecimento sobre o impacto destes sistemas neuro‐hormonais na IC desde os seus primeiros estudos até ao conhecimento atual. Para além disso, são também revisitadas as oportunidades terapêuticas que cada um deles apresenta, bem como as famílias de antagonistas neuro‐hormonais atualmente utilizadas na terapia da IC. Nesta última parte dá‐se especial destaque ao último fármaco aprovado para utilização em doentes com IC com fração de ejeção reduzida, o sacubitril/valsartan, que combina dois antagonistas e que por isso atua simultaneamente em dois sistemas neuro‐hormonais: o SRAA e o NPS.
Our knowledge of the pathophysiology of heart failure (HF) underwent profound changes during the 1980s. Once thought to be of exclusively structural origin, HF began to be seen as the consequence of hormonal imbalance. A number of seminal studies were published in that decade focusing on the impact of neurohormonal activation in HF. Presently, eight neurohormonal systems are known to have a key role in HF development: four stimulate vasoconstriction and sodium/water retention (the sympathetic nervous system, the renin‐angiotensin‐aldosterone system [RAAS], endothelin, and the vasopressin‐arginine system), while the other four stimulate vasodilation and natriuresis (the prostaglandin system, nitric oxide, the dopaminergic system, and the natriuretic peptide system [NPS]). These systems are strongly interconnected and are subject to intricate regulation, functioning together in a delicate homeostasis. Disruption of this homeostasis is characteristic of HF. This review explores the historical development of knowledge on the impact of the neurohormonal systems on HF pathophysiology, from the first studies to current understanding. In addition, the therapeutic potential of each of these systems is discussed, and currently used neurohormonal antagonists are characterized. Special emphasis is given to the latest drug approved for use in HF with reduced ejection fraction, sacubitril/valsartan. This drug combines two different molecules, acting on two different systems (RAAS and NPS) simultaneously.
A insuficiência cardíaca (IC) é uma síndrome clínica de origem estrutural ou funcional que se caracteriza por um deficiente enchimento ventricular ou ejeção de sangue a nível do ventrículo. Braunwald definiu esta síndrome como «uma condição em que o coração é incapaz de manter o débito cardíaco adequado para satisfazer as necessidades metabólicas e o retorno venoso». Mais recentemente, a European Society of Cardiology (ESC) propôs uma nova definição, terminologia e critérios de diagnóstico da IC na fase não aguda1. Assim, nas últimas décadas assistiu‐se a uma evolução profunda no conhecimento da IC: desde a sua visão tradicional como um problema de origem exclusivamente cardíaca, chegou‐se atualmente a um modelo integrado em que a natureza progressiva desta doença é atribuída a um quadro complexo de alterações estruturais e funcionais, em resposta às quais estão envolvidos não só o sistema cardiovascular, mas também os sistemas renal, respiratório e neuro‐hormonal, entre outros2,3.
Inerente à questão da IC está a capacidade de contração do músculo cardíaco, descrita pelo conjunto de eventos denominado por acoplamento excitação‐contração. A contração dos miofilamentos é iniciada por um aumento de cálcio (Ca2+) intracelular, Ca2+ esse que é libertado do retículo sarcoplasmático após indução por Ca2+ (calcium‐induced calcium release – CICR) ou pela abertura de canais sensíveis à voltagem (voltage‐sensitive release mechanism – VSRM). Num contexto de IC, as contribuições relativas das vias CICR e VSRM parecem estar alteradas, com a última a ser atenuada e a contribuir para a disfunção contráctil característica desta síndrome4.
De entre os mecanismos fisiopatológicos envolvidos na IC interessa aqui destacar três: a fibrose (i.e., a acumulação excessiva de proteínas estruturais na matriz extracelular), a apoptose celular e a disfunção ventricular. Todos eles estão relacionados com uma reação inflamatória exacerbada tipicamente presente em situações de stress do músculo cardíaco, como por exemplo na hipertensão. Nestas situações ocorre uma ativação dos monócitos, seguida de infiltração nos tecidos e diferenciação em macrófagos. Consequentemente, há um aumento dos níveis de citocinas pró‐inflamatórias (como sendo o fator de necrose tumoral alfa [TNFα], interleucina (IL) 1, IL6, IL8 e proteína quimiotática de monócitos‐1) na periferia e no miocárdio de doentes com IC5,6. Para além disso, estes macrófagos produzem também o fator de transformação do crescimento beta (TGFβ), estando associados à fibrose do miocárdio e à remodelação tipicamente observadas na IC5,7.
Em termos clínicos, a IC manifesta‐se por um conjunto de sinais que incluem dilatação e hipertrofia do miocárdio, alteração do inotropismo e aumento da frequência cardíaca, elevação da pré‐carga e da pós‐carga e retenção renal de sódio e água8. A nível de sintomatologia, estas alterações traduzem‐se em dificuldades respiratórias, edema, crepitações na auscultação, fadiga, distensão abdominal e taquicardia, entre outros9. Assim, os doentes com IC estão normalmente limitados em termos de atividade física e a sua qualidade de vida é substancialmente afetada10.
A IC é um problema de saúde pública de dimensão global que acarreta elevados custos para doentes, hospitais e sistemas de saúde envolvidos. A nível mundial, estima‐se que 23 milhões de indivíduos estejam afectados11,12. Embora a incidência desta patologia pareça ter estabilizado nos últimos anos, a sua prevalência continua a subir, fruto do envelhecimento da população, da melhoria no tratamento e aumento da sobrevida de outras doenças cardiovasculares e da própria IC, e ainda de um aumento na prevalência das comorbilidades11. Uma revisão sistemática recente de Van Riet et al. estimou uma prevalência mediana da IC de 11,8% entre a população com 60 ou mais anos13. Em Portugal continental, dados publicados em 2002 apontam para uma prevalência global de 4,36%, prevalência essa que aumenta de forma considerável com a idade (desde 1,36% para o grupo etário de 25 a 49 anos até 16,14% para indivíduos com idade superior a 80 anos)14. Face a estes dados, foi estimado que o número de doentes com IC em Portugal continental atingirá 397 805 indivíduos em 2018 e cerca de 494 191 em 206015. Os fatores de risco da IC foram amplamente estudados e são sobejamente conhecidos: incluem idade avançada, sexo masculino, isquemia do miocárdio, hipertensão, diabetes, dislipidemia, obesidade e tabaco, entre outros3,11. Curiosamente, a sua importância relativa varia com a região demográfica, com a isquemia do miocárdio a assumir um papel preponderante nos países ocidentais desenvolvidos12.
Em 1989 publicamos, sob a orientação do Prof. Mário Cerqueira Gomes, uma revisão intitulada Mecanismos neuro‐humorais na insuficiência cardíaca – Da fisiopatologia ao tratamento, em que se tentava explicar, ainda de uma forma especulativa, os benefícios dos tratamentos então emergentes da IC com base nas suas influências favoráveis sobre os sistemas neuro‐hormonais ativados8. A presente revisão, para além de pretender ser uma homenagem à visão pioneira do Prof. Cerqueira Gomes e aos coautores desse trabalho, alguns entretanto falecidos, tem como objetivo revisitar o impacto dos sistemas neuro‐hormonais na IC desde a sua descoberta até as evidências mais recentes, bem como perceber os mecanismos através dos quais as terapêuticas atuais interferem e modelam estes sistemas. Será dada especial ênfase a um fármaco recente – o sacubitril/valsartan – que tem a particularidade de atuar em dois dos sistemas neuro‐hormonais de forma simultânea (atenuando sistemas agressores e amplificando sistemas protetores a nível cardiovascular) e que tem demonstrado uma eficácia e tolerabilidade muito promissoras nos vários ensaios clínicos em que foi testado. Uma excelente revisão sobre o enquadramento deste medicamento na IC foi alvo de anterior publicação nesta revista16.
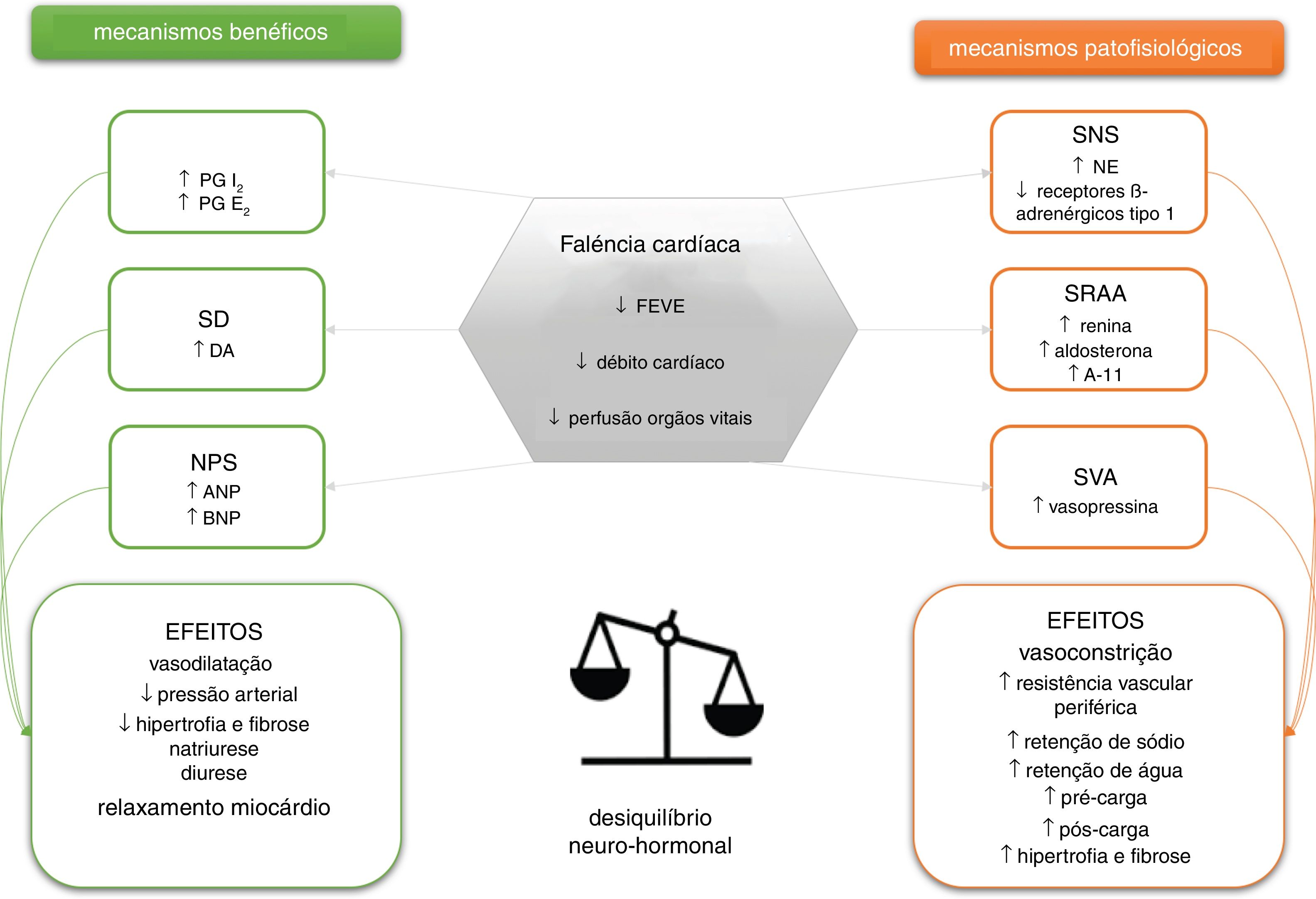
O impacto dos mecanismos neuro‐hormonais na ICTal como mencionado anteriormente, a estimulação excessiva dos sistemas neuro‐hormonais está intrinsecamente associada à fisiopatologia da IC, a qual se expressa a nível hormonal, autócrino e parácrino. O reconhecimento da importância destes sistemas data dos anos 1980, em que a acumulação de uma série de evidências científicas conduziu à identificação da correlação estreita entre os mecanismos hormonais e o quadro clínico/prognóstico da IC8,17,18. São essencialmente seis os sistemas neuro‐hormonais envolvidos na IC: três deles têm uma função essencialmente vasoconstritora e antinatriurética – sistema simpático, sistema da renina‐angiotensina‐aldosterona e o sistema da vasopressina‐arginina –, enquanto que os restantes têm uma função essencialmente vasodilatadora e natriurética – sistema das prostaglandinas e do óxido nítrico, sistema dopaminérgico e sistema dos peptídeos natriuréticos (Figura 1)8,18.
Esquema representativo dos sistemas neuro‐hormonais envolvidos na insuficiência cardíaca e dos seus principais efeitos. PG, prostaglandina; SD, sistema dopaminérgico; NPS, sistema dos péptidos natriuréticos; FEVE, fração de ejeção do ventrículo esquerdo; SNS, sistema nervoso simpático; SRAA, sistema renina‐angiotensina‐aldosterona; A‐II, angiotensina II; SVA, sistema vasopressina‐arginina.
A ativação destes sistemas está intimamente ligada a uma fase inicial de aparente compensação (adaptação) da disfunção ventricular e das suas manifestações sistémicas. Porém, a sua estimulação persistente, sobretudo no caso dos sistemas vasoconstritores e antinatriuréticos, vai suscitar a expressão dos seus efeitos citotóxicos, pró‐coagulantes, pró‐inflamatórios e pró‐proliferativos (entre outros), acabando por desempenhar um papel importante na deterioração e agravamento progressivo do quadro de IC.
Desde os anos 1980, e após a falência das terapêuticas estimulantes no inotropismo cardíaco, a estratégia do tratamento médico da IC teve como alvo contrariar os vários sistemas neuro‐humorais vasoconstritores e antinatriuréticos ou as suas consequências. Neste contexto inclui‐se a terapêutica com base na associação nitratos/hidralazina19, na inibição do sistema renina‐angiotensina‐aldosterona (SRAA) com inibidores da enzima conversora da angiotensina (ACE‐Is)20,21, nos antagonistas do recetor AT1da angiotensina II (ARAs)22, nos antialdosterónicos23, na inibição do sistema nervoso central com bloqueadores beta24 e na redução pura da frequência cardíaca com ivabradina25. Porém, a inibição do SRAA e do simpático pode não ser universalmente benéfica. De facto, alguns doentes (raros) mesmo em fases avançadas da ICC podem sofrer agravamentos com bloqueador beta e/ou bloqueador do SRAA. Presumivelmente configuram situações em que a perfusão de órgãos está muito dependente da ativação do SRAA ou da inotropia cardíaca e em que a inibição destes sistemas se revela inconveniente.
É hoje claro que se por um lado quer a inibição do SNS e do SRAA quer a amplificação do sistema dos péptidos ́natriuréticos acarreta benefícios na redução da mortalidade e morbilidade dos doentes com ICC, verifica‐se que, pelo contrário, não se demonstrou (para já) benefício equivalente com inibição da vasopressina e amplificação do sistema das prostaglandinas e dopamina. A explicação mais simples é que em termos filogenéticos são estes (SNS, SRAA e péptidos ntriuréticos) os sistemas que atingiram maior intensidade, dominância e organização na capacidade de resposta aos desequilíbrios de homeostasia de volume e perfusão pelo que interação nestes traduz‐se por efeitos mais acentuados. Porém, não é de excluir que, em alternativa, os instrumentos de que atualmente dispomos para interagir nestes sistemas sejam mais eficazes e seletivos do que os de que dispomos para interferir nos sistemas vasopressina prostaglandinas vasodilatadoras e dopamina.
Sistema nervoso simpáticoO sistema nervoso simpático (SNS) foi um dos primeiros mecanismos a serem estudados no contexto da IC8. De facto, já em 1897 Starling publicou um artigo em que associava a taquicardia e a vasoconstrição típicas da IC a um mecanismo reflexo26. Quase 70 anos mais tarde, Chidsey et al. haveriam de demonstrar que a IC está intrinsecamente associada a um aumento da atividade do SNS, refletido numa maior excreção de norepinefrina em doentes com IC, geralmente acompanhada por uma menor concentração desta hormona a nível dos tecidos do miocárdio (Figura 2)26. Foi depois demonstrado que a concentração plasmática de norepinefrina está diretamente correlacionada com a disfunção ventricular esquerda27, uma vez que a exposição sistemática a esta hormona conduz a uma diminuição na densidade dos recetores β‐adrenérgicos – mas não dos recetores α‐adrenérgicos ou dos da histamina – no miocárdio de doentes com IC28,29. Daqui decorreria uma diminuição do inotropismo e uma vasoconstrição periférica com aumento da pós‐carga.
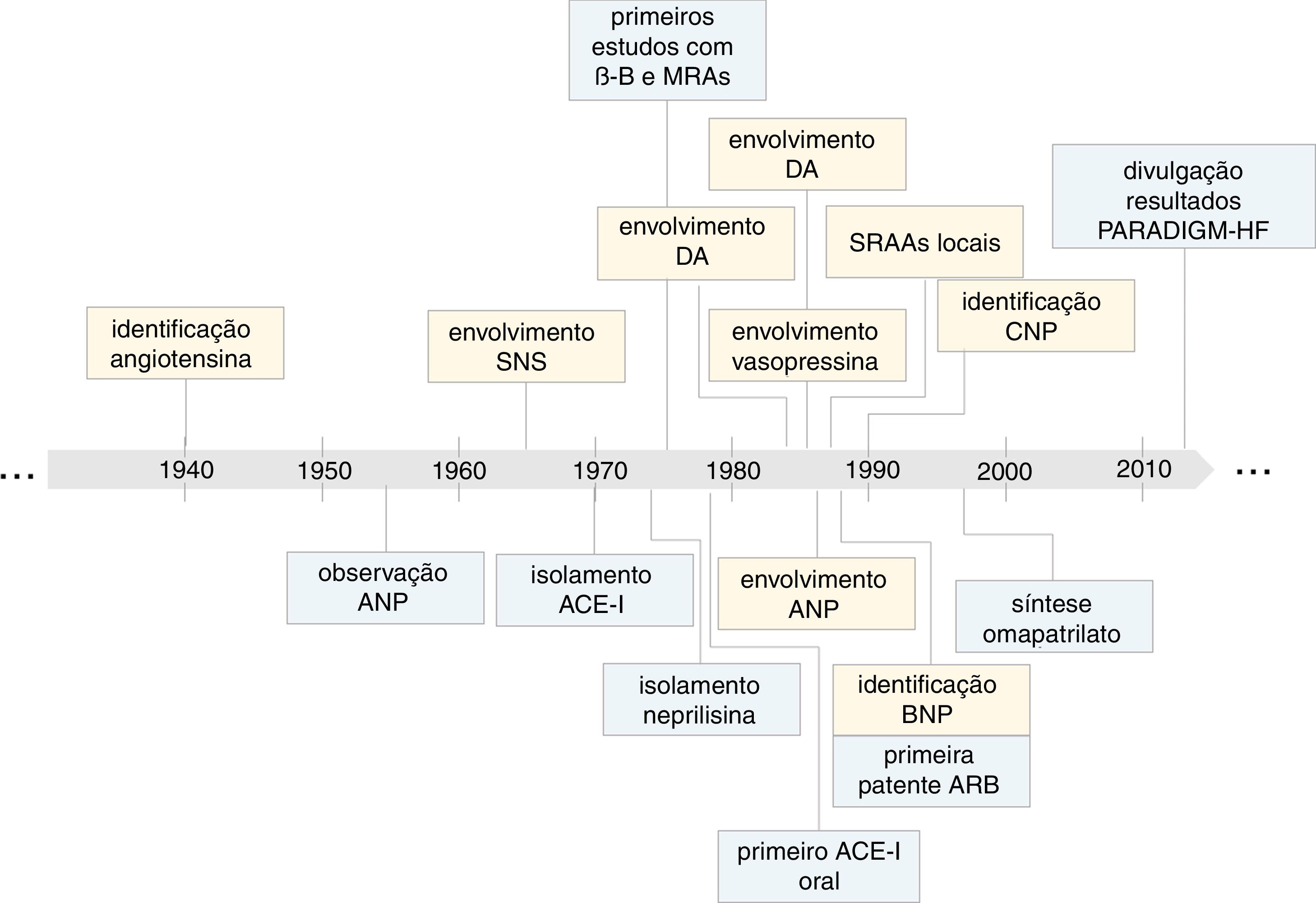
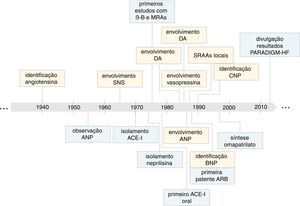
Momentos chave na evolução do conhecimento sobre o impacto dos sistemas neuro‐hormonais na insuficiência cardíaca (em amarelo) e no desenvolvimento de terapêuticas baseadas na inibição destes sistemas (em azul). SNS, sistema nervoso simpático; PGs, β‐B, bloqueadores adrenérgicos β; IC, insuficiência cardíaca; PGs, prostaglandinas; DA, dopamina; CNP, péptido natriurético tipo C; ANP, péptido natriurético tipo A; ACE‐I, inibidor da enzima de conversão da angiotensina; BNP, péptido natriurético tipo B; ARB, antagonistas dos recetores da angiotensina II; PARADIGM‐HF, Prospective comparison of ARNi with ACEi to determine impact on global mortality and morbidity in HF trial.
O impacto do SNS no sistema cardiovascular é hoje amplamente reconhecido e inclui aumento do ritmo cardíaco, inotropismo positivo e vasoconstrição periférica; por oposição, e através da enervação vagal e ativação de baroreceptores, o sistema nervoso parassimpático diminui o ritmo cardíaco30. Este conjunto de forças antagonistas que regulam a função do miocárdio via SNS e sistema nervoso parassimpático é conhecido como modulação cardíaca autonómica31. Numa situação de IC, o SNS é progressivamente estimulado por mecanismos centrais e periféricos, sendo em grande parte regulado pela angiotensina II. Este aumento da atividade do SNS é inicialmente benéfico, já que aumenta a pressão de perfusão tecidular e contraria o débito cardíaco reduzido; no entanto, e a longo prazo, torna‐se patológico, levando a repercussões várias resultantes do aumento da norepinefrina, a modificações a nível da hierarquia neuronal do miocárdio e a uma diminuição específica da densidade dos recetores β‐adrenérgicos do tipo 1 nos tecidos cardíacos30,32,33. O papel do sistema parassimpático no contexto de IC tem sido menos estudado: é sabido que neste contexto ocorre uma redução da estimulação parassimpática, que tem como consequências um aumento do ritmo cardíaco e diminuição da variabilidade da frequência cardíaca, estando ambos estes fatores associados a uma maior mortalidade. Por outro lado, a estimulação dos recetores muscarínicos parece ter um efeito antagonista sobre a estimulação β‐adrenérgica.31
Sistema renina‐angiotensina‐aldosteronaO interesse no SRAA despertou quando Tigerstedt identificou uma substância produzida pelo córtex renal de coelhos que desencadeava uma resposta vasoconstritora, substância essa que foi denominada renina34. No entanto, mais de 40 anos passaram até que a substância responsável pela vasoconstrição – hoje conhecida como angiotensina – fosse identificada (Figura 2)35,36. Baseada nestes e outros estudos basilares nasceu a visão tradicional do SRAA, que englobava a produção de renina no rim, responsável por catalisar a transformação do angiotensinogénio (de origem hepática) em angiotensina I, que por sua vez era catalisada em angiotensina II (A‐II) pela enzima conversora da angiotensina (ECA, de origem pulmonar). Esta noção do SRAA, de funcionamento sistémico, haveria de evoluir no início dos anos 1980, quando uma série de experiências sugeriu a existência de SRAAs locais ou tecidulares (Figura 2)8,37. De facto, demonstrou‐se que a produção de angiotensina ocorria em diferentes órgãos (como por exemplo miocárdio, cérebro e rim) e que os níveis de A‐II locais podiam mesmo exceder os da A‐II plasmática, desempenhando importantes funções a nível da resistência vascular e funções cardíaca e atividade adrenérgica8,37. Para além disso foram identificadas várias vias enzimáticas alternativas de produção de angiotensina II, bem como diferentes tipos e subtipos de recetores com efeitos multifacetados a nível cardiovascular.
De uma forma sucinta, o SRAA é ativado como resposta à presença de hipoperfusão renal: os barorrecetores presentes na parede na arteríola aferente renal estimulam os grânulos secretores para a produção de renina38,39. Consequentemente, verifica‐se um aumento de atividade da renina plasmática (ARP), aumento esse que é particularmente conspícuo nas classes de IC III e IV (de acordo com a escala funcional definida pela New York Heart Association [NYHA]). Nas classes funcionais menos sintomáticas – I e II – e mesmo na ausência de um aumento marcado de ARP, poderá haver estimulação dos SRAAs locais. Dessa forma existe, por um lado, a A‐II sistémica, que é o principal mediador da resposta ao decréscimo de volume e pressão arterial, e, por outro lado, a A‐II local, responsável pela manutenção da homeostasia a nível do órgão/tecido8,39. Os efeitos da A‐II são variados e incluem: aumento da resistência vascular periférica, vasoconstrição da arteríola eferente glomerular, estimulação da reabsorção de sódio e água, contração da musculatura lisa vascular, estimulação das glândulas adrenais para a produção de aldosterona e estimulação da produção de prostaglandinas (PGs)8,39,40. A nível cardíaco, a A‐II estimula a hipertrofia celular, bem como a hipertrofia dos fibroblastos e deposição de colagénio, promovendo dessa forma a fibrose do miocárdio8,39,40. Esta fibrose dos tecidos, juntamente com a expansão da matriz extracelular, são dois dos sinais indicadores da remodelação ventricular característica da IC com fração de ejeção reduzida (IC‐FER)39. Efeitos semelhantes ocorrem também a nível vascular (espessamento da parede arterial e disfunção endotelial, entre outros) e neurovascular e muitos destes são também exibidos pela aldosterona e por outras hormonas com efeito mineralocorticóide. Finalmente, outro dos efeitos do SRAA é a inativação da bradicinina – um péptido vasodilatador – por ação da ECA40. Os benefícios conseguidos pelos fármacos moduladores do SRAA nos sintomas e no prognóstico da IC foram a prova mais robusta da importância do SRRA na fisiopatologia da síndrome de IC. Existe uma relação muito próxima entre os efeitos vasodilatadores da bradicinina e os efeitos das prostaglandinas e do óxido nítrico (NO). De facto, na IC ocorre uma atenuação da vasodilatação dos pequenos leitos arteriais dependentes da produção de NO pelo endotélio, a qual é normalizada pela inibição do SRAA.41
Sistema vasopressina‐argininaOs primeiros estudos que se debruçaram sobre o impacto da vasopressina na IC datam do início dos anos 1980: alguns investigadores (por exemplo, Szatalowicz et al., em 1981, e Goldsmith et al., em 1983) publicaram de forma quase simultânea a observação de que os níveis de vasopressina estavam geralmente elevados em doentes com IC (Figura 2) 42,43. A relação potencial entre este aumento e a fisiopatologia da IC surgiria uns anos mais tarde44, embora de alguma forma marcada pela ideia de que a importância da vasopressina seria relativa ou, pelo menos, inferior à dos SNS e SRAA. De facto, Creager et al., em 1986, monitoraram os três sistemas – arginina‐vasopressina, SNS e SRAA – num cohorte de 10 doentes com IC avançada, mas o aumento da vasopressina foi apenas detetado em três deles45. Não obstante, estes doentes respondiam a um antagonista da vasopressina apresentando vasodilatação sistémica, provando desta forma que a vasopressina efetivamente contribuía para a vasoconstrição típica da IC. Na mesma linha de pensamento, Johnston et al. publicaram no mesmo ano um estudo em que mostraram que um modelo de coelho com IC apresentava níveis normais de vasopressina, mas uma sensibilidade acrescida a esta hormona46. Consequentemente, a administração de um antagonista da vasopressina levava a um decréscimo na pressão arterial e na resistência periférica, bem como a um aumento do débito cardíaco.
A hormona vasopressina é sintetizada pelo hipotálamo e armazenada no lobo posterior da glândula pituitária. Em condições fisiológicas, a sua libertação ocorre em resposta a um aumento da osmolaridade ou diminuição do volume plasmático e as suas ações – mediadas pelos recetores V1A, V1B e V2 – visam a manter a homeostasia do conteúdo de água do organismo e da pressão arterial47. Numa situação de falência cardíaca, o SNS e o SRAA estimulam a libertação de vasopressina na ausência de um aumento da osmolaridade48. A vasopressina, por usa vez, estimula a vasoconstrição via recetor V1A, aumenta a retenção de água e concentra a urina via recetor V2 (e, em parte, também via recetor V1A) e poderá ainda mediar a libertação de aldosterona via recetor V1B.48,49. Como resultado geral há um aumento da resistência vascular e da pós‐carga, uma diminuição da irrigação e da capacidade de contração do miocárdio, hipertrofia e remodelação ventricular e retenção de água acompanhada por congestão pulmonar, edema e aumento da pré‐carga49. Para além disto, e como consequência da reabsorção de água a nível renal na presença de uma osmolaridade já de si baixa, poderá ocorrer hiponatremia, um importante marcador de mau prognóstico e mortalidade aumentada na IC47–49.
Endotelina (ET)A endotelina (ET) é um peptídeo de origem endotelial, foi descoberta em 1988 por Yanagisawa et al,50, sendo um dos vasoconstritores endógenos mais potentes com efeitos mediados pela estimulação de recetores nomeadamente os ET‐A localizados no musculo liso vascular e miocárdio e ET‐B de localização endotelial51. Apesar de produzida em baixas quantidades, os seus níveis elevam‐se em situações patológicas como a hipertensão arterial pulmonar, as doenças do tecido conjuntivo, fibrose do pulmão e insuficiência cardíaca52–55. Existem antagonistas dos recetores da endotelina como o bosentan (inespecífico), o atrasentan (seletivo para o recetor ETA) e o tezosentan utilizável na síndrome hepatorrenal e falência cardíaca aguda.
Prostaglandinas vasodilatadoras e óxido nítrico (NO)Dzau et al., em 1984, foram os primeiros a postular que uma ativação compensatória de sistemas vasodilatadores poderia ter lugar na IC para contrabalançar o efeito vasoconstritor do SNS, do SRAA e da vasopressina‐arginina (Figura 2)56. Com o objetivo de determinar o envolvimento de PGs vasodilatadoras na fisiopatologia da falência cardíaca, estes investigadores mediram os níveis plasmáticos dos metabolitos das PGs I2 e E2 em 15 doentes com IC. Os seus resultados mostraram uma elevação destas PGs entre três a dez vezes quando os seus níveis eram comparados com os de sujeitos saudáveis. Por outro lado, estes níveis estavam correlacionados com a ARP e os níveis plasmáticos de A‐II. Finalmente, a presença de um inibidor da síntese de PGs acarretava efeitos deletérios a nível da hemodinâmica circulatória, particularmente no caso de doentes com maior gravidade da IC e hiponatremia56.
As PGs são produzidas a nível renal, maioritariamente na zona medular, e são responsáveis por modular a resposta a moléculas vasoconstritoras e por mediar a resposta a alguns vasodilatadores e a libertação de renina após estimulação dos barorecetores renais ou da mácula densa57,58. De facto, é sabido que o efeito de alguns diuréticos e de muitos vasodilatadores comumente utilizados na doença cardiovascular é exercido precisamente através do efeito do aumento da síntese das PGs natriuréticas e vasodilatadoras8,56–60. Por outro lado, fármacos cuja atuação interfere na síntese das PGs – como é o caso de muitos anti‐inflamatórios não esteroides (AINEs) – influenciam negativamente a IC8,58,61. Intimamente associado aos efeitos da relação entre as PGs e o SRAA está a produção de NO, um outro sistema endógeno vasodilatador‐natriurético. É sabido que o NO e as PGs contrariam fisiologicamente os efeitos renais do SRRA (hemodinâmicos e de retenção de sódio e agua)62. Na medida em que as PGs renais e o NO contribuem para a natriurese e protegem a arteríola aferente dos efeitos vasoconstritores da angiotensina II, a inibição da síntese quer das PGs quer do NO acentuam os efeitos antinatriuréricos desta hormona.
Sistema dopaminérgicoTal como no caso de outros sistemas neuro‐hormonais, o interesse no estudo do sistema dopaminérgico no contexto da IC partiu da observação da sobre‐estimulação deste sistema (elevação dos níveis de dopamina endógena) em doentes com falência cardíaca (Figura 2)63,64. Hoje é amplamente reconhecido que a dopamina, para além de um importante neurotransmissor cerebral, é também uma molécula reguladora periférica com um importante papel a nível renal e cardiovascular65,66. De facto, a dopamina renal – que é maioritariamente sintetizada no próprio rim – tem um papel essencial na modulação da pressão arterial, do equilíbrio eletrolítico e das funções renais e adrenérgicas65,66. A caracterização dos recetores dopaminérgicos – que se agrupam em dois tipos, os DA1 e os DA2 – permitiu uma melhor perceção do impacto da dopamina na IC8,67. Os recetores do tipo DA1 têm uma localização pós‐sináptica (a nível do órgão efetor, nomeadamente rins, artérias coronárias, mesentério e cérebro), enquanto que os recetores do tipo DA2 têm uma localização pré‐sináptica nos terminais simpáticos8,65–67. Em termos de funcionalidade, agonistas dos recetores do tipo DA1 causam hipotensão, reduzem a pós‐carga, aumentam o fluxo sanguíneo para alguns órgãos e promovem a excreção de sódio e água; já os agonistas dos recetores do tipo DA2 originam hipotensão e bradicardia, reduzem a pós‐carga e provocam vasodilatação em certos locais específicos8,65–67.
Sistema dos péptidos natriuréticosO sistema dos péptidos natriuréticos (NPS) é aquele cuja descoberta e reconhecimento da importância no contexto da IC são mais recentes. Foi De Bold que, em 1978, atribuiu uma natureza peptídica a grânulos presentes no tecido cardíaco auricular de mamíferos que tinham sido observados pela primeira vez por Kisch, 22 anos antes (Figura 2)40,68. Foi também De Bold que reportou um aumento maciço e rápido na excreção de água e sódio quando homogeneizados destes grânulos eram injetados em ratos69. Cinco anos mais tarde, em 1986, Burnett et al. detetaram uma elevação clara nos níveis plasmáticos do péptido natriurético auricular (ANP) – a substância ativa dos grânulos identificados por Kisch – em doentes com IC (Figura 2)70. Já em 1988, Sudoh et al. identificaram um novo péptido isolado a partir do cérebro do porco com propriedades semelhantes ao ANP, o qual foi denominado como péptido natriurético cerebral (hoje designado péptido natriurético do tipo B [de brain], BNP) (Figura 2)71,72. É hoje reconhecido que a produção do BNP também ocorre a nível do tecido ventricular. Finalmente, e já no início dos anos 1990, Sudoh et al. identificaram o último péptido (conhecido até hoje) do NPS, o péptido natriurético do tipo C (CNP)73. Várias publicações do Prof. Cerqueira Gomes e de seus colaboradores contribuíram para o melhor conhecimento da importância fisiopatológica destes peptídeos74–79.
É amplamente aceite que o NPS exerce um efeito‐chave na IC, contrariando os efeitos da sobre‐estimulação do SNS, SRAA e da vasopressina‐arginina40. Dos três péptidos natriuréticos conhecidos, o ANP e o BNP parecem ser os que maior impacto têm na regulação hormonal cardíaca. Sintetizados maioritariamente nos tecidos auriculares e ventriculares, respetivamente, o ANP e o BNP são libertados em resposta a um aumento da pressão e da distensão das células miocárdicas80,81. Existem três recetores com capacidade para se ligarem a estes péptidos (NPR‐A, NPR‐B e NPR‐C), dos quais os do tipo A são aqueles que estimulam a maior parte das respostas fisiológicas conhecidas dos NPS40,81. Em termos de funcionalidade, os péptidos natriuréticos atuam no rim (provocando a vasodilatação da arteríola aferente e o consequente aumento na taxa de filtração glomerular, bem como a redução na reabsorção de água e sódio), nos vasos sanguíneos (estimulando a vasodilatação e reduzindo a pré‐ e a pós‐carga) e no coração (contrariando os efeitos da remodelagem verificada na IC via regulação local da síntese de colagénio e hipertrofia celular e induzindo o relaxamento do miocárdio)40,80,81. Para além disso, os péptidos natriuréticos são também responsáveis pela inibição da produção e secreção da aldosterona e da renina e por um efeito hemoconcentrador, bem como por efeitos antifibróticos e anti‐apoptóticos. De referir que, ao contrário de outros diuréticos, o efeito natriurético dos NPS não se associa a depleção de potássio.
Numa fase inicial da IC, as funções desempenhadas pelos péptidos natriuréticos e descritas acima desempenham um papel benéfico na manutenção de uma hemodinâmica fisiológica. No entanto, e com a degradação progressiva da função cardíaca, o NPS perde eficiência via um dos seguintes mecanismos: uma diminuição da disponibilidade dos péptidos natriuréticos (devido a produção reduzida, remoção aumentada ou degradação enzimática, nomeadamente via neprilisina); uma diminuição da capacidade de resposta aos péptidos natriuréticos (devido a expressão reduzida ou dessensibilização dos seus recetores ou inibição das vias sinalizadoras a jusante); e/ou uma sobreposição do efeito dos sistemas neuro‐hormonais com função contrária à do NPS, nomeadamente o SRAA e o SNS80,81. Não obstante, persiste uma elevação dos níveis plasmáticos dos péptidos natriuréticos, pelo que o doseamento plasmático do BNP constitui um marcador da gravidade da doença e um indicador de mau prognóstico82.
Antagonistas neuro‐hormonais na terapêutica da ICCom a rápida expansão do conhecimento dos circuitos neuro‐hormonais no início dos anos 1980 abriu‐se todo um novo horizonte de possibilidades terapêuticas, agora centradas no restabelecimento do equilíbrio de forças entre os vários sistemas intervenientes (Figura 2). Atualmente, a terapêutica da IC desenvolve‐se a partir de antagonistas neuro‐hormonais (Tabela 1), cujas principais características, funcionamento e indicações estão brevemente resumidas abaixo. Todas estas modalidades terapêuticas, isoladas ou combinadas com outros fármacos, foram avaliadas em estádios diversos de gravidade da doença e associaram‐se a uma redução de mortalidade e morbilidade em doentes com IC‐FER, incluindo redução das taxas de internamento hospitalar.
Antagonistas neuro‐hormonais atualmente usados na terapia da IC
| Classe | Exemplos de fármacos | Recomendações terapêuticas§ |
|---|---|---|
| ACE‐I | Enalapril | fármaco de primeira linha: recomendado para todos os doentes sintomáticos a não ser que contraindicado ou não tolerado pelo doente |
| Lisinopril | ||
| Ramipril | ||
| Trandolapril | ||
| Captopril | ||
| ARB | Losartan | recomendados em doentes que não toleram ACE‐I |
| Valsartan | ||
| CandesartanEtc. | ||
| β‐B | Bisoprolol | complementares dos ACE‐I: podem ser iniciados em coterapia após diagnóstico da IC‐FER; recomendados em doentes com historial de enfarte do miocárdio, angor, arritmias e doentes assimptomáticos com disfunção sistólica do ventrículo esquerdo |
| Carvedilol | ||
| Succinato de metoprololNebivolol | ||
| MRAs | Espirolactona | recomendados em doentes que permanecem sintomáticos após tratamento com ACE‐I e β‐B, e que têm IC‐FER com fração de ejeção ≤ 35% |
| Eplerenona | ||
| ARNi | Sacubitril/Valsartan | recomendado como substituto dos ACE‐I em doentes ambulatório com IC‐FER que permanecem sintomáticos após otimização da terapia e que encaixam nos critérios do ensaio PARADIGM‐HF |
Os inibidores da enzima de conversão da angiotensina (ACE‐I) reduzem a quantidade de A‐II disponível através da inibição da sua síntese a partir da angiotensina I e aumentam as concentrações disponíveis de bradicinina. Estes fármacos são, neste momento, considerados como o tratamento de primeira linha para várias doenças cardiovasculares e renais83. São recomendados em todos os doentes com IC‐FER, exceto na presença de contraindicações ou quando estes são intolerantes ao fármaco (Tabela 1). Vários estudos clínicos realizados ao longo dos últimos anos demonstraram que os ACE‐I são eficientes na redução de mortalidade e morbilidade em doentes com IC‐FER, incluindo redução das taxas de internamento hospitalar, enfartes do miocárdio e remodelação ventricular1,83,84.
Antagonistas dos recetores da angiotensina IIOs antagonistas dos recetores da angiotensina II (ARB) atuam a jusante dos ACE‐I, inibindo a transdução do sinal da A‐II quando estimulam os seus recetores do tipo 1. Os vários ensaios clínicos realizados com esta classe de fármacos indicam que estes não são superiores ao ACE‐I na redução da mortalidade e morbilidade associadas à IC‐FER, sendo, portanto, recomendados apenas quando os doentes são intolerantes aos últimos (Tabela 1)1,83,84. De facto, e ao contrário dos ACE‐I, os ARB praticamente não inibem a degradação da bradicinina, uma enzima vasodilatadora que aumenta as concentrações de PGs e de NO, bem como a permeabilidade vascular40,83. Assim, e em comparação com o tratamento com ACE‐I, efeitos secundários como tosse e angioedema ocorrem em menor frequência quando os doentes são tratados com ARB.83,84
Bloqueadores adrenérgicos βOs bloqueadores adrenérgicos β (β‐B) inibem a ação do SNS e a transdução do sinal da noradrenalina e adrenalina a nível destes recetores. Quando adicionados a um ACE‐I (ou ARB), os β‐B contribuem para uma redução na mortalidade e morbilidade dos doentes com IC‐FER1,84. Tendo em consideração a sua seletividade (ou ausência de), os β‐B podem ser classificados em primeira geração (não seletivos, i.e. bloqueiam recetores β1 e β2); segunda geração (com maior afinidade para os recetores β1 do que para os β2); e terceira geração (inclui β‐B seletivos e não seletivos), alguns com efeito vasodilatador adicional30. Nem todos os β‐B são eficientes no tratamento da IC‐FER, mas o bisoprolol e o sucinato de metoprolol (segunda geração), bem como o carvedilol (terceira geração, com efeito vasodilatador por mecanismo bloqueador alfa adicional) e o nebivolol (efeito vasodilatador adicional dependente da libertação de NO), têm revelado bons resultados nos ensaios clínicos e estão aprovados para o tratamento da patologia em causa de forma quase universal30.
Antagonistas dos recetores mineralocorticoídesOs antagonistas dos recetores mineralocorticoides (MRA) inibem a ação do SRAA e a transdução do sinal da aldosterona. São recomendados para os doentes medicados com um ACE‐I e um β‐B que permanecem sintomáticos e que possuem uma fração de ejeção do ventrículo esquerdo inferior a 35% (Tabela 1)1. De acordo com as recomendações da ESC, estes medicamentos (espironolactona e eplerenona) associam‐se a uma redução da mortalidade cardiovascular, mas devem ser usados com precaução em doentes com função renal reduzida e níveis de potássio plasmático superiores a 5.0 mmol/L1,83.
Inibidores da reninaOs inibidores da renina bloqueiam o SRAA no seu primeiro passo, isto é, na conversão do antiogensinogénio a angiotensina I. Os primeiros estudos a envolver fármacos inibidores da renina foram feitos ainda nos anos 1980. No entanto, e tendo em consideração a sua baixa potência e falta de especificidade, bem como a sua baixa biodisponibilidade e curta semivida, estes fármacos acabaram por ser descartados para o tratamento da IC. Existem, no entanto, ensaios a decorrer e novos inibidores da renina em desenvolvimento. De referir também que os principais estudos com o primeiro inibidor da renina disponível para administração ora – aliscireno – situaram‐se sobretudo nas áreas da hipertensão arterial e da nefropatia diabética (e não da IC). Em doentes com IC crónica a adição de aliscireno ao enalapril associou‐se, no estudo Atmosphere, a um aumento de reações adversas. Comparativamente ao enalapril o aliscireno mostrou ausência de não inferioridade85.
Inibidores da neprilisinaA neprilisina é uma enzima que surge numa posição chave no NPS, já que é responsável pela degradação enzimática do ANP, BNP e CNP. O racional para o desenvolvimento de um inibidor da neprilisina assenta, pois, na possibilidade de aumentar as concentrações destes péptidos vasodilatadores. No entanto, a neprilisina não é específica dos péptidos natriuréticos: na realidade, esta enzima é também capaz de degradar um grande número de outros péptidos vasodilatadores. O sacubitril é uma molécula inibidora da neprilisina (NEPi) desenvolvida nos anos 1990. Mas não obstante os seus resultados promissores em experiências com modelos animais, os benefícios verificados em doentes com IC e hipertensão eram variáveis e modestos na sua amplitude40. De facto, verificou‐se que este NEPi, para além de aumentar a concentração de compostos vasodilatadores, aumentava também a concentração de hormonas vasoconstritoras (nomeadamente a A‐II e a endotelina I), originando um conjunto de forças opostas que se anulavam umas às outras40. Assim, e neste momento, os inibidores da neprilisina não são, por si só, recomendados para o tratamento da IC83.
Inibidores dos recetores da vasopressinaVários inibidores dos recetores da vasopressina (nomeadamente o conivaptan – inibidor dos recetores V1a/V2 – e o lixivaptan e o tolvaptan – inibidores dos recetores V2 e utilizados no contexto de IC aguda) foram desenvolvidos e têm sido testados em diversos ensaios clínicos48. Os resultados são promissores, mostrando uma melhoria na dispneia e hiponatremia, mas não há evidência de benefícios na morbimortalidade cardiovascular.
Inibidores dos recetores da endotelinaO peptídeo endotelina (ET‐1), bem como os seus recetores ET‐A e ET‐B, são sintetizados e segregados pelos cardiomiócitos e por outras células cardíacas86. A elevação dos níveis da ET‐1 contribui para a disfunção endotelial, rigidez arterial, vasoconstrição, hipertensão pulmonar e fibrose miocárdica87. Apesar de os níveis circulantes de ET se encontrarem elevados na IC e serem preditores de mortalidade, não foi possível demonstrar que a inibição dos recetores da ET beneficiasse o prognóstico de doentes com IC55,88.
Outros tratamentos inovadoresA terapêutica génica que tem como alvos os mecanismos moleculares envolvidos na IC surgiu recentemente como uma alternativa de tratamento aparentemente viável e potencialmente eficiente para esta patologia. Os estudos nesta área têm‐se focado em diferentes mecanismos envolvidos na contractilidade do músculo cardíaco (nomeadamente o sistema β‐adrenérgico, as proteínas responsáveis pela circulação do cálcio e os miofilamentos), a angiogénese, a proteção celular e o recrutamento de células estaminais. No que diz respeito a este último aspeto, o fator 1 derivado de células do estroma (stromal cell‐derived factor‐1 alpha, SDF‐1) parece ter um papel fundamental, já que induz a migração de células estaminais da médula óssea até aos tecidos danificados do miocárdio, promovendo a sua regeneração89. De facto, estudos pré‐clínicos demonstraram que a sobre‐expressão do SDF‐1 promove a angiogénese, melhora a função cardíaca e atenua a remodelação cardíaca patogénica em ratos com IC isquémica90.
Um outro tratamento promissor passa pela utilização de inibidores do cotransportador de sódio e glucose 2 (sodium‐glucose transporter‐2, SGLT‐2). Estes inibidores surgiram no contexto da terapêutica de doentes diabéticos como fármacos capazes de melhorar o controlo glicémico. No entanto, dois ensaios clínicos recentes focados em dois destes inibidores (empagliflozina e canagliflozina) mostraram que os doentes com diabetes tipo 2 medicados com estes fármacos apresentavam uma redução de risco relativo de 14% de morte cardiovascular e enfarte miocárdio e AVC não fatais, 35% (empagliflozina) e 33% (canagliflozina) de hospitalização por IC e de 32% (empagliflozina) e 13% (canagliflozina) de morte por qualquer causa91,92. A hipótese de que os inibidores de SGLT‐2 possam ser usados como um tratamento para a IC – em doentes com e sem diabetes – ainda não foi demonstrada está atualmente a ser estudada em diferentes ensaios clínicos.93
Sacubitril/valsartan – Duas visões antigas para uma abordagem recenteO último fármaco aprovado para a IC‐FER segue a tendência atual da modulação das vias neuro‐hormonais como meio para atingir os objetivos terapêuticos. O seu carácter inovador reside não na identidade das moléculas que o compõem – sacubitril e valsartan, um NEPi e um ARB anteriormente testados e, no caso do valsartan, comercializado individualmente – mas antes na sua conjugação num único fármaco (Figura 3). Assim, esta terapêutica para a IC visa não apenas a atenuação dos mecanismos neuro‐humorais potencialmente deletérios, mas também a amplificação dos mecanismos protetores a nível cardiovascular.
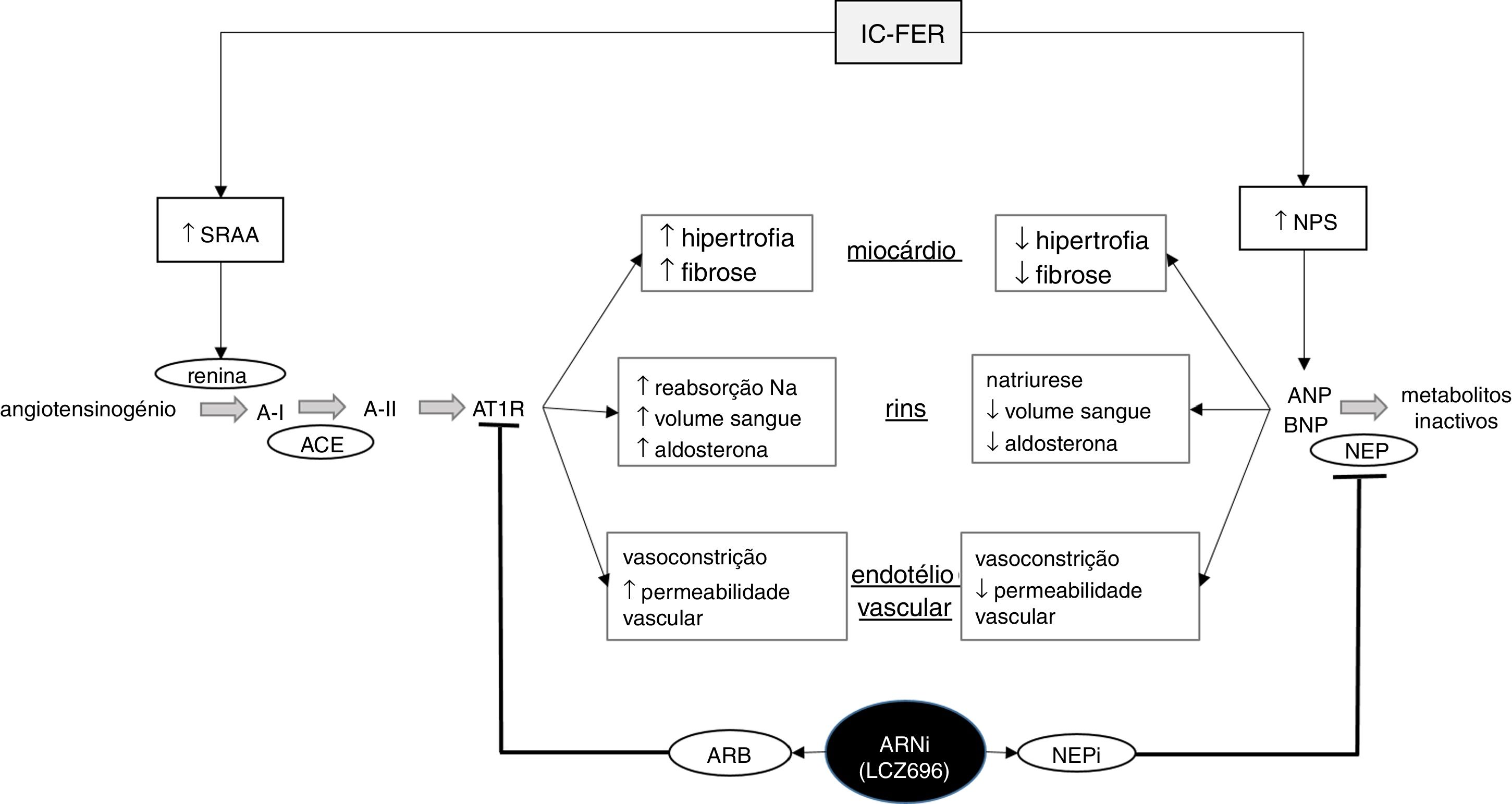
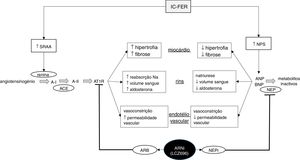
Esquema ilustrativo do funcionamento dos sistemas renina‐angiotensina‐aldosterona e péptidos natriuréticos na insuficiência cardíaca, bem como da ação do sacubitril/valsartan, o primeiro fármaco da classe ARNi disponível no mercado. IC‐FER, insuficiência cardíaca com fração de ejeção reduzida; SRAA, sistema renina‐angiotensina‐aldosterona; NPS, sistema dos péptidos natriuréticos; A‐I, angiotensina I; A‐II, angiotensina II; ATR1, recetor da angiotensina tipo 1; ANP, péptido natriurético do tipo A; BNP, péptido natriurético do tipo B; ARB, antagonista dos recetores da angiotensina II; NEP, neprilisina; NEPi, inibidor da neprilisina. Adaptado de Ansara e colaboradores, 201699.
O principal obstáculo identificado nos testes realizados com o sacubitril foi a elevação da concentração da A‐II, cujos efeitos vasoconstritores contrariavam os efeitos positivos exercidos pelos NPs40. A solução óbvia para tal problema parecia ser a inibição simultânea da A‐II, cuja primeira tentativa data de 1991 e foi levada a cabo por Seymour et al.40,94. Estes investigadores mostraram que a adição de um ACE‐I (captopril) a um NEPi seletivo reduzia a pressão arterial em ratos hipertensos mais do que qualquer um dos fármacos separadamente, resultados mais tarde comprovados em outros modelos animais40,94. A consequência óbvia desta constatação foi a tentativa de juntar as duas moléculas num só medicamento: omapatrilato foi o primeiro e o mais estudado exemplo dessa classe de fármacos, conhecida como inibidores de vasopeptidases95.
O omapatrilato gerou grande entusiasmo numa fase inicial: a sua comparação com um ACE‐I, o lisinopril, levou a resultados promissores em termos de eficácia e segurança96. Da mesma forma, comparações com o enalapril mostraram que o omapatrilato tinha uma maior capacidade anti‐hipertensiva, reduzindo significativamente as taxas de hospitalização e morte por motivos cardiovasculares, não sendo inferior a este ACE‐I na prevenção de hospitalização por IC ou morte por qualquer causa97,98. No entanto, estes dois últimos estudos revelaram também que o omapatrilato estava associado com uma maior incidência de angioedemas, particularmente entre os indivíduos negros. Presume‐se que a maior ocorrência deste efeito adverso esteja ligada com o desfavorável sinergismo da NEPi e do ACEi na inibição da degradação da bradicinina99. Tendo em consideração o seu efeito na vasodilatação e permeabilidade vascular, o aumento da concentração de bradicinina é uma causa provável dos angioedemas. O passo seguinte surgiu quase como uma consequência natural desta constatação: uma vez que os ARBs, ao contrário dos ACE‐Is, não inibem a degradação da bradicinina, a substituição por um ARB prometia manter os efeitos benéficos do omapatrilato alienando o seu potencial para causar angioedemas. Surgiu, assim, o primeiro antagonista do recetor da angiotensina‐inibidor da neprilisina (ARNi): o sacubitril/valsartan (LCZ696), cujo funcionamento está esquematizado na Figura 3.
Eficácia, segurança e recomendações para a sua utilizaçãoO ensaio decisivo para o reconhecimento do potencial terapêutico do sacubitril/valsartan foi o PARADIGM‐HF, cujos resultados foram publicados em 2014 por McMurray et al.100. Este ensaio foi terminado antes do previsto – mediana de seguimento de 27 meses – tendo em consideração a existência de evidências cabais da superioridade do sacubitril/valsartan. No seu desenho, o PARADIGM‐HF incluía 8.442 doentes sintomáticos com IC‐FER e tinha como objetivo comparar o sacubitril/valsartan com um ACE‐I (enalapril). Os seus resultados demonstraram que o sacubitril/valsartan é superior na redução da mortalidade (por causas cardiovasculares ou outras) e taxas de internamento hospitalar100. Em termos de segurança, o sacubitril/valsartan apresentou uma associação com hipotensão sintomática; no entanto, não houve associação significativa com angioedemas (muito embora tenha havido uma tendência não estatística para a ocorrência destes eventos adversos no grupo de teste) e os casos que ocorreram não envolveram comprometimento das vias aéreas superiores100. Uma outra análise aos dados do PARADIGM‐HF mostrou que o sacubitril/valsartan não só reduzia a mortalidade como também tinha um efeito positivo na morbilidade de doentes com IC‐FER (traduzido numa menor necessidade de intensificar os tratamentos e de recorrer aos serviços de urgência hospitalares, menor taxa de internamentos hospitalares e uma menor probabilidade de necessitarem de cuidados intensivos, agentes inotrópicos intravenosos, implantação de aparelhos ou transplantação cardíaca)101. Estas evidências, no seu conjunto, levaram a ESC a reconhecer o potencial terapêutico do sacubitril/valsartan: sem prejuízo do reconhecimento de necessidade de estudos de segurança a longo prazo (baseados, entre outras coisas, nos critérios de inclusão/exclusão muito restritivos do PARADIGM‐HF e na baixa percentagem de indivíduos negros incluídos), a ESC recomenda a utilização do sacubitril/valsartan em substituição de ACE‐Is no caso de indivíduos com IC‐FER em ambulatório que permaneçam sintomáticos após otimização da terapêutica e que cumpram os critérios do ensaio (Tabela 1)1.
Como nota final, será importante referir que, muito embora o sacubitril/valsartan esteja apenas aprovado e recomendado para o tratamento da IC‐FER, Solomon et al. mostraram que este fármaco terá também potencial e deverá ser considerado no âmbito da terapia da IC‐FEP102. Estes investigadores realizaram um ensaio clínico de fase 2 envolvendo doentes com IC‐FEP (com fração de ejeção ≥ 45%) e mostraram que a redução de NT‐proBNP (um marcador do stress da parede do ventrículo esquerdo) às 12 semanas era superior nos doentes tratados com sacubitril/valsartan quando comparado com a redução verificada nos doentes tratados com valsartan. Para além disso, os doentes tratados com sacubitril/varsartan mostravam uma melhoria na classe funcional NYHA às 36 semanas, bem como uma reversão da remodelação da aurícula esquerda99,102. Com base nestes resultados promissores de fase II, o sacubitril/valsartan encontra‐se a ser estudado no estudo PARAGON‐HF (NCT01920711) para avaliar os efeitos deste fármaco sobre morbilidade e mortalidade em doentes com IC‐FEP, tendo conclusão prevista para meados de 2019.
ConclusãoA IC é uma síndrome clínica complexa cuja progressão envolve diversos mecanismos e sistemas. O conhecimento sobre o impacto dos sistemas neuro‐hormonais nesta patologia data dos anos 1980 do século passado e tem vindo a ser progressivamente explorado nas suas mais variadas vertentes. A terapêutica atual da IC assenta na modulação destes sistemas neuro‐hormonais, uma estratégia que tem vindo a demonstrar benefício em termos de redução de mortalidade e morbilidade, incluindo redução das taxas de internamento hospitalar. O último fármaco aprovado neste contexto, o sacubitril/valsartan, tem a particularidade de atuar em dois dos sistemas neuro‐hormonais de forma simultânea (atenuando sistemas agressores e amplificando sistemas protetores). É expectável que o futuro traga novas combinações terapêuticas, que permitam prolongar a sobrevivência e aumentar a qualidade de vida dos doentes com IC.
Conflitos de interesseO autor Jorge Polónia atuou como consultor da Novartis, AstraZeneca Pharmaceuticals, Servier (empresas que desenvolvem e comercializam tratamentos para insuficiência cardíaca). Participou em Steering Commitees de estudos clínicos patrocinados pela Novartis, Sanofi/BMS. Recebeu honorários como palestrante em sessões sobre insuficiência cardíaca, ou bolsas de investigação, da Novartis.
O autor Francisco Rocha Gonçalves não tem conflitos de interesse a declarar.
O apoio financeiro para assistência editorial científica foi fornecido pela Novartis Farma – Produtos Farmacêuticos S.A. Agradecemos a Catarina L. Santos, PhD (W4Research, Lda.) pelo suporte editorial científico com este manuscrito. À memória do Prof. Mário Cerqueira Gomes.