Os autores descrevem um caso de um doente admitido no Serviço de Urgência por cetoacidose diabética. Apesar de não haver queixas do foro cardiovascular, a avaliação analítica revelou uma elevação do nível de troponina I (TropI) e de péptidos natriuréticos (proBNP), associada a alterações da repolarização no eletrocardiograma. O ecocardiograma transtorácico (ETT) mostrou um ventrículo esquerdo não dilatado com disfunção sistólica ventricular esquerda grave, por hipocinesia difusa, assumindo‐se assim concomitantemente um perfil L de insuficiência cardíaca (IC). A investigação etiológica foi negativa e quando um novo ETT foi realizado, sete dias após o primeiro, a função ventricular esquerda era normal. Apesar de raramente considerados, os distúrbios metabólicos e hidroeletrolíticos, nomeadamente a cetoacidose diabética, podem ser uma causa de disfunção VE e esta é outra das formas pela qual a diabetes pode ter impacto no sistema cardiovascular.
The authors describe a case of a patient admitted to the emergency department with diabetic ketoacidosis. Although there were no symptoms attributable to the cardiovascular system, lab tests revealed elevated troponin I and natriuretic peptides, coupled with repolarization abnormalities on the ECG. The transthoracic echocardiogram (TTE) showed a non‐dilated left ventricle with severe left ventricular systolic dysfunction due to diffuse hypokinesia, and a concomitant diagnosis of profile L heart failure was proposed. Etiologic investigation was negative, and when a new TTE was performed seven days after the first, left ventricular function was normal. Although rarely considered, metabolic and electrolyte disorders, especially diabetic ketoacidosis, can be a cause of left ventricular systolic dysfunction, and should be considered in the differential diagnosis. This is another way diabetes can have an impact on the cardiovascular system.
A prevalência de doentes com diabetes mellitus (DM) tem vindo a aumentar de forma consistente em todo o mundo, estimando‐se que no território nacional seja de 13,3%, sendo que 44% da população ainda não estará diagnosticada. Além disso, a doença macrovascular associada, incluindo o acidente vascular cerebral e o enfarte agudo do miocárdio (EAM), representam uma percentagem significativa da morbimortalidade associada a esta doença.1 A DM afeta o sistema cardiovascular, nomeadamente o coração, de diversas formas, a mais evidente sendo a doença arterial coronária (DAC), com as diversas manifestações da cardiopatia isquémica e subsequente disfunção ventricular esquerda e insuficiência cardíaca. Nos últimos anos, contudo, investigadores têm vindo a descrever que, mesmo na ausência de DAC, os doentes com DM têm uma maior prevalência de insuficiência cardíaca (IC) e que a IC, independentemente da etiologia, nestes doentes, têm pior prognóstico.2 Importa ainda salientar a relativamente “jovem”, e ainda mal compreendida, miocardiopatia associada à diabetes, na qual hiperglicemia, hiperlipidemia, hipertensão e estado inflamatório associado ao stress oxidativo, com consequente alteração da expressão genética e ativação de vias de morte celular programada, levam a disfunção ventricular.3
Este caso pretende demonstrar que a DM tem consequências cardiovasculares não só a longo prazo, mas também agudas, e que as alterações iónicas, ácido‐base e hemodinâmicas associadas a estes estados podem mimetizar as alterações cardiovasculares que ocorrem ao longo da evolução da doença.
Caso clínicoDoente do sexo masculino, de 46 anos, é admitido no Serviço de Urgência por um quadro, com duas horas de evolução de vómitos incoercíveis e alteração do estado de consciência (confusão). De antecedentes pessoais salienta‐se uma história conhecida de diabetes mellitus tipo 1, diagnosticado oito anos antes, sob insulinoterapia, com mau controlo metabólico, seguido em consulta de diabetes, e um distúrbio psiquiátrico inespecífico (previamente seguido na psiquiatria). Salienta‐se ainda tabagismo atual (70 UMA). Além de insulinoterapia o doente negava o consumo de outros fármacos, assim como hábitos etanólicos e/ou toxífilicos.
Ao primeiro contacto médico foi notado que o doente tinha um hálito cetónico, estava hipotenso (pressão arterial não invasiva no membro superior esquerdo 77/52mmHg), taquicárdico (frequência cardíaca 102bpm), polipneico (frequência respiratória 30 cpm) e hipotérmico (temperatura corporal axilar 35,8° C). A glicémia capilar era imensurável por teste capilar (HIGH) e a cetonemia aumentada pela mesma técnica, 3 (normal < 1,2). A gasometria arterial realizada demonstrava uma acidemia metabólica grave (pH 7,1, pCO2 9,2mmHg, pO2 139mmHg, HCO3− 2,9 mmol/L), hiperlactacidemia (Lactatos 9 mmol/L), hipercaliémia (K+ 7,52mEq/L) e hiponatremia (Na+ 126mEq/L.), considerada pseudo‐hiponatrémia, e corrigida para glicémia estimada de 500mg/dl (teste capilar HIGH) com valor de 136mEq/L. O diagnóstico de cetoacidose diabética foi estabelecido e foi iniciada terapêutica com insulina rápida EV em perfusão contínua e hidratação endovenosa com cloreto de sódio 0,9% a 100cc/hora e aquecimento externo. O fator de descompensação foi a não administração de insulina nos dois dias anteriores.
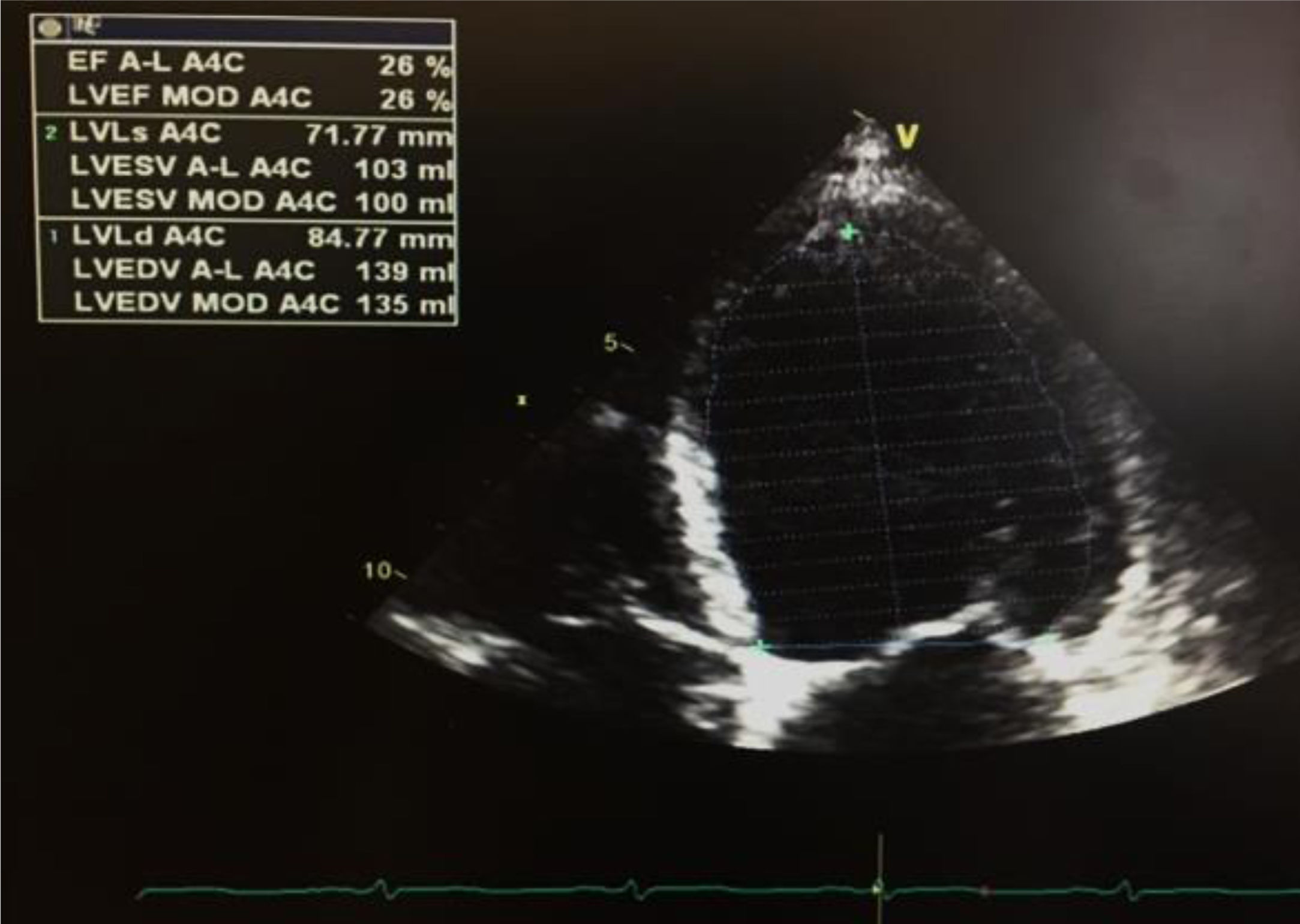
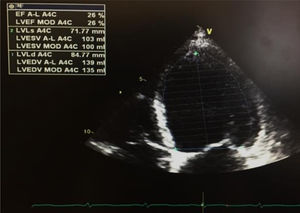
Na primeira avaliação laboratorial venosa realizada foi constatada elevação do nível de troponina I (2,01 ng/mL; normal < 0,02 ng/ml), com um pico máximo de 3,23ng/ml, 12 horas após admissão. O proBNP era de 17316 pg/ml (N < 125). O doente negava dor torácica, atual ou prévia, ou quaisquer sintomas de insuficiência cardíaca. O exame objetivo não demonstrava sinais de patologia cardiovascular, nomeadamente sem sopros ou extrassons à auscultação cardíaca, sem fervores à auscultação pulmonar, sem organomegálias à avaliação abdominal e sem edemas dos membros inferiores. O eletrocardiograma encontrava‐se em taquicardia sinusal (FC 109bpm), com retificação do segmento ST em V5, V6, I e aVL. Um ecocardiograma transtorácico (ETT) foi requisitado, e realizado no dia da admissão, em ecógrafo portátil Vivid I GE, demonstrando um ventrículo esquerdo não dilatado, não hipertrofiado, com um compromisso grave da função sistólica ventricular esquerda, estimada em 26%, devido a hipocinesia difusa; sem doença valvular aórtica ou mitral significativa; ventrículo direito com função sistólica longitudinal conservada, veia cava inferior (VCI) de 17mm, com cinética respiratória mantida e pressão da artéria pulmonar estimada em 28mmHg (Figura 1).
Às 48 horas de internamento, e com a cetoacidose diabética resolvida, o doente foi admitido na Enfermaria de Cardiologia para investigação etiológica da disfunção ventricular esquerda. Durante essa investigação, percebeu‐se que o doente tinha tido um internamento prévio, cerca de 15 meses antes, também no contexto de cetoacidose diabética, durante o qual, também associado à descoberta de uma elevação no valor de troponina I, um ETT sumário foi realizado no Serviço de Urgência, demonstrando um compromisso grave da função sistólica global do ventrículo esquerdo. Durante essa hospitalização, oito dias após admissão, um segundo ETT foi realizado no Laboratório de Ecocardiografia, altura em que o exame foi considerado normal, assumindo‐se que o primeiro havia sido incorretamente relatado. Nenhum follow‐up foi programado.
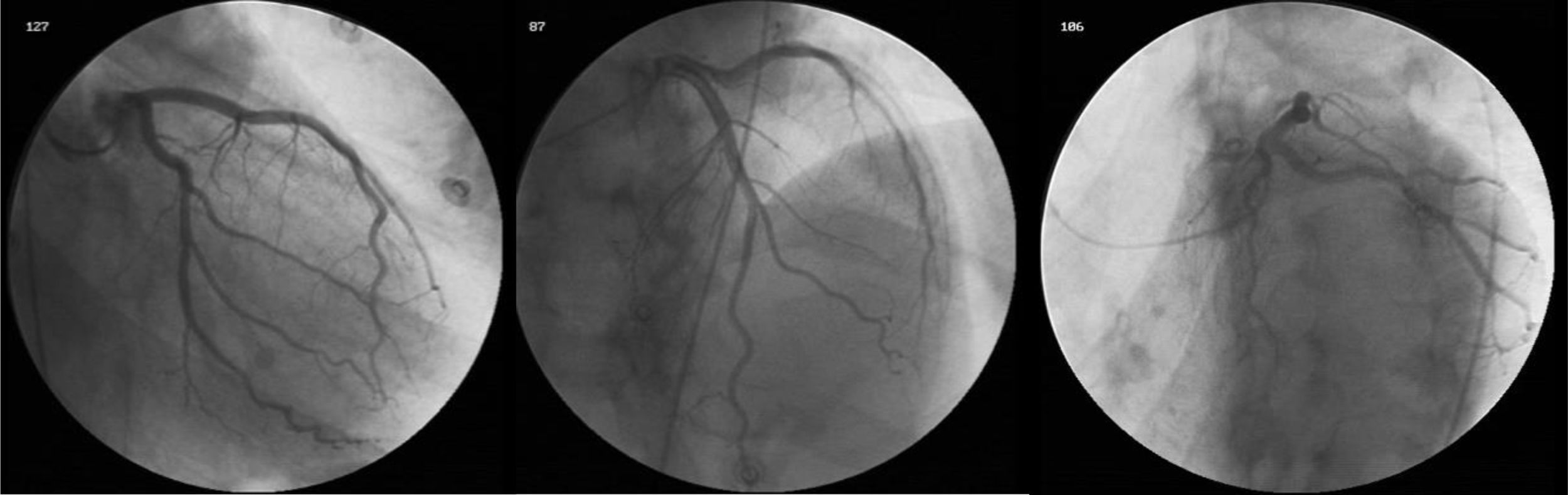
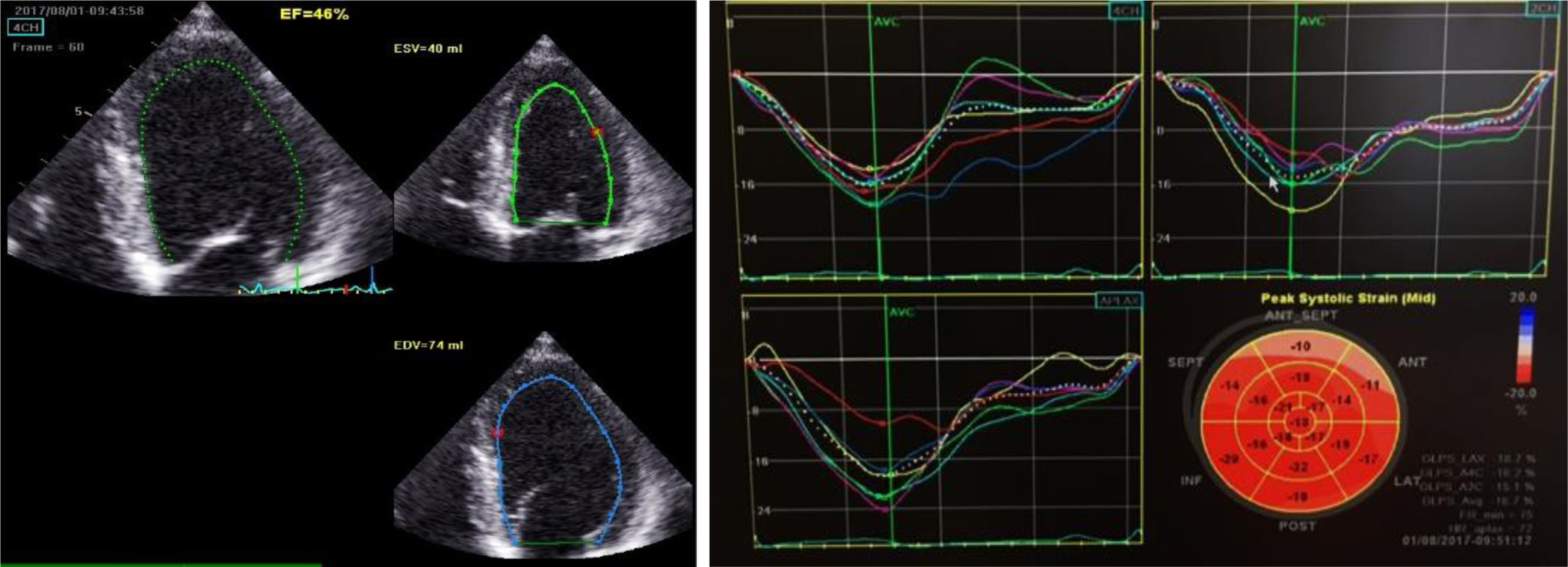
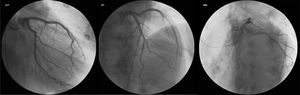
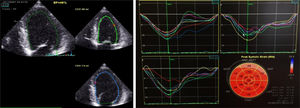
Durante o internamento na Enfermaria de Cardiologia, um cateterismo cardíaco diagnóstico foi realizado, com coronárias sem lesões (Figura 2). Não havia história familiar de IC, miocardiopatia ou morte súbita. O doente negava história recente de infeção viral ou bacteriana e nunca havia viajado para fora do país. O estudo laboratorial foi negativo, nomeadamente para vírus da imunodeficiência humana e hepatotrópicos. A função tiroideia não demonstrava alterações (avaliações prévias ao longo do seguimento na consulta de diabetes também normais), não tendo sido avaliados anticorpos antitiroideus neste contexto. Ressalvam‐se ainda outros parâmetros laboratoriais ao longo do internamento: hemoglobina (Hb) à admissão de 15g/dl, com nadir de 13g/dl, sem perdas hemáticas objetivadas; sem ferropénia funcional ou absoluta (Ferritina 326ng/mL) e sem défice de ácido fólico ou vitamina B12 (5,9ng/mL e 590pg/mL, respetivamente); vitamina B1 avaliada por protocolo nos doentes com IC / disfunção ventricular esquerda de 28ng/mL (N 16‐48). Sete dias após admissão hospitalar, um novo ETT foi realizado: ventrículo esquerdo não dilatado, com compromisso ligeiro da função sistólica (FEj estimada em 46%), com strain global longitudinal ligeiramente reduzido (‐16%) (Figura 3). Foi proposta a realização de ressonância magnética cardíaca, que o doente recusou. À data de alta hospitalar, o doente encontrava‐se em NYHA I, com proBNP de 448pg/ml, e medicado com Ramipril 2,5mg/dia e Bisoprolol 5mg/dia, além de insulina lenta para administração bidiária, tendo sido proposto seguimento em consulta de cardiologia e consulta hospitalar de diabetes.
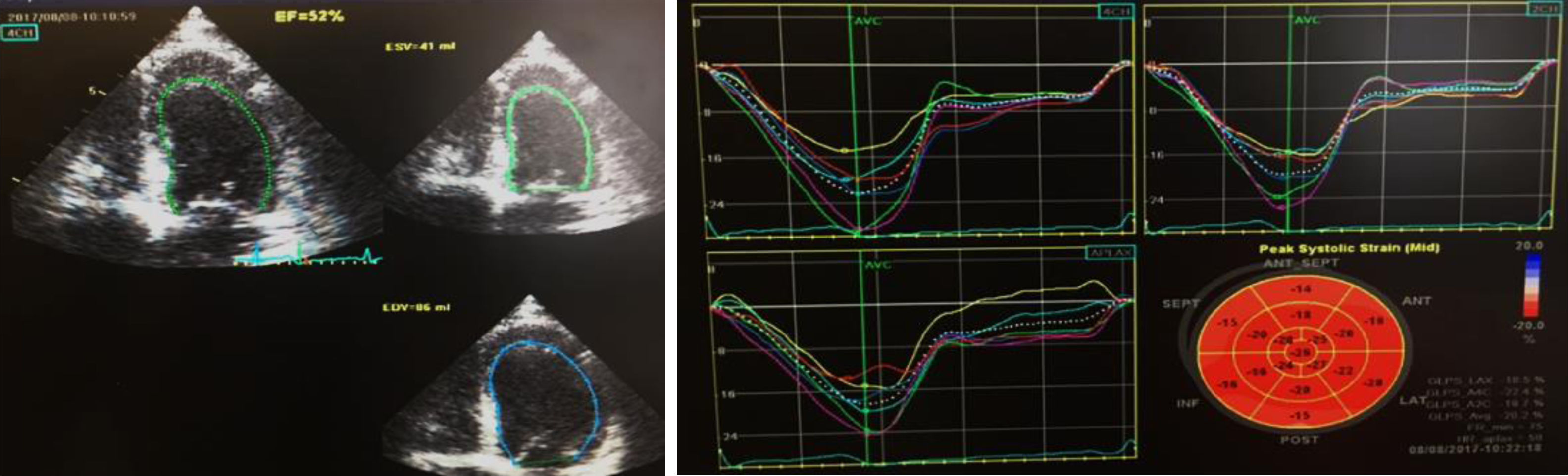
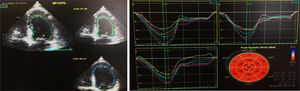
Uma semana após a alta programou‐se a realização de um terceiro ETT, demonstrando uma função sistólica global do VE conservada (FEj 52%) com strain global longitudinal normal (‐20,2%) (Figure 4). A oito meses de follow‐up sem novos internamentos, sem queixas do foro cardiovascular.
DiscussãoA cetoacidose diabética (DKA) caracteriza‐se pela tríade de hiperglicemia, cetose e acidemia metabólica, resultado de um défice relativo ou absoluto de insulina e um excesso de hormonas contrarreguladoras, associado a profundas alterações eletrolíticas. Doentes com DKA habitualmente têm numa avaliação inicial uma hipercaliémia ligeira a moderada, apesar de um défice corporal total de potássio.4,5
De acordo com as classificações internacionais o nosso doente apresentava‐se com cetoacidose diabética de gravidade intermédia a alta (pH 7,1, HCO3‐ 2.3 e alteração do estado de consciência).4 Graças à rápida instituição da terapêutica recomendada com insulinoterapia e hidratação endovenosa (EV) não se registaram complicações ameaçadoras de vida, considerando que a taxa de mortalidade desta condição oscila, de acordo com os registos existentes, entre 1 e 5%, dependendo da idade e das comorbilidades.5 No caso apresentado, apesar da existência de hipercaliémia, não foi efetuada terapêutica específica dirigida, considerando o entendimento de que, na realidade, nestes doentes, há um défice corporal de K+ e que o início da insulinoterapia EV conduz ao influxo de K+ para o interior das células, com consequente redução de caliémia.
Em 2004 Stentz et al. publicaram uma investigação que teve como objetivo avaliar o estado de citocinas proinflamatórias, marcadores de stress oxidativo e o risco cardiovascular, associados ao reconhecido estado pro‐inflamatório da hiperglicemia, aguda e crónica, tanto em doentes com DKA como na hiperglicemia não cetónica. Concluíram que ambas as condições se associavam a elevação de citocinas, espécies reativas de oxigénio e fatores de risco cardiovascular (como a proteína C reativa, homocisteína e inibidor 1 do ativador do plasminogénio). Demonstraram também (na ausência de infeção ou patologia cardiovascular óbvia) que estes parâmetros retornavam ao valor basal (conhecido através de controlos) após terapêutica com insulinoterapia,6 cunhando estas patologias como doenças com base inflamatória. Evidência de outros estudos demonstrou uma ligação significativa e independente entre inflamação, sépsis, resistência à insulina e disfunção cardíaca.7 O expoente desta relação é a denominada Síndrome de Resposta Inflamatória Sistémica (SIRS), presente em múltiplas patologias, a mais reconhecida é a sépsis, mas também em contextos inflamatórios agudos não infeciosos, como pancreatite aguda, trauma, queimaduras, e definida como a presença de dois ou mais dos seguintes: temperatura> 38°C ou < 36°C, FC > 90bpm, FR > 20cpm ou PaCO2 <32mmHg, contagem leucocitária > 12.000/mm3 ou < 4.000/mm3 ou > 10% de formas imaturas (8). O doente que aqui apresentamos incluiu‐se neste grupo de doentes, apresentando‐se com SIRS num contexto inflamatório agudo devido a uma descompensação aguda da DM, a DKA.
A disfunção miocárdica é uma complicação comum em doentes com SIRS por sépsis e associa‐se a um aumento do risco de mortalidade que pode atingir os 70‐90%,8 assim como em contexto de SIRS por trauma e queimaduras.7
O ETT inicial foi realizado num contexto urgente, mas já após hidratação intensiva como parte do protocolo de tratamento da DKA. Assim, uma estimativa da volemia do doente à admissão por intermédio da veia cava inferior não é possível. Os autores consideram que, em comparação a outros doentes com disfunção ventricular esquerda grave, um aumento tão significativo da pré‐carga (como o associado a uma hidratação intensiva para terapêutica da DKA) poderia conduzir a um estado de sobrecarga de volume/edema pulmonar agudo. Contudo, tal não se verificou no nosso doente, provavelmente pelo facto de que, na realidade, além da DKA, se associava um quadro de IC aguda Perfil L (frio e seco),9 demonstrado pelo perfil hipotensivo e pela hiperlactacidemia, marcador de hipoperfusão (que também pode ser fator contributivo para a alteração do estado de consciência demonstrado à admissão). O perfil L da IC está mais comumente associado ao uso excessivo de diuréticos e a terapêutica indicada será exatamente a reposição de fluidos,9 que os autores consideram que deve ser judiciosamente monitorada tanto clinicamente como por métodos de imagens facilmente disponíveis em um Serviço de Urgência, como a ecocardiografia, de forma a evitar complicações associadas ao uso excessivo de reposição de volémia.
Justin Berk et al. também relataram em 2015 o caso de uma doente admitida com o diagnóstico de síndrome hiperosmolar hiperglicémico (SHH). No contexto de alterações eletrocardiográficas realizou ETT, que demonstrou um compromisso grave da função ventricular esquerda. Ao 4.° dia de internamento realizou teste imagiológico de isquémia, negativo, e com função ventricular esquerda normal, sugerindo os autores como causas para esta disfunção reversível SHH, SIRS e sick euthyroid syndrome.10 Já Nanda et al. relatam o único caso descrito de miocardiopatia de stress (MCPS) associada a DKA numa mulher com DM tipo 1, hipotetizando por um lado que a raridade desta associação se deve ao facto de que no Takotsubo o metabolismo dos ácidos gordos e a utilização de glicose pelo miocárdico estão comprometidos, tornando‐se os corpos cetónicos o substrato metabólico preferencial (estando estes presentes na DKA). Por outro lado, a ocorrência de DKA e MCPS poderia estar associada a uma acidemia grave, com HCO3∼‐ de 4 mmol/L (11), um dos possíveis contributos para a disfunção ventricular no caso reportado.11
Além do papel das citocinas pró‐inflamatórias e ERO nestes contextos de disfunção miocárdica associada a SIRS, também alterações na homeostasia do cálcio estão envolvidas, com redução da entrada de cálcio para os miócitos e inibição da libertação deste catião do retículo sarcoplasmático.12
Não é possível excluir que a acidemia metabólica, presente na DKA, seja também um fator contributivo para a disfunção ventricular esquerda reversível observada neste caso. De acordo com o conhecimento dos autores, existe uma escassez de literatura sobre o impacto que os distúrbios ácido‐base podem ter sobre a função cardíaca. Em 1990, Teplinsky et al. avaliaram de forma experimental o efeito que a acidose láctica tinha sobre a hemodinâmica e função ventricular esquerda de modelos caninos. Nesta investigação foi demonstrado que, durante acidemia progressiva induzida por infusão EV de ácido láctico, há uma redução do débito cardíaco, volume de ejeção e pressão arterial sistémica média e um aumento da pressão média na artéria pulmonar e auricular direita, concluindo‐se que a acidemia láctica levava a uma redução de cerca de 40% no volume de ejeção por depressão da contratilidade VE, caracterizada por uma diminuição no dP/dT máximo.13 Nesse mesmo ano, numa revisão sobre o efeito da acidose na contratilidade cardíaca, sumariza‐se que este distúrbio ácido‐base afeta todos os passos do acoplamento excitação‐contração, incluindo os efeitos contrarregulados na entrega de cálcio (Ca+2) aos miofilamentos (por um lado diminuição na entrega por inibição da corrente de Ca+2 e redução da libertação deste catião do retículo sarcoplasmático e por outro, aumento da entrega por prolongamento do potencial de ação) e na resposta dos miofilamentos ao Ca+2, que no global está diminuída.14
Uma outra revisão, publicada em 1995, conclui que o efeito da acidemia sobre a função ventricular depende do nível de pH: na acidemia ligeira, um aumento do nível de catecolaminas libertadas compensa os efeitos cardio‐depressores da acidemia, com aumento do inotropismo, cronotropismo, débito cardíaco e resistência vascular periférica; contudo, com pH < 7,2, como é o caso do nosso doente, os iões H+ têm um efeito cardio‐depressor direto, não suscetível de ser compensado pelo aumento das catecolaminas.15
ConclusãoA disfunção miocárdica é uma complicação comum associada a SIRS, seja ela secundária a sépsis ou a outros estados inflamatórios agudos como a cetoacidose diabética, o mecanismo comum é o elevado nível de citocinas pró‐inflamatórias e espécies reativas de oxigénio. Neste doente, além da SIRS, também os distúrbios eletrolíticos e ácido base podem contribuir para a disfunção ventricular esquerda reversível observada, enxertando‐se no quadro de DKA uma IC Aguda em perfil L. Os autores acreditam que, estando comprovado o impacto negativo que a disfunção ventricular tem sobre o prognóstico destes doentes, avaliação ecocardiográfica de rotina deve ser realizada. Nue naqueles em que houver compromisso de função sistólica ou diastólica, deverá ser programado seguimento para monitoração, visando documentação de reversibilidade, controlo de outros fatores de risco e investigação de outras etiologias concomitantes.
Considerando que a miocardiopatia diabética tem na sua patogénese o stress oxidativo,3 a associação deste à disfunção ventricular em contextos de descompensação aguda pode ser um passo inicial para estudos terapêuticos que visem à inibição destes componentes pró‐inflamatórios, com o intuito de reduzir a mortalidade nestes contextos agudos e eventualmente impedir a evolução até um estádio de disfunção ventricular irreversível.
Conflitos de interesseOs autores não reportam quaisquer conflitos de interesse.