Grávida de 37 anos de idade com 29 semanas de idade gestacional recorre ao serviço de urgência por síncope e dispneia causadas por tromboembolismo pulmonar com repercussão hemodinâmica. Por hipotensão persistente foi-lhe administrada terapêutica trombolítica com tenecteplase com excelente resposta hemodinâmica e clínica, sem intercorrências hemorrágicas maternas ou fetais.
A apresentação clínica do tromboembolismo pulmonar é por vezes camuflada pelas transformações fisiológicas que ocorrem na gravidez e o diagnóstico é muitas vezes atrasado pela relutância em expor o feto a radiação ionizante. A trombólise é um tratamento de alto risco na grávida e há poucos casos descritos da sua utilização; porém, as taxas de complicações com a terapia trombolítica são aceitáveis em relação à doença subjacente.
We describe the case of a 37-year-old pregnant woman who presented at 29 weeks of gestation with syncope and shortness of breath caused by pulmonary embolism. Due to persistent hypotension thrombolytic therapy with tenecteplase was administered and the clinical and hemodynamic response was excellent, with no maternal or fetal hemorrhagic complications.
The clinical presentation of pulmonary embolism is sometimes camouflaged by the physiological changes that occur in pregnancy and diagnosis is often delayed by reluctance to expose the fetus to ionizing radiation. Systemic thrombolysis is considered a high-risk treatment in pregnancy and very few women have received it. However the complication rates of thrombolytic therapy are acceptable in the light of the underlying disease.
Calcula-se que atualmente 0,2 a 4% das gravidezes no mundo ocidental são complicadas por doença cardiovascular e este número tem vindo a aumentar. A necessidade de intervenção diagnóstica e/ou terapêutica a uma grávida pela Cardiologia não é rara e é sempre delicada tanto pela escassa experiência profissional da maioria dos Cardiologistas perante estas doentes como pela ausência de abordagens firmemente validadas da própria Especialidade nesta população tão única.
As guidelines muito recentemente publicadas para tratamento das doenças cardiovasculares na grávida foram desenvolvidas mais por extensão da evidência em não-grávidas do que a partir dos dados (limitados) disponíveis e a maioria das recomendações correspondem a um nível de evidência C (opinião de peritos e/ou pequenos estudos, estudos retrospetivos ou registos)1.
Caso clínicoGrávida de 37 anos de idade com 29 semanas de idade gestacional (2 GESTA 1 PARA) com antecedentes pessoais de excesso de peso, antecedentes familiares irrelevantes e sem medicação habitual inicia queixas de cansaço e dor na face lateral e dorsal da coxa esquerda 24 horas após curta viagem de avião (cerca de 3 horas). O quadro clínico foi interpretado como possível hérnia discal com inflamação do nervo ciático esquerdo e foi medicada com analgésicos e anti-inflamatórios. Notou agravamento progressivo das queixas de cansaço com dispneia para esforços sucessivamente menores e ao 9.° dia teve breve episódio de perda do conhecimento no domicílio e com dor torácica opressiva na região precordial, pelo que recorreu ao Serviço de Urgência (SU).
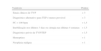
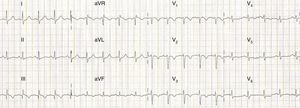
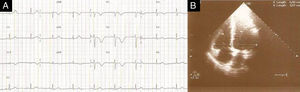
Objetivamente, apresentava-se agitada com hipotensão (73/35mmHg), taquicardia (115 bpm), hipoxémia (saturação de O2 em ar ambiente 80%) e polipneia (50 cpm). Sem sinais de trombose venosa profunda (TVP). Fez análises (hemoglobina 12,3g/dL; plaquetas 170x109/L; d-dímeros 2.962 ng/mL e troponina I 0,43 ng/mL (referência <1,50 ng/mL)) e na gasometria arterial realizada já com O2 suplementar a 5 L/min apresentava alcalose respiratória (pH 7,49; pO2 105mmHg; pCO2 28mmHg, HCO3− 20,9 mmol/L e saturação de O2 98%). Realizou eletrocardiograma (ECG), que mostrou taquicardia sinusal e sinais de sobrecarga no ventrículo direito (VD) (Figura 1) confirmados por ecocardiograma transtorácico (ETT) à cabeceira (Figura 2).
ETT (A) Plano apical de 4 câmaras telediastólico com dilatação do ventrículo direito, movimento paradoxal do septo intraventricular e PSAP estimada em 65mmHg, (B) no plano paraesternal curto-eixo com retificação diastólica do septo intraventricular em relação com hipertensão pulmonar e (C) função sistólica do ventrículo direito preservada (TAPSE 23mm).
O feto encontrava-se em situação transversa, com boa vitalidade, apresentando registo cardiotocográfico reativo com boa variabilidade e ausência de contratilidade uterina. A avaliação ecográfica mostrou crescimento fetal concordante.
Fez ecodoppler dos membros inferiores que excluiu TVP.
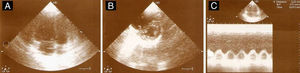
De acordo com o score de Weels, a probabilidade clínica para tromboembolismo pulmonar (TEP) agudo era intermédia (Tabela 1). Foi medicada com enoxaparina subcutânea (1mg/kg), iniciou fluidoterapia e foi decidida a realização de tomografia computadorizada (TC) torácica após administração de contraste endovenoso em fase arterial pulmonar, efetuando-se radioproteção do feto com aventais de chumbo. A AngioTC confirmou TEP agudo bilateral (Figura 3).
«Scoring system» de Wells
| Variáveis | Pontos |
| Sinais clínicos de TVP | + 3 |
| Diagnóstico alternativo para TEP é menos provável | + 3 |
| FC> 100 bpm | + 1,5 |
| Imobilização nos últimos 3 dias ou cirurgia nas últimas 4 semanas | + 1,5 |
| Diagnóstico prévio de TVP/TEP | + 1,5 |
| Hemoptises | + 1 |
| Neoplasia maligna | + 1 |
Probabilidade clínica.
0-1 é baixa.
2-6 é intermédia.
7 > alta.
(A) Trombo oclusivo na artéria pulmonar direita, que se estende aos seus ramos lobares. À esquerda existe trombo oclusivo na artéria lobar superior, que se estende à artéria pulmonar esquerda. Existe também trombo na artéria lobar inferior, não totalmente oclusivo, que se estende aos seus ramos segmentares. (B) Ventrículo direito com 57mm e ventrículo esquerdo com 29mm. (C) Reconstrução no plano coronal em corte espesso (24mm) com reformatação em MIP (maximum intensity projection) com trombo na artéria pulmonar direita (seta vermelha).
Foi transferida para a Unidade de Cuidados Intensivos Coronários (UCIC) e, passadas 4 horas, mantinha-se agitada com hipotensão (80/45mmHg), taquicardia (115 bpm) e polipneia (60 cpm). Ponderado o risco hemorrágico versus o risco eminente de descompensação clínica irreversível, foi decidida a realização de terapêutica trombolítica com tenecteplase (bólus de 40mg em 5 minutos) e a partir da terceira hora verificou-se melhoria clínica e hemodinâmica franca com tensão arterial de 95/65mmHg, frequência cardíaca de 100 bpm, frequência respiratória de 25 cpm e necessidades decrescentes de oxigenoterapia adicional.
Ao 4.° dia teve alta da UCIC e foi transferida para o Departamento de Obstetrícia e Ginecologia. Durante todo o internamento, apresentou-se sempre hemodinâmicamente estável, com saturações de O2 em ar ambiente de 96%. Não foram registadas quaisquer intercorrências hemorrágicas maternas ou fetais.
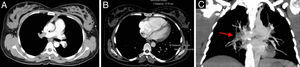
Ao 5.° dia de internamento realizou ECG e ETT (Figura 4) que mostrava o VD com dimensões normais e sem sinais de hipertensão pulmonar e ao 17.° dia teve alta medicada com enoxaparina 60mg bid sc.
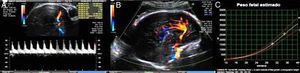
Ao 30.° dia após o diagnóstico, realizou ecografia obstétrica (Figura 5) que demonstrou crescimento fetal mantido na mesma curva de percentil, morfologia, volume de líquido amniótico e fluxometria umbilical e da artéria cerebral média normais. O estudo materno de trombofilia revelou heterozigotia para o fator V de Leiden.
DiscussãoDoença tromboembólica venosaA doença tromboembólica venosa (DTV) tem a sua expressão clínica mais temível na forma do TEP, que é uma entidade frequente e que se associa a uma mortalidade de 30% quando não tratada, principalmente por eventos recorrentes. A instituição de anticoagulação (ACO) com doses terapêuticas eficazes em até 24 horas reduz a mortalidade para 2 a 8% dos casos2,3. A mortalidade hospitalar está entre os 5 e 17% nos doentes que na altura do diagnóstico apresentam evidência de disfunção do VD4 e entre 20 a 30% nos que se verifica compromisso hemodinâmico5.
Doença tromboembólica venosa na grávidaA DTV engloba a TVP e o TEP e é a primeira causa de morte materna (20% dos casos) em países desenvolvidos, responsável por 1,2 a 4,7 mortes por 100000 gravidezes6. A incidência exata da DTV não é conhecida, mas estima-se entre 0,5 a 2 casos por 1000 grávidas7. O maior risco encontra-se nas 3 primeiras semanas após o parto por cesariana2. O risco entre a 3.a e a 6.a semana após o parto está ainda aumentado e é idêntico ao da gravidez. A partir da 6.a semana após o parto, o risco é semelhante ao das não-grávidas8.
Há 3 mecanismos patofisiológicos que podem, isoladamente ou em associação, ser responsáveis pela alta incidência de DTV na grávida (conhecidos como a tríade de Virchow:9
- (1)
Estase sanguínea: inicia-se no 1.° trimestre, é máxima às 36 semanas e é causada por venodilatação induzida pela progesterona, compressão pélvica pelo útero gravídico e compressão pulsátil por qualquer das artérias ilíacas sobre a veia ilíaca esquerda (e por isso a TVP na gravidez é em 80% dos casos à esquerda, denominando-se este último fenómeno a síndrome de May-Thurner)10;
- (2)
Lesão vascular: no parto pode acontecer distensão e/ou traumatismo das veias da região pélvica, especialmente se realizado por cesariana (o que explica o maior risco referido anteriormente);
- (3)
Hipercoagulabilidade: com a gravidez aumenta a produção de vários fatores da coagulação (I, II, VII, VIII, IX e X) e diminui a proteína S e a atividade dos inibidores da fibrinólise PAI-1 e PAI-2. Estas alterações fisiológicas são fundamentais para o desafio hemostático que vai constituir o parto (a hemorragia periparto é a principal causa de morte materna nos países em desenvolvimento11). Este estado pró-trombótico será ainda mais amplificado na presença de trombofilias hereditárias como a mutação do fator V de Leiden, do gene da protrombina (G20210A), deficiências de antitrombina III, proteína C ou S ou na presença de anticorpos antifosfolipídeos12.
A clínica da DTV pode ser frustre e difícil de valorizar, pois a maioria das grávidas saudáveis apresenta edema dos membros inferiores e até 70% tem queixas de dispneia no decurso da gravidez.13 Para o diagnóstico de DTV e sobretudo do TEP, é determinante a suspeita clínica, que deve ser sempre baseada em condições predisponentes/fatores de risco para situações pró-trombóticas (no caso descrito são o excesso de peso, a gravidez acima dos 35 anos, a trombofilia, a imobilização na viagem de avião e as queixas iniciais no membro inferior esquerdo compatíveis com possível TVP)1,2.
A partir dos fatores de risco identificados e do exame objetivo pode ser calculada a probabilidade clínica do TEP com o score system de Wells (ou de Genova) e que vai orientar a escolha de modalidades diagnósticas a seguir (Tabela 1)2. Estas ferramentas clínicas nunca foram validadas na gravidez, tendo sido no entanto encontradas num estudo 3 variáveis que parecem ser preditivas de TVP na grávida: sintomas na perna esquerda, diferença no perímetro da coxa> 2cm e 1.° trimestre14.
As alterações laboratoriais como a alcalose respiratória ou a elevação dos produtos de degradação da fibrina estão também frequentemente presentes na gravidez saudável (estes últimos aumentam com a idade gestacional e atingem o pico no parto, mas devem ser pedidos especialmente pela sua capacidade em excluir a doença e evitar a exposição desnecessária a radiação ionizante)1,15.
Avaliação imagiológicaEcodoppler venoso periféricoO sistema venoso profundo dos membros inferiores é difícil de aceder no exame objetivo e a sua avaliação em doentes com suspeita de TVP e/ou TEP recorre fundamentalmente ao estudo ecográfico em modo B e à compressão venosa em plano transversal com a ajuda do doppler a cores.1,2 A ressonância magnética parece ter uma sensibilidade de 100% para diagnosticar TVP e é aparentemente segura na gravidez16. A documentação de TVP numa grávida hemodinâmicamente estável é achado suficiente para iniciar tratamento com ACO sem ser necessário excluir/confirmar o TEP; porém, pelo menos 70% dos doentes com TEP não tem TVP na altura do diagnóstico17.
Avaliação radiográficaNas mulheres em idade fértil os exames com radiação ionizante devem ser feitos nos primeiros 10 dias após o ciclo menstrual e, sempre que existam dúvidas quanto a eventual gravidez, é necessário excluí-la primeiro. A exposição do ovário pré-concepção não tem efeitos mensuráveis em futuras gestações e o risco da radiação ionizante para a mulher grávida é o mesmo que para a não grávida.
Para o feto, a radiação ionizante pode causar morte, malformações (sobretudo oculares), atraso de crescimento e efeitos mutagénicos e carcinogénicos, dependendo sobretudo da idade gestacional (o período mais sensível é entre a 2.a e a 8.a semana) e da dose de radiação absorvida.
Um dos grandes obstáculos ao diagnóstico do TEP associa-se à relutância dos clínicos em expor o feto a radiação ionizante, atitude que resulta muitas vezes de uma perceção sobrevalorizada do risco de malefício fetal por estes exames. Perante a probabilidade clínica do TEP, as hipóteses para avaliação diagnóstica são a cintigrafia de perfusão-ventilação (CPV) pulmonar ou a TC torácica. A TC tem uma dose de radiação absorvida pelo feto estimada em 0,003 a 0,13 mGy e a CPV 0,2 mGy. A exposição fetal até doses de 50 mGy não tem evidência de provocar anomalias fetais, baixo QI, restrição de crescimento ou aborto. Com a CPV, há menos radiação absorvida pelo tecido mamário e pulmão da mulher comparativamente com a TC18,19. Apesar da aparente segurança da CPV e da TCE para o feto, importa referir que há estudos que sugerem que a exposição a baixas doses de radiação in utero pode aumentar o risco de leucemia na infância (o risco basal de qualquer criança é de 1 em 2800 e passa para 1 em 2000), que não é comparável com o risco de mortalidade da mãe por TEP não diagnosticado e tratado (cerca 15%)20.
Na grávida com radiografia de tórax normal, a CPV pode ser melhor para o diagnóstico do TEP face à TC devido à possibilidade neste último exame de interrupção do material de contraste por sangue não opacificado da veia cava inferior. Por outro lado, na grávida com radiografia torácica anormal a TC deve ser escolhida pelo conjunto de diagnósticos alternativos que pode oferecer (pneumonia ou outra pneumopatia). A angiografia pulmonar não deve ser usada na gravidez1,21.
A utilização de contraste iodado pode associar-se a disfunção tireoideia fetal (nunca descrita em utilização pontual) e que deve ser controlada na 1.a semana após o nascimento.
Tratamento- 1)
Prevenção. Todas as mulheres devem ter por rotina uma avaliação do risco de DTV no período pré-conceção ou nas primeiras semanas da gravidez. Reconhecem-se como fatores de risco mais importantes a história prévia de TVP não provocada, DTV recorrente, o TEP ou as trombofilias (e aqui é importante a história familiar de DTV). Metade das mulheres com DTV na gravidez ou tem uma trombofilia ou já teve evento trombótico prévio e estima-se que em cerca de 80% dos casos de morte por TEP na gravidez há fatores de risco identificáveis1,22. A melhor forma de tratar a DTV na gravidez é evitando-a com a instituição de medidas profiláticas na presença de critérios de alto risco (podendo também ser considerada nas mulheres com risco moderado): ACO (enoxaparina 0,5mg/kg peso) e meias de compressão1.
- 2)
Tratamento agudo. A ACO (com heparina não fracionada ou heparina de baixo peso molecular) deve ser administrada de forma a ser atingida uma dose terapêutica eficaz nas primeiras 24 horas, associando-se a uma diminuição da mortalidade por prevenir as recorrências e melhorar a função do VD. Globalmente, nunca se provaram diferenças na mortalidade no TEP com a utilização de ACO isolada versus ACO e trombólise, embora nos doentes com sinais de disfunção do VD a trombólise se associe a menor deterioração clínica (10% versus 25%)23, maior rapidez na resolução das alterações hemodinâmicas e provável benefício a longo prazo sobre a pressão arterial pulmonar e resistências vasculares pulmonares24. O tratamento do TEP com trombólise está indicado nos casos de maior instabilidade clínica que se associam a mortalidade precoce elevada (> 15%) (i.e. nos doentes com choque ou tensão arterial sistólica <90mmHg ou com queda superior a 40mmHg em 15 minutos que não é causada por arritmia de novo, hipovolemia ou sepsis). Ainda que possa ser considerada noutras situações como a hipoxémia grave, defeitos cintigráficos de perfusão muito importantes, disfunção do VD, TEP maciça pela TC, trombo livre na AD ou no VD e foramen ovale patente, a utilização consensual de trombolíticos é apenas na hipotensão persistente2. A tendência atual é não dirigir a trombólise à extensão ou gravidade anatómica da doença mas apenas ao seu rebate hemodinâmico. A gravidez é uma contraindicação relativa à realização de tratamento com trombolíticos2; porém, o sucesso desta opção terapêutica já foi descrito em pelo menos 200 mulheres1. O risco descrito é de 1% de mortalidade materna, 6% de perda fetal e 8% de complicações hemorrágicas (mais frequentes por via genital). No parto, a trombólise deve ser reservada para casos de gravidade extrema e apenas se a embolectomia cirúrgica não estiver imediatamente disponível. Os trombolíticos com utilização mais descrita na gravidez são a estreptoquinase, a uroquinase e o ativador do plasminogénio tecidular recombinante (rt-PA). Se a ACO estiver absolutamente contraindicada (por exemplo, pós-operatório imediato, no pós-parto imediato) poderá ser ponderada a colocação de filtro na veia cava inferior, fragmentação mecânica do trombo com ou sem trombólise local ou embolectomia cirúrgica. A utilidade do fluid challenge no compromisso hemodinâmico por TEP é controversa, não devendo exceder os 500-1000 cc de correção2.
- 3)
Manutenção. A ACO com varfarina não deve ser usada na grávida, sobretudo no 1.° trimestre por risco de embriopatia e no 3.° trimestre por possível descolamento de placenta, hemorragia fetal ou hemorragia neonatal, podendo ser depois usada após o parto e durante o aleitamento. O parto por via vaginal é sempre preferível relativamente à cesariana, sendo esta última reservada para indicações específicas de causa fetal ou materna. No período pós-parto é seguro iniciar a ACO 12 horas depois, que deve durar pelo menos 3 meses1,2.
O tenecteplase (TNKase) é uma glicoproteína adquirida por engenharia genética a partir do rt-PA e, com a substituição de 3 aminoácidos, é conseguida uma clearence plasmática mais lenta com semivida mais longa, maior afinidade com a fibrina, menor fibrinogenólise, menor coagulopatia e maior resistência à inativação pelo inibidor do ativador do plasminogénio 1. O TNKase não atravessa a barreira hematoplacentar e a sua administração em bólus único leva à formação mais rápida de plasmina e consequente resolução do quadro clínico25.
De acordo com uma pesquisa realizada no PubMed de artigos com a combinação de palavras pregnancy e tenecteplase, este é o 5.° caso em que se descreve a utilização deste trombolítico específico na gravidez e o 1.° no contexto do TEP (nos 4 prévios, 2 foram em enfarte agudo do miocárdio e 2 em trombose de prótese valvular mecânica).
ConclusõesSendo o TEP uma doença frequente na gravidez com grande impacto na morbimortalidade materna, deve ser sempre equacionado aquando dos sintomas e sinais suspeitos e confirmado com os exames complementares de diagnóstico adequados, incluído a CPV ou a TC. A ACO deve ser instituída de imediato e, em casos de instabilidade hemodinâmica, deve ser ponderada a trombólise, que se tem revelado eficaz nos poucos casos descritos na literatura e no caso apresentado.
Conflito de InteressesOs autores declaram não haver conflito de interesses.