A avaliação do risco isquémico e hemorrágico é fundamental na abordagem dos idosos com síndromes coronárias agudas, mas tem sido pouco estudada.
ObjetivoEste estudo pretende avaliar a adequação dos scores GRACE e CRUSADE a doentes com síndrome coronária aguda sem supradesnivelamento‐ST e idade ≥80 anos, e identificar os principais preditores de mortalidade intra‐hospitalar e hemorragia major nesta população.
MétodosForam avaliados 544 doentes com idade ≥80 anos com síndrome coronária aguda sem supradesnivelamento‐ST, incluídos no Registo Português de Síndromes Coronárias Agudas. Foram identificados os preditores de mortalidade intra‐hospitalar e de hemorragia major durante o internamento. Criaram‐se modelos preditores destes endpoints, posteriormente comparados com os scores GRACE e CRUSADE, e avaliada a sua adequação à população em estudo.
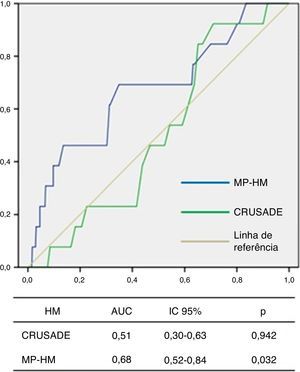
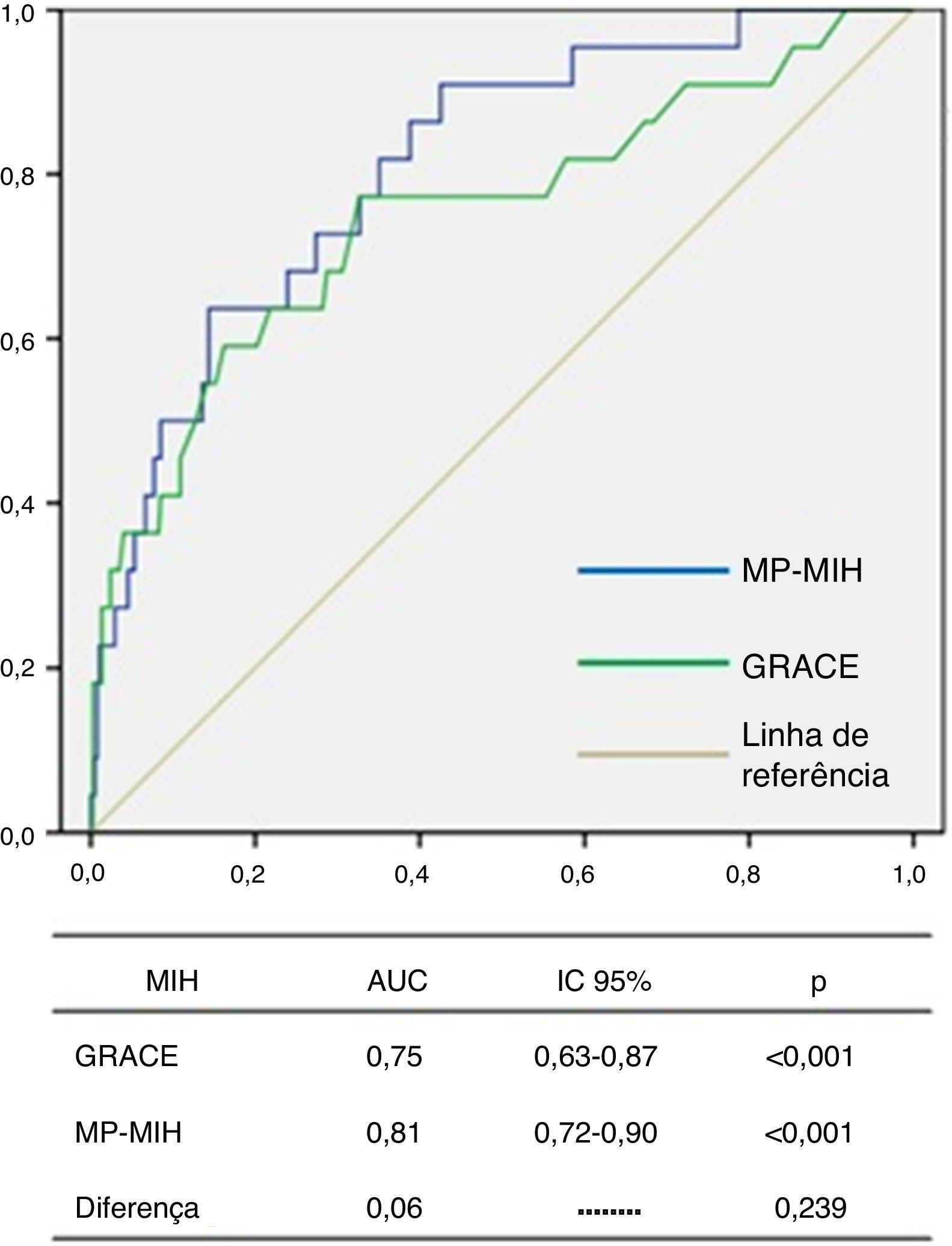
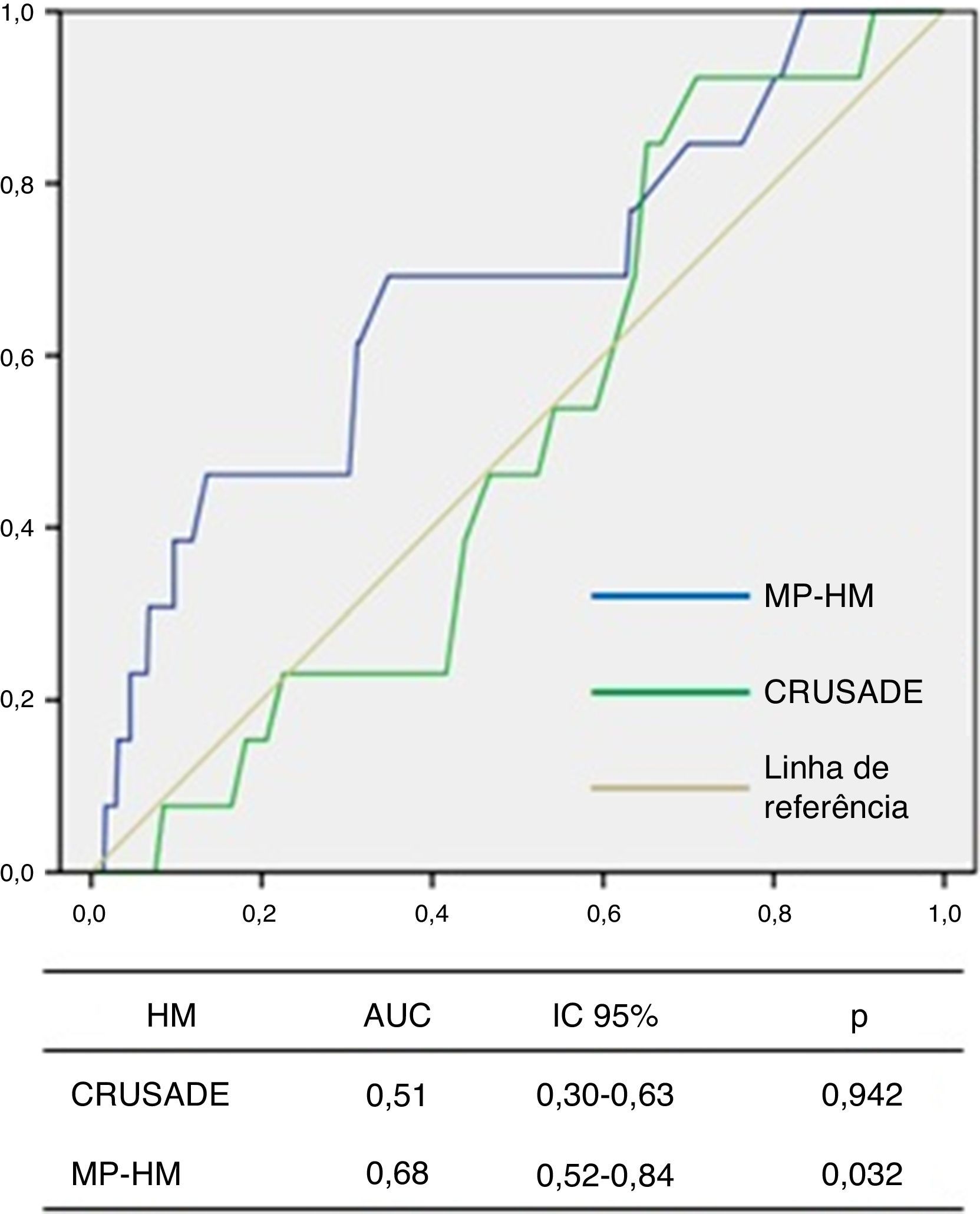
ResultadosA realização de coronariografia associou‐se a redução do risco de mortalidade intra‐hospitalar e não se associou a aumento do risco de hemorragia major (OR 0,2, IC 95% 0,006‐0,49, p = 0,001). A hemorragia major foi preditora independente de mortalidade intra‐hospitalar (OR 10,9, IC 95% 2,36‐50,74, p=0,002), e associou‐se a comorbilidades e à terapêutica farmacológica instituída. O score GRACE apresentou boa acuidade diagnóstica para mortalidade intra‐hospitalar (AUC 0,75, IC 95% 0,63‐0,87, p <0,001), mas o CRUSADE mostrou fraca capacidade discriminatória de hemorragia major (AUC 0,51, IC 95% 0,30‐0,63, p=0,942), contrariamente ao modelo preditor (AUC 0,68, IC 95% 0,52‐0,84, p=0,032).
ConclusõesO score GRACE é adequado para avaliação de risco nos octogenários, mas o CRUSADE é desajustado, sendo necessários novos scores para a avaliação de risco hemorrágico nesta faixa etária.
Assessment of ischemic and bleeding risk is critical for the management of elderly patients with acute coronary syndromes, but it has been little studied.
ObjectiveThis study aims to assess the applicability of the GRACE and CRUSADE scores in patients aged ≥80 years with non‐ST‐elevation acute coronary syndrome (NSTE‐ACS), and to identify the main predictors of in‐hospital mortality and major bleeding in this population.
MethodsWe analyzed 544 patients aged ≥80 years with NSTE‐ACS included in the Portuguese Registry on Acute Coronary Syndromes and identified the predictors of in‐hospital mortality and major bleeding during hospitalization. Prediction models were created for these endpoints, then compared with the GRACE and CRUSADE scores, and their applicability to the study population was assessed.
ResultsUse of coronary angiography was associated with reduced risk of in‐hospital mortality, without increasing risk of major bleeding (OR 0.2, 95% CI 0.006‐0.49, p=0.001). Major bleeding was an independent predictor of in‐hospital mortality (OR 10.9, 95% CI 2.36‐50.74, p=0.002), and was associated with comorbidities and pharmacological therapy during hospitalization. The GRACE score showed good diagnostic accuracy for in‐hospital mortality (AUC 0.75, 95% CI 0.63‐0.87, p<0.001), but the CRUSADE score had weak discriminatory capacity for major bleeding (AUC 0.51, 95% CI 0.30‐0.63, p=0.942), unlike our prediction model (AUC 0.68, 95% CI 0.52–0.84, p=0032).
ConclusionsThe GRACE score is suitable for risk assessment in octogenarians with NSTE‐ACS, but the CRUSADE score is inadequate, and new scores are required to assess bleeding risk in this age‐group.
Ácido acetilsalicílico
Angina instável
Área debaixo da curva
Doença pulmonar obstrutiva crónica
Enfarte agudo do miocárdio sem supradesnivelamento do segmento ST
Hemorragia major
Mortalidade intra‐hospitalar
Modelo predictor
Registo Nacional de Síndromes Coronárias Agudas
Síndromes Coronárias Agudas sem supradesnivelamento do segmento ST
A estratégia terapêutica invasiva associada a medicação antitrombótica mais agressiva nos doentes com síndrome coronária aguda sem supradesnivelamento do segmento ST (SCANST) tem demonstrado reduzir as complicações isquémicas, associando‐se, contudo, ao aumento de complicações hemorrágicas1–4. A ponderação do risco‐benefício destas terapêuticas é fundamental para a redução da mortalidade nesta população de doentes, sendo atualmente recomendada pela Sociedade Europeia de Cardiologia a utilização de scores de estratificação de risco isquémico, como o GRACE5, e de risco hemorrágico, como o CRUSADE6.
A idade avançada associa‐se a maior prevalência e extensão de doença coronária, maior risco de complicações isquémicas e mortalidade, sendo que 30% das mortes relacionadas com enfarte agudo do miocárdio ocorrem em doentes com mais de 85 anos7 e que a principal causa de morte nos doentes com ≥75 anos se deve a complicações isquémicas8. Tendo em conta este aumento de risco, os mais idosos serão, em teoria, os que mais beneficiam das terapêuticas com impacto prognóstico9–11. Contudo, esta faixa etária apresenta características próprias, como a presença de múltiplas comorbilidades, redução da capacidade para as atividades de vida diária, fragilidade fisiológica, psicológica e cognitiva, que influenciam o prognóstico após SCANST e que limitam o benefício de terapêuticas mais agressivas11. Por outro lado, nos idosos também se encontra alterada a metabolização de fármacos, em virtude da deterioração da função renal e hepática, interação medicamentosa por polimedicação, alteração da composição corporal e comorbilidades. Estes fatores condicionam maior vulnerabilidade à terapêutica e são responsáveis pelo aumento significativo das complicações hemorrágicas nesta faixa etária11, conduzindo ao receio da utilização de terapêuticas invasivas e medicação antitrombótica agressiva nos idosos, apesar do potencial benefício. Este facto tem‐se traduzido, nas diferentes séries publicadas, numa percentagem baixa de acesso às referidas terapêuticas nas faixas etárias mais avançadas, mesmo na ausência de contraindicações10,11.
Apesar da complexidade acrescida na orientação dos idosos com SCANST, os dados existentes são limitados para a faixa etária acima dos 80 anos, em virtude destes doentes terem sido frequentemente excluídos dos ensaios clínicos7,11. As recomendações atuais para esta população baseiam‐se, portanto, na extrapolação de dados obtidos para doentes mais jovens, que pode não refletir a realidade deste extremo cronológico, não se conhecendo, nomeadamente, se os scores recomendados para avaliação de risco isquémico e hemorrágico se adequam a esta faixa etária.
A obtenção de conhecimento através de outras fontes, como os registos, adquire, por isso, especial relevância nesta população. O Registo Nacional de Síndromes Coronárias Agudas da Sociedade Portuguesa de Cardiologia (RNSC)12 apresenta a robustez necessária para a avaliação desta população, como demonstrado por outros trabalhos resultantes da sua atividade13,14.
Este trabalho tem como principal objetivo avaliar a adequação dos scores GRACE e CRUSADE em doentes com SCANST e idade ≥80 anos, e adicionalmente identificar os principais preditores de mortalidade intra‐hospitalar (MIH) e hemorragia major (HM) nesta população.
MétodosDesenho do estudoEstudo observacional, multicêntrico, de doentes incluídos prospetivamente na segunda fase do Registo Nacional de Síndromes Coronárias Agudas (RNSCA)13, com o diagnóstico de SCANST e idade ≥80 anos. Foram avaliados os preditores de MIH e HM durante o internamento e criados modelos preditores (MP) destes endpoints. Os scores GRACE, CRUSADE, MP‐MIH e MP‐HM foram posteriormente avaliados e comparados na predição de MIH e HM.
Seleção de doentesForam avaliados 544 doentes consecutivos com idade ≥80 anos e diagnóstico de SCANST incluídos no RNSCA no período de 1 de outubro de 2010 a 25 de outubro de 2012, provenientes de 14 hospitais portugueses.
A definição de SCANST incluiu os diagnósticos de admissão: enfarte agudo do miocárdio sem supradesnivelamento do segmento ST (EAMNST: ausência de supradesnivelamento persistente [< 30 minutos] do segmento ST associada a elevação dos marcadores de necrose miocárdica [troponina ou CK‐mb] em contexto clínico sugestivo de isquemia miocárdica), e angina instável (AI: clínica sugestiva de angor ou equivalente anginoso, associada ou não a alterações electrocardiográficas indicativas de isquemia, na ausência de elevação de biomarcadores de necrose do miocárdio).
O RNSCA12 é um estudo observacional com inclusão contínua e prospetiva de doentes adultos (>18 anos) com o diagnóstico de síndrome coronária aguda com <48h de evolução. Foram excluídos deste registo enfartes dos tipos 4, 5 e 2 (classificação de acordo com a redefinição do enfarte do miocárdio de 2007 da Joint ESC/ACCF/AHA/WHF Task Force)15. Informação adicional em relação ao protocolo deste registo pode ser consultada no sítio da Sociedade Portuguesa de Cardiologia16.
Colheita de dadosDe entre as variáveis existentes no RNSCA, foram avaliadas as seguintes, que foram incluídas na análise univariável: dados demográficos (idade, género, índice de massa corporal); fatores de risco cardiovascular (definidos por história conhecida de hipertensão arterial, diabetes, dislipidemia, tabagismo atual [se consumo até 30 dias antes da admissão], e história familiar de doença coronária); antecedentes pessoais cardiovasculares (antecedentes de enfarte agudo do miocárdio, insuficiência cardíaca, acidente vascular cerebral/acidente isquémico transitório) e antecedentes não‐cardiovasculares (neoplasia, hemorragia [clinicamente significativa ou que tenha colocado a vida em risco], demência, doença pulmonar obstrutiva crónica [DPOC], insuficiência renal crónica [definida como história prévia ou presença de pelo menos um dos seguintes critérios: creatinina prévia ao internamento > 2 mg/dL, diálise ou transplante renal]); medicação prévia à admissão (antiagregantes [aspirina, clopidogrel, ambos, outros]; anticoagulantes [antagonistas da vitamina K, outros]); dados relativos à admissão hospitalar (local, forma de transporte para o hospital, clínica, tensão arterial, frequência cardíaca, classe Killip17, infradesnivelamento do segmento ST no eletrocardiograma, e avaliação analítica à admissão [elevação isolada de troponina, valor de hemoglobina, hematócrito, plaquetas, glicemia, HbA1c e creatinina]). O valor do hematócrito foi calculado a partir da hemoglobina, de acordo com a equação descrita por Bain e Bates18 (hematócrito = hemoglobina [g/dl] × 3). O valor do clearance de creatinina foi estimado através da fórmula de Cockcroft‐Gault19. Foram ainda avaliados dados relativos ao internamento, tais como a duração, variáveis analíticas (hemoglobina mínima, creatinina máxima), medicação administrada (antiagregantes: ácido acetilsalicílico [AAS]), clopidogrel, outros não‐AAS/clopidogrel; anticoagulantes: heparina não fracionada, enoxaparina, fondaparinux, antagonistas da vitamina K, outros; inibidores da glicoproteína IIb/IIIa, bloqueador‐beta, inibidor do enzima de conversão da angiotensina ou antagonista dos recetores de angiotensina, estatina, nitratos, antagonistas do cálcio, ivabradina, antagonistas da aldosterona, diuréticos, antiarrítmicos, insulina, antidiabéticos orais, inotrópicos, levosimendan), realização de coronariografia, acesso vascular, uso de sistemas de encerramento arterial, artéria culprit, número de vasos com estenose ≥ 50%, angioplastia, tipo de stent utilizado, revascularização cirúrgica, função ventricular esquerda, tratamentos como implantação de pacemaker provisório, balão intra‐aórtico, ventilação mecânica invasiva e não invasiva, e ainda complicações verificadas durante o internamento (re‐enfarte, complicações mecânicas, arritmias, paragem cardiorrespiratória reanimada, acidente vascular cerebral, insuficiência cardíaca, HM e morte).
Os scores GRACE5 (avaliação de MIH) e CRUSADE6 foram calculados para todos os doentes.
Esclarecimentos adicionais no que respeita à definição das diferentes variáveis podem ser obtidos por consulta do sítio da Sociedade Portuguesa de Cardiologia20.
Endpoints do estudoOs endpoints deste estudo corresponderam à avaliação de MIH e HM.
A MIH foi definida como morte de qualquer causa ocorrida durante o internamento por SCANST. A HM foi definida como ocorrência durante o internamento de hemorragia intracraniana ou hemorragia com compromisso hemodinâmico requerendo intervenção (critérios Global Use of Strategies to Open Occluded Arteries21 – GUSTO). A seleção dos critérios GUSTO para definição de HM deveu‐se ao facto de ser esta a classificação utilizada no RNSCA. Contudo, os autores consideram que se trata também da classificação mais adequada à população e aos objetivos do estudo, uma vez que importa identificar a hemorragia suficientemente grave para justificar a não utilização de terapêuticas efetivas na redução das complicações isquémicas, mas que aumentam o risco hemorrágico no SCA.
Análise estatísticaFoi realizada uma caracterização global da amostra considerando todos os parâmetros avaliados. As variáveis categóricas foram caracterizadas por frequências absolutas e relativas, e as variáveis contínuas recorrendo à média e desvio padrão.
Foram determinados os preditores independentes de cada um dos endpoints considerados, MIH e HM, tendo‐se realizado uma análise univariável em que se testou a associação entre o endpoint e cada um dos potenciais preditores. No caso das variáveis categóricas recorreu‐se ao teste Qui‐Quadrado e no caso de variáveis contínuas recorreu‐se ao teste T. Sempre que os pressupostos de utilização do teste T não eram satisfeitos utilizou‐se o teste Mann‐Whitney. A normalidade da distribuição dos valores das variáveis contínuas e a igualdade das suas variâncias foram testadas usando o teste Kolmogorov‐Smirnov e o teste de Levene, respetivamente.
Foram aplicadas técnicas de regressão logística para identificar os preditores independentes de MIH e HM tendo em conta todas as variáveis com significância estatística (método Stepwise Forward com teste razão de verosimilhanças). As variáveis identificadas como preditoras independentes de HM foram adicionalmente avaliadas por regressão logística (método Stepwise Forward com teste razão de verosimilhanças), incluindo‐se no modelo as variáveis utilizadas no score CRUSADE, e separadamente variáveis relativas à medicação realizada durante o internamento: dupla antiagregação, ou a associação desta a anticoagulantes (terapêutica tripla) ou a inibidores da glicoproteína IIb/IIa (antiagregação tripla). Os valores p de entrada e saída do modelo considerados foram 0,10 e 0,15, respetivamente. O risco de ocorrência de cada endpoint associado a cada preditor foi estimado por intermédio do Odds rtio e respetivo intervalo de confiança (IC) a 95%.
Por regressão logística (método enter) foram criados MP de MIH e de HM com base em variáveis presentes à admissão hospitalar, com significância estatística para cada endpoint ou que adicionalmente apresentavam interesse clínico: MP‐MIH – fração de ejeção do ventrículo esquerdo <30%, classe Killip >I, infradesnivelamento do segmento ST no eletrocardiograma, tensão arterial sistólica, frequência cardíaca, glicemia, creatinina, elevação isolada de troponina; MP‐MH – antecedentes de hemorragia, antecedentes de DPOC, classe Killip à admissão >I e creatinina à admissão. A calibração dos modelos foi avaliada através do teste de Hosmer‐Lemeshow.
A partir dos coeficientes de regressão estimados foram determinados os valores preditos de cada modelo para posterior avaliação da sua capacidade discriminatória, que foi feita estimando a área sob as curvas ROC (Receiver Operating Characteristic Curve), para além da determinação da sensibilidade e especificidade. Estas curvas avaliam a capacidade de um modelo atribuir uma probabilidade mais elevada de eventos aos doentes que atingiram o endpoint em estudo. Desta forma avaliou‐se a acuidade diagnóstica do score GRACE e do MP‐MIH para MIH, e do score CRUSADE e do MP‐HM para HM. A comparação das curvas ROC para MIH e para HM foi feita com recurso ao software MedCalc para Windows versão 9.2.0.1. A restante análise estatística foi realizada usando o software SPSS versão 19, com o teste definido por Hanley e McNeil (1982, 1983). O nível de significância utilizado nesta análise foi de 5%.
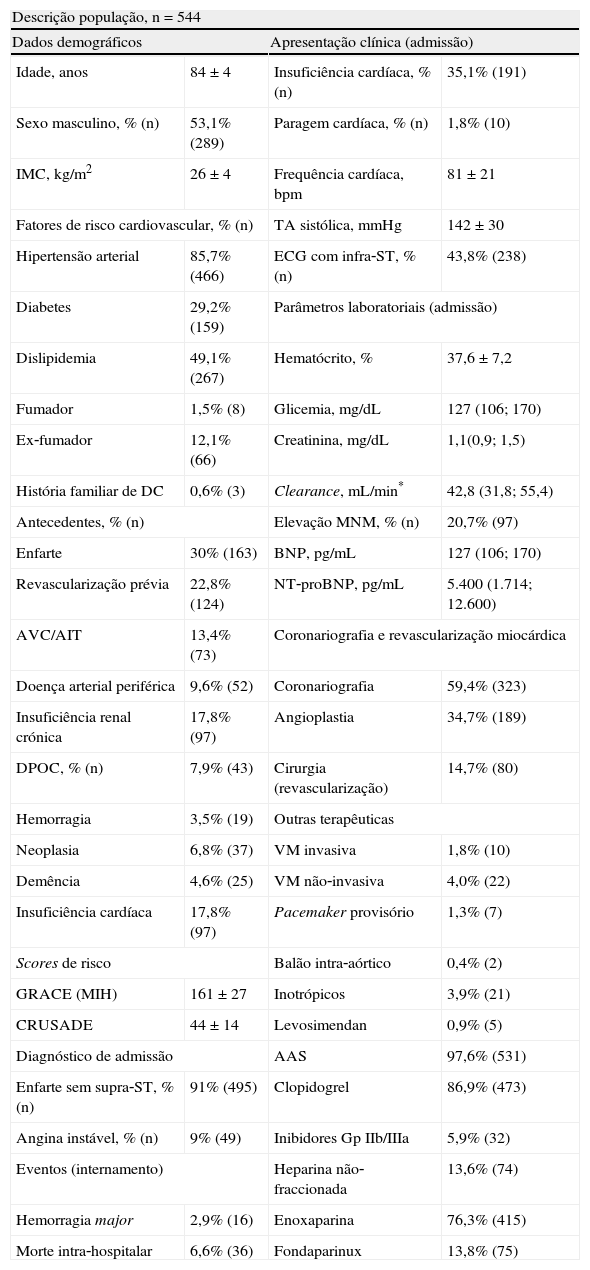
ResultadosCaracterização da populaçãoAs características dos 544 doentes avaliados são apresentadas na Tabela 1. A idade mínima incluída na amostra foi de 80 anos, enquanto a máxima foi de 92 anos, com uma média de 84 anos. O diagnóstico de admissão foi EAMNST em 91% (n=495) dos doentes, e AI em 9% (n=49). A Figura 1 apresenta a distribuição da população e dos doentes com MIH e HM pelos diferentes grupos de risco dos scores GRACE e CRUSADE, respetivamente. Na população em estudo, 93,6% dos doentes que atingiram o endpoint MIH foram classificados no grupo de alto risco pelo score GRACE; já o score CRUSADE classificou apenas 53,9% dos doentes com HM na classe de risco alto ou muito alto (Figura 1).
Características basais da população em estudo
| Descrição população, n=544 | |||
| Dados demográficos | Apresentação clínica (admissão) | ||
| Idade, anos | 84±4 | Insuficiência cardíaca, % (n) | 35,1% (191) |
| Sexo masculino, % (n) | 53,1% (289) | Paragem cardíaca, % (n) | 1,8% (10) |
| IMC, kg/m2 | 26±4 | Frequência cardíaca, bpm | 81±21 |
| Fatores de risco cardiovascular, % (n) | TA sistólica, mmHg | 142±30 | |
| Hipertensão arterial | 85,7% (466) | ECG com infra‐ST, % (n) | 43,8% (238) |
| Diabetes | 29,2% (159) | Parâmetros laboratoriais (admissão) | |
| Dislipidemia | 49,1% (267) | Hematócrito, % | 37,6±7,2 |
| Fumador | 1,5% (8) | Glicemia, mg/dL | 127 (106; 170) |
| Ex‐fumador | 12,1% (66) | Creatinina, mg/dL | 1,1(0,9; 1,5) |
| História familiar de DC | 0,6% (3) | Clearance, mL/min* | 42,8 (31,8; 55,4) |
| Antecedentes, % (n) | Elevação MNM, % (n) | 20,7% (97) | |
| Enfarte | 30% (163) | BNP, pg/mL | 127 (106; 170) |
| Revascularização prévia | 22,8% (124) | NT‐proBNP, pg/mL | 5.400 (1.714; 12.600) |
| AVC/AIT | 13,4% (73) | Coronariografia e revascularização miocárdica | |
| Doença arterial periférica | 9,6% (52) | Coronariografia | 59,4% (323) |
| Insuficiência renal crónica | 17,8% (97) | Angioplastia | 34,7% (189) |
| DPOC, % (n) | 7,9% (43) | Cirurgia (revascularização) | 14,7% (80) |
| Hemorragia | 3,5% (19) | Outras terapêuticas | |
| Neoplasia | 6,8% (37) | VM invasiva | 1,8% (10) |
| Demência | 4,6% (25) | VM não‐invasiva | 4,0% (22) |
| Insuficiência cardíaca | 17,8% (97) | Pacemaker provisório | 1,3% (7) |
| Scores de risco | Balão intra‐aórtico | 0,4% (2) | |
| GRACE (MIH) | 161±27 | Inotrópicos | 3,9% (21) |
| CRUSADE | 44±14 | Levosimendan | 0,9% (5) |
| Diagnóstico de admissão | AAS | 97,6% (531) | |
| Enfarte sem supra‐ST, % (n) | 91% (495) | Clopidogrel | 86,9% (473) |
| Angina instável, % (n) | 9% (49) | Inibidores Gp IIb/IIIa | 5,9% (32) |
| Eventos (internamento) | Heparina não‐fraccionada | 13,6% (74) | |
| Hemorragia major | 2,9% (16) | Enoxaparina | 76,3% (415) |
| Morte intra‐hospitalar | 6,6% (36) | Fondaparinux | 13,8% (75) |
AAS: ácido acetilsalicílico; AIT: acidente isquémico transitório; AVC: acidente vascular cerebral; BNP: peptídeo natriurético do tipo B; DC: doença coronária; DPOC: doença pulmonar obstrutiva crónica; ECG: eletrocardiograma; IMC: índice de massa corporal; MNM: marcadores de necrose do miocárdio; NT‐proBNP: porção N‐terminal do pro‐BNP; TA: tensão arterial; VM: ventilação mecânica.
As variáveis com distribuição não‐normal são apresentadas como: mediana (percentil 25; percentil 75).
* Clearance de creatinina estimado pela fórmula Cockcroft‐Gault.
Cerca de 98% dos doentes foram medicados com AAS, 86,9% com clopidogrel e 5,9% com inibidores da glicoproteína IIb/IIIa. A enoxaparina foi o anticoagulante mais frequentemente utilizado. Foi realizada coronariografia em 59,4% dos doentes, angioplastia em 34,7% e cirurgia de revascularização em 14,7%. Esta população apresentou um score GRACE de 161±27 e CRUSADE de 44±14. A duração mediana do internamento foi de cinco dias (P25: 3; P75: 8), tendo sido observado o endpoint MI em 6,6% e HM em 2,9% (Tabela 1).
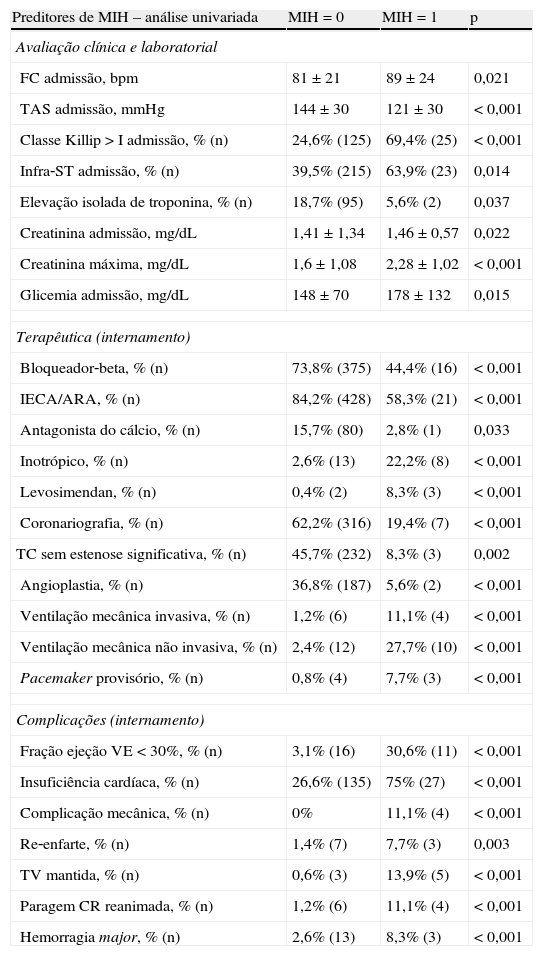
Preditores de mortalidade intra‐hospitalarEm análise univariada, a MIH associou‐se a valores mais elevados de frequência cardíaca e creatinina à admissão, creatinina máxima, presença à admissão de classe Killip >I, infradesnivelamento do segmento ST, elevação não isolada de troponina e valores mais baixos de tensão arterial sistólica (Tabela 2). A sobrevivência durante o internamento associou‐se a medicação mais frequente com bloqueadores‐beta, antagonistas do cálcio e IECA/ARA, a realização de coronariografia e angioplastia, e à ausência de doença do tronco comum (Tabela 2). Os doentes que faleceram no internamento necessitaram mais frequentemente de terapêutica com levosimendan, inotrópicos, ventilação mecânica e pacemaker provisório. Também apresentaram maior prevalência de complicações isquémicas e hemorrágicas (Tabela 2). Não foi identificada associação da MIH com a idade, fatores de risco CV, medicação prévia, acesso vascular ou sistemas de encerramento arterial utilizados na coronariografia, no tipo de stent utilizado na angioplastia ou na realização de cirurgia de revascularização miocárdica.
Variáveis associadas a mortalidade intra‐hospitalar em análise univariada
| Preditores de MIH – análise univariada | MIH=0 | MIH=1 | p |
| Avaliação clínica e laboratorial | |||
| FC admissão, bpm | 81±21 | 89±24 | 0,021 |
| TAS admissão, mmHg | 144±30 | 121±30 | <0,001 |
| Classe Killip >I admissão, % (n) | 24,6% (125) | 69,4% (25) | <0,001 |
| Infra‐ST admissão, % (n) | 39,5% (215) | 63,9% (23) | 0,014 |
| Elevação isolada de troponina, % (n) | 18,7% (95) | 5,6% (2) | 0,037 |
| Creatinina admissão, mg/dL | 1,41±1,34 | 1,46±0,57 | 0,022 |
| Creatinina máxima, mg/dL | 1,6±1,08 | 2,28±1,02 | <0,001 |
| Glicemia admissão, mg/dL | 148±70 | 178±132 | 0,015 |
| Terapêutica (internamento) | |||
| Bloqueador‐beta, % (n) | 73,8% (375) | 44,4% (16) | <0,001 |
| IECA/ARA, % (n) | 84,2% (428) | 58,3% (21) | <0,001 |
| Antagonista do cálcio, % (n) | 15,7% (80) | 2,8% (1) | 0,033 |
| Inotrópico, % (n) | 2,6% (13) | 22,2% (8) | <0,001 |
| Levosimendan, % (n) | 0,4% (2) | 8,3% (3) | <0,001 |
| Coronariografia, % (n) | 62,2% (316) | 19,4% (7) | <0,001 |
| TC sem estenose significativa, % (n) | 45,7% (232) | 8,3% (3) | 0,002 |
| Angioplastia, % (n) | 36,8% (187) | 5,6% (2) | <0,001 |
| Ventilação mecânica invasiva, % (n) | 1,2% (6) | 11,1% (4) | <0,001 |
| Ventilação mecânica não invasiva, % (n) | 2,4% (12) | 27,7% (10) | <0,001 |
| Pacemaker provisório, % (n) | 0,8% (4) | 7,7% (3) | <0,001 |
| Complicações (internamento) | |||
| Fração ejeção VE <30%, % (n) | 3,1% (16) | 30,6% (11) | <0,001 |
| Insuficiência cardíaca, % (n) | 26,6% (135) | 75% (27) | <0,001 |
| Complicação mecânica, % (n) | 0% | 11,1% (4) | <0,001 |
| Re‐enfarte, % (n) | 1,4% (7) | 7,7% (3) | 0,003 |
| TV mantida, % (n) | 0,6% (3) | 13,9% (5) | <0,001 |
| Paragem CR reanimada, % (n) | 1,2% (6) | 11,1% (4) | <0,001 |
| Hemorragia major, % (n) | 2,6% (13) | 8,3% (3) | <0,001 |
CR: cardiorrespiratória; FC: frequência cardíaca; MIH: mortalidade intra‐hospitalar; TAS: tensão arterial sistólica; TC: tronco comum.
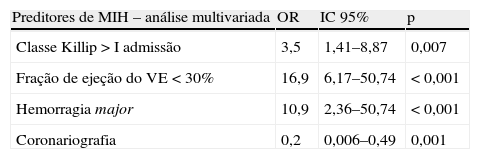
Em análise multivariada, foram preditores independentes de MIH a classe Killip à admissão >1, fração de ejeção do ventrículo esquerdo <30% e a ocorrência de HM – a qual aumentou quase 11 vezes o risco de MIH (Tabela 3). A realização de coronariografia nesta população mostrou ser protetora (Tabela 3).
Variáveis associadas a mortalidade intra‐hospitalar em análise multivariada
| Preditores de MIH – análise multivariada | OR | IC 95% | p |
| Classe Killip >I admissão | 3,5 | 1,41–8,87 | 0,007 |
| Fração de ejeção do VE <30% | 16,9 | 6,17–50,74 | <0,001 |
| Hemorragia major | 10,9 | 2,36–50,74 | <0,001 |
| Coronariografia | 0,2 | 0,006–0,49 | 0,001 |
IC: intervalo de confiança; MIH: mortalidade intra‐hospitalar; OR: Odds ratio; p: significância estatística.
O score GRACE mostrou uma boa acuidade diagnóstica para identificar os doentes que faleceram durante o internamento, com uma área debaixo da curva ROC (AUC) de 0,75, IC 95% 0,63‐0,87, p <0,001 (Figura 1). O Youden índex identificado para este score foi 170 (sensibilidade 77%, especificidade 67%).
O MP‐MIH apresentou uma boa calibração para MIH, de acordo com o teste de Hosmer‐Lemeshow (p=0,533). A análise de curvas ROC mostrou uma excelente capacidade discriminativa de MIH (AUC 0,81, IC 95% 0,72‐0,90, p <0,001) sem que, no entanto, se tenha verificado diferença significativa (0,06, p=0,239) entre as AUC dos dois modelos (Figura 2).
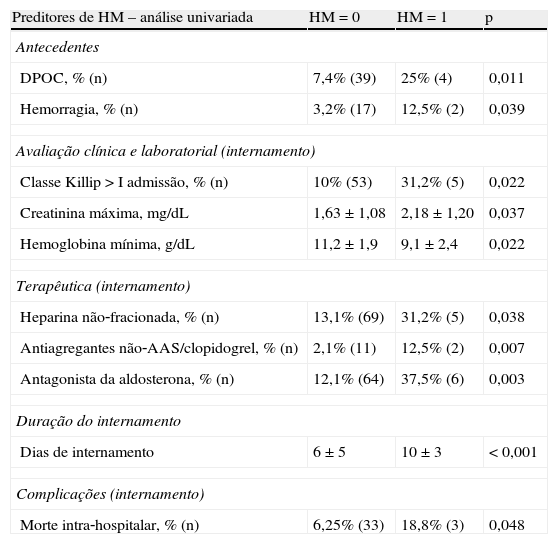
Preditores de hemorragia major durante o internamentoO endpoint HM associou‐se a antecedentes de hemorragia ou de DPOC, a classe Killip à admissão >1, a valores mais elevados de creatinina máxima e a mais baixos de hemoglobina mínima, a terapêuticas durante o internamento com heparina não‐fracionada, antiagregantes diferentes de AAS ou clopidogrel, ou antagonistas da aldosterona. Também se associou a prolongamento do internamento e a uma taxa superior de MIH (Tabela 4). Em análise univariada não foi verificada associação entre HM e idade, género, outros fatores de risco cardiovascular, medicação prévia, índice de massa corporal, valores à admissão de hemoglobina, creatinina ou plaquetas, medicação durante o internamento com inibidores da glicoproteína IIb/IIIa, ou com a realização de coronariografia, angioplastia, cirurgia de revascularização miocárdica, quanto ao tipo de stent ou acesso vascular utilizado, ou quanto ao uso de sistemas de encerramento arterial.
Variáveis associadas a hemorragia major em análise univariada
| Preditores de HM – análise univariada | HM=0 | HM=1 | p |
| Antecedentes | |||
| DPOC, % (n) | 7,4% (39) | 25% (4) | 0,011 |
| Hemorragia, % (n) | 3,2% (17) | 12,5% (2) | 0,039 |
| Avaliação clínica e laboratorial (internamento) | |||
| Classe Killip >I admissão, % (n) | 10% (53) | 31,2% (5) | 0,022 |
| Creatinina máxima, mg/dL | 1,63±1,08 | 2,18±1,20 | 0,037 |
| Hemoglobina mínima, g/dL | 11,2±1,9 | 9,1±2,4 | 0,022 |
| Terapêutica (internamento) | |||
| Heparina não‐fracionada, % (n) | 13,1% (69) | 31,2% (5) | 0,038 |
| Antiagregantes não‐AAS/clopidogrel, % (n) | 2,1% (11) | 12,5% (2) | 0,007 |
| Antagonista da aldosterona, % (n) | 12,1% (64) | 37,5% (6) | 0,003 |
| Duração do internamento | |||
| Dias de internamento | 6±5 | 10±3 | <0,001 |
| Complicações (internamento) | |||
| Morte intra‐hospitalar, % (n) | 6,25% (33) | 18,8% (3) | 0,048 |
AAS: ácido acetilsalicílico; DPOC: doença pulmonar obstrutiva crónica; HM: hemorragia major; p: significância estatística.
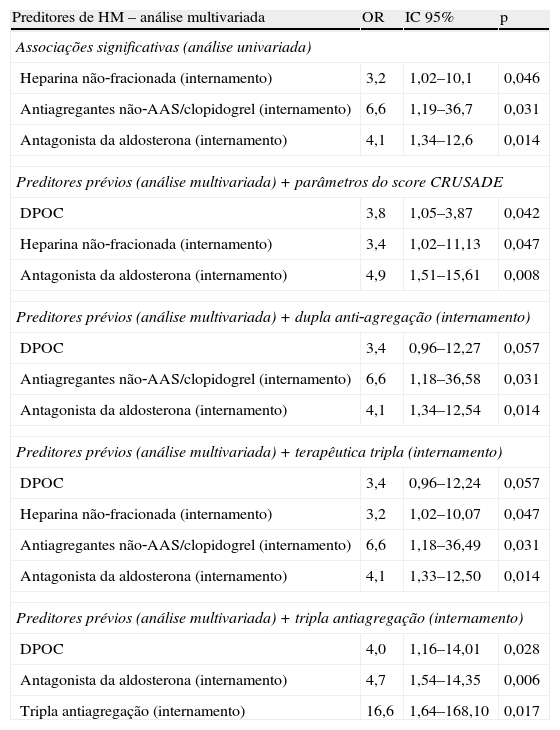
Quando incluídas em análise multivariada todas as associações significativas previamente referidas, apenas terapêutica médica administrada durante o internamento, nomeadamente heparina não‐fracionada, outros antiagregantes que não AAS ou clopidogrel e antagonistas da aldosterona, foram preditores independentes de HM (Tabela 5). A mesma análise incluindo estes preditores independentes e os parâmetros incluídos no score CRUSADE identificou como preditores de HM antecedentes de DPOC, medicação com heparina não‐fracionada e com antagonistas da aldosterona (Tabela 5). Incluindo em análise multivariada os preditores independentes iniciais e a terapêutica com dupla antiagregação ou com terapêutica tripla, separadamente, foram obtidos valores marginalmente significativos para DPOC e heparina não‐fracionada, tendo sido preditores de HM a terapêutica com antiagregantes não AAS/clopidogrel e com antagonistas da aldosterona (Tabela 5). Em análise semelhante incluindo a terapêutica antiagregante tripla, esta foi preditora independente de HM, assim como a DPOC e a terapêutica com antagonistas da aldosterona (Tabela 5).
Variáveis associadas a hemorragia major em análise multivariada
| Preditores de HM – análise multivariada | OR | IC 95% | p |
| Associações significativas (análise univariada) | |||
| Heparina não‐fracionada (internamento) | 3,2 | 1,02–10,1 | 0,046 |
| Antiagregantes não‐AAS/clopidogrel (internamento) | 6,6 | 1,19–36,7 | 0,031 |
| Antagonista da aldosterona (internamento) | 4,1 | 1,34–12,6 | 0,014 |
| Preditores prévios (análise multivariada) + parâmetros do score CRUSADE | |||
| DPOC | 3,8 | 1,05–3,87 | 0,042 |
| Heparina não‐fracionada (internamento) | 3,4 | 1,02–11,13 | 0,047 |
| Antagonista da aldosterona (internamento) | 4,9 | 1,51–15,61 | 0,008 |
| Preditores prévios (análise multivariada) + dupla anti‐agregação (internamento) | |||
| DPOC | 3,4 | 0,96–12,27 | 0,057 |
| Antiagregantes não‐AAS/clopidogrel (internamento) | 6,6 | 1,18–36,58 | 0,031 |
| Antagonista da aldosterona (internamento) | 4,1 | 1,34–12,54 | 0,014 |
| Preditores prévios (análise multivariada) + terapêutica tripla (internamento) | |||
| DPOC | 3,4 | 0,96–12,24 | 0,057 |
| Heparina não‐fracionada (internamento) | 3,2 | 1,02–10,07 | 0,047 |
| Antiagregantes não‐AAS/clopidogrel (internamento) | 6,6 | 1,18–36,49 | 0,031 |
| Antagonista da aldosterona (internamento) | 4,1 | 1,33–12,50 | 0,014 |
| Preditores prévios (análise multivariada) + tripla antiagregação (internamento) | |||
| DPOC | 4,0 | 1,16–14,01 | 0,028 |
| Antagonista da aldosterona (internamento) | 4,7 | 1,54–14,35 | 0,006 |
| Tripla antiagregação (internamento) | 16,6 | 1,64–168,10 | 0,017 |
DPOC: doença pulmonar obstrutiva crónica; HM: hemorragia major; IC: intervalo de confiança; OR: Odds ratio; p: significância estatística.
Através de análise de curvas ROC, o score CRUSADE mostrou não ter acuidade diagnóstica para a identificação de HM nesta população (AUC 0,51, IC 95% 0,30‐0,63, p=0,942; Figura 3).
O MP‐HM apresentou uma boa calibração no teste de Hosmer‐Lemeshow (p=0,111) e, em análise de curvas ROC, mostrou um bom poder discriminatório de HM para a população em estudo (AUC 0,68, IC 95% 0,52‐0,84, p=0,032; Figura 3).
DiscussãoOs dados apresentados sugerem que o score GRACE é adequado para avaliação de risco de MIH em octogenários com SCANST, enquanto o CRUSADE parece ser desajustado para avaliação de risco hemorrágico nesta faixa etária. Do que é nosso conhecimento, este é o primeiro estudo realizado até ao momento a avaliar a adequação dos scores GRACE e CRUSADE a esta população.
As comorbilidades e os fatores de risco cardiovascular verificados foram semelhantes aos publicados noutras séries de SCANST em doentes idosos7,9.
A incidência de terapêutica antitrombótica nesta amostra atingiu valores idênticos aos apresentados num subestudo da iniciativa CRUSADE (Can Rapid risk stratification of Unstable angina patients Suppress Adverse outcomes with Early implementation of the ACC/AHA guidelines)7, em doentes com SCANST e idade compreendida entre os 75 e os 89 anos, com exceção de no CRUSADE haver uma frequência maior de medicação com inibidores da glicoproteína IIb/IIIa (29,2 versus 5,9%). A realização de coronariografia e angioplastia reportada nesse grupo de doentes do CRUSADE também foi inferior à verificada nesta população, embora apenas tenham sido apresentados resultados para os procedimentos realizados nas primeiras 48h após admissão, numa faixa etária com limites diferentes7. Uma análise do registo Acute Coronary Syndromes Israeli Survey9 publicou resultados para doentes com EAMNST com mais de 80 anos, tendo sido verificada uma frequência de coronariografia (55%) ligeiramente inferior à da nossa população (59,4%), em que 91% dos doentes foram admitidos por EAMNST. Ainda assim, em 40% destes idosos não foi realizada coronariografia e 50% não foram submetidos a revascularização.
A realização de coronariografia associou‐se a um prognóstico favorável em termos de MIH, mas não se associou a HM. A revascularização com angioplastia também se associou a menor MIH, embora de modo não‐independente. Estes dados são consistentes com os apresentados pelo subestudo do Acute Coronary Syndromes Israeli Survey9 acima mencionado, em que se observou uma redução da mortalidade a um ano com procedimentos de revascularização (HR 0,5, p=0,004), redução da mortalidade a um ano (HR 0,4, p=0,04) e a 30 dias (HR 0,38, p=0,02) com a realização de coronariografia nas primeiras 24h de evolução de EAMNST em doentes com mais de 80 anos. Também o subestudo do registo CRUSADE7 concluiu que a adesão a terapêuticas recomendadas pelas guidelines, incluindo cateterização nas primeiras 48h de evolução, se encontrava associada a redução da MIH em doentes com ACSNST e idade superior a 75 anos.
O valor preditivo superior da coronariografia face à angioplastia verificado nesta população poderá refletir as diferentes estratégias de revascularização realizadas. Por outro lado, a angioplastia não se associou à ocorrência de HM.
Deve‐se, contudo, ressalvar o possível viés de seleção originado pelo status fisiológico, cognitivo e social dos idosos, que poderá ter contribuído para a seleção dos mais aptos e viáveis para a estratégia invasiva, mas que tem também reconhecido impacto prognóstico9. Estes dados salientam a importância do ajuste dos scores utilizados na estratificação de risco às características próprias desta faixa etária.
A incidência de MIH e de HM encontrada no RNSCA foi inferior à reportada noutros estudos com população idêntica, nomeadamente no subestudo do registo CRUSADE7 – o maior estudo realizado em idosos com SCANST (n=5.557), em que se verificou uma MIH de 7,8% (versus 6,6%) e HM em 13,1% (versus 2,9%). Neste último caso, foi utilizada uma definição de hemorragia mais abrangente, tendo sido também incluídos outros critérios que poderão justificar essa diferença (queda de hematócrito em ≥12%, hemorragia retroperitoneal, transfusão de glóbulos vermelhos em contexto de hemorragia documentada e com hematócrito basal <28%, ou transfusão com hematócrito basal ≥28%)7.
A importância das comorbilidades no prognóstico a curto prazo dos doentes com ≥80 anos foi bem evidenciada pelos resultados obtidos, sobretudo o contributo da insuficiência cardíaca como predisponente a MIH e HM, e da DPOC para a HM. Ambas se associam a um estado inflamatório crónico, condicionando uma maior fragilidade fisiológica e propiciando anemia. No caso da DPOC, poderão ainda contribuir para HM terapêuticas frequentemente utilizadas neste contexto, como a corticoterapia.
Os nossos resultados reforçam também a relação estreita e independente da HM com a MIH.
O risco acrescido de HM verificado para terapêuticas como a heparina não‐fracionada, antiagregantes não‐AAS/clopidogrel, antiagregação tripla (inibidores da glicoproteína IIb/IIIa associados a dupla antiagregação) ou antagonistas da aldosterona, poderá relacionar‐se com sobredosagem dos mesmos. Com efeito, este tem sido um problema frequentemente reportado nos idosos, associado à deterioração da função renal. Também nas terapêuticas com ajuste de dose em função do peso corporal, como a heparina não‐fracionada, tem sido documentada sobredosagem associada a alteração da composição corporal e dos níveis de proteínas nos idosos11. No caso dos antitrombóticos, a sobredosagem poderá aumentar o risco de complicações hemorrágicas. A associação da HM com os antagonistas da aldosterona poderá advir de múltiplos fatores, tais como o possível agravamento da função renal pelo fármaco e a sua maior utilização em doentes com clínica de insuficiência cardíaca.
A escolha das variáveis incluídas em cada um dos modelos criados prendeu‐se com o objetivo destes poderem ser aplicados no momento da admissão hospitalar. Por esse motivo, no MP‐HM, optou‐se por incluir a variável creatinina à admissão, apesar de a significância estatística ter sido verificada para a creatinina máxima, face ao reduzido número de variáveis que seriam incluídas no modelo seguindo o critério inicial. Não se incluiu a hemoglobina de admissão pelo facto do seu valor mínimo, que demonstrou associação a HM, refletir uma consequência óbvia da mesma.
Segundo a nossa análise, o score GRACE discriminou de modo adequado os eventos de MIH nesta população, sem diferença significativa em relação ao MP‐MIH ajustado; o seu Youden índex foi superior ao ponto de corte de alto risco de MIH recomendado pelas guidelines da Sociedade Europeia de Cardiologia para doentes com SCANST1,2 e corresponderá a um ajuste para a faixa etária em avaliação. Contudo, o score CRUSADE, também recomendado pelas mesmas guidelines, mostrou‐se completamente desajustado à predição de HM nesta população. Em parte, este desajuste poderia ser explicado por se ter utilizado uma definição de HM diferente da utilizada no estudo CRUSADE. Ainda assim, seria esperado que o score CRUSADE apresentasse alguma capacidade discriminativa para hemorragia grave, como a HM definida pelos critérios GUSTO, o que não se verificou. Numa análise do RNSCA apresentada no ESC Congress 201222, o score CUSADE mostrou uma capacidade discriminatória bem superior à verificada nesta análise (AUC 0,755, IC 95% 0,69‐0,82, p <0,001); contudo, a idade média desta população era 66±13 anos. Estes resultados põem em evidência a necessidade de novos scores para predição de risco hemorrágico nos octogenários. O MP‐HM criado poderia ser uma alternativa, já que demonstrou uma boa acuidade diagnóstica para HM. Contudo, tratando‐se de um modelo ajustado a esta população, teria de ser validado com outra amostra para garantir a extensibilidade destes resultados à população geral de octogenários com SCANST.
Neste trabalho são apresentados dados do mundo real, com uma distribuição geográfica alargada e um número significativo de doentes para a patologia e faixa etária. Contudo, algumas limitações devem ser consideradas na interpretação dos resultados.
Tratando‐se de um estudo observacional, tem de ser considerado um possível viés de seleção das estratégias terapêuticas em função do status fisiológico, psicológico, cognitivo e meio social dos doentes, que por sua vez também são fatores com impacto prognóstico. Uma das limitações inerentes a este trabalho prende‐se com a falta de informação relativa à fragilidade dos doentes. O RNSCA inclui informação relativa a comorbilidades potencialmente associadas a maior fragilidade como demência, antecedentes de acidente vascular cerebral, neoplasia, insuficiência renal, DPOC, contudo, a fragilidade associada é variável de acordo com a severidade da doença. Assim, e à semelhança de outros estudos abordando esta temática, não se encontra adequadamente descriminada e definida a fragilidade nas suas diferentes vertentes: debilidade fisiológica, cognitiva, psicológica ou social, limitações funcionais e qualidade de vida, que, no entanto, tem sido descrita como um fator de prognóstico adverso mais importante nos idosos do que os fatores de risco cardiovascular clássicos ou as comorbilidades11. Estes dados seriam importantes na interpretação das terapêuticas efetuadas, da HM e da MIH.
Apesar de se tratar de um estudo multicêntrico, esta amostra baseia‐se nos critérios de admissão do RNSCA: apresentação clínica sugestiva em doentes com <48 horas de evolução, o que poderá ter conduzido à exclusão de idosos com apresentação atípica, frequente nesta faixa etária e condicionadora de atraso no diagnóstico. Do mesmo modo, apenas foram incluídos os octogenários com SCANST que sobreviveram até à admissão hospitalar, impedindo, assim, que doentes mais graves pudessem ser incluídos na análise. A participação no RNSCA de apenas 14 centros portugueses também não garante a representatividade destes resultados à população portuguesa de octogenários com SCANST.
Neste estudo só foi avaliada a MIH, no entanto, a mortalidade a longo prazo e a informação relativa à qualidade de vida após a alta seriam importantes na avaliação do risco‐benefício das diferentes terapêuticas. A MIH foi utilizada como endpoint para avaliação de risco isquémico, contudo, tal como se verificou neste trabalho, este endpoint reflete também risco hemorrágico. A avaliação do risco isquémico seria mais correta utilizando um endpoint como enfarte fatal e não‐fatal, mas tal implicaria um seguimento a longo prazo, que limitaria ainda mais a dimensão da amostra.
ConclusõesNos doentes com SCANST e idade ≥80 anos o score GRACE adequou‐se à predição de MIH, enquanto o CRUSADE se mostrou desajustado na avaliação de risco hemorrágico nesta faixa etária. A presença de sinais de insuficiência cardíaca à admissão, uma fração de ejeção do ventrículo esquerdo <30% e a ocorrência de HM foram preditores independentes de MIH. Os principais preditores de HM corresponderam a medicação instituída no internamento e a antecedentes de DPOC. A realização de coronariografia associou‐se a um prognóstico favorável durante o internamento em termos de MIH e não aumentou o risco de HM. Estes dados sugerem o benefício de uma estratégia invasiva em doentes selecionados, bem como a necessidade de novos scores para avaliação do risco hemorrágico nestes doentes.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos do seu centro de trabalho acerca da publicação dos dados de pacientes.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesOs autores declaram não haver conflito de interesses.
Os autores agradecem o contributo de todos os investigadores do RNSCA que participaram na colheita dos dados apresentados neste trabalho.


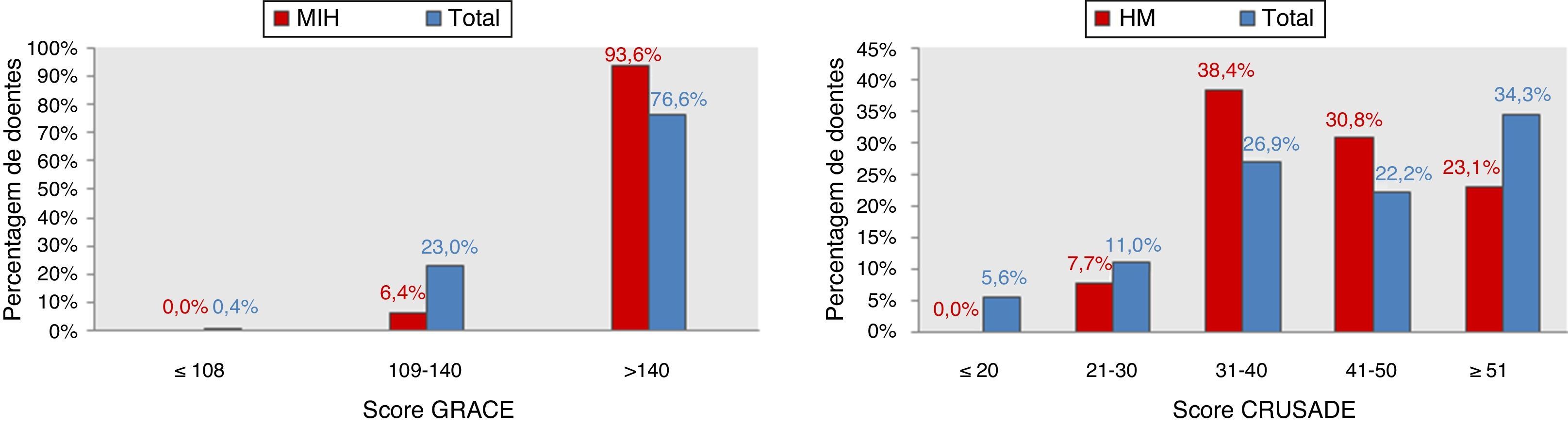
 MIH: mortalidade intra‐hospitalar.' title='Distribuição da população total e dos doentes com eventos de acordo com a pontuação dos scores GRACE e CRUSADE. HM: hemorragia major;
MIH: mortalidade intra‐hospitalar.' title='Distribuição da população total e dos doentes com eventos de acordo com a pontuação dos scores GRACE e CRUSADE. HM: hemorragia major; 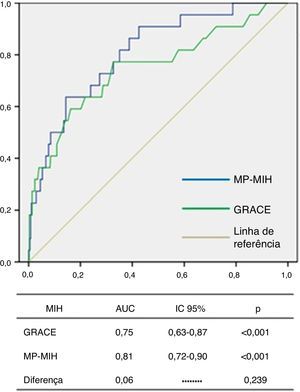 MIH para avaliação de mortalidade intra‐hospitalar. Diferença: diferença entre as áreas debaixo das duas curvas ROC.' title='Análise de curvas ROC do GRACE e do MP‐
MIH para avaliação de mortalidade intra‐hospitalar. Diferença: diferença entre as áreas debaixo das duas curvas ROC.' title='Análise de curvas ROC do GRACE e do MP‐