Em 1992, Brugada et Brugada descreveram pela primeira vez uma entidade, conhecida atualmente por síndrome de Brugada, associada a aumento do risco de arritmias ventriculares e morte súbita cardíaca em indivíduos sem cardiopatia estrutural. Esta síndrome caracteriza‐se por um fenótipo eletrocardiográfico distinto, padrão de Brugada tipo 1, o qual consiste numa elevação (≥0,2mV) «arqueada» do segmento ST seguida de uma onda T negativa em mais de uma derivação precordial direita. Este fenótipo é dinâmico, podendo ser espontâneo ou encontrar‐se oculto, sendo desmascarado em múltiplas circunstâncias, nomeadamente em contexto febril.
Os autores apresentam um caso clínico em que o diagnóstico de síndrome de Brugada é efetuado na sequência do estudo etiológico de síncopes recorrentes em contexto febril.
In 1992, Brugada and Brugada first described a new entity, which became known as Brugada syndrome, that is associated with a high risk of ventricular arrhythmias and sudden cardiac death in patients without structural heart disease. This syndrome is characterized by a distinct electrocardiographic phenotype, type 1 Brugada pattern, consisting of a coved ST‐segment elevation (≥0.2 mV) followed by a negative T wave in more than one right precordial lead. This pattern is dynamic, and can be spontaneous or concealed, but is unmasked under certain circumstances, like febrile states.
The authors report a case in which the diagnosis of Brugada syndrome was made in the course of etiologic investigation of recurrent syncope in a febrile state.
Apresenta‐se o caso de um homem de 40 anos de idade, que recorreu ao serviço de urgência (SU) por febre e tosse produtiva com cerca de dois dias de evolução. Durante a sua permanência no SU apresentou dois episódios de síncope precedidos por palpitações, diaforese e visão turva, com rápida recuperação do estado de consciência ao seu padrão habitual. Em ambos os episódios não se encontrava sob monitorização eletrocardiográfica.
Referia, desde a idade pediátrica, síncopes recorrentes em contexto febril e alguns meses antes da admissão terá tido episódio de pré‐síncope precedido de palpitações durante a noite. Não apresentava outros antecedentes patológicos relevantes, nem efetuava medicação crónica habitual, sendo que, no dia da admissão, teria tomado apenas paracetamol. Também não tinha história familiar de patologia cardíaca, morte súbita cardíaca (MSC) ou síncopes recorrentes.
Ao exame objetivo encontrava‐se normotenso, taquicárdico, febril, ligeiramente polipneico, com diminuição do murmúrio vesicular nas bases e sem alterações à auscultação cardíaca.
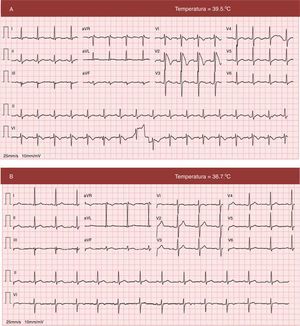
O eletrocardiograma (ECG) efetuado após os eventos sincopais (Figura 1A) documentou uma elevação «arqueada» do segmento ST em V1 e V2, máxima de 0,6mV em V2, seguida de uma onda T negativa, alterações da repolarização ventricular compatíveis com padrão de Brugada tipo 1.
ECG 12 derivações (A) à admissão, com febre, mostrando ritmo sinusal, 100/min, elevação «arqueada» do segmento ST em V1 e V2, máxima de ∼0,6mV em V2, seguida de uma onda T negativa, compatível com padrão de Brugada tipo 1, intervalo QTc 412. (B) ECG em apirexia, mostrando resolução das alterações da repolarização ventricular observadas em V1 e V2.
Analiticamente apresentava marcadores inflamatórios e D‐dímeros elevados. O potássio sérico e os marcadores de necrose miocárdica encontravam‐se dentro dos parâmetros da normalidade. Após realização de angio‐TC de tórax, que não evidenciou tromboembolismo, foi admitido na unidade de cuidados intermédios com o diagnóstico de pneumonia adquirida na comunidade complicada com insuficiência respiratória tipo 1. Iniciou antibioterapia empírica com ceftriaxona e claritromicina e permaneceu sob monitorização eletrocardiográfica continua.
A evolução do quadro infecioso foi favorável, com resolução de febre nas primeiras 24 horas. Não apresentou novos episódios de síncope ou eventos arrítmicos. No ECG realizado em apirexia, verificou‐se resolução das alterações típicas de Brugada previamente documentadas em contexto febril (Figura 1B). Efetuou ecocardiograma transtorácico que não evidenciou cardiopatia estrutural.
Dado apresentar quadro compatível com síndrome de Brugada (SB), com padrão de Brugada tipo 1 espontâneo e história de síncopes recorrentes, foi‐lhe implantado um cardioversor desfibrilador (CDI) para prevenção primária de MSC. Teve alta ao 11.° dia de internamento, com recomendação para vigilância e controlo imediato da temperatura corporal aquando de intercorrências febris e facultada informação relativa à evicção de fármacos contraindicados na SB.
Aos seis meses após a alta, o doente encontrava‐se assintomático e sem registos de eventos arrítmicos. O rastreio familiar encontrava‐se em curso.
DiscussãoA SB encontra‐se incluída num conjunto de patologias hereditárias denominadas de canalopatias. Estes são distúrbios primários do ritmo cardíaco causados por anomalias em canais iónicos e que condicionam suscetibilidade a arritmias ventriculares e consequentemente a MSC em indivíduos sem cardiopatia estrutural1,2. Estima‐se que a SB seja responsável por cerca de 4% de todas as MSC e de até 20% destas em indivíduos sem cardiopatia estrutural2.
A SB é uma patologia hereditária com transmissão autossómica dominante. Em 1998, Chen et al. identificaram a primeira mutação associada a esta entidade, envolvendo o gene SCN5A que codifica para a subunidade α do canal de sódio cardíaco3,4. Posteriormente, mutações em novos genes, codificando para proteínas de canais de cálcio e potássio, foram associadas a esta entidade, refletindo a sua heterogeneidade genética. As mutações no gene SCN5A são o genótipo mais comum (>70%), contudo, estão presentes em apenas 11‐28% dos indivíduos5.
A verdadeira prevalência desta patologia é ainda desconhecida, estimando‐se que afete cerca de 5/10 000 indivíduos, embora este valor possa estar subestimado pela existência de formas eletrocardiográficas ocultas6,7.
Apesar de a sua hereditariedade autossómica dominante, é cerca de oito a dez vezes mais prevalente no género masculino, exceto na idade pediátrica, em que a proporção entre os géneros parece ser idêntica. No homem a apresentação clínica tende a ser mais severa. Diferenças estruturais nas correntes iónicas e a influência de fatores hormonais têm sido apontados como potencias mecanismos explicativos destas diferenças entre os géneros8.
Apesar de poder ocorrer em qualquer idade, a SB surge tipicamente no adulto jovem, apresentando um pico de incidência entre a 3.a e 4.a década de vida2. Uma das características interessantes do presente caso clínico consiste na aparente presença de sintomatologia desde a infância. Apesar de na primeira descrição por Brugada et Brugada três dos oito doentes incluídos serem crianças, o conhecimento desta entidade na idade pediátrica é ainda limitado1. A apresentação neste grupo etário é rara. Estudos baseados na população japonesa estimaram uma prevalência de 0,0098%, muito inferior àquela encontrada no adulto (0,12%)9,10. Probst et al., num estudo envolvendo 30 crianças com SB, verificaram que em mais de metade o diagnóstico foi efetuado na sequência de rastreio familiar11. Em Portugal, os dados na literatura relativos à SB na idade pediátrica são escassos. Santos et al. analisaram 122 membros de uma família portuguesa a partir de um caso índex de SB com uma nova mutação SCN5A e identificaram nove crianças assintomáticas portadoras da mutação de entre 40 indivíduos identificados, três das quais apresentavam um ECG diagnóstico12.
De acordo com o segundo Consenso da Heart Rhythm Society/European Heart Rhythm Association (2005), o diagnóstico de SB requer a presença de um padrão de Brugada tipo 1, espontâneo ou induzido por bloqueadores dos canais de sódio, em conjugação com pelo menos um dos seguintes critérios: 1) documentação de fibrilhação ventricular (FV) ou taquicardia ventricular (TV) polimórfica; 2) história familiar de MSC antes dos 45 anos; 3) padrão de Brugada tipo 1 em familiares; 4) indução de TV/FV em estimulação elétrica programada; ou 5) história pessoal de síncope ou respiração agónica noturna. Segundo este consenso, o fenótipo eletrocardiográfico de Brugada tipo 1 pressupõe a presença de um padrão diagnóstico em pelo menos duas derivações precordiais direitas2. Contudo, Richter et al. alertaram, posteriormente, para a eventual necessidade de revisão destes critérios, ao verificarem que indivíduos com envolvimento de apenas uma derivação tinham um risco arrítmico semelhante àqueles com envolvimento de mais de uma derivação precordial direita13. No presente caso clínico, o diagnóstico de SB baseou‐se na presença de um padrão eletrocardiográfico de Brugada tipo 1 espontâneo e história pessoal de síncopes recorrentes.
Para além do padrão de Brugada tipo 1, dois outros padrões sugestivos mas não diagnósticos de SB foram descritos – o padrão tipo 2 (elevação ≥2mm do ponto J, com segmento ST descendente seguido de uma onda T positiva ou bifásica, resultando numa configuração em «sela de cavalo») e o padrão tipo 3 (padrão tipo 1 ou 2, mas com elevação do segmento ST <1mm). O diagnóstico de SB deve ser considerado apenas quando há conversão destes padrões num padrão tipo 12. É fundamental reconhecer que no mesmo indivíduo o fenótipo eletrocardiográfico pode ser dinâmico, flutuando ao longo do tempo entre um padrão diagnóstico e padrões não diagnósticos (tipo 2, 3, normal), tal como se verifica no presente caso clínico. Veltmann et al. efetuaram uma análise seriada de 310 ECG pertencentes a 43 doentes com SB. Os autores demonstraram que apenas 35% dos indivíduos apresentavam um ECG inicial com padrão de Brugada tipo 1. A documentação de um padrão diagnóstico era possível apenas após teste de provocação farmacológica em 47% dos doentes. A alternância de padrões ocorreria ao longo do tempo em cerca de metade dos indivíduos, sendo que, apenas um apresentou sistematicamente um padrão diagnóstico14. Os resultados deste estudo alertam para a importância da realização de ECG seriados, o que poderá ter implicações na acuidade diagnóstica e na estratificação do risco destes doentes.
Vários fatores moduladores podem explicar em parte esta variabilidade eletrocardiográfica temporal, ao desmascarem fenótipos eletrocardiográficos ocultos. Para além disso, parecem igualmente influenciar a suscetibilidade a eventos arrítmicos. De entre os fatores moduladores incluem‐se uma multiplicidade de fármacos, a intoxicação alcoólica ou por cocaína, a elevação da temperatura corporal, o sistema nervoso autónomo e os distúrbios do potássio e do cálcio15.
O crescente reconhecimento da temperatura corporal enquanto modulador do risco arrítmico no contexto da SB advém da publicação de múltiplos casos isolados, nomeadamente em Portugal, de apresentação desta entidade em contexto de intercorrências febris16–19. Barra et al. alertaram para a importância da febre como modulador do fenótipo eletrocardiográfico, através da publicação de um caso clínico em que, apesar dos testes da flecainida e de estimulação elétrica programada prévios serem negativos, o padrão diagnóstico foi desmascarado pela febre18. O mecanismo molecular pelo qual a temperatura modula o fenótipo eletrocardiográfico e o risco arrítmico é complexo e não se encontra ainda completamente compreendido. Vários autores sugerem que em determinadas mutações SCN5A a elevação da temperatura corporal acentue o processo de inativação dos canais de sódio20,21. A modulação da função de canais de sódio pela temperatura já foi demonstrada noutras entidades, entre as quais, a epilepsia desencadeada pela febre22. Amin et al. verificaram que 18% dos eventos sintomáticos em doentes com SB ocorreriam em contexto febril. Os autores compararam ainda o fenótipo eletrocardiográfico em contexto febril e após apirexia. Dos 24 doentes incluídos nesta análise todos apresentaram padrão de Brugada tipo 1 durante a febre, o qual persistiu em normotermia em apenas um23. Os doentes com SB, particularmente aqueles com sintomatologia prévia em contexto febril, devem ser alertados para a necessidade do controlo rigoroso da temperatura corporal durante intercorrências febris. O efeito modulador da temperatura corporal no fenótipo eletrocardiográfico e clínico encontra‐se bem evidente no presente caso clínico; na ausência de fármacos, distúrbios do potássio, o padrão eletrocardiográfico de Brugada tipo 1 é desmascarado na presença de febre, enquanto em apirexia tais alterações desaparecem por completo. Por outro lado, é em contexto febril que a sintomatologia surge, e neste caso particular com história desde a infância de síncopes recorrentes nesse contexto. Efetivamente, na idade pediátrica, dada a elevada prevalência de intercorrências infeciosas, a febre assume‐se como um precipitante comum de eventos arrítmicos nos indivíduos com SB. Estima‐se que cerca de metade dos eventos sincopais neste grupo etário ocorram em contexto febril11. No presente caso clínico, o evento arrítmico que desencadeou os sintomas não foi documentado, dado o doente encontrar‐se sem monitorização eletrocardiográfica durante os episódios de síncope.
Até ao momento, a implantação de um CDI constitui o único tratamento comprovadamente eficaz na SB2. A estratificação do risco de MSC assume primordial relevância na seleção dos candidatos para este dispositivo, maximizando os seus potenciais benefícios. Contudo, a estratificação do risco nesta população tem sido dificultada em parte pelo seu diversificado espectro de apresentação, o qual engloba desde indivíduos assintomáticos até àqueles que se apresentam com síncopes, respiração agónica noturna e até MSC.
A morte súbita ressuscitada constitui a primeira manifestação desta entidade em cerca de 6‐21% dos doentes24–27. Probst et al. analisaram 1029 indivíduos com SB incluídos num registo multicêntrico (registo FINGER) e verificaram que neste grupo o risco de recorrência de eventos é muito elevado, estimado em aproximadamente 7,7%/ano24. Consequentemente, o benefício da implantação do CDI em prevenção secundária é indiscutível e consensual (recomendação classe I)2.
Entre 17‐31% dos doentes com SB o diagnóstico é efetuado aquando do estudo etiológico de síncopes, as quais são geralmente secundárias a episódios autolimitados de TV polimórfica24–27. Brugada et al. verificaram que 19% dos doentes com história prévia de síncope apresentavam MSC durante o follow‐up25. Contudo, vários autores estimaram uma incidência de eventos arrítmicos neste subgrupo inferior, de cerca de 6% (1,9%/ano, no registo FINGER)24–27. Esta diferença pode ser atribuída a um viés de seleção, pois a população do registo de Brugada parece incluir doentes com maior severidade. Na SB a presença de história prévia de síncope constitui um marcador de risco arrítmico, sendo este adicionalmente influenciado pela presença de um padrão de Brugada tipo 1 espontâneo ou induzido por bloqueadores dos canais de sódio. Desta forma, a presença de história prévia de síncope e concomitantemente de um padrão de Brugada tipo 1 constitui um potente preditor de MSC e, portanto, uma indicação para implantação de CDI (recomendação classe I2 ou IIa 28)2,25–27. No presente caso clínico estes pressupostos estavam presentes pelo que o doente implantou CDI em prevenção primária. Priori et al. estudaram a história natural da SB e verificaram que 10% dos indivíduos na sua população apresentaram história prévia de síncope e padrão de Brugada tipo 1 espontâneo e que destes 44% tiveram MSC26.
ConclusãoNa abordagem etiológica da síncope ou MSC aquando de uma intercorrência febril a SB deverá ser sempre considerada no diagnóstico diferencial. Para tal, a realização de um ECG, especialmente após o evento sintomático, durante a febre é mandatória. A documentação de um padrão diagnóstico poderá ser possível apenas durante a febre, característica que reflete o carácter dinâmico do fenótipo eletrocardiográfico e clínico desta patologia.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos do seu centro de trabalho acerca da publicação dos dados de pacientes.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesOs autores declaram não haver conflito de interesses.