Curtos períodos de isquemia do miocárdio seguida de reperfusão induzem um mecanismo de cardioproteção quando este é depois submetido a um período de isquemia prolongada, um fenómeno designado pré-condicionamento isquémico.
Além da sua aplicação local no miocárdio, o pré-condicionamento isquémico também pode ser induzido por breves interrupções da circulação sanguínea em outros órgãos, nomeadamente no músculo esquelético. De uma forma não invasiva, a indução de isquemia transitória através da insuflação de um braçal num dos membros, seguida de reperfusão, leva à diminuição dos danos causados no miocárdio pela interrupção da circulação coronária.
O pré-condicionamento isquémico remoto envolve a ativação de vias humorais e/ou neuronais que, atuando no miocárdio, provocam a abertura de canais de potássio mitocondriais sensíveis ao ATP e o encerramento do poro de transição de permeabilidade mitocondrial, tornando os cardiomiócitos menos sensíveis à morte celular causada pela isquemia.
Este mecanismo cardioprotetor pode já ser transposto para a prática clínica, havendo resultados positivos em vários estudos clínicos realizados na cirurgia coronária, cirurgia de reparação de aneurismas da aorta abdominal, cirurgia de substituição valvular e intervenção coronária percutânea. Contudo, existem alguns fatores que atenuando os mecanismos subcelulares do pré-condicionamento – idade, comorbilidades, medicação, protocolo anestésico – parecem explicar a heterogeneidade de resultados nalguns estudos.
Finalmente, é de esperar que a compreensão detalhada das vias envolvidas na cardioproteção induzida pelo pré-condicionamento isquémico possam permitir o desenvolvimento de novos fármacos que permitam reduzir as consequências da isquemia prolongada.
Short periods of myocardial ischemia followed by reperfusion induce a cardioprotective mechanism when the myocardium is subsequently subjected to a prolonged period of ischemia, a phenomenon known as ischemic preconditioning.
As well as its application in the myocardium, ischemic preconditioning can also be induced by brief interruptions of blood flow to other organs, particularly skeletal muscle. Transient ischemia induced noninvasively by inflating a cuff on a limb, followed by reperfusion, helps reduce the damage caused to the myocardium by interruption of the coronary circulation.
Remote ischemic preconditioning involves activation of humoral and/or neural pathways that open mitochondrial ATP-sensitive potassium channels in the myocardium and close mitochondrial permeability transition pores, making cardiomyocytes less vulnerable to ischemia-induced cell death.
This cardioprotective mechanism is now being translated into clinical practice, with positive results in several clinical trials in coronary artery bypass surgery, surgical repair of abdominal aortic aneurysms, valve replacement surgery and percutaneous coronary intervention. However, certain factors weaken the subcellular mechanisms of preconditioning - age, comorbidities, medication, anesthetic protocol - and appear to explain the heterogeneity of results in some studies.
Detailed understanding of the pathways involved in cardioprotection induced by ischemic preconditioning is expected to lead to the development of new drugs to reduce the consequences of prolonged ischemia.
O corpo humano é capaz de recrutar vários mecanismos protetores que permitem manter a homeostasia em resposta a diferentes agressões.
Quando há interrupção da circulação coronária o tamanho do enfarte é proporcional à duração da isquemia1. Paradoxalmente, mesmo a revascularização precoce causa lesão tecidular, um fenómeno chamado de lesão de isquemia-reperfusão2, e que se estima ser responsável por até 30% do tamanho do enfarte3. Tal facto levou à procura de mecanismos citoprotetores que possam tornar o miocárdio menos sensível a esta lesão, não só em situações agudas (revascularização no contexto da síndrome coronária aguda), como também após procedimentos cirúrgicos que impliquem a interrupção temporária da circulação coronária, nomeadamente na cirurgia cardíaca com clampagem da aorta ou no transplante cardíaco.
Em 1986, Murry et al.4 observaram que animais submetidos a curtos episódios de isquemia coronária antes da oclusão prolongada da mesma artéria tinham uma redução da extensão do enfarte em 75%. A equipa colocou a hipótese de que curtos períodos de isquemia não letal do miocárdio, seguidos de reperfusão, o poderiam proteger de episódios subsequentes de isquemia prolongada, fenómeno a que chamaram de pré-condicionamento isquémico do miocárdio (PIM).
Posteriormente, a investigação dos mecanismos no pré-condicionamento isquémico permitiu a descrição de dois outros fenómenos: per-condicionamento isquémico5 e pós-condicionamento isquémico6, em que o estímulo cardioprotetor isquémico é provocado durante ou após a oclusão coronária prolongada, respetivamente.
Przyklenk et al.7 fizeram evoluir o conceito pré-condicionamento ao provar que a oclusão breve e repetida de uma artéria coronária protege não só o território que diretamente irriga, como sugerido por Murry, mas também o restante miocárdio. A esta proteção intracardíaca chamaram pré-condicionamento isquémico regional do miocárdio. Neste seguimento levantou-se a hipótese da citoproteção poder ser induzida por isquemia em órgãos à distância, o que foi confirmado pela descrição do pré-condicionamento isquémico remoto do miocárdio (PIRM) em que o estímulo, inicialmente, era a isquemia renal e mesentérica8. Apesar do interesse experimental desta descoberta, os rins e, em menor grau, o intestino são vulneráveis mesmo a curtos períodos de isquemia9 e não estão acessíveis para aplicação clínica.
O grande avanço na investigação do PIRM deu-se com a utilização de músculo esquelético como território isquémico10. O uso de um garrote ou braçal insuflado num dos membros permitiu a aplicação do PIRM sem necessidade de procedimentos invasivos ou de impedir o suprimento sanguíneo a órgãos vitais11.
Assim, o pré-condicionamento isquémico remoto do miocárdio é um mecanismo através do qual a isquemia transitória de territórios vasculares à distância aumenta a resistência dos cardiomiócitos a situações de isquemia coronária prolongada e à lesão de isquemia-reperfusão.
Este artigo de revisão tem como objetivo descrever os mecanismos fisiopatológicos responsáveis pelo pré-condicionamento isquémico remoto do miocárdio, bem como exemplificar possíveis formas de aplicação na prática clínica, abordando os principais estudos clínicos que testaram a sua eficácia. A utilização dos membros é a alternativa com maior potencial clínico uma vez que o músculo esquelético está facilmente acessível e tem uma resistência prolongada à isquemia12. Por estes motivos, nesta revisão bibliográfica será dada especial atenção ao PIRM induzido por isquemia muscular esquelética.
Materiais e métodosFoi realizada uma pesquisa online na base de dados Pubmed por artigos científicos publicados desde 1986, data da primeira descrição do pré-condicionamento isquémico4, até dezembro de 2012, que contenham os termos remote ischemic preconditioning ou ischemic preconditioning at a distance. Esta pesquisa foi complementada por uma procura adicional nas bases de dados Scopus e Cochrane. Todos os artigos considerados relevantes para a discussão foram incluídos.
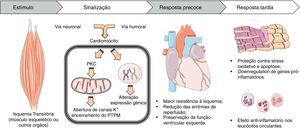
Mecanismos fisiopatológicos envolvidos no pré-condicionamento isquémico remotoTal como no pré-condicionamento local13, o pré-condicionamento isquémico remoto gera duas fases de proteção miocárdica. A fase precoce (ou imediata) que dura cerca de quatro horas, à qual se segue uma fase tardia, com início > 24horas após a indução da isquemia e que se prolonga por pelo menos 48horas14.
A fase precoce leva a alterações imediatas no miocárdio e na circulação coronária com aumento do fluxo diastólico15 e vasodilatação das artérias coronárias16. Permite desde logo a redução da área de enfarte, do risco de arritmias de reperfusão11,17 (nomeadamente extrassistolia, fibrilação e taquicardia ventricular18) e preservação da função ventricular esquerda19,20.
A segunda janela de cardioproteção depende da síntese de proteínas, o que é consistente com a alteração da expressão génica que se observa nos cardiomiócitos21 e leucócitos22 no período que se segue à isquemia miocárdica.
Os mecanismos fisiopatológicos envolvidos no PIRM ainda não são totalmente compreendidos, mas podem ser divididos em três fases: i) o efetor (ou efetores) produzidos ou libertados no tecido isquémico; ii) os mecanismos de comunicação entre o território remoto e o miocárdio; e iii) a indução de uma resposta cardioprotetora (ver Figura 1).
A indução de períodos transitórios de isquemia-reperfusão provoca a libertação e/ou produção de várias substâncias pelo tecido isquémico. Diversos fatores têm sido implicados (Tabela 1), não havendo ainda consenso quanto à importância relativa de cada um. Dependendo do local onde se origina o estímulo (tecidos renal, mesentérico ou músculo esquelético) podem estar envolvidas substâncias e mecanismos de proteção diferentes, o que impede a extrapolação dos dados obtidos com um determinado protocolo experimental para os restantes23. Por exemplo, o hexametónio, um antagonista colinérgico, anula o pré-condicionamento induzido pela isquemia mesentérica8 mas não altera o pré-condicionamento causado pela isquemia renal8 ou do músculo esquelético24.
Substâncias implicadas no desenvolvimento do pré-condicionamento isquémico remoto do miocárdio
| Isquemia renal | Isquemia mesentérica | Isquemia esquelética |
| Adenosina76–79 | Bradicinina80,81 | Opioides30,87–89 |
| Canabinoides18 | NO24,31 | |
| CGRP82–84 | Noradrenalina11 | |
| Opioides85,86 | RLO31,40,88 |
CGRP: calcitonin gene-related peptide; NO: óxido nítrico; RLO: radicais livres de oxigénio.
Estes mediadores vão induzir cardioproteção por mecanismos neuronais e/ou humorais, existindo evidências científicas para ambos.
A hipótese neuronal considera que substâncias produzidas no território remoto submetido a isquemia atuam localmente em vias neuronais aferentes. Estas ativam várias vias eferentes induzindo cardioproteção. A favor de um envolvimento de vias neuronais está a demonstração de que o membro sujeito a pré-condicionamento tem de ser enervado, uma vez que o corte do nervo femoral anula ou atenua a proteção conferida pela isquemia transitória do membro inferior25,26. Também o antagonismo dos recetores nicotínicos e a reserpina (fármaco que inibe a captação de neurotransmissores para as vesículas sinápticas) têm um efeito atenuante sobre o PIRM11,14. Os neurónios do núcleo motor dorsal do nervo vago parecem ter um papel fundamental na cardioproteção ao mediar um «reflexo remoto de pré-condicionamento». A ativação deste grupo pré-ganglionar vagal, mesmo sem isquemia muscular, é suficiente para reproduzir o efeito do pré-condicionamento remoto27.
A hipótese humoral, por seu lado, defende que o estímulo isquémico leva à produção de várias substâncias que, entrando em circulação, atingem o miocárdio e exercem aí o seu efeito protetor. A apoiar esta hipótese está a necessidade de reperfusão do órgão à distância antes do início da isquemia coronária para haver proteção8,28. Este facto sugere a existência de um washout de substâncias que têm que atingir o coração através da circulação antes de ocorrer o evento isquémico.
Estudos com transplantes cardíacos em modelos animais também apoiam a hipótese humoral. Em porcos submetidos a PIRM antes de receberem um coração de dador a limitação da área de enfarte após enfarte agudo do miocárdio (EAM) mantém-se no miocárdio transplantado29. Como, neste caso, o coração não recebe enervação extrínseca, é provável que se mantenha em circulação um fator humoral que atua no coração transplantado. Além disso, em preparações experimentais em que é removido o coração do organismo, se este for perfundido com plasma de coelhos sujeitos a PIRM, observa-se um efeito cardioprotetor com redução significativa da área de enfarte30, o que apoia a hipótese de existir uma substância no plasma que causa citoproteção.
Finalmente, independentemente do mecanismo responsável, existe ainda um fenómeno de «memória protetora» no miocárdio uma vez que depois de explantado o coração mantém o efeito do PIRM a que foi sujeito in vivo19.
Mecanismos subcelulares envolvidosApesar de não estar definido que substância(s) induz(em) cardioproteção, o seu efeito a nível subcelular nos cardiomiócitos está melhor caracterizado. O passo inicial de cardioproteção parece envolver a ativação da proteína cínase C (PKC) do miocárdio30 (Figura 1).
Os canais de potássio dependentes do ATP (KATP+) mitocondriais do miocárdio são abertos durante a isquemia transitória do músculo esquelético19,31. Estes encontram-se a jusante da PKC no PIM32 e são dependentes desta para a sua ativação33. Assim, é provável que agonistas da proteína G iniciem uma cascata de sinalização que leva a cardioproteção via ativação da PKC, com abertura subsequente de canais KATP+ mitocondriais.
Fisiopatologicamente, durante a isquemia, com a depleção de ATP, os canais iónicos perdem a sua função e levam à acumulação de Ca2+ intracelular, que por sua vez contribui ainda mais para a diminuição de ATP. A sobrecarga mitocondrial de Ca2+ dá-se principalmente quando à isquemia se segue a reperfusão. Apesar do fornecimento de O2 permitir novamente a produção de ATP, a lesão isquémica e de reperfusão provoca alterações da cadeia de transporte de eletrões das mitocôndrias, o que leva a que estas produzam radicais livres de oxigénio (RLO). O aumento de RLO, de Ca2+ mitocondrial e a diminuição do potencial transmembranar das mitocôndrias que se seguem à isquemia-reperfusão conduzem à abertura do poro de transição de permeabilidade mitocondrial (PTPM)34. O PTPM é um canal mitocondrial transmembranar multiproteico que está ausente ou maioritariamente fechado em condições fisiológicas. A abertura do PTPM em resposta à isquemia leva à libertação de proteínas da mitocôndria para o citoplasma, como o citocromo c. Estas provocam a ativação da cascata das caspases o que, juntamente com os baixos níveis de ATP e alterações da homeostasia iónica, causa rotura da membrana plasmática e morte celular35.
A abertura dos canais mito KATP+, via ativação da PKC, estará envolvida na cardioproteção ao contrariar estes mecanismos. A sua ativação despolariza as mitocôndrias36, logo reduz a captação de Ca2+ e os seus níveis durante a reperfusão, mantendo a integridade dos organelos celulares. Diminui também a atividade dos canais iónicos dependentes de voltagem e conserva ATP durante a isquemia pois reduz a sua hidrólise37,38. Durante o pré-condicionamento aumenta a produção de RLO31 o que, além de possivelmente diminuir a sua concentração durante a isquemia subsequente39, aumenta a produção de enzimas antioxidantes que mantêm a função mitocondrial e diminuem a apoptose40.
A importância da PKC não se restringe ao seu efeito nos KATP+ mitocondriais, atuando também no PMPT. Durante o pré-condicionamento, a PKC forma um complexo com o PTPM e impede a sua abertura, inibindo assim a apoptose dos cardiomiócitos aquando da isquemia-reperfusão41.
Esta sequência subcelular, apesar de ser a teoria dominante, é apenas uma das várias que tentam explicar os mecanismos de pré-condicionamento. O grande número de substâncias envolvidas no PIRM dificulta que se descreva uma teoria unificadora. É possível que estas tenham um efeito sinérgico entre si ou que haja redundância nas vias subcelulares envolvidas na cardioproteção, o que dificulta a determinação da importância relativa de cada uma42.
A fase tardia do pré-condicionamento isquémicoAlém das alterações imediatas, a janela tardia de proteção é aparentemente desencadeada por modificações da expressão de genes envolvidos na resposta do miocárdio a lesões oxidativas e inflamatórias (Figura 1).
As reações inflamatórias estão aumentadas durante a reperfusão. Acumulam-se polimorfonucleares no miocárdio que contribuem para o dano cardíaco por libertação de RLO, proteases e leucotrienos43. Em humanos, o mecanismo de PIRM leva a alterações genéticas anti-inflamatórias nos leucócitos circulantes (supressão de proteínas envolvidas na quimiotaxia, adesão, migração, exocitose, apoptose e imunidade inata) nos primeiros 15minutos após o estímulo e, principalmente, depois de 24horas, aquando da janela tardia de proteção22.
Além do seu papel na modulação da função mitocondrial como referido anteriormente, a PKC está também envolvida na regulação da expressão de genes44 e é possível que seja responsável pelas alterações que ocorrem na janela tardia de proteção.
Quando comparados com cardiomiócitos nos primeiros 15minutos após PIRM, 24horas depois observou-se que a expressão de genes envolvidos na citoproteção (gene Hsp73) e proteção contra o stress oxidativo (genes Hadhsc, Prdx4 e Fabp4) está aumentada, enquanto a de vários genes pró-inflamatórios (genes Egr-1, Dusp 1 e 6) está diminuída21.
Li et al.20 demonstraram o envolvimento do NF-κB no PIRM. O NF-κB é um fator de transcrição redox-sensível que regula vários genes inflamatórios, como a síntase de NO indutível (iNOS) e a cicloxigenase indutível. Apesar de a ativação do NF-κB durante a lesão de isquemia-reperfusão ter efeitos nefastos por aumentar as moléculas de adesão leucocitárias, a produção de citocinas e quimiocinas e o tamanho do enfarte, a sua ativação após o PIRM leva a uma resposta adaptativa no coração em 24horas. Isto acontece porque, paralelamente, há um aumento do seu próprio inibidor, o iNF-κB, que atenua a ativação do NF-κB após a reperfusão, levando à diminuição do tamanho do enfarte e à melhoria da função ventricular esquerda. Depois do pré-condicionamento também se observa um aumento gradual do RNAm da iNOS, que atinge o nível máximo em 24horas. Em ratinhos knock-out para os genes do NF-κB e da iNOS não se verificou adaptação à isquemia45.
Assim, o pré-condicionamento pode diminuir a resposta inflamatória durante a reperfusão porque a indução do NF-κB aumenta o seu próprio inibidor e leva à transcrição da iNOS. A indução da iNOS aumenta o NO produzido. O seu papel na fase tardia não é conhecido, mas provavelmente é dependente de efeitos antiapoptóticos e anti-inflamatórios46,47.
Aplicação à clínica do pré-condicionamento isquémico remotoA indução de cardioproteção através de pré-condicionamento isquémico é uma terapêutica muito promissora, estando atualmente em curso mais de 100 ensaios clínicos registados em clinicaltrials.gov.
A confirmar-se a reprodutibilidade dos resultados laboratoriais na prática clínica, o PIRM pode ser feito, por exemplo, através de ciclos de insuflação-desinsuflação de um braçal num dos membros. Este é um método simples, rápido, virtualmente sem custos, não invasivo e não farmacológico que poderia ser aplicado antes de intervenções (percutâneas ou cirúrgicas) em que seja previsível a interrupção do fluxo coronário.
Pré-condicionamento isquémico remoto do miocárdio como adjuvante da cirurgia ou da intervenção coronária percutâneaO primeiro ensaio clínico a utilizar o pré-condicionamento isquémico remoto envolveu crianças submetidas a cirurgia de correção de cardiopatias congénitas48. Neste estudo, a indução de quatro ciclos de isquemia no membro inferior, através da insuflação de um braçal durante cinco minutos seguida de cinco minutos de reperfusão, permitiu uma redução dos níveis de troponina I no pós-operatório, uma menor necessidade de agentes inotrópicos e uma menor resistência das vias respiratórias.
Posteriormente, num ensaio clínico randomizado com a aplicação de um protocolo de PIRM semelhante desta vez a 57 indivíduos submetidos a cirurgia de revascularização coronária eletiva, foram obtidos resultados semelhantes, com uma redução dos níveis de troponina T nas primeiras 72horas do pós-operatório49.
Desde então, vários estudos foram efetuados em cirurgia de revascularização coronária (com e sem circulação extracorporal), cirurgia de reparação de aneurismas da aorta abdominal, cirurgia de substituição valvular e intervenção coronária percutânea (resumo dos principais estudos clínicos na Tabela 2). O endpoint principal na maioria dos casos foi o nível de libertação de troponina no período pós-operatório, que se associa a pior prognóstico a curto e longo prazo50,51 e se correlaciona com a área de enfarte52,53.
Ensaios clínicos com aplicação do PIRM (duração do tempo de isquemia em minutos)
| Ensaio clínico | Procedimento cirúrgico | Estímulo isquémico | Agentes anestésicos utilizados | Resultados |
| Cheung (2006)48 | Reparação de defeitos cardíacos congénitos em crianças, com recurso a CEC | MI 4x (5I+5R) | Indução com sevoflurano e manutenção com isoflurano + fentanil | Menor nível de troponina I, menor necessidade de agentes inotrópicos às três e seis horas pós-operatórias e menor resistência nas vias aéreas às seis horas |
| Ali (2007)90 | Reparação de aneurisma da aorta abdominal em cirurgia aberta | AIC 2x (10I+10R) 1.° ciclo à direita, 2.° à esquerda | Indução com propofol e remifentanil, manutenção com desflurano | Redução da troponina I e creatinina séricaMenor incidência de EAM e duração do internamento na UCI |
| Hausenloy (2007)49 | Cirurgia coronária eletiva com CEC | MS Direito 3x (5I+5R) | Indução com midazolam, propofol e etomidato ou fentanil, manutenção com propofol | Redução da troponina T às seis, 12, 24 e 48horas pós-operatórias, diminuição em 43% da ASC |
| Hoole (2009)91 | ICP eletiva em adultos com doença coronária | MS 3x (5I+5R) | Não aplicável | Diminuição da cTnI e alterações do segmento ST. Menor incidência de desconforto torácico pós-operatório e eventos cardíacos/cerebrais aos seis meses |
| Hong (2010)55 | Cirurgia coronária eletiva sem CEC | MS 4x (5I+5R) | Indução com midazolam e sufentanil, manutenção com sevoflurano e remifentanil | Redução não estatisticamente significativa da troponina I |
| Li (2010)92 | Substituição valvular por valvulopatia reumática | MI Direito 3x (4I+4R) | Indução com midazolam, manutenção com fentanil e isoflurano | Redução da cTnI e menor incidência de fibrilação ventricular pós-operatória |
| Thielmann (2010)93 | Cirurgia coronária eletiva com CEC em adultos com doença coronária de três vasos | MS Esquerdo 3x (5I+5R) | Indução com sufentanil e etomidato, manutenção com isoflurano ou propofol | Redução da cTnI (máxima, total e ASC) pós-operatória |
| Rahman (2010)94 | Cirurgia coronária eletiva ou urgente com CEC em adultos com doença coronária em mais que um vaso | MS 3x (5I+5R) | Indução com etomidato e fentanil, manutenção com propofol e alfentanil, suplementada com enflurano ou sevoflurano durante a CEC | Sem diferenças entre os grupos |
| Kottenberg (2011)63 | Cirurgia coronária eletiva com CEC em adultos com doença coronária de três vasos | MSE 3x (5I+5R) | Indução com sufentanil e etomidato, manutenção com isoflorano ou propofol | Diminuição da cTnI (máxima, total e ASC) com isoflurano mas não propofol |
| Karuppasamy (2011)95 | Cirurgia coronária eletiva com CEC | MS esquerdo 3x (5I+5R) | Indução com remifentanil e propofol, manutenção com isoflurano antes da CEC e propofol durante e após este | Sem diferenças na cTnI, BNP, CK-MB, concentração venosa central de citocinas ou fatores de crescimento |
| Venugopal (2011)96 | Cirurgia coronária eletiva com CEC | MS Direito 3x (5I+5R) | Indução com midazolam e etomidato ou propofol, manutenção com propofol ou agentes voláteis | Redução da troponina T total nas 72 horas pós-operatórias |
| Ghaemian (2012)97 | ICP electiva em adultos com doença coronária | MI 2x (5I+5R) | Não aplicável | Redução da dor torácica e desvio do segmento ST intra-operatórios, diminuição da troponina T nas 24horas após a intervenção |
| Prasad (2012)98 | ICP eletiva em adultos com doença coronária | MS 3x (3I+3R) | Não aplicável | Sem diferenças na cTnT, hsCPR ou CPE |
| Lomivorotov (2012)99 | Cirurgia coronária eletiva com CEC | MS 3x (5I+5R) | Indução com fentanil e propofol, manutenção com isoflurano e fentanil | Redução da pressão arterial média e da resistência vascular, aumento do volume de ejeção. Sem diferenças nos marcadores de necrose cardíaca |
| Young (2012)100 | Cirurgia coronária eletiva com CEC em doentes de alto risco | MS 3x (5I+5R) | Indução com midazolam e fentanil, manutenção com propofol e isoflurano | Sem diferenças na cTnT, marcadores de lesão renal aguda ou medidas de suporte no internamento |
AIC: artéria ilíaca comum; ASC: área sob a curva; BNP: brain natriuretic peptide; CEC: circulação extracorporal; CK-MB: creatine kinase MB; CPE: células progenitoras endoteliais; cTnI: troponina I cardíaca; cTnT: troponina T cardíaca; EAM: enfarte agudo do miocárdio; hsCPR: proteína C reativa de alta sensibilidade; I: isquemia; ICP: intervenção coronária percutânea; MI: membro inferior; MS: membro superior; R: reperfusão; UCI: unidade de cuidados intensivos.
Contudo, os resultados de todos estudos que aplicaram PIRM não são uniformes, o que pode ser explicado pelas diferenças no protocolo utilizado (local escolhido para pré-condicionamento, número de ciclos, tempo de isquemia/reperfusão), a idade do doente, as comorbilidades associadas, a medicação concomitante e o regime anestésico utilizado durante a cirurgia.
As diferenças nos protocolos de pré-condicionamento e nas populações envolvidas nos ensaios clínicos tornam difícil a comparação entre estes, o que impediu a elaboração de um protocolo de pré-condicionamento capaz de induzir cardioproteção máxima. Num dos estudos, envolvendo doentes com angina estável e doença coronária de um vaso submetidos a intervenção coronária percutânea (ICP) eletiva, a indução prévia de isquemia bilateral dos membros superiores até induziu um aumento da libertação de CK-MB e de troponina I, principalmente nos indivíduos não medicados com estatinas54. Este facto poderá ter sido devido a um aumento do estado inflamatório após a isquemia esquelética que, na ausência de estatinas, potenciou (em vez de proteger) a lesão de isquemia-reperfusão no miocárdio. Além disso, a utilização de isquemia bilateral simultânea dos membros superiores parece ser um estímulo demasiado intenso, e não benéfico, para o organismo, porque a maioria dos outros estudos têm utilizado como estímulo desencadeador a isquemia de apenas um membro. Também é provável que, dadas as diferentes massas musculares dos membros superiores e inferiores, a potência do estímulo desencadeada por cada um deles seja diferente55.
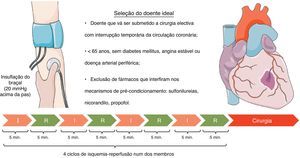
A idade do doente pode ser uma limitação à aplicação desta técnica. Com o envelhecimento, os cardiomiócitos sofrem alterações que resultam na diminuição da função contráctil e perda de mecanismos de cardioproteção53. Assim, o tecido cardíaco perde a sensibilidade ao pré-condicionamento56,57, o que poderá vir a limitar a sua aplicabilidade aos doentes com mais de 65 anos58.
Também as comorbilidades dos doentes podem influenciar a eficácia do pré-condicionamento. Por exemplo, num doente com angina estável os períodos transitórios de isquemia despoletados pelo esforço desencadeiam um mecanismo de pré-condicionamento «natural» a nível cardíaco. De facto, é interessante verificar que dados de vários estudos demonstraram que doentes com angina nas 48horas que antecedem o enfarte têm melhor prognóstico que os restantes58,59. Desta forma, em teoria, nos doentes com angina estável a indução adicional de pré-condicionamento remoto pode não trazer benefícios adicionais. O mesmo será verdade para indivíduos com doença arterial periférica, patologia que simula o pré-condicionamento remoto.
A diabetes mellitus tipo 2 induz um estado crónico basal de resistência à lesão de isquemia-reperfusão. Este fenómeno deve-se ao aumento de proteínas glicosiladas que modulam, entre outras, a função mitocondrial. Uma das consequências é a supressão do PTPM o que, como referido anteriormente, é também um efeito do PIRM. Como contrapartida a cardioproteção adicional induzida pelo pré-condicionamento é atenuada pois envolve os mesmos mecanismos subcelulares. Assim, em doentes diabéticos, o PIRM parece não induzir cardioproteção adicional59.
Os fármacos utilizados pelos doentes também influenciam o efeito do PIRM. As sulfonilureias, por exemplo, são antidiabéticos orais que atuam por inibição dos canais KATP+ mitocondriais. O uso destes fármacos está associado a maior mortalidade após EAM60, o que pode ser decorrente da interrupção do efeito do pré-condicionamento nos cardiomiócitos61 pois, como referido anteriormente, envolve a abertura dos mesmos canais. A exposição crónica a estes agentes hipoglicemiantes torna o miocárdio insensível ao pré-condicionamento61. As novas sulfonilureias, como a gliclazida, mais específicas para as células β pancreáticas, parecem não causar alterações da mortalidade cardiovascular62.
O regime anestésico utilizado durante a cirurgia também pode influenciar a indução de PIRM. Kottenberg et al.63 compararam grupos de doentes sujeitos a PIRM com diferentes regimes anestésicos durante cirurgia coronária com circulação extracorporal. Não encontraram diferenças quando o agente anestésico utilizado para manutenção era propofol, mas quando era aplicado o isoflurano observou-se uma redução dos valores de troponina I. Esta observação é consistente com os dados que sugerem que os agentes anestésicos voláteis têm efeitos pré-condicionantes intrínsecos64. Assim, é possível que a cardioproteção só se torne evidente após um efeito aditivo/sinérgico entre a isquemia esquelética e a anestesia utilizada ou então que seja anulada pelo propofol.
Uma meta-análise recente sobre a aplicação do PIRM na cirurgia cardíaca confirmou uma redução dos níveis de troponina no pós-operatório, embora com uma elevada heterogeneidade, que também pode ser explicada pelo grau de ocultação. Nos estudos com dupla ocultação, esta redução dos marcadores de necrose cardíaca no pós-operatório não foi tão marcada65. Uma outra meta-análise englobando nove ensaios clínicos e 704 doentes, mostrou uma redução estatisticamente significativa da libertação de troponina, mesmo após excluídos fatores de confundimento como o uso de agentes anestésicos voláteis66.
Para estudos futuros é necessário esclarecer vários aspetos do PIRM, nomeadamente o protocolo de pré-condicionamento recomendado (duração, número de ciclos e local do estímulo isquémico a utilizar). Além disso, até ao momento só foram testados os benefícios da resposta imediata e não da resposta tardia.
Com base na análise dos vários estudos clínicos realizados, na Figura 2 propomos um modelo de indução de PIRM que pode ser aplicado a indivíduos que irão ser submetidos a cirurgia cardíaca.
Para se esclarecer definitivamente os benefícios clínicos do pré-condicionamento isquémico está atualmente em curso um ensaio clínico multicêntrico, randomizado, com dupla ocultação (estudo RIPHeart67), que pretende incluir cerca de 2000 doentes submetidos a cirurgia cardíaca tendo como endpoint primário determinar se o PIRM pode reduzir a mortalidade total.
Indução de pré-condicionamento isquémico farmacológicoO conhecimento dos mecanismos fisiopatológicos envolvidos no PIRM pode levar ao desenvolvimento de fármacos que possam reproduzir o seu efeito e, desta forma, criar uma nova estratégia terapêutica para preservar o tecido cardíaco submetido a isquemia. Um dos fármacos alvo de investigação é o diazóxido, um ativador dos canais KATP+ mitocondriais que mostrou, em modelos laboratoriais, reduzir o tamanho de enfarte do miocárdio uma vez que a sua administração antes de um episódio de isquemia atrasa a morte dos cardiomiócitos68. A aplicação deste fármaco em ensaios clínicos, no contexto de pré-condicionamento, ainda é limitada uma vez que existe apenas um ensaio clínico publicado, que mostrou que a administração de diazóxido, aquando da cardioplegia na cirurgia coronária, é segura e melhora a função mitocondrial69.
Contudo, existem já no mercado fármacos que, em parte, devem o seu efeito à ativação dos mecanismos subcelulares do pré-condicionamento isquémico. Um exemplo é o nicorandilo, utilizado na prática clínica como antianginoso. O nicorandilo apresenta um mecanismo de ação duplo: por um lado é um dador de NO, induzindo a vasodilatação das artérias coronárias epicárdicas, por outro abre os canais KATP+ mitocondriais, dilatando os vasos coronários de resistência. No estudo IONA, o tratamento da angina estável com nicorandilo permitiu uma redução do endpoint combinado de mortalidade cardiovascular, enfarte do miocárdio e hospitalização70, o que não parece ser explicado simplesmente pelo seu efeito vasodilatador. É provável que o nicorandilo, através da abertura dos canais KATP+ mitocondriais, faça pré-condicionamento do miocárdio e reduza a lesão de isquemia-reperfusão71.
Aplicação do pré-condicionamento isquémico à transplantação de órgãosUma área aliciante para o uso de PIRM é a transplantação cardíaca. Antes de ser transplantado, o órgão é sujeito a períodos variáveis de isquemia ocorrendo também lesão de isquemia-reperfusão no recetor72. Ensaios pré-clínicos demonstram que, mesmo que o pré-condicionamento seja realizado no recetor antes do transplante, a cardioproteção é transferida para o órgão29.
Apesar dos mecanismos fisiopatológicos conhecidos sugerirem que, teoricamente, o PIRM será uma técnica viável a utilizar antes do transplante, não existem ainda ensaios clínicos a analisar esta questão.
Aplicação à clínica de outras formas de condicionamento isquémico remotoNa última década foram descritos dois novos fenómenos de condicionamento isquémico: o per-condicionamento isquémico e o pós-condicionamento isquémico remoto do miocárdio.
O pós-condicionamento isquémico remoto envolve a aplicação dos ciclos de isquemia-reperfusão num dos membros após a reperfusão do miocárdio. Aplica-se, por exemplo, imediatamente após intervenção coronária percutânea (ICP) primária de doentes com síndrome coronária aguda com supradesnivelamento ST. Nos estudos pré-clínicos até agora realizados parece ter um efeito citoprotetor semelhante ao pré-condicionamento isquémico remoto6.
O per-condicionamento isquémico remoto consiste na imposição do estímulo isquémico durante a isquemia do miocárdio, ainda antes da terapêutica de reperfusão5. Apresenta implicações clínicas aliciantes porque, dada a impossibilidade de prever os eventos isquémicos, possibilita a sua aplicação em situações agudas, como no EAM. Um ensaio clínico publicado em 2010, na Lancet73, avaliou 330 doentes com síndrome coronária aguda com supra ST, submetidos a ICP primária. Estes foram aleatorizados durante o transporte pré-hospitalar em dois grupos: terapêutica standard versus um grupo em que se aplicou PIRM através da insuflação de um braçal no membro superior com quatro ciclos de cinco minutos de isquemia e cinco minutos de reperfusão, antes da ICP primária. Trinta dias após o evento, o volume de miocárdio viável, quando comparado com a área em risco de necrose, estava aumentado no grupo submetido a per-condicionamento isquémico remoto.
Finalmente, a proteção da lesão de isquemia-reperfusão pelo pré-condicionamento não se limita ao miocárdio. Os últimos anos têm visto um crescimento exponencial na investigação deste fenómeno e, atualmente, estão descritos o pré-condicionamento hepático por isquemia muscular esquelética74 e pulmonar por isquemia intestinal transitória75.
ConclusãoO pré-condicionamento isquémico remoto do miocárdio parece fazer parte de uma complexa rede de interações intra e inter-orgãos através da qual o organismo gera estímulos citoprotetores que aumentam a sua resistência à isquemia.
Num futuro próximo espera-se que a aplicação deste conceito em vários contextos clínicos (antes da cirurgia cardíaca, após terapêutica de reperfusão, transplantação cardíaca) permita reduzir a lesão de isquemia-reperfusão e reduzir a área de enfarte.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
FinanciamentoTrabalho financiado pela Fundação Portuguesa para a Ciência e Tecnologia (Projetos, PEst-C/SAU/UI0051/2011 e EXCL/BIM-MEC/0055/2012) através da Unidade de I&D Cardiovascular e pela European Commission Grant FP7-Health-2010 (MEDIA-261409).
Conflito de interessesTrabalho financiado pela Fundação Portuguesa para a Ciência e Tecnologia (Projetos, PEst-C/SAU/UI0051/2011 e EXCL/BIM-MEC/0055/2012) através da Unidade de I&D Cardiovascular e pela European Commission Grant FP7-Health-2010 (MEDIA-261409).