Os autores apresentam dois casos de pericardite purulenta secundária a pneumonia por pneumococos, um deles num doente sem antecedentes patológicos conhecidos. É feita uma sistematização da abordagem diagnóstica ao derrame pericárdico de moderadas dimensões e uma revisão da pericardite purulenta, uma entidade muito rara na era da antibioterapia. A constatação de derrame pericárdico com quadro de febre persistente, com ou sem origem conhecida, fundamentalmente no doente com compromisso imune, mas também no aparentemente saudável, deve levantar-se sempre a possibilidade de pericardite purulenta.
The authors present two cases of purulent pericarditis secondary to pneumococcus pneumonia, a rare entity in the antibiotic era, one of them in an apparently healthy person. A systematized diagnostic approach to moderate pericardial effusion is presented, together with a review of purulent pericarditis. The presence of pericardial effusion with persistent fever with or without known etiology, particularly in the immunocompromised but also in the apparently healthy patient, should always raise the possibility of purulent pericarditis.
O envolvimento patológico do pericárdio cursa fundamentalmente com pericardite e/ou derrame pericárdico (DP) e resulta de variadas etiologias conhecidas (infeciosa, inflamatória, neoplásica, iatrogénica, traumática, metabólica…) ou desconhecidas (idiopática).
Pode acontecer como um processo isolado e independente ou ser um dos elementos, de menor ou maior relevância clínica, que constitui a forma de apresentação de entidades de envolvimento sistémico1.
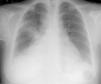
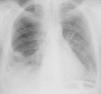
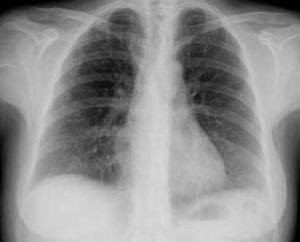
Caso clínicoCaso clínico n.° 1Doente do sexo feminino com 39 anos, sem antecedentes patológicos conhecidos e sem medicação habitual. Recorreu ao serviço de urgência (SU) por quadro com cerca de uma semana de evolução de lombalgia direita e dispneia progressiva para esforços moderados, não referindo febre, tosse ou expetoração. Apresentava-se normotensa com taquiarritmia e ligeira insuficiência respiratória hipoxémica. Analiticamente com padrão inflamatório/infecioso, ECG com taquiarritmia por fibrilhação auricular com resposta rápida (+/-115bpm) e radiografia de tórax com índice cardiotorácico aumentado e infiltrado segmentar no terço médio do hemitórax direito (Figura 1).
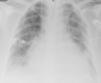
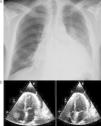
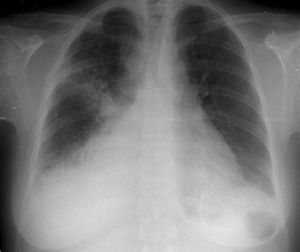
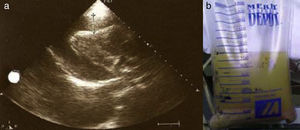
Foi internada com o diagnóstico de pneumonia adquirida na comunidade e iniciou antibioterapia empírica com ceftriaxone e azitromicina. Ao 2.° dia de internamento realizou tomografia computadorizada (TC) torácica que mostrou condensações pneumónicas bilaterais, derrame pleural bilateral e DP, que no ecocardiograma transtorácico (ETT) media 10mm na parede posterior em diástole (PPD), sem sinais de tamponamento cardíaco. Durante o 2.° dia de internamento verificou-se deterioração fulminante do quadro clínico com evolução para choque séptico, pelo que foi transferida para a unidade de cuidados intensivos polivalentes (UCIP). Ao 3.° dia foi identificado nas hemoculturas colhidas à entrada Streptococcus pneumoniae (S. pneumoniae) multissensível e descalada a terapêutica para penicilina G. Necessitou de suporte inotrópico com aminas durante três dias e conseguida a cardioversão química a ritmo sinusal logo no decorrer do 2.° dia de internamento. A partir do 4.° dia o quadro clínico estabilizou do ponto de vista respiratório e hemodinâmico, embora a doente continuasse dependente de ventilação mecânica, febril e sem resolução dos parâmetros analíticos de infeção. A silhueta cardíaca mantinha-se aumentada e em ETT seriados constatou-se agravamento progressivo do DP, que ao 10.° dia media 20mm na PPD com sinais de tamponamento cardíaco (Figuras 2 e 3a), pelo que realizou pericardiocentese diagnóstica e evacuadora.
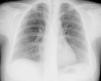
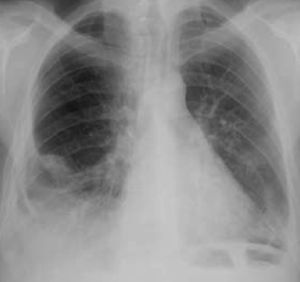
Foram drenados 800cc de conteúdo fibrino-purulento (Figura 3b) cujo exame citobacteriológico direto e cultural foi negativo. A pesquisa de BAAR foi negativa. Os ETT realizados posteriormente revelaram resolução do derrame que se acompanhou de melhoria clínica, radiológica e analítica (Figura 4). Todo o estudo de doenças imunodepressoras foi negativo. Em ETT de follow-up após 12 meses a doente não apresenta padrão constritivo.
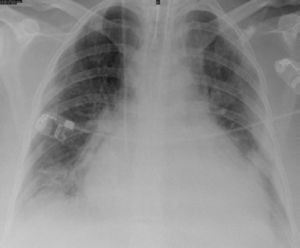
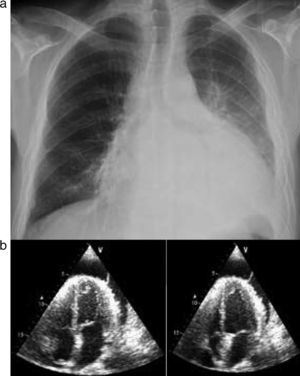
Caso clínico n.° 2Doente do sexo masculino com 33 anos, antecedentes pessoais conhecidos de hipogamaglobulinemia congénita diagnosticada em 2001, alcoolismo crónico e pneumonias de repetição, a última em 2005 e complicada por derrame pleural com necessidade de descorticação. Não fazia qualquer medicação desde 2005 (por abandono). Recorreu ao SU por febre e dispneia de agravamento progressivo nos últimos cinco dias. À admissão apresentava-se febril, prostrado, taquicárdico e hipotenso. Analiticamente com elevação marcada dos parâmetros inflamatórios/infeciosos e na gasometria arterial insuficiência respiratória hipoxémica. Na radiografia de tórax constatou-se aumento marcado da silhueta cardíaca sem alterações pleuro-parenquimatosas, pelo que realizou ETT que confirmou presença de DP com 23mm na PPD com movimentos anómalos e colapso diastólico da parede livre da aurícula direita (Figura 5a e b).
Face ao quadro de choque séptico/obstrutivo foi transferido para a UCIP e realizada pericardiocentese diagnóstica e terapêutica, com drenagem de 700cc de líquido purulento (Figura 6).
A TC torácica realizada após pericardiocentese mostrou moderado DP, pequeno derrame pleural direito e imagem de condensação parenquimatosa dos segmentos superiores e posteriores do lobo inferior esquerdo, com broncogramas aéreos, muito sugestivos de lesão inflamatória.
Do ponto de vista hemodinâmico manteve choque cardiocirculatório com necessidade de suporte inotrópico com aminas até ao 7.° dia. Verificou-se drenagem inicial de líquido pericárdico purulento que evoluiu para sero-fibrinoso. Ao 9.° dia a concomitância de ausência de drenagem pericárdica e evidência de pequeno derrame com 3mm na PPD levou à retirada do dreno. Na admissão havia iniciado terapêutica empírica com ceftriaxone e vancomicina, descalada para penicilina G ao 3.° dia após confirmação de bacteriémia por S. pneumoniae multissensível. A presença de pneumococo com o mesmo padrão de sensibilidade foi confirmada no líquido pericárdico e a pesquisa de BAAR foi negativa. Administração de imunoglobulina durante quatro dias, com boa tolerância e sem intercorrências. Ao 14.° dia com recidiva da febre, o ETT revelou DP com 15mm na PPD e realizou novo TC torácico que mostrou locas de empiema pleural. Foi contactado o Serviço de Cirurgia Torácica dos HUC para resolução cirúrgica, tendo sido submetido a drenagem e descorticação de ambas as pleuras, pericardiotomia e realização de janela pleuropericárdica, com melhoria importante do ponto de vista clínico e analítico (Figura 7).
Em ETT de follow-up passados 12 meses o doente não apresenta padrão constritivo.
DiscussãoDerrame pericárdicoO DP pode desenvolver-se no decurso de pericardite ou surgir como um «parafenómeno» de significado mais ou menos esclarecido numa variedade de desordens sistémicas. A etiologia do DP de moderadas dimensões é em cerca de 29% dos casos idiopática, podendo estar relacionada com iatrogenia (16%), neoplasia (13%), pós-enfarte do miocárdio (8%), uremia (6%), doenças do tecido conjuntivo e da tireoide (5%) ou infeção (2%)2.
No caso de DP que se apresenta de forma aguda com sintomas cardiorrespiratórios a distribuição etiológica é diferente: neoplasia (33%), idiopática (14%), pericardite aguda (12%), trauma (12%), uremia (6%), pós-pericardiotomia (5%) e infeção (5%, que em 4% dos casos é bacteriana)3.
Existem alguns contextos clínicos em que é imperativa a exclusão de DP:
- 1.
Pericardite aguda;
- 2.
Aumento da silhueta cardíaca sem congestão pulmonar;
- 3.
Deterioração hemodinâmica grave após evento coronário agudo, cirurgia cardíaca ou procedimento cardíaco invasivo;
- 4.
Quadro de febre persistente inexplicada com ou sem origem determinada.
A abordagem sistemática ao DP envolve três fases4:
- 1.
Confirmar a sua presença por ETT;
- 2.
Avaliar a sua repercussão hemodinâmica (amplo espectro de gravidade, do mais benigno ao mais catastrófico e que depende do volume que o constitui, da velocidade da sua instalação e da elasticidade do pericárdio);
- 3.
Estabelecer etiologia.
No estabelecimento da etiologia há determinados contextos clínicos mais óbvios que podem justificar uma abordagem não invasiva, como o enfarte do miocárdio recente, hipotireoidismo ou insuficiência renal. Noutras situações o diagnóstico assenta tanto na avaliação clínica como no estudo bioquímico e citobacteriológico do líquido pericárdico ou do próprio pericárdio.
A pericardiocentese tem um baixo valor diagnóstico (cerca de 6%) em contexto de pericardite aguda. Nos casos de derrame crónico volumoso a análise do líquido pericárdico permite um diagnóstico definitivo em 36% e provável em 40% dos casos5.
Há indicação formal para realizar pericardiocentese (guiada por ecografia ou fluoroscopia) no caso de6:
- 1.
Tamponamento cardíaco;
- 2.
Derrame com mais de 20mm que não responde após uma semana de tratamento conservador com AINE;
- 3.
Suspeita clínica de pericardite purulenta, tuberculosa ou neoplásica.
A pericardite purulenta (PP) define-se como uma infeção localizada no espaço pericárdico que produz um líquido que é micro ou macroscopicamente purulento e pode ser primária (excecionalmente rara) ou secundária a outro processo infecioso concomitante. Na PP secundária o espaço pericárdico pode ser invadido por cinco mecanismos patogénicos7:
- •
Continuidade com foco intratorácico;
- •
Disseminação hematogénea;
- •
Extensão de foco no miocárdio;
- •
Lesão perfurante ou cirurgia;
- •
Extensão de foco subdiagramático.
O pneumococo está mais vezes associado à via da disseminação direta por foco intratorácico, ficando o Staphylococcus aureus (S. aureus) mais vezes implicado na via hematogénea.
A PP é hoje uma entidade francamente invulgar e acontece mais frequentemente em doentes com doença prévia do pericárdio sujeitos a quimioterapia, submetidos a cirurgia cardíaca ou em diálise, tendo como fatores predisponentes a imunossupressão, alcoolismo e trauma torácico5. Antes do advento da antibioterapia era com frequência uma complicação da pneumonia, endocardite, meningite e de outras infeções mais ou menos graves (osso, pele e ouvido)7.
Uma revisão retrospetiva realizada em Espanha, de 1972-1991, numa população hospitalar de 593 601 doentes, encontrou 33 casos de PP, mas só 19 (57%) com diagnóstico realizado em vida, fundamentalmente porque não é considerado8. Na Tabela 1 é apresentada a revisão da literatura em que é mencionada a etiologia, bacteriologia, comorbilidades associadas, forma de tratamento e resultado.
Pericardite purulenta: revisão sumária da literatura
| Autor e referência | Número de doentes | Comorbilidades identificadas | Local de origem infeciosa | Bacteriologia | Forma de tratamento | Resultado |
| Sagrista-Sauleda et al. | 33 | Alcoolismo, artrite reumatoide, colite ulcerosa (n=5) | Pneumonia (n=10)Abcesso peritonsilar, abcesso cervical, mediastinite (n = 5)Sépsis (pele, cavidade oral, nutrição parentérica, neoplasia do cólon) (n = 4)Infeção periododontal, abcesso oral, mediastinite (n = 3)Infeção das vias biliares (n = 3)Infeção das vias urinárias (n = 2)Sépsis com ponto de partida em cateter, incluindo por pacemaker provisório (n = 2)Abcesso subfrénico pós-traumático (n=1)Meningite (n=1)Mastoidite (n=1)Transplante hepático (n=1) | Peptococcus spp. Anaeróbios Gram (-) (n=1)Streptococcus milleri (n = 1)Streptococcus pneumoniae (n = 2)Streptococcus mitis, Bacteroides spp., anaeróbios Gram (-) (n = 1)Staphylococcus aureus (n = 2)Clostridium septicum (n = 1)Pseudomonas aeruginosa (n = 2)Escherichia coli (n = 1)S. aureus, S. mitis, P. aeruginosa (n = 1)Klebsiella spp., Enterococcus faecalis, Proteus spp. (n = 1)E. coli, Klebsiella spp. (n = 1)E. coli, anaeróbios (n=1) | Pericardiocentese seguida de pericardiectomia (n=12)Pericardiectomia, abordagem inicial (n = 4)Pericardiocentese (n = 2)Diagnóstico post-mortem (n = 14) | Morte (n=3; insuficiência renal n=1, complicações devidas a patologia pericárdica n=2) |
| Kauffman et al. | 118 | Alcoolismo crónico (n=2), Hipogamaglobulinemia (n=1) | Pneumonia (n=81)Pneumonia e empiema (n=58)Otite média (n=6)Artrite (n=2)Abcesso subcutâneo (n=2)Meningite (n=1)Endocardite (n=1)Nenhuma identificada (n=2)N.B. Alguns doentes têm mais de um local de infeção | S. pneumoniae (toda a amostra) | Nenhum (n=52)Pericardiectomia (n=49)Pericardiectomia + antibioterapia (n=10)Pericardiocentese (n=1)Pericardiocentrse + antibioterapia (n=1) | Morte (n=64, que inclui todos os doentes não submetidos a tratamento, 19 doentes submetidos apenas a pericardectomia e 1 submetido apenas a pericardiocentese) |
| Rubin et al. | 26 | Insuficiência hepática (n=2)Uremia (n=1)Diabetes mellitus (n=3)Leucopenia (n=1)Queimaduras de pele do 3.° grau (n=2)Leucemia linfoblástica aguda (n=1)Imunosupressão iatrogénica (n=1) | Pós-cirurgia torácica por perfuração esofágica (n=2) Infeção de ferida pós-cirurgia torácica (n=6)Pneumonia (n=6)Abcesso mediastínico (n=1)Endocardite infeciosa (n=3)Abcesso intramiocárdico (n=2)Bacteriemia (n=6) | S. aureus (n=8)S. pneumoniae (n=2)Haemophilus influenzae (n=2)Neisseria meningitidis (n=1)P. aeruginosa (n=1)Bacteroides spp. (n=1)Salmonella typhimurium (n=1)Nocardia asteroides (n=1)S. mitis (n=1)Infeções bacterianas mistas (n=2)Candida spp. (n=5) | Antibioterapia + pericardiocentese (n=11)Antibioterapia sem pericardiocentese (n=15) | Morte (n=15, nos doentes submetidos apenas a antiobioterapia) |
| Klacksmann et al. | 200 | Doença renal crónica (n=16)Neoplasia maligna (13)Enfarte agudo do miocárdio (n=2)Diabetes, doenças mieloproliferativas (n = 10)Anemia de células falciformes (n = 3) | Pneumonia (n=104)Bacteriemia (n=44)Endocardite/abcesso miocárdico (n=30)Lesão perfurante torácica (n = 18)Lesão supurativa infradiafragmática (n = 4) | S. pneumoniae (n=69)Sthapylococcus spp. (n=38)Streptococcus spp. (n=21)Proteus spp., E. coli, Pseudomonas spp., Klebsiella spp. (n=25)Salmonella spp./Shigella spp. (n = 4)N. meningitidis (n = 5) | Diagnóstico post-mortem (n=200) | Morte (toda a amostra) |
A constatação de um quadro séptico num doente com uma doença de base conhecida que justifique a presença de DP acrescenta maior dificuldade em obter o diagnóstico em tempo útil2.
A confirmação do diagnóstico só pode ser feita por pericardiocentese, que é nestes casos terapêutica. O aspeto macroscópico do líquido faz o diagnóstico, que tem características bioquímicas de exsudado e que deve ser sujeito a exame microscópico direto e cultural para bactérias, fungos e BAAR.
O tratamento passa imperiosamente pela drenagem do espaço pericárdico e deve ser articulado com antibioterapia sistémica, numa primeira fase empírica (vancomicina + ceftriaxone ou imipenem ou meropenem ou piperacilina-tazobactam e em doentes imunodeprimidos deve ser adicionado também fluconazol) e depois dirigida em função dos resultados microbiológicos (não há benefícios na antibioterapia local). A antibioterapia deve ser mantida pelo menos 28 dias e/ou até apirexia e ausência de sinais analíticos de infeção.
A estratégia para conseguir a drenagem completa do espaço pericárdico deve ser apropriada ao tecido humano e técnico da instituição que acolhe o doente6,11:
- 1.
Pericardiocentese. É o método mais simples, mais rápido, mas muitas vezes ineficaz para drenar líquido espesso, loculado e rico em fibrina. É também o que evolui mais frequentemente para pericardite constritiva. A infusão intrapericárdica de fibrinolíticos pode aumentar a sua eficácia terapêutica, mas a sua utilização pode associar-se a complicações e não é em regra recomendada12.
- 2.
Pericardiotomia (janela pericárdica, se procedimento isolado, por via subxifoideia). É a via recomendada pela Sociedade Europeia de Cardiologia nas suas linhas de orientação, pois é a abordagem que se associa a maior percentagem de sucesso com menor incidência de pericardite constritiva.
- 3.
Pericardiectomia. Associa-se a uma mortalidade de 8%, mas é a abordagem que resolve todas as situações, mesmo as mais complicadas (adesões, locas ou infeção persistente)6.
Sem a drenagem do espaço pericárdico, a PP progride inexoravelmente para a morte. Nos doentes atempadamente diagnosticados e corretamente tratados a mortalidade cifra--se pelos 40%, em regra por tamponamento cardíaco, choque séptico ou constrição. A mortalidade aumenta quanto mais tardio for o diagnóstico e subsequente início da terapêutica e é mais frequente na infeção por S. aureus e no doente desnutrido11.
ConclusõesA pertinência destes dois casos clínicos prende-se substancialmente na questão da abordagem ao doente séptico com DP. A constatação de derrame com quadro de febre persistente, com ou sem origem conhecida, deve levantar sempre a possibilidade de PP. Esta afirmação é válida tanto no doente com compromisso imunitário como no indivíduo aparentemente saudável que, apesar de não ter condição predisponente, tem o risco decorrente do quadro de pneumonia – a principal causa identificada de PP em várias séries2,7-10. Além disso, apesar da PP ser um diagnóstico tanto mais provável quanto mais próximo for o foco infecioso primário do pericárdio, a existência de fenómenos embólicos sépticos a partir dum foco supurativo permite a disseminação pericárdica, miocárdica ou mediastínica por via das artérias brônquicas sem envolvimento da restante circulação sistémica7, constituindo este o mecanismo mais provável de PP no caso 1.
O reconhecimento atempado desta entidade rara e a instituição de abordagem terapêutica adequada constituem os pilares do sucesso na terapêutica desta entidade rara, mas potencialmente letal.
Conflito de interessesOs autores declaram não haver conflito de interesses.