Insuficiência cardíaca direita recorrente após pericardectomia pode ser causada por pericardectomia incompleta, constrição recorrente, disfunção diastólica ou atingimento miocárdico. A identificação de pericardite constritiva (PC) recorrente após pericardectomia é desafiante, uma vez que, muitas das características da constrição podem estar ausentes e não existem ainda guidelines de diagnóstico ou terapêutica para a abordagem desta patologia dada a sua extrema raridade.
Os autores descrevem o caso de um homem, 59 anos de idade, com antecedentes de pericardectomia após PC tuberculosa em 1984, internado para esclarecimento de um quadro clínico dominado por sinais e sintomas de insuficiência cardíaca direita. Após estudo complementar foi diagnosticado PC recorrente. Dada a escassez de casos reportados sobre esta patologia, foram discutidas possíveis abordagens terapêuticas nomeadamente uma segunda pericardectomia, transplante cardíaco e terapêutica médica.
Recurrent right‐sided heart failure after pericardiectomy may be caused by incomplete pericardiectomy, recurrent constriction, diastolic dysfunction or myocardial involvement. Identifying recurrent constrictive pericarditis (CP) in patients who have recurring symptoms after pericardiectomy is challenging, since the characteristic Doppler echocardiographic features may not be present if a portion of the ventricles are free of constricting pericardium, and there are no diagnostic or treatment guidelines for management of recurrent CP.
The authors report the case of a 59‐year‐old man with a history of pericardiectomy for tuberculous CP in 1984, admitted to our hospital with signs and symptoms of right heart failure. After a complete diagnostic workup, recurrent CP was diagnosed. Given the scarcity of cases reported on this disease, three possible therapeutic approaches are discussed: a second pericardiectomy, heart transplantation and medical therapy.
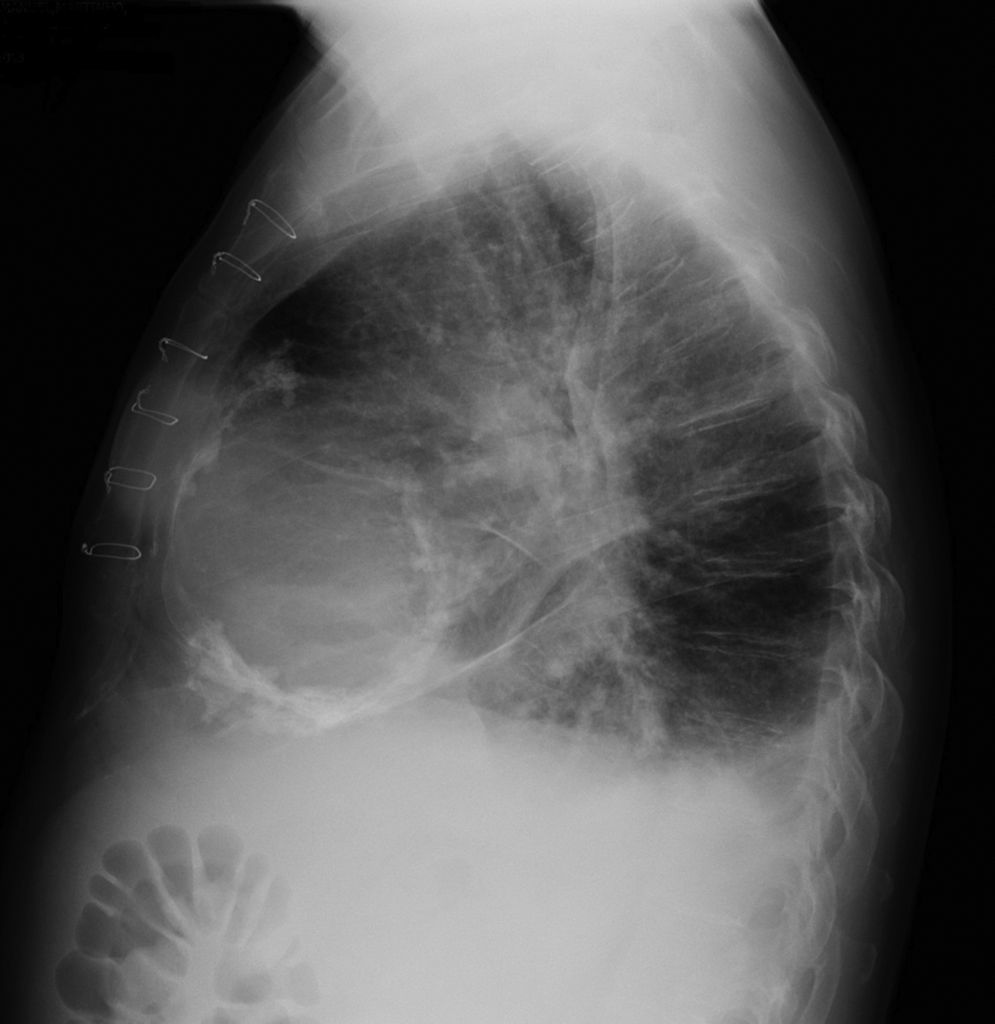
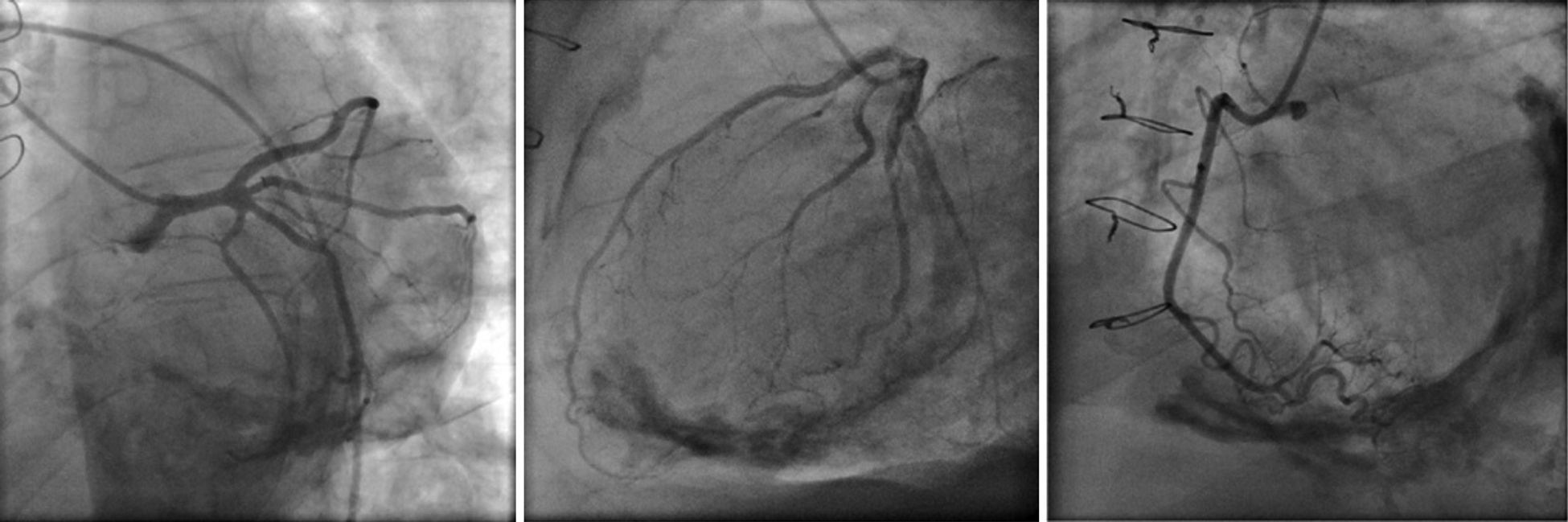
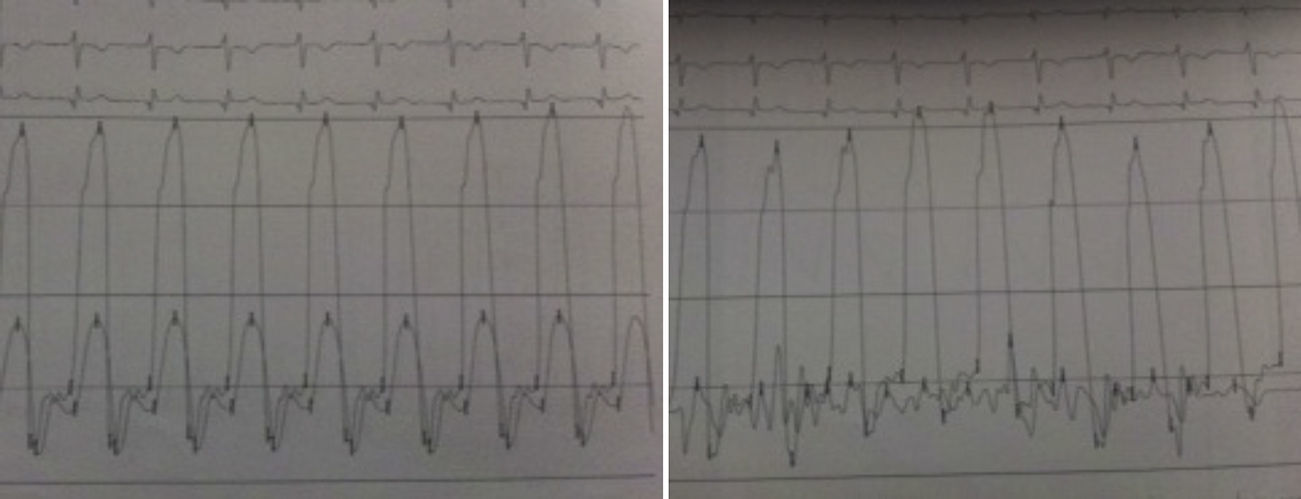
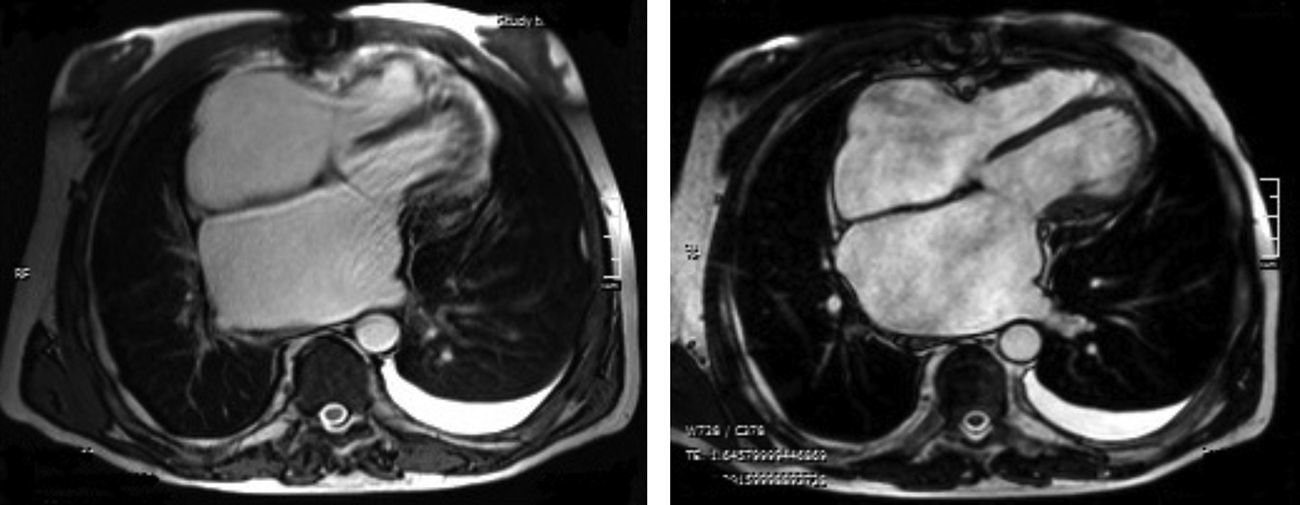
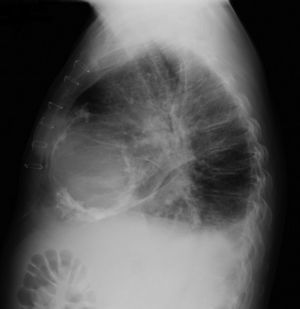
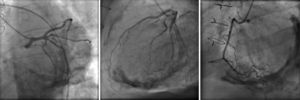
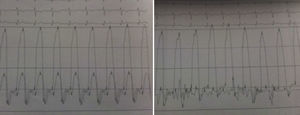
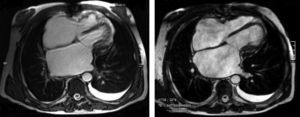
Os autores descrevem o caso de um homem, 59 anos de idade, com antecedentes de tuberculose aos 12 anos e posteriormente pericardite constritiva (PC) de etiologia tuberculosa, submetido a pericardectomia a 7/11/84. O relatório cirúrgico apenas referia pericardectomia por esternotomia mediana, sem mais detalhes. Apresentava, também, como antecedentes fibrilhação auricular (FA) permanente, diabetes mellitus tipo II, hipotiroidismo e história de múltiplos episódios de vindas ao serviço de urgência (SU) por quadros clínicos interpretados como insuficiência hepática, medicado em ambulatório com varfine, bisoprolol 2,5mg id, metformina 1000mg 2i.d. e levotiroxina 0,1mg i.d. Admitido novamente no SU em setembro de 2013 por desconforto abdominal, edemas periféricos e ascite. Ao exame físico apresentava ingurgitamento jugular, impulso apical mal definido, S1 e S2 audíveis e arrítmicos, sem sopros cardíacos, diminuição do murmúrio vesicular na metade inferior do hemotórax direito, hepatomegalia palpável e refluxo hepatojugular presente, ascite e edema dos membros inferiores. Foi internado no serviço de medicina interna. Durante o internamento teve episódio de dor retroesternal tipo aperto com irradiação para ambos os membros superiores associado a hipersudorese, pelo que foi pedida colaboração da cardiologia. Foi transferido para o serviço de cardiologia onde completou estudo complementar. O eletrocardiograma revelou FA com padrão de bloqueio de ramo direito, desvio direito do eixo elétrico e aumento do intervalo QTc (470msc). Analiticamente apresentava hemoglobina de 13,0g/dL; função renal e ionograma sem alterações; troponina I seriada negativa; pro BNP 313pg/mL; proteína C reativa negativa; pró calcitonina negativa; aumento da fosfatase alcalina (178U/L) e GGT (109U/L); TGO e TGP sem alterações; bilirrubina total normal; diminuição das proteínas totais (4,6g/dL) e da albumina (1,83g/dL); sem alterações no perfil eletroforético das proteínas; estudo virológico negativo (HIV, HBV e HCV); estudo imunológico sem alterações (ANCA, imunoglobulinas e complemento); função tiroideia normal. A ecografia abdominal demonstrou fígado de dimensões aumentadas, com estrutura difusamente heterogénea, sugerindo quadro de hepatopatia crónica, ingurgitamento da veia cava inferior e supra‐hepáticas. A telerradiografia do tórax revelou calcificação da silhueta cardíaca e derrame pleural à direita (Figura 1). O ecocardiograma demonstrou dilatação severa da aurícula esquerda (área de 44cm2) e ligeira da aurícula direita (25cm2); restantes cavidades cardíacas e raiz dos grandes vasos de dimensões normais; espessura do ventrículo esquerdo normal; movimento anormal do septo interventricular; função sistólica do ventrículo esquerdo preservada (FEVE 61%); sem alterações da contratibilidade segmentar; fluxo diastólico mitral compatível com padrão restritivo (razão E/E¿ média de 19); função sistólica do ventrículo direito preservada (TAPSE de 17mm); sem alterações valvulares significativas; PSAP estimada em 45mmHg; pericárdio diafragmático espessado por fibrose; dilatação da veia cava inferior e veias supra‐hepáticas. A angiografia coronária revelou ausência de doença coronária (Figura 2). O cateterismo demonstrou dados hemodinâmicos compatíveis com fisiologia constritiva: curva ventricular tipo dip and plateau; equalização das pressões telediastólicas biventriculares; curva direita com descida Y pronunciada; hipertensão pulmonar ligeira (PAP – 45mmHg) (Figura 3). A ressonância magnética (RM) mostrou alguns focos de hipossinal na dependência do pericárdio inferior no contexto de calcificações residuais do pericárdio com aparente componente restritivo ventricular associado, constatado pela hipomotilidade do miocárdio nas sequências funcionais dinâmicas (Figura 4).
Após início de terapêutica diurética intensiva, restrição de sal e fluidoterapia apresentou evolução clínica favorável com resolução do quadro congestivo. Foi discutido o caso com a cirurgia cardíaca sobre a possibilidade de nova pericardectomia, no entanto, após ponderados riscos e benefícios de uma nova cirurgia, foi decidido não realizar o procedimento (30 anos após a primeira). Outra hipótese que foi discutida foi a possibilidade de transplante cardíaco, pelo que realizou provas funcionais respiratórias (síndrome obstrutiva moderada), no entanto, esta estratégia foi protelada para caso o doente apresente sintomas classe III/IV da New York Heart Association (NYHA) refratários à terapêutica médica. O doente teve alta orientado para a consulta de cardiologia mantendo terapêutica diurética, permanecendo em classe I/II da NYHA; sem registo de novos internamentos por descompensação até ao momento; tem ainda pedida uma prova de esforço cardiopulmonar para melhor caraterização da capacidade funcional.
DiscussãoA PC é uma patologia rara, cujo diagnóstico permanece um desafio clínico1,2. É definida como o estádio terminal de um processo inflamatório que envolve o pericárdio, sendo que virtualmente qualquer processo inflamatório pode causar constrição. Nos países ditos desenvolvidos as principais causas de PC são idiopática, pós‐cirúrgica e radiação1. A tuberculose era uma das etiologias mais frequentes, no entanto, dada a eficácia da terapêutica antibacilar a incidência de PC tuberculosa tem vindo a decrescer, em oposição ao que acontece nos países em desenvolvimento em que a tuberculose permanece como uma das etiologias mais frequentes1,2. Nos países africanos é, também, muito frequente a associação entre PC tuberculosa e doentes HIV‐positivos1,3.
A constrição evolui, geralmente, durante anos e o desfecho final é o desenvolvimento de espessamento fibrótico do pericárdio, muitas vezes calcificado com adesões entre o folheto parietal e visceral resultando num pericárdio rígido e não distensível, responsável pela restrição do enchimento diastólico das câmaras cardíacas1,2. Esta restrição conduz à elevação e equalização das pressões de enchimento nas câmaras cardíacas e veias sistémicas e pulmonares. No início da diástole o enchimento ventricular é anormalmente rápido causado pela elevação da pressão auricular e pela acentuada sucção ventricular; durante a meso e telediástole o enchimento ventricular cessa abruptamente quando o volume intracardíaco atinge o limite imposto pelo pericárdio espessado; como resultado final praticamente todo o enchimento ventricular ocorre no início da diástole; advindo em congestão venosa sistémica1,4.
A apresentação clínica da PC é dominada por sinais e sintomas de insuficiência cardíaca direita. O estádio inicial é caracterizado por edemas periféricos, desconforto abdominal e algum grau de congestão hepática. Com a progressão da doença surge ascite, anasarca e icterícia. Sinais e sintomas de elevação da pressão venosa pulmonar como dispneia, tosse e ortopneia também podem surgir, assim como FA e insuficiência tricúspide. Num estádio ainda mais avançado poderá coexistir cansaço e caquexia por baixo débito cardíaco1,2. Ocasionalmente pode ocorrer angor associado a doença coronária ou compressão da coronária pelo pericárdio espessado2.
Os achados no exame físico incluem a elevação marcada da pressão venosa jugular com uma onda y descendente proeminente e rapidamente colapsada; sinal de Kussmaul (aumento da pressão venosa na inspiração); pulso paradoxal (queda >10mmHg da pressão arterial sistólica durante a inspiração) presente até um terço dos doentes com PC; impulso apical mal definido; sons cardíacos poderão estar hipofonéticos; knock pericárdico (som diastólico precoce no bordo esquerdo do esterno ou ápex, provocado pela cessação abruta do enchimento ventricular); hepatomegalia; ascite; icterícia; eritema palmar; aranha vascular e edema dos membros inferiores. Como referido anteriormente num estádio avançado poderão também estar presentes sinais de caquexia e atrofia muscular1,2.
O diagnóstico diferencial inclui embolia pulmonar; doença pulmonar obstrutiva crónica; insuficiência hepática e miocardiopatia restritiva5. O diagnóstico diferencial com miocardiopatia restritiva é o mais difícil e é extremamente importante, uma vez que a estratégia terapêutica é completamente diferente.
Na PC a telerradiografia do tórax pode revelar calcificação pericárdica numa minoria do doentes e deve levantar a suspeita da PC tuberculosa1,2. No ecocardiograma transtorácico é possível observar o espessamento pericárdico, movimento posterior abruto do septo interventricular no início da diástole (chamado bounce septal), a dilatação da veia cava inferior sem colapso inspiratório e das veias supra‐hepáticas e a predominância do enchimento precoce ventricular. O Doppler pode demonstrar o aumento do fluxo transmitral na expiração (variação >25%); morfologia do fluxo restritivo e tempo de desaceleração <160mseg; aumento da velocidade e tempo de ejeção pulmonar na inspiração; aumento da inversão do fluxo diastólico na expiração >25% do fluxo anterógrado nas veias supra‐hepáticas6. Na RM é possível observar o espessamento e as calcificações pericárdicas1,2.
O cateterismo cardíaco permite documentar o efeito hemodinâmico da PC e estabelecer o diagnóstico diferencial com miocardiopatia restritiva. Na PC as pressões das aurículas e diastólica dos ventrículos estão elevadas e em equilíbrio (cerca de 20mmHg). A curva de pressão na aurícula direita tem a típica configuração em M ou W, resultante da existência de onda x descendente sistólica preservada, de uma onda y descendente diastólica proeminente e das ondas a e v de pequena e idêntica amplitude. As curvas de pressão diastólicas dos ventrículos apresentam uma descida no início da diástole seguida de um planalto (dip and plateau). A PSAP é, geralmente inferior a 45‐50mmHg. O volume de ejeção é habitualmente reduzido, mas o débito cardíaco em repouso mantem‐se até estádios mais avançados devido à taquicardia compensatória1,2.
As guidelines da Sociedade Europeia de Cardiologia recomendam como único tratamento definitivo para a PC a pericardectomia, que pode ser realizada por uma abordagem ântero‐lateral ou esterno mediana. A pericardectomia pode ainda ser total ou parcial. Chowdhury et al. fizeram um5 estudo retrospetivo comparativo dos resultados cirúrgicos da peridardectomia total versus parcial e verificaram que houve um benefício significativo na sobrevivência e na classe funcional com a pericardectomia total7.
A pericardectomia total é definida como a excisão alargada do pericárdico anteriormente com extensão a ambos os nervos frénicos e incluindo o pericárdio diafragmático. A parcial é definida como qualquer extração pericárdica que não cumpre os critérios de pericardectomia frénico a frénico8.
Ling et al. avaliaram os doentes da Mayo Clinic submetidos a pericardectomia entre 1985‐1995 e compararam com um cohort histórico, verificando uma diminuição da taxa de mortalidade perioperatória (14 versus 6%; p=0,011), uma diminuição na idade média na altura da pericardectomia (61 versus 45 anos), um aumento da prevalência da PC por radiação e uma sobrevida a longo prazo não tão favorável como era esperado. Nesse estudo as principais causas de mortalidade perioperatória foram: estado de baixo débito cardíaco, sépsis, complicações hemorrágicas major, insuficiência renal e respiratória. Relativamente à menor sobrevida a longo prazo, foram identificados três fatores preditivos de eventos tardios: classe da NYHA, idade e a PC por radiação9.
Um estudo retrospetivo realizado por Bertog et al. com 163 doentes submetidos a pericardectomia num período de 24 anos concluiu que nesses doentes os únicos fatores preditores de eventos tardios foram: PC por radiação, idade, disfunção ventricular esquerda, elevação da pressão arterial pulmonar, creatinina e sódio sérico8. Já George et al. concluíram no seu estudo que a PC por radiação, hiperbilirrubinemia e hipoalbuminemia foram fatores preditores de eventos tardios após pericardectomia10.
Insuficiência cardíaca direita após pericardectomia pode ser causada por pericardectomia incompleta ou parcial, constrição recorrente por cicatriz do tecido exuberante, disfunção diastólica ou extensão da calcificação do pericárdio ao miocárdio7,9. Pode, também, ter origem noutras etiologias, nomeadamente miocardiopatia ou hipertensão pulmonar7.
A identificação de constrição em doentes com sintomas recorrentes após pericardectmia é desafiante, dado que muitas das características da constrição no ecocardiograma e Doppler podem estar ausentes porque parte dos ventrículos está livre do pericárdico constritivo. Outro fator a ter em conta é que muitos destes doentes estão sob terapêutica diurética agressiva e podem ter outra doença cardíaca subjacente (p. ex. doença coronária) que pode mascarar os sinais e sintomas. A RM e o cateterismo cardíaco são essenciais para estabelecer o diagnóstico7.
Uma das possíveis abordagens terapêuticas à PC recorrente após pericardectomia é uma segunda pericardectomia, embora os riscos e benefícios da segunda cirurgia ainda não estejam bem definidos. Cho et al. analisaram os resultados de uma segunda pericardectomia em 41 doentes admitidos por PC recorrente entre 1993‐2010 e dividiram os doentes em dois grupos consoante o intervalo de tempo entre a primeira e a segunda cirurgia (<1 ano ou >1 ano), verificando que a sobrevida aos cinco anos era significativamente superior no grupo com o menor intervalo de tempo entre as cirurgias (73 versus 29%, p=0,032). A análise multivariada demonstrou que a classe funcional da NYHA foi, também, um importante fator preditivo de sobrevivência7. Os autores enfatizaram a importância da resseção completa na primeira cirurgia dado o aumento significativo da mortalidade com a repetição da pericardectomia; por outro lado o mau prognóstico dos doentes reoperados um ano ou mais após a primeira pericardectomia poderá ser explicado por disfunção diastólica progressiva e atingimento miocárdico7.
Concluindo, a PC é uma doença heterogénea com aumento de incidência de algumas etiologias na era atual, nomeadamente, a radiação e a cirurgia cardíaca. Embora a pericardectomia seja realizada frequentemente e tenha resultados excelentes em alguns doentes, esta pode não ser a cura ou não apresentar bons resultados a longo prazo na PC avançada ou por radiação9. Assim, é essencial procurar outras alternativas terapêuticas, designadamente, o transplante cardíaco que deve ser considerado em doentes selecionados sem história de neoplasia ativa e com boa reserva pulmonar9. Sendo a PC rara, a PC recorrente é ainda mais rara; não existindo ainda guidelines de diagnóstico ou terapêutica para a abordagem desta patologia. Assim, perante a necessidade de definir a melhor estratégia nestes doentes são necessários mais estudos e um longo caminho de investigação a percorrer.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos do seu centro de trabalho acerca da publicação dos dados de pacientes.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesOs autores declaram não haver conflito de interesses.