A não compactação do miocárdio é uma anomalia congênita rara, definida por excessiva trabeculação do ventrículo esquerdo, profundos recessos intertrabeculares e uma camada compactada fina, devido à interrupção do processo de compactação das fibras miocárdicas durante a fase embriogênica. Relatamos um caso de uma paciente jovem com miocárdio não compactado isolado evoluindo para insuficiência cardíaca refratária, com necessidade de uso de oxigenação por membrana extracorpórea seguido de transplante cardíaco de emergência.
Left ventricular noncompaction is a rare congenital anomaly characterized by excessive left ventricular trabeculation, deep intertrabecular recesses and a thin compacted layer due to the arrest of compaction of myocardial fibers during embryonic development. We report the case of a young patient with isolated left ventricular noncompaction, leading to refractory heart failure that required extracorporeal membrane oxygenation followed by emergency heart transplantation.
A não compactação do miocárdio é uma anomalia rara, definida por excessiva trabeculação do ventrículo esquerdo (VE), profundos recessos intertrabeculares e uma camada compactada fina, devido à interrupção do processo de compactação das fibras miocárdicas durante a fase embriogênica ou adquirida por remodelamento cardíaco, principalmente em atletas jovens, grávidas e anemia falciforme1. Essa anomalia geralmente está associada a outros defeitos cardíacos congênitos1,2. No caso do miocárdio não compactado (MCNC) isolado (MCNCI), sua causa é desconhecida e ainda não foi identificado qualquer fator que possa justificar uma interrupção na compactação miocárdica ventricular1,3.
Essa alteração da formação do coração cursa com uma ampla variedade de manifestações clínicas, desde pacientes assintomáticos, a outros com início de sintomas em qualquer idade, como insuficiência cardíaca (IC), fenômenos tromboembólicos e arritmias cardíacas, conferindo a essa doença um mau prognóstico. O MCNC ocorre em 0,81 por 100 000 lactentes/ano, em 0,12 casos por 100 000 crianças/ano e em adultos tem uma prevalência de 0,014%1,3. Em relação a histopatologia, não há achado específico, além da presença de fibrose4.
Descrevemos um caso de uma paciente com MCNCI evoluindo com IC refratária e necessidade de transplante cardíaco (Tx) de emergência.
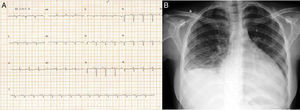
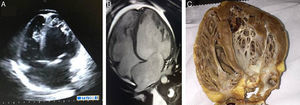
Relato do casoTSA, 14 anos, sexo feminino, branca, solteira, natural e procedente do município de Barueri – SP, atleta de handebol, antecedente de pai falecido há seis meses devido a miocardiopatia dilatada idiopática (sem estudo anatomopatológico), procurou pronto‐socorro do Instituto Dante Pazzanese de Cardiologia com queixa de dispneia progressiva há 15 dias e, no momento da admissão, queixando‐se de dispneia em repouso. Exame físico de entrada: REG, consciente, orientada, ausculta pulmonar com estertores crepitantes bilateral em terço inferior e ausculta cardíaca com ritmo de galope (presença de B3), sem sopros, edema de membros inferiores (+/4+), PA=100x70mmHg e fígado a 7cm do rebordo costal direito. Eletrocardiograma de 12 derivações (Figura 1A): ritmo sinusal, QRS estreito, baixa voltagem de QRS em plano frontal, sobrecarga atrial esquerda, sugestivo de sobrecarga atrial direita, alteração de repolarização ventricular difusa, desvio do eixo para direita (–170 graus) sem preencher critérios para bloqueio divisional póstero‐inferior esquerdo. Radiografia de tórax: aumento importante de área cardíaca (Figura 1B). Ecocardiograma bidimensional (Figura 2A): átrio esquerdo de 38mm, aumento importante de átrio direito, VE dilatado (60mm/68mm), fração de ejeção (FE) de VE de 25%, veia cava superior de 14mm, insuficiência tricúspide com dilatação do anel (30mm), disfunção sistólica de ventricular direita moderada. Presença de imagem hiperrefringente arredondada no átrio esquerdo medindo 17x14mm, correspondendo a trombo, derrame pericárdico discreto, pressão arterial pulmonar =40mmHg (hipertensão pulmonar moderada). Ressonância magnética de coração (Figura 2B): disfunção biventricular importante, apresentando aumento da musculatura não compactada, principalmente junto a parede anterior e ápice, apresentando relação de massa não compactada sobre massa compactada do VE de 5,5. Ausência de realce tardio sugestivo de fibrose miocárdica. VE 67mm/71mm. FEVE 8%, FEVD 2%. Não foi realizado cinecoronarioangiografia, Holter ou estudo eletrofisiológico. Laboratório: enzimas cardíacas sem alterações, peptídeo natriurético tipo B (NT‐proBNP) de 6850pg/mL, sorologias negativas.
Imagens de ecocardiograma bidimensional (A), ressonância magnética (B) evidenciando miocárdio não compactado isolado em ventrículo esquerdo, além de ventrículos direito e esquerdo dilatados. Imagens em eixo longo quatro câmaras, em diástole. Relação de massa não compactada sobre massa compactada do ventrículo esquerdo de 5,5. Peça anatômica macroscópica de coração nativo da paciente em eixo quatro câmaras (C).
Iniciado dobutamina 5mcg/kg/min e anticoagulação sistêmica com enoxaparina em dose plena. Calculada resistência vascular pulmonar de 1,7 unidades Woods via cateter de Swan‐Ganz.
Paciente evoluiu com baixo débito, fibrilação atrial de alta resposta ventricular (FC=160bpm), rebaixamento do nível de consciência, hipotensão, crise convulsiva, com necessidade de entubação orotraqueal e cardioversão elétrica sincronizada. Indicado uso de oxigenação por membrana extracorpórea (ECMO). Paciente evoluiu para disfunção de múltiplos órgãos (insuficiência renal aguda com indicação de diálise, disfunção hepática com alteração de transaminases e coagulograma, plaquetopenia e elevação de bilirrubinas). Culturas negativas. Mantida em prioridade para Tx.
Após 72h em uso de ECMO, a paciente foi submetida ao Tx sem intercorrências durante o procedimento. Manteve insuficiência renal aguda, com necessidade de hemodiálise por três dias. Houve melhora da coagulopatia e das demais disfunções orgânicas.
Não houve necessidade de terapia de assistência ventricular artificial após a cirurgia (balão intra‐aórtico ou ECMO). Resultado anatomopatológico e peça anatômica (Figura 2C) com hipertrofia e leve degeneração das fibras. Paciente permaneceu estável, sem novas complicações e recebeu alta em bom estado geral. Mantém acompanhamento ambulatorial.
DiscussãoA não compactação miocárdica é uma entidade relativamente rara, que acomete principalmente o sexo masculino, representando de 56‐82% dos casos nas quatro maiores séries2, já tendo sido descritas formas familiar e esporádica do MCNC. No primeiro artigo original publicado sobre o tema houve predominância de crianças e a recorrência familiar foi vista em metade dos pacientes2. Na maior população já descrita de casos de MCNC houve recorrência familiar em 18% da população afetada descrita, embora a maioria dos autores insista em relatar que devido a uma triagem ineficaz, há provavelmente subnotificação de casos4.
Em termos de genética, foram descritas mutações em vários genes humanos que codificam as proteínas sarcoméricas, do citoesqueleto e da membrana nuclear, incluindo: G4.5, TAZ, PRDM16, TNNT2, LDB3, MYBPC3, MYH7, ACTC1, TPM1, MIB1 e DTNA, muitos associados a miocardiopatia dilatada ou hipetrófica1,5,6.
Com relação à definição do diagnóstico, o ecocardiograma é a primeira ferramenta diagnóstica para pacientes e familiares, porém há divergências entre os critérios. Para o grupo de Chin2, o diagnóstico é definido por uma relação inferior a 0,5 entre as distâncias do início ao pico das trabéculas. As medidas correspondem à espessura da parede livre do VE no final da diástole2,7. Petersen et al.1,8 mantêm o conceito de que o critério mais importante é em relação à camada trabeculada, que deve ter uma relação MCNC/miocárdio compactado >2. Outros achados incluem disfunção sistólica e diastólica1. A ressonância magnética adiciona detalhes anatômicos e informação funcional da cinética dos segmentos não compactado versus compactado e fibrose1. Porém, distinguir entre MCNC patológica e hipertrabeculação fisiológica é um desafio diagnóstico que está se tornando cada vez mais comum com o desenvolvimento das técnicas de imagem9.
Pela elevada prevalência de arritmias malignas, o Holter deverá ser realizado no mínimo anualmente. A realização de estudo eletrofisiológico e/ou implantação profilática de CDI deve ser ponderada. Esportes de competição devem ser evitados1,10. A morte súbita foi responsável por cerca de metade dos óbitos nas maiores séries de MCNCI isolada10.
Dados da literatura mostram melhor prognóstico nos pacientes assintomáticos1,2. Ao início dos sintomas (IC, embolia, arritmia), a conduta deve ser iniciada independente do diagnóstico de base e individualizada para cada paciente. Não existem diretrizes específicas para MCNC.
No caso de insucesso dos tratamentos, o Tx pode ser a única possibilidade terapêutica10, como no caso descrito, onde a paciente evoluiu rapidamente para IC refratária.
Concluindo, o diagnóstico de MCNCI pode ter comprovação diagnóstica ao ecocardiograma bidimensional ou ressonância magnética, e estes achados em geral correspondem aos achados morfológicos macroscópicos durante a necropsia. É um diagnóstico a ser considerado em caso de falência ventricular em pacientes jovens e sem causa definida, embora não seja uma patologia comum. MCNC representa um fenótipo único, com aumento do risco de IC progressiva, morte súbita cardíaca, arritmias ventriculares e eventos embólicos.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflito de interessesOs autores declaram não haver conflito de interesses.