Os péptidos natriuréticos BNP e NT‐proBNP são atualmente os biomarcadores mais utilizados na insuficiência cardíaca, no entanto, permanecem algumas limitações. Isso justifica a necessidade de identificar novos biomarcadores que possam revelar vantagens, isoladamente ou em associação, no rastreio, diagnóstico e prognóstico. A Galectina‐3 é uma proteína envolvida em diversas vias de sinalização celular. Pode ser encontrada em vários tecidos, sendo a sua expressão baixa no coração normal e elevada no coração fibrótico. Entre outros efeitos, é responsável pela proliferação de fibroblastos, promoção da síntese de colagénio, contribuindo para a remodelagem cardíaca que é determinante no desenvolvimento e progressão da insuficiência cardíaca.
A insuficiência cardíaca mediada pela Galectina‐3 (>17,8ng/mL) afeta 30‐50% dos doentes com insuficiência cardíaca crónica, apresentando pior prognóstico, com maior taxa de reinternamento a curto prazo e mortalidade.
Pensa‐se que através da inibição da ação da Galectina‐3 ou mesmo através do knock‐out genético se possa reverter ou promover um atraso na progressão desta doença.
Quando avaliados isoladamente, a Galectina‐3 parece ter maior valor prognóstico do que os péptidos natriuréticos, no entanto, quando se combinam, o valor prognóstico é ainda superior. É possível admitir que a Galectina‐3, associada ao BNP ou ao NT‐proBNP, possa vir a ser considerada no futuro como uma alternativa que permita melhorar o diagnóstico e o prognóstico da insuficiência cardíaca.
The natriuretic peptides BNP and NT‐proBNP are currently the most commonly used biomarkers in heart failure, but they have limitations. There is thus a need to identify new biomarkers that may prove useful, alone or in combination, for screening, diagnosis and prognosis.
Galectin‐3 is a protein involved in a variety of cellular signaling pathways and is found in many tissues. Its expression is low in normal hearts but elevated in fibrotic hearts. Among other effects, it promotes fibroblast proliferation and collagen synthesis, contributing to the cardiac remodeling that is central to the development and progression of heart failure.
Heart failure associated with elevated galectin‐3 (>17.8 ng/ml) affects 30‐50% of patients with chronic heart failure, and is a marker of worse prognosis, with higher rates of short‐term rehospitalization and mortality.
It is thought that galectin‐3 inhibition, or even genetic disruption, may reverse or delay disease progression.
Galectin‐3 appears to have greater prognostic value than natriuretic peptides when assessed separately, however, when combined their prognostic value is even higher. Galectin‐3, associated with BNP or NT‐proBNP, may help improve the diagnosis and prognosis of heart failure.
N‐acetil‐seril‐aspartil‐lisil‐prolina
«American Heart Association»
Actina do músculo liso alfa
Área abaixo da curva
«Coordinating study evaluating Outcomes of Advising and Counseling in Heart failure»
Colagénio tipo 1, alfa 1
Domínio de reconhecimento dos carbohidratos
«Deventer‐Alkmaar heart failure»
Enzima conversora da angiotensina
Fibrilhação auricular
Fração de ejeção
Galectina‐3
Hospital de Santa Maria/Centro Hospitalar Lisboa Norte
Insuficiência cardíaca
Inibidor da enzima conversora da angiotensina
Metaloproteínases da matriz
Cloreto de sódio
«New York Heart Association»
«Prevention of Renal and Vascular Endstage Disease»
«Pro‐BNP Investigation of Dyspnea in the Emergency Department»
Homólogo da fosfatase e da tensina
Proteína tirosina quinase 2
Característica de operação do recetor
Fator de transformação do crescimento beta
Inibidores das metaloproteínases tecidulares
Ventrículo esquerdo
A insuficiência cardíaca (IC) continua a ser uma doença associada a uma grande mortalidade e morbilidade. É considerada uma das epidemias do século XXI, estimando‐se um aumento de 50‐75% na sua prevalência até 2030. Em Portugal, a prevalência aumenta com a idade, variando de 1,36% na faixa etária dos 20‐50 anos e 16% na faixa etária acima dos 80 anos1,2.
A hospitalização destes doentes é frequente (dois terços são internados em média duas vezes por ano), recorrente (20‐30% são reinternados num prazo de três meses) e muito dispendiosa. A evicção de internamentos recorrentes, para além de significar uma vasta poupança de verbas, também constitui uma melhoria da qualidade de vida destes doentes, justificando‐se assim a necessidade de adquirir mais e melhores métodos de diagnóstico e prognóstico1,2.
Para melhorar o prognóstico dos doentes com IC, tanto a curto como a longo prazo, é importante não só melhorar a identificação dos doentes com IC avançada, como identificar aqueles com risco mais elevado de eventos nefastos3. Desta forma, tem‐se vindo a dar cada vez maior relevância à identificação de biomarcadores que poderão estar envolvidos na fisiopatologia da doença4,5. A Galectina‐3 (Gal‐3) é um biomarcador cujos níveis séricos parecem elevar‐se mesmo antes do estabelecimento da IC6 e parecem ainda identificar doentes com IC que apresentam risco aumentado de reinternamento precoce7.
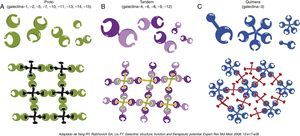
A Galectina‐3As galectinas constituem uma família de lectinas animais, exibem similaridade no domínio de reconhecimento de carboidratos (Carbohydrate Recognition Domain [CRD]) e afinidade por glicoconjugados ricos em N‐acetil‐lactosamina8.
Dividem‐se em três tipos de acordo com a sua arquitetura: proto, tandem e quimera (Figura 1)8.
Membros da família das galectinas e respetivas ligações. Adaptado de: Yang et al.8.
A Gal‐3 é até agora a única representante identificada das galectinas do tipo quimera e é provavelmente o membro mais estudado desta família. Tem um peso molecular de 29‐35kDa, forma pentâmeros após a sua ligação com carboidratos e pode ser encontrada numa grande variedade de espécies e tecidos8.
Em tecidos normais, a Gal‐3 é expressa em maior quantidade no pulmão, baço, estômago, cólon, glândulas suprarrenais, útero e ovários. Também é expressa, apesar de em muito menor quantidade, nos rins, coração, cérebro, pâncreas e fígado. No entanto, sob condições fisiopatológicas, o nível de expressão de Gal‐3 pode mudar substancialmente9, estando assim aumentada na fibrose cardíaca, na cirrose hepática, na fibrose pulmonar idiopática, na pancreatite, em diversas neoplasias e na fibrose renal, sendo esta última um dos preditores de prognóstico mais importantes na IC10,11. A Gal‐3 é secretada por macrófagos ativados, tendo locais de ligação nos fibroblastos cardíacos, levando a um aumento da expressão de colagénio no miocárdio e fibrose intersticial, a uma ativação do TGF‐β e subsequente disfunção ventricular esquerda. Assim sendo, a Gal‐3 pode desempenhar um papel fundamental na resposta à lesão e inflamação durante a IC, podendo mesmo ser uma parte determinante na remodelagem ventricular6.
De modo semelhante às restantes galectinas, localiza‐se primariamente no citoplasma e ocasionalmente no núcleo e na mitocôndria das células. Quando é secretada para o espaço extracelular a Gal‐3 consegue interagir com recetores das superfícies celulares e glicoproteínas de forma a iniciar vias de sinalização transmembranares envolvidas em diferentes funções celulares6.
Em termos de funções biológicas, a Gal‐38,10–13:
- 1.
Contribui para a maturação do pré‐mRNA.
- 2.
Extracelularmente induz apoptose de células T e monócitos.
- 3.
Intracelularmente tem atividade antiapoptótica.
- 4.
Participa na adesão e agregação celulares.
- 5.
Induz migração de monócitos e macrófagos.
- 6.
Promove a proliferação de fibroblastos e a síntese de colagénio.
- 7.
Promove o crescimento tumoral, metástases e angiogénese.
- 8.
Acelera a reepitelialização da córnea lesada.
- 9.
Contribui para o crescimento e diferenciação de células B e T.
- 10.
Apresenta propriedades anti‐inflamatórias na asma e modula a aterosclerose e diabetes.
No local da lesão, a Gal‐3 é secretada para o espaço extracelular, o que contribui para o processo fibrótico por ativar fibroblastos latentes em fibroblastos produtores de matriz. A ativação fibroblástica é caracterizada pelo aumento da expressão da proteína actina do músculo liso12.
A Gal‐3 não só afeta a síntese de novos componentes da matriz (como o colagénio tipo I), como também influencia a degradação de componentes da matriz extracelular através de um conjunto de inibidores das metaloproteínases tecidulares (TIMP) e metaloproteínases da matriz (MMP)12.
A Galectina‐3 na insuficiência cardíacaAtualmente, apenas os péptidos natriuréticos BNP e NT‐proBNP estão validados e recomendados em guidelines para o diagnóstico e prognóstico de doentes com IC14,15.
Estes biomarcadores respondem rapidamente ao aumento da tensão na parede cardíaca e têm comprovado a sua utilidade para o diagnóstico da IC, quer em doentes em ambulatório com IC crónica quer em doentes com IC descompensada (sobretudo quando dispneicos e a etiologia dessa dispneia não é clara)3,16.
Os níveis de BNP e NT‐proBNP podem ainda ser utilizados como métodos de monitorização e ajuste da terapêutica, de forma a atingirem níveis ótimos de dosagem. A diminuição gradual dos seus níveis faz prever um melhor prognóstico para estes doentes16.
No entanto, apesar de níveis baixos de BNP ou NT‐proBNP excluírem a presença de IC (com um valor preditivo negativo de 96 e 99%, respetivamente) e níveis elevados terem valor preditivo positivo relativamente alto para diagnosticar IC (79 e 76%, respetivamente), devemos estar cientes de que níveis plasmáticos destes péptidos variam substancialmente durante o dia e que mesmo níveis elevados de ambos foram associados a diversas causas, tanto cardíacas (por exemplo síndrome coronária aguda, fibrilhação auricular ou miocardite) como não cardíacas (por exemplo, idade avançada, anemia, insuficiência renal ou pneumonia)12,16,17.
Para além da tensão dos cardiomiócitos, existem outros mecanismos, como a inflamação ou diversas vias reguladoras da contratilidade cardíaca, que também desempenham um papel importante na IC. No entanto, este tipo de mecanismo não é refletido pelos níveis de BNP e NT‐proBNP3.
Neste sentido, têm‐se tentado encontrar novos biomarcadores envolvidos nestes diferentes processos.
Recentemente, vários estudos, como por exemplo o Deventer‐Alkmaar heart failure (DEAL‐HF Study) e o Coordinating study evaluating Outcomes of Advising and Counseling in Heart failure (COACH), têm identificado a Gal‐3 como um biomarcador associado à fibrose e inflamação, processos fisiopatológicos esses relacionados com a remodelagem cardíaca, determinante no desenvolvimento e progressão da IC. Visto que a remodelagem contribui para um pior prognóstico destes doentes, reverter ou promover um atraso na sua progressão é atualmente reconhecido como um objetivo importante das intervenções terapêuticas na IC10,12. Níveis plasmáticos elevados de Gal‐3 em doentes com IC aguda e crónica têm sido consistentemente associados a pior prognóstico18.
Nas subanálises dos estudos DEAL‐HF, COACH, Pro‐BNP Investigation of Dyspnea in the Emergency Department (PRIDE) e Prevention of Renal and Vascular End‐stage Disease (PREVEND), a Gal‐3 mostrou relacionar‐se com a idade (doentes mais novos tinham níveis mais baixos desta proteína)6,10,18–20, com o sexo (níveis mais elevados de Gal‐3 estavam mais frequentemente associados a mulheres, levantando‐se a possibilidade de esta ser regulada por hormonas sexuais)10,19, com a taxa de filtração glomerular (doentes com maior disfunção renal tinham aparentemente níveis mais elevados de Gal‐3)6,10,19,20, com fatores de risco cardiovasculares (doentes com níveis mais elevados de Gal‐3 tinham mais frequentemente fibrilhação auricular (FA), hipertensão arterial, dislipidemia e obesidade)18,19 e com os níveis crescentes de BNP/NT‐proBNP (doentes com níveis mais elevados de BNP/NT‐proBNP tinham habitualmente níveis de Gal‐3 também mais elevados)6,10,18–20.
Nas subanálises DEAL‐HF e COACH, a Gal‐3 continuava a ser um marcador de prognóstico independente, mantendo o seu valor prognóstico após ajuste para a idade, sexo e níveis de BNP/NT‐proBNP10,20,21.
Observou‐se ainda na subanálise COACH que, após o ajuste para a taxa de filtração glomerular, a Gal‐3 perdia um pouco o seu valor prognóstico, sugerindo que algum deste valor poderá ser mediado pela função renal18.
Nas subanálises DEAL‐HF e PRIDE não parecia existir relação estatisticamente significativa entre os níveis de Gal‐3 e a etiologia da IC, nem com a sua forma de apresentação (aguda ou crónica) ou com a classe da NYHA3,6,10,11,22.
Na subanálise do estudo COACH demonstrou‐se ainda haver uma relação estatisticamente significativa entre a fração de ejeção (FEj) do ventrículo esquerdo (VE) e o valor preditivo da Gal‐3. Ou seja, um aumento igual nos valores séricos da Gal‐3 representava um risco muito superior de morte ou reinternamento em doentes com IC com FEj preservada (>40%) do que naqueles que têm FEj reduzida (≤40%). No entanto, os valores absolutos da Gal‐3 não diferiam entre doentes com IC com FEj preservada e IC com FEj reduzida18.
A subanálise do estudo HF‐ACTION não parecia estar de acordo com estas observações, isto é, neste estudo identificou‐se igualmente associação da Gal‐3 e a idade, assim como com uma maior taxa de hospitalização ou mortalidade, no entanto, a Gal‐3 não se relacionava com o sexo, FEj nem com os níveis de NT‐proBNP. Inclusivamente a Gal‐3 perdia o seu valor prognóstico após ajuste para o NT‐proBNP. Uma das justificações dadas para este achado foi o facto de este estudo incluir apenas doentes com disfunção sistólica (com FEj<40%) e os dados anteriores pareciam demonstrar que o poder prognóstico deste biomarcador é superior em doentes com função sistólica preservada14.
A Gal‐3 parece aumentar com a idade, de forma semelhante à maioria dos marcadores cardiovasculares (um estudo preliminar em octogenários demostrou que os níveis de Gal‐3 eram frequentemente superiores a 20ng/mL em doentes sem IC). Postula‐se assim que os níveis séricos de Gal‐3 devem ser considerados tendo em conta a idade do indivíduo, isto é, são necessários intervalos de referência para os diversos grupos etários19.
A Galectina‐3 no rastreio da insuficiência cardíacaA inflamação é um processo fisiopatológico que serve como pré‐requisito para a formação cicatricial e consequente regeneração tecidular após uma lesão. No entanto, quando a inflamação se torna permanente pode levar a um processo cicatricial difuso, formando‐se um extenso tecido cicatricial para além do local inicial da lesão, culminando na incapacidade total do órgão: a IC12. Atualmente considera‐se que a Gal‐3 promove esta fibrose difusa22.
Num estudo em ratos efetuaram‐se biópsias do miocárdio em corações normais e descobriu‐se que os ratos que mais tarde iriam desenvolver fibrose cardíaca grave e consequentemente IC tinham os níveis mais elevados de Gal‐3 no momento da biópsia12. Sharma et al. investigaram ainda o efeito cardíaco direto da Gal‐3 através da injeção pericárdica desta proteína em ratos normais. Nestes ratos observou‐se o desenvolvimento de remodelagem cardíaca, com diminuição acentuada da FEj do VE (Tabela 1), aumento da expressão de colagénio e alteração da razão entre o colagénio tipo I e tipo III (com aumento do colagénio tipo I, uma proteína com elasticidade mais limitada do que o colagénio tipo III), podendo também este fenómeno ajudar a explicar as alterações do relaxamento ventricular esquerdo que frequentemente ocorrem na IC. Dado o aumento da expressão da Gal‐3 muito antes da transição para IC, esta proteína poderá futuramente ajudar o clínico a identificar doentes em risco de desenvolvimento de IC9,23.
Comparação entre as alterações ecocardiográficas quatro semanas após infusão intrapericárdica de Galectina‐3 ou um placebo
| FEVE (%) | Placebo | Galectina‐3 |
|---|---|---|
| Basal | 67,3±2,5 | 66,1±1,6 |
| Quatro semanas após injeção intrapericárdica | 66,0±0,4 | 51,8±3,1 |
Adaptado de: Galectin‐3 as a diagnostic and prognostic tool in heart failure23.
Henderson et al. observaram que a depleção de macrófagos reduzia significativamente a ativação de miofibroblastos, diminuindo assim a fibrose. Desta maneira, concluiu‐se que os macrófagos são as células major responsáveis pelo desenvolvimento da fibrose12. Sendo a Gal‐3 um produto de macrófagos ativados, extrapola‐se assim que este biomarcador tenha um efeito direto na fibrose miocárdica e no desenvolvimento da IC15. Num coração normal, a expressão de Gal‐3 é baixa, no entanto, com a progressão da IC os níveis de Gal‐3 aumentam rapidamente12,24.
A IC mediada pela Gal‐3, isto é, a IC que se agrava significativamente pela presença desta proteína no tecido cardíaco, afeta 30‐50% dos doentes com IC crónica em ambulatório. Para além disto, dois em cada três doentes hospitalizados por IC apresentam IC mediada pela Gal‐322.
No entanto, apesar de esta proteína estar envolvida no processo que promove a IC, parece não ter um valor diagnóstico tão forte como o BNP/NT‐proBNP15.
A Galectina‐3 na monitorização e seguimento da insuficiência cardíacaTal como referido anteriormente, visto que os níveis de Gal‐3 se elevam antes das manifestações clínicas da IC, esta torna‐se ainda um potencial marcador para os doentes em risco de progressão do estádio B (evidência de doença cardíaca estrutural, mas sem sintomas) para o estádio C (IC sintomática), segundo a classificação da American Heart Association (AHA)15.
A subanálise do estudo COACH demonstrou que os valores de Gal‐3 são bastante estáveis ao longo de seis meses, não parecendo assim haver indicação para medições seriadas: uma curva característica de operação do recetor (ROC) que comparava os níveis de Gal‐3 basal e os níveis de Gal‐3 passados seis meses demostrou uma área abaixo da curva (AUC) de 0,67 para o primeiro e uma AUC de 0,66 para o segundo. Esta observação parece estar relacionada com o facto da ativação e deposição de Gal‐3 na matriz ser um processo irreversível, o que difere substancialmente das publicações acerca dos péptidos natriuréticos BNP/NT‐proBNP. Em relação a estes últimos, tem‐se sugerido que medições seriadas podem aumentar o valor diagnóstico e prognóstico dos mesmos e assim permitir a sua utilização na orientação e ajuste da terapêutica em doentes com IC18.
Comparativamente com o NT‐proBNP, os níveis de Gal‐3 parecem ser menos influenciados pela gravidade dos sintomas, não sendo afetados na descompensação da IC e visto que não alteram com a terapêutica comum para a IC não devem ser utilizados para a monitorização da terapêutica15,22.
No futuro, a identificação de doentes com níveis aumentados de Gal‐3 (>17,8ng/mL) poderá contribuir para diversas decisões clínicas, nomeadamente: a frequência das consultas de seguimento (visto que estes doentes têm pior prognóstico deverão ser seguidos de forma mais rigorosa), a necessidade de referenciação para um especialista (nos casos em que o doente é seguido apenas pelo seu médico de família), quando internado ajudar na decisão acerca do melhor momento para a alta e eventualmente um dia ser alvo de terapêutica específica22.
A Galectina‐3 no prognóstico da insuficiência cardíacaA Gal‐3 tem sido identificada como marcador independente de prognóstico adverso em doentes com IC18.
Demonstrou‐se que doentes com IC e níveis de Gal‐3>17,8ng/mL apresentavam duas a três vezes maior probabilidade de reinternamento devido a IC num prazo de 30, 60 e 90 dias após a alta inicial, independentemente do estado clínico à data da alta, comparativamente com doentes com IC e níveis de Gal‐3 baixos (<17,8ng/mL) (Tabela 2)7.
Risco de re‐hospitalização em doentes com IC e níveis baixos (≤17,8ng/mL) ou elevados (>17,8ng/mL) de Galectina‐3
| p‐value | Percentagem de doentes re‐hospitalizados por IC ao longo de todos os estudos (Galectina‐3 ≤17,8ng/mL) | Percentagem de doentes re‐hospitalizados por IC ao longo de todos os estudos (Galectina‐3>17,8ng/mL) | |
|---|---|---|---|
| 30 dias | 0,003 | 3,0% | 7,3% |
| 60 dias | 0,001 | 4,5% | 10,0% |
| 90 dias | <0,001 | 5,5% | 13,6% |
| 120 dias | <0,001 | 7,3% | 15,8% |
Adaptado de: Boer et al.7.
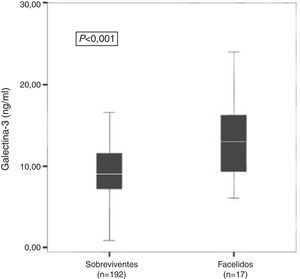
Na subanálise PRIDE evidenciou‐se ainda que indivíduos que faleceram durante 60 dias (Figura 2), um ano (Figura 3A) e quatro anos de acompanhamento (Figura 3B) apresentavam concentrações médias de Gal‐3 significativamente mais elevadas do que aqueles que tinham sobrevivido durante esses períodos3,6,7.
Concentrações médias de Galectina‐3 de indivíduos que faleceram durante 60 dias de acompanhamento e que sobreviveram em igual período – resultados da subanálise PRIDE3.
Galectina‐3 em doentes que morreram em um ano (A) e em quatro anos (B) em doentes dispneicos – resultados da subanálise PRIDE6.
Durante a subanálise do estudo DEAL‐HF os doentes que morreram (n=98) apresentaram simultaneamente níveis mais elevados de Gal‐3 e de NT‐proBNP do que os doentes que sobreviveram. Doentes com níveis simultaneamente elevados de NT‐proBNP e Gal‐3 apresentaram 1,5‐2 vezes maior probabilidade de mortalidade do que os doentes em outras categorias. Demonstrou‐se ainda que a probabilidade de sobrevivência estava inversamente relacionada com os quartis de Gal‐3 (quartil 1 [Gal‐3 < 13,63 ng/mL] apresentava maior probabilidade de sobrevivência do que o quartil 4 [Gal‐3 > 21,62 ng/mL])10.
Estes achados apoiam os pressupostos iniciais de que a Gal‐3 desempenharia um papel importante na doença de base e que a sua elevação estaria associada à progressão da doença e pior prognóstico para os doentes com IC12.
Na subanálise do estudo PRIDE, quando se compara o valor prognóstico destes marcadores, obtemos uma curva ROC para o prognóstico de IC aguda a 60 dias com uma AUC para a Gal‐3 de 0,74 e uma AUC para o NT‐proBNP de 0,67. Isto significa que a Gal‐3 tem aparentemente maior valor prognóstico do que os péptidos natriuréticos BNP/NT‐proBNP3,7.
Na subanálise do estudo COACH também se encontrou um valor prognóstico da Gal‐3 superior ao do BNP (com AUC de 0,67 e 0,65, respetivamente), no entanto, quando combinados parecem ter um valor superior do que cada um dos marcadores sozinhos (com uma AUC de 0,69 para Gal‐3+BNP), ou seja, têm um valor prognóstico sinérgico15,18.
A Galectina‐3 na terapêutica da insuficiência cardíacaLiu et al. demonstraram que a injeção intrapericárdica de Gal‐3 em corações de ratos normais causaria fibrose miocárdica e remodelagem cardíaca, enquanto a coinjeção de um agente antifibrótico (N‐acetil‐seril‐aspartil‐lisil‐prolina, também designado por Ac‐SDKP) contrariava esse efeito11,12.
Nesta experiência dividiram‐se ratos em quatro grupos, tendo cada um desses grupos recebido as seguintes injeções intrapericárdicas durante quatro semanas: 1) NaCl; 2) Ac‐SDKP; 3) Gal‐3; 4) Ac‐SDKP+Gal‐3. Verificou‐se que, no VE, a Gal‐3 aumentou a infiltração de macrófagos e mastócitos, aumentou a fibrose cardíaca intersticial e perivascular, causou hipertrofia cardíaca, aumentou a expressão de TGF‐β e aumentou a fosforização da via de sinalização Smad3. O Ac‐SDKP preveniu parcial ou completamente estes efeitos, concluindo‐se neste estudo que o Ac‐SDKP preveniu a inflamação, fibrose, hipertrofia e disfunção cardíaca induzida pela Gal‐3 em ratos, possivelmente pela inibição da via de sinalização do TGF‐β/Smad325.
Especula‐se assim que ao bloquear a ação da Gal‐3 se pode abrandar a progressão da IC e possivelmente reduzir os seus níveis de morbilidade e mortalidade11,12. Fármacos que se liguem ao CRD da Gal‐3, como o Ac‐SDKP, podem reduzir a fibrogénese cardíaca e são candidatos para a prevenção e tratamento da IC26.
Liu et al. observaram ainda resultados positivos na prevenção da IC através do knock‐out do gene da Gal‐3 concluindo que esta alteração genética diminui o grau de fibrose, atenuando assim o desenvolvimento da remodelagem cardíaca. Estes achados sugerem que a Gal‐3 está efetivamente envolvida na fisiopatologia da IC27.
Apesar do apresentado, ainda não existem estudos em humanos com objetivo terapêutico nesta área. Assim sendo, não se podem extrapolar conclusões definitivas a partir de experiências em cobaias, aguardando‐se que no futuro se possa elucidar todo o papel da Gal‐3 na abordagem clínica e terapêutica da IC.
ConclusõesResumindo, a Gal‐3 parece ter valor diagnóstico inferior, mas valor prognóstico superior ao dos péptidos natriuréticos BNP e NT‐proBNP, sendo particularmente útil em doentes com FEj do VE preservada. A Gal‐3 em conjunto com o BNP/NT‐proBNP poderá vir a ser utilizada para identificar doentes com risco elevado de readmissão hospitalar ou morte a curto‐prazo, permitindo assim ao médico gerir o seguimento destes doentes da forma mais adequada.
Relativamente à intervenção terapêutica, a injeção de Ac‐SDKP em ratos demonstrou prevenir a inflamação, fibrose, hipertrofia e disfunção cardíaca induzida pela Gal‐3 e o knock‐out genético levou a que ratos desenvolvessem menor remodelagem cardíaca. Visto que estas intervenções atuam na origem da doença, poderão tornar‐se futuramente numa alternativa terapêutica viável em doentes com IC.
No entanto, atualmente existem poucos estudos acerca da Gal‐3, sendo ainda necessário elucidar todo o papel desta proteína na abordagem da IC.
Conflito de interessesOs autores declaram não haver conflito de interesses.









 PRIDE3.'/>
PRIDE3.'/>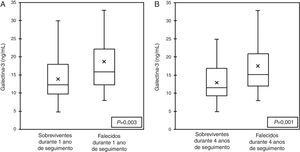 PRIDE6.'/>
PRIDE6.'/>

