Nefropatia induzida por contraste (NIC) após intervenção coronária percutânea (ICP) em pacientes com taxa de filtração glomerular (TFG)≥60mL/min, estimada pela equação de Cockcroft‐Gault (C‐G), não é infrequente. O objetivo desse estudo foi avaliar a capacidade da equação CKD‐EPI (Chronic Kidney Disease Epidemiology Collaboration) em predizer NIC em indivíduos sem disfunção renal significativa basal pela fórmula C‐G.
MétodosIncluídos pacientes submetidos a ICP entre 2008‐2013, com TFG basal≥60mL/min pela equação de C‐G. Estes indivíduos foram divididos em dois grupos, conforme ocorrência ou não de NIC. Para todos os casos, foi calculada a TFG basal conforme a equação do CKD‐EPI.
ResultadosA amostra consistiu de 140 pacientes. A TFG C‐G basal foi de 87,5±21,3mL/min e de 77,1±15,0mL/min/1,73m2 para CKD‐EPI. NIC ocorreu em 84,6% dos pacientes com TFG CKD‐EPI basal<60mL/min/1,73m2, contra 51,1% daqueles com TFG CKD‐EPI basal≥60mL/min/1,73m2 (p=0,021). Indivíduos masculinos ou com peso corporal elevado apresentaram mais frequentemente TFG CKD‐EPI basal<60mL/min/1,73m2. Contraste não‐iônico e TFG CKD‐EPI basal≥60mL/min/1,73m2 foram fatores protetores à ocorrência de NIC. Em indivíduos com creatinina<1,0mg/dL, o achado de TFG superestimada por C‐G, mas não pelo CKD‐EPI, foi mais frequente (sensibilidade de 100,0%; especificidade de 52,0%).
ConclusõesEm pacientes sem disfunção renal por C‐G, submetidos a ICP, o achado de TFG CKD‐EPI<60ml/min/1,73m2 implicou em maior chance de NIC, principalmente entre indivíduos do sexo masculino e de maior massa corpórea.
Individuals with glomerular filtration rate (GFR) ≥60 ml/min/1.73 m2 estimated by the Cockcroft‐Gault formula (CG) who undergo percutaneous coronary intervention (PCI) frequently develop contrast‐induced nephropathy (CIN). This study aimed to assess whether individuals with significant renal impairment assessed by the Chronic Kidney Disease Epidemiology Collaboration (CKD‐EPI) formula, but not by CG, more often develop CIN following PCI than those without renal impairment by either formula.
MethodsIn this cross‐sectional study analyzing patients with baseline CG GFR ≥60 ml/min/1.73 m2 before PCI, subjects were divided into two groups according to CIN occurrence. Baseline CKD‐EPI GFR was calculated for all patients.
ResultsWe analyzed 140 patients. Baseline GFR was 87.5±21.3 and 77.1±15.0 ml/min/1.73 m2 for CG and CKD‐EPI, respectively. CIN occurred in 84.6% of individuals with baseline CKD‐EPI GFR <60 ml/min/1.73 m2 vs. 51.1% of those without. Males and those with higher body mass index were more likely to present baseline CKD‐EPI GFR <60 ml/min/1.73 m2 (p=0.021). Non‐ionic contrast agent use and baseline CKD‐EPI GFR ≥60 ml/min/1.73 m2 were protective factors against CIN. Greater amounts of contrast agent and acute coronary syndrome were associated with higher CIN risk. In subjects with serum creatinine <1.0 mg/dl, GFR was more likely to be overestimated by CG, but not by CKD‐EPI (sensitivity 100.0%; specificity 52.0%).
ConclusionIn patients undergoing PCI without renal dysfunction by CG, a finding of CKD‐EPI GFR <60 ml/ min/1.73 m2 was associated with a higher probability of CIN, especially among men and those with higher body mass index.
A nefropatia induzida por contraste representa uma forma de injúria renal aguda, que ocorre dentro de poucos dias após a exposição à meios de contraste iodados, frequentemente utilizados em procedimentos médicos diagnósticos e terapêuticos. Na última década, a nefropatia induzida por contraste (NIC) foi identificada como a terceira causa mais comum de insuficiência renal adquirida no ambiente hospitalar, com implicações prognósticas importantes1‐5 no curto e longo prazo.
Diversos fatores já foram identificados como preditores para ocorrência de NIC. Indivíduos com disfunção renal pré‐existente representam o subgrupo de maior risco pra seu desenvolvimento6‐10. Portanto, a identificação de tais pacientes é de fundamental importância para a implementação de estratégias de prevenção da ocorrência de NIC2,3,10‐12.
Relação direta já foi demonstrada entre os níveis de creatinina sérica (sCr) e o risco para desenvolvimento de NIC, ou seja, quanto maior a sCr basal, maior a chance de desenvolver NIC10. No entanto, a sCr é um marcador imperfeito para mensuração da função renal, em especial pela sua baixa sensibilidade para monitorar alterações na função renal, uma vez que reduções>50% na taxa de filtração glomerular (TFG) podem ocorrer antes que qualquer aumento na sCr seja observado. Dessa forma, métodos que permitam estimar a TFG são desejáveis para identificar os pacientes de maior risco para desenvolvimento de NIC.
Pela sua praticidade e facilidade de uso, o cálculo do clearance de creatinina (Cl.Cr.) é uma das formas mais utilizadas para estimar a TFG na prática médica, e a fórmula de Cockcroft‐Gault (C‐G) o recurso mais utilizado para este fim, com reprodutibilidade e acurácia satisfatórias13,14. Considera como variáveis o peso, sexo, idade e sCR. No entanto, apesar da grande factibilidade de memorização e aplicação, a equação de C‐G tem perda de acurácia quando empregada na avaliação de alguns contextos clínicos ou populações específicas, especialmente os obesos e idosos15‐20.
A equação alternativa proposta para estimar a TFG pelo grupo de estudos Modification of Diet in Renal Diseases (MDRD) considera a utilização de seis variáveis: sCr, idade, etnia, sexo e níveis de ureia sanguínea nitrogenada (BUN) e albumina sérica. No entanto, esta ferramenta foi validadas apenas para pacientes com doença renal crônica, não sendo aplicável no cenário da injúria renal aguda. A fórmula MDRD frequentemente subestima a TFG em pacientes com TFG real, medida, maior que 60mL/min. Como não possuem ajuste para a massa corporal, também subestimam a TFG para pessoas obesas e a superestimam em indivíduos de baixo peso, em comparação com a fórmula de C‐G17,18,21‐23.
Estes aspectos têm grande importância prática, uma vez que medidas de prevenção da NIC não são rotineiramente aplicadas em pacientes sem disfunção renal significativa – estágios 1 e 2 da doença renal crônica. No entanto, não é incomum o desenvolvimento de NIC em pacientes sem disfunção renal basal significativa (TFG estimada≥60mL/min) pelas equações de C‐G e MDRD24.
Em 2009, Levey et al.25 descreveram a equação Chronic Kidney Disease Epidemiology Collaboration (CKD‐EPI), uma nova ferramenta para estimar a TFG, a qual demonstrou melhor performance, com maior acurácia e menos erros em estimar a TFG em comparação com as fórmulas de C‐G e MDRD, especialmente quando a TFG era maior que 60mL/min/1,73m2. Esta equação foi validada em populações, sexo, etnias, comorbidades e contextos clínicos15‐17,20,21,26‐33.
Face ao exposto, visamos com essa pesquisa avaliar o poder discriminatório da equação CKD‐EPI para predizer a ocorrência de NIC em pacientes sem disfunção renal significativa (TFG≥60mL/min) pela fórmula de C‐G após intervenção coronária percutânea (ICP).
MétodosDesenho do estudo e seleção dos pacientesO presente estudo tem caráter retrospectivo, observacional e analítico‐descritivo. No período compreendido entre fevereiro de 2008 e agosto de 2013, foram avaliados retrospectivamente os registros hospitalares de uma coorte histórica de pacientes consecutivos, sem disfunção renal significativa basal pela fórmula de C‐G, submetidos à ICP no Instituto Dante Pazzanese de Cardiologia (IDPC), e que desenvolveram NIC.
O cálculo do Cl.Cr. estimado pela fórmula de C‐G é realizado em todos os pacientes em nossa instituição, previamente à realização de procedimentos diagnósticos ou terapêuticos, com o intuito de identificar os indivíduos que possuem maior risco para desenvolvimento NIC e, portanto, instituir medidas preventivas para esta população. Para todos os paciente incluídos no presente estudo, calculamos, de forma retrospectiva, a TFG pela fórmula CKD‐EPI antes e depois da ICP. Em todos os casos, o Cl.Cr. estimado pela fórmula de C‐G também foi estimado após a ICP.
Todos os pacientes incluídos possuíam Cl.Cr. ≥60mL/min de acordo com estimativa pela fórmula de C‐G basal. Os indivíduos participantes foram alocados em dois grupos. Um grupo controle foi composto por pacientes sem disfunção renal basal significativa pela fórmula de C‐G e que não desenvolveram NIC. O outro grupo foi constituído de pacientes sem disfunção renal conforme C‐G, porém que evoluíram com NIC.
Foram excluídos os pacientes que não possuíam medidas da sCr pré‐procedimento, ou pacientes que receberam alta hospitalar no mesmo dia da ICP, para os quais não foi coletada Cr nos dias seguintes, consequentemente inviabilizando a verificação da ocorrência de NIC.
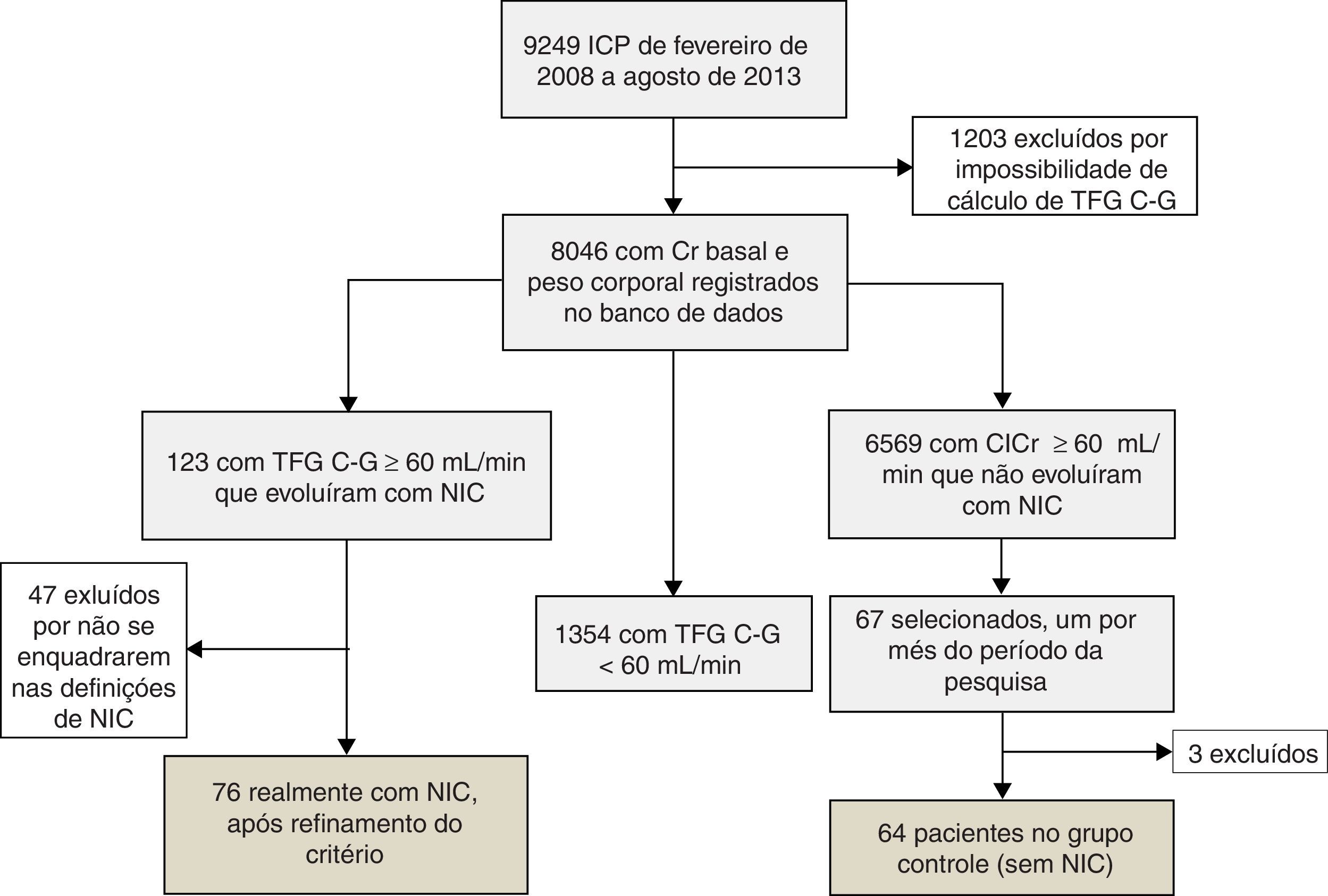
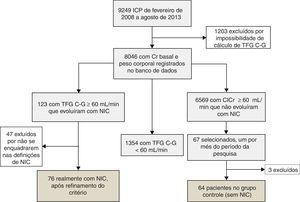
Entre fevereiro de 2008 e agosto de 2013, foram realizadas 9249 ICP em nossa instituição. Destas, 8046 (86,9%) possuíam medidas da sCr basal com possibilidade de cálculo do Cl.Cr. pela fórmula de C‐G. Com base nos registros do banco de dados, encontramos 123 pacientes sem disfunção renal significativa, que evoluíram com injúria renal aguda pós‐ICP.
Como o número de indivíduos do grupo controle excedeu em demasia aqueles que evoluíram com NIC, calculamos um número mínimo de participantes para este grupo, que pudesse ser estatisticamente representativo da população de estudo. Baseados na variabilidade da TFG – tanto pelas equações de C‐G e CKD‐EPI – observada entre todos os pacientes sem disfunção renal basal significativa pela fórmula de C‐G – e que não tenham desenvolvido NIC pós‐ICP, foi calculada uma amostra mínima de 12 indivíduos para esse fim. Por fim, para a composição da amostra referente ao grupo controle, incluímos o primeiro caso de cada mês (compreendido no período definido para esta pesquisa), com TFG C‐G≥60mL/min que não evoluiu para NIC. Dessa forma, o grupo controle foi composto por 67 indivíduos.
Coleta de dadosFoi elaborado protocolo para coleta dos dados relevantes em questionário padronizado, semifechado, com referência às características demográficas, clínicas e laboratoriais, pré e pós‐ICP. Essas informações foram obtidas por meio de consulta no banco de dados eletrônico do Serviço de Cardiologia Invasiva do IDPC. Quando julgado necessário pelos autores, as mesmas foram confirmadas após análise do registro médico dos pacientes.
DefiniçõesO Cl.Cr. estimado pela fórmula de C‐G foi calculado como previamente descrito por Cockcroft e Gault14. A equação CKD‐EPI foi calculada como originalmente descrita por Levey et al.25.
A NIC foi definida como uma diminuição aguda da função renal, não explicada por outras causas que não a exposição ao meio de contraste, caracterizada por um aumento absoluto≥0,5mg/dL na sCr ou queda≥25% da TFG, estimada por qualquer das equações aplicadas34.
Análise estatísticaTratamento estatístico descritivo e analítico dos dados obtidos foi realizado com o auxílio do software IBM® SPSS 21.0.0.0®. As variáveis contínuas foram expressas como média±DP, enquanto as variáveis categóricas como número e porcentual. A significância estatística da diferença intergrupos para uma mesma variável foi determinada pelo teste doχ2,ou exato de Fischer, para as categóricas e teste de Mann‐Whitney para as contínuas. O nível de significância adotado foi de 5,0%. Análise de regressão linear foi utilizada para a determinação dos coeficientes de correlação entre os valores obtidos pelas fórmulas de C‐G e CKD‐EPI. Análise baiesiana das mensurações obtidas pelas fórmulas de C‐G e CKD‐EPI incluíram estimativas da área sob a curva receiver‐operating characteristic curve (ROC), identificação dos pontos de corte ótimos para predizer a ocorrência de NIC e suas sensibilidade e especificidade associadas. A classificação de Swets modificada foi utilizada para classificar a eficiência diagnóstica das fórmulas de C‐G e CKD‐EPI de acordo com os valores sob a curva ROC como: baixa (<70%), moderada (entre 70‐90%) e alta (>90%). Análise de regressão logística multivariada foi realizada em caráter exploratório para a definição dos preditores de NIC e reclassificação da TFG pelo CKD‐EPI.
ResultadosApós análise caso a caso e aplicação precisa das definições de NIC, 76 pacientes foram elegíveis para a composição final do grupo NIC. O grupo controle, inicialmente composto por 67 indivíduos, teve exclusão de três casos, após constatação de discrepância entre os valores de sCr registrados no banco de dados e àqueles divulgados pelo laboratório de análises clínicas, totalizando 64 pacientes (Figura 1).
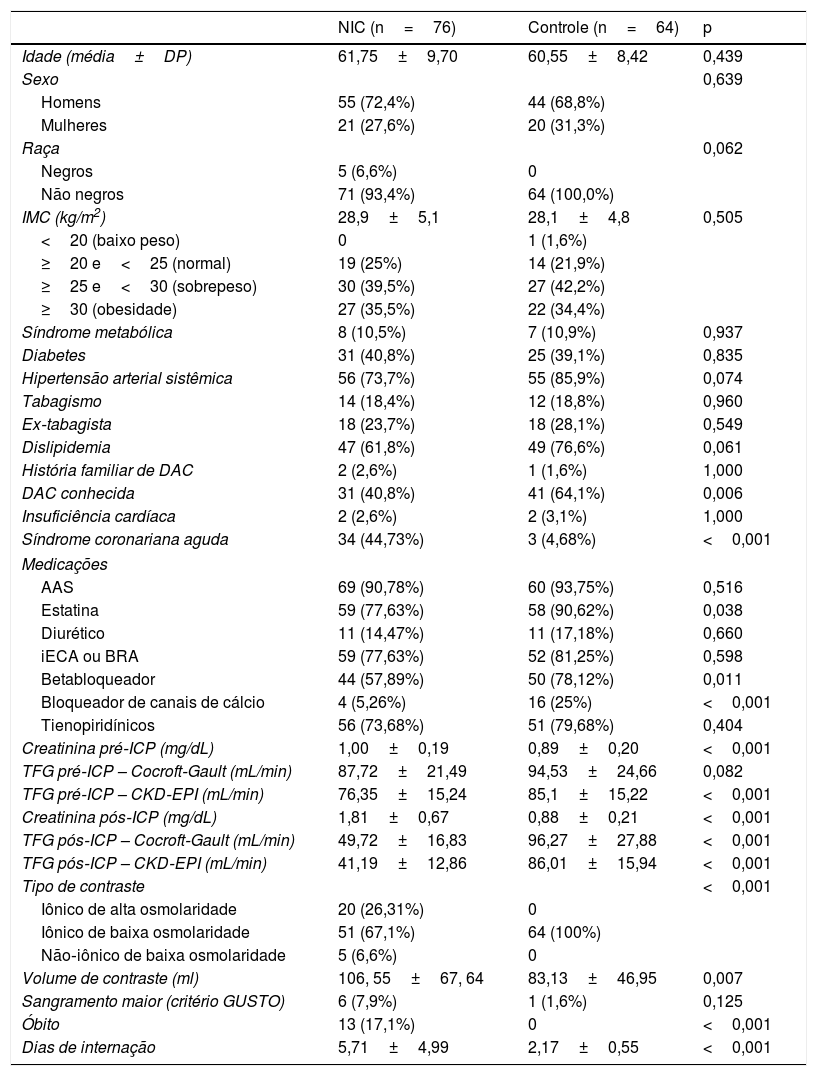
Não houve diferenças estatisticamente significativas entre os pacientes que desenvolveram NIC e os do grupo controle acerca da idade, sexo, raça ou índice de massa corpórea (IMC) (Tabela 1). Em relação às comorbidades, síndrome coronariana aguda e doença arterial coronariana pré‐existente foram mais frequentes no grupo NIC. Uso de estatinas, betabloqueadores e bloqueadores dos canais cálcio foi mais comum entre a população que evoluiu com injúria renal aguda.
Características demográficas e clínicas da população de estudo, conforme evolução ou não para nefropatia induzida por contraste
| NIC (n=76) | Controle (n=64) | p | |
|---|---|---|---|
| Idade (média±DP) | 61,75±9,70 | 60,55±8,42 | 0,439 |
| Sexo | 0,639 | ||
| Homens | 55 (72,4%) | 44 (68,8%) | |
| Mulheres | 21 (27,6%) | 20 (31,3%) | |
| Raça | 0,062 | ||
| Negros | 5 (6,6%) | 0 | |
| Não negros | 71 (93,4%) | 64 (100,0%) | |
| IMC (kg/m2) | 28,9±5,1 | 28,1±4,8 | 0,505 |
| <20 (baixo peso) | 0 | 1 (1,6%) | |
| ≥20 e<25 (normal) | 19 (25%) | 14 (21,9%) | |
| ≥25 e<30 (sobrepeso) | 30 (39,5%) | 27 (42,2%) | |
| ≥30 (obesidade) | 27 (35,5%) | 22 (34,4%) | |
| Síndrome metabólica | 8 (10,5%) | 7 (10,9%) | 0,937 |
| Diabetes | 31 (40,8%) | 25 (39,1%) | 0,835 |
| Hipertensão arterial sistêmica | 56 (73,7%) | 55 (85,9%) | 0,074 |
| Tabagismo | 14 (18,4%) | 12 (18,8%) | 0,960 |
| Ex‐tabagista | 18 (23,7%) | 18 (28,1%) | 0,549 |
| Dislipidemia | 47 (61,8%) | 49 (76,6%) | 0,061 |
| História familiar de DAC | 2 (2,6%) | 1 (1,6%) | 1,000 |
| DAC conhecida | 31 (40,8%) | 41 (64,1%) | 0,006 |
| Insuficiência cardíaca | 2 (2,6%) | 2 (3,1%) | 1,000 |
| Síndrome coronariana aguda | 34 (44,73%) | 3 (4,68%) | <0,001 |
| Medicações | |||
| AAS | 69 (90,78%) | 60 (93,75%) | 0,516 |
| Estatina | 59 (77,63%) | 58 (90,62%) | 0,038 |
| Diurético | 11 (14,47%) | 11 (17,18%) | 0,660 |
| iECA ou BRA | 59 (77,63%) | 52 (81,25%) | 0,598 |
| Betabloqueador | 44 (57,89%) | 50 (78,12%) | 0,011 |
| Bloqueador de canais de cálcio | 4 (5,26%) | 16 (25%) | <0,001 |
| Tienopiridínicos | 56 (73,68%) | 51 (79,68%) | 0,404 |
| Creatinina pré‐ICP (mg/dL) | 1,00±0,19 | 0,89±0,20 | <0,001 |
| TFG pré‐ICP – Cocroft‐Gault (mL/min) | 87,72±21,49 | 94,53±24,66 | 0,082 |
| TFG pré‐ICP – CKD‐EPI (mL/min) | 76,35±15,24 | 85,1±15,22 | <0,001 |
| Creatinina pós‐ICP (mg/dL) | 1,81±0,67 | 0,88±0,21 | <0,001 |
| TFG pós‐ICP – Cocroft‐Gault (mL/min) | 49,72±16,83 | 96,27±27,88 | <0,001 |
| TFG pós‐ICP – CKD‐EPI (mL/min) | 41,19±12,86 | 86,01±15,94 | <0,001 |
| Tipo de contraste | <0,001 | ||
| Iônico de alta osmolaridade | 20 (26,31%) | 0 | |
| Iônico de baixa osmolaridade | 51 (67,1%) | 64 (100%) | |
| Não‐iônico de baixa osmolaridade | 5 (6,6%) | 0 | |
| Volume de contraste (ml) | 106, 55±67, 64 | 83,13±46,95 | 0,007 |
| Sangramento maior (critério GUSTO) | 6 (7,9%) | 1 (1,6%) | 0,125 |
| Óbito | 13 (17,1%) | 0 | <0,001 |
| Dias de internação | 5,71±4,99 | 2,17±0,55 | <0,001 |
BRA: bloqueadores do receptor de angiotensina; DAC: doença arterial coronária; DP: desvio padrão; ICP: intervenção coronária percutânea; iECA: inibidores da enzima de conversão de angiotensina; IMC: índice de massa corpórea; NIC: nefropatia induzida por contraste; TFG: taxa de filtração glomerular.
O uso de agentes de contraste mais nefrotóxicos foi maior no grupo NIC, assim como o volume de contraste administrado.
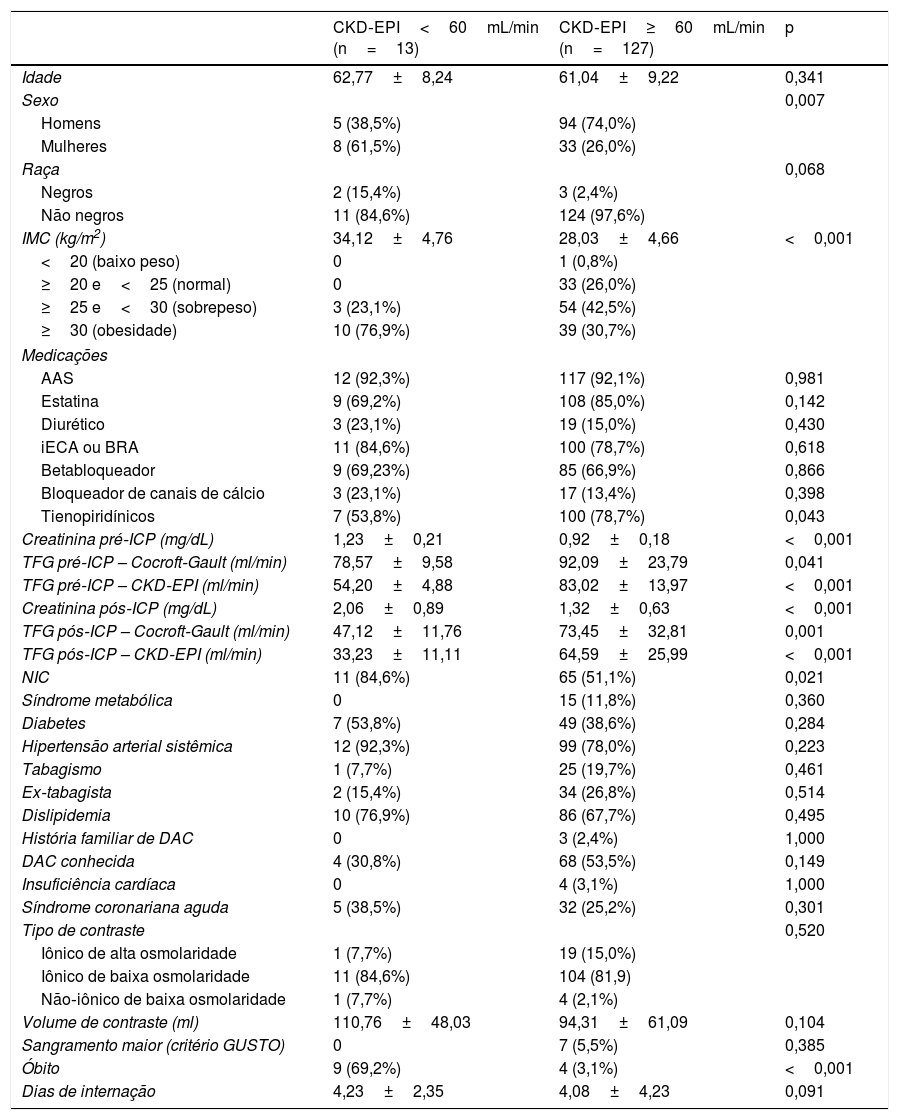
Os pacientes do grupo NIC apresentaram valor médio de sCr mais alto que o grupo controle, porém sem diferença estatística entre a estimativa de TFG basal pela equação de C‐G. De forma geral, a equação CKD‐EPI apresentou valores de TFG menores do que os fornecidos pela fórmula de C‐G, independentemente do grupo ao qual os pacientes foram alocados (NIC ou controle) ou período de observação (pré ou pós‐ICP). Dentre os pacientes sem disfunção renal basal significativa pela fórmula de C‐G, a aplicação do CKD‐EPI sobre os valores de sCr basal reclassificou a TFG para níveis menores que 60mL/min/1,73m2 em 13 (9,2%) indivíduos, sendo 11 (14,5%) no grupo NIC e dois (3,1%) no grupo controle (p=0,03). Sexo masculino e IMC elevado se associaram com níveis de TFG<60mL/min/1,73m2 após aplicação da equação CKD‐EPI (p=0,007) (Tabela 2). Em ambos os grupos, a TFG pós‐procedimento também foi menor quando calculada pelo CKD‐EPI, em comparação com a fórmula de C‐G (Tabela 1).
Características demográficas e clínicas da população de estudo, conforme presença de disfunção renal significativa pelo CKD‐EPI
| CKD‐EPI<60mL/min (n=13) | CKD‐EPI≥60mL/min (n=127) | p | |
|---|---|---|---|
| Idade | 62,77±8,24 | 61,04±9,22 | 0,341 |
| Sexo | 0,007 | ||
| Homens | 5 (38,5%) | 94 (74,0%) | |
| Mulheres | 8 (61,5%) | 33 (26,0%) | |
| Raça | 0,068 | ||
| Negros | 2 (15,4%) | 3 (2,4%) | |
| Não negros | 11 (84,6%) | 124 (97,6%) | |
| IMC (kg/m2) | 34,12±4,76 | 28,03±4,66 | <0,001 |
| <20 (baixo peso) | 0 | 1 (0,8%) | |
| ≥20 e<25 (normal) | 0 | 33 (26,0%) | |
| ≥25 e<30 (sobrepeso) | 3 (23,1%) | 54 (42,5%) | |
| ≥30 (obesidade) | 10 (76,9%) | 39 (30,7%) | |
| Medicações | |||
| AAS | 12 (92,3%) | 117 (92,1%) | 0,981 |
| Estatina | 9 (69,2%) | 108 (85,0%) | 0,142 |
| Diurético | 3 (23,1%) | 19 (15,0%) | 0,430 |
| iECA ou BRA | 11 (84,6%) | 100 (78,7%) | 0,618 |
| Betabloqueador | 9 (69,23%) | 85 (66,9%) | 0,866 |
| Bloqueador de canais de cálcio | 3 (23,1%) | 17 (13,4%) | 0,398 |
| Tienopiridínicos | 7 (53,8%) | 100 (78,7%) | 0,043 |
| Creatinina pré‐ICP (mg/dL) | 1,23±0,21 | 0,92±0,18 | <0,001 |
| TFG pré‐ICP – Cocroft‐Gault (ml/min) | 78,57±9,58 | 92,09±23,79 | 0,041 |
| TFG pré‐ICP – CKD‐EPI (ml/min) | 54,20±4,88 | 83,02±13,97 | <0,001 |
| Creatinina pós‐ICP (mg/dL) | 2,06±0,89 | 1,32±0,63 | <0,001 |
| TFG pós‐ICP – Cocroft‐Gault (ml/min) | 47,12±11,76 | 73,45±32,81 | 0,001 |
| TFG pós‐ICP – CKD‐EPI (ml/min) | 33,23±11,11 | 64,59±25,99 | <0,001 |
| NIC | 11 (84,6%) | 65 (51,1%) | 0,021 |
| Síndrome metabólica | 0 | 15 (11,8%) | 0,360 |
| Diabetes | 7 (53,8%) | 49 (38,6%) | 0,284 |
| Hipertensão arterial sistêmica | 12 (92,3%) | 99 (78,0%) | 0,223 |
| Tabagismo | 1 (7,7%) | 25 (19,7%) | 0,461 |
| Ex‐tabagista | 2 (15,4%) | 34 (26,8%) | 0,514 |
| Dislipidemia | 10 (76,9%) | 86 (67,7%) | 0,495 |
| História familiar de DAC | 0 | 3 (2,4%) | 1,000 |
| DAC conhecida | 4 (30,8%) | 68 (53,5%) | 0,149 |
| Insuficiência cardíaca | 0 | 4 (3,1%) | 1,000 |
| Síndrome coronariana aguda | 5 (38,5%) | 32 (25,2%) | 0,301 |
| Tipo de contraste | 0,520 | ||
| Iônico de alta osmolaridade | 1 (7,7%) | 19 (15,0%) | |
| Iônico de baixa osmolaridade | 11 (84,6%) | 104 (81,9) | |
| Não‐iônico de baixa osmolaridade | 1 (7,7%) | 4 (2,1%) | |
| Volume de contraste (ml) | 110,76±48,03 | 94,31±61,09 | 0,104 |
| Sangramento maior (critério GUSTO) | 0 | 7 (5,5%) | 0,385 |
| Óbito | 9 (69,2%) | 4 (3,1%) | <0,001 |
| Dias de internação | 4,23±2,35 | 4,08±4,23 | 0,091 |
BRA: bloqueadores do receptor de angiotensina; DAC: doença arterial coronária; ICP: intervenção coronária percutânea; iECA: inibidores da enzima de conversão de angiotensina; IMC: índice de massa corpórea; NIC: nefropatia induzida por contraste; TFG: taxa de filtração glomerular.
Os pacientes que desenvolveram NIC apresentaram pior evolução intra‐hospitalar do que os pacientes do grupo controle, com aumento do período de internação e maior mortalidade.
Pacientes com TFG basal<60mL/min/1,73m2 pelo CKD‐EPI evoluíram com maior elevação de sCr e queda da TFG pós‐procedimento. Nesse mesmo subgrupo, 69,2% dos pacientes evoluíram a óbito, contra apenas 3,1% no grupo com TFG basal≥60mL/min/1,73m2 pelo CKD‐EPI (p<0,001).
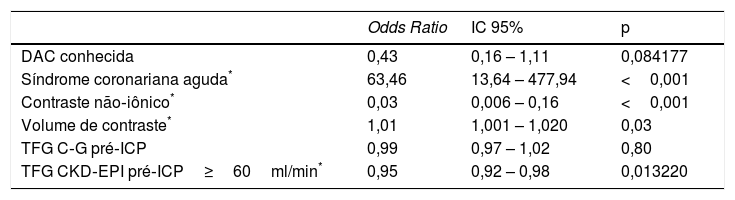
O uso de contraste não‐iônico e TFG CKD‐EPI basal≥60mL/min/1,73m2 foram fatores protetores à ocorrência de NIC, conforme regressão multivariada. Síndrome coronariana aguda e maior volume de contraste estiveram associados a maior risco de disfunção renal aguda pós‐procedimento (Tabela 3).
Preditores de NIC em pacientes com TFG>60 pela equação de Cocroft‐Gault, conforme análise multivariada
| Odds Ratio | IC 95% | p | |
|---|---|---|---|
| DAC conhecida | 0,43 | 0,16 – 1,11 | 0,084177 |
| Síndrome coronariana aguda* | 63,46 | 13,64 – 477,94 | <0,001 |
| Contraste não‐iônico* | 0,03 | 0,006 – 0,16 | <0,001 |
| Volume de contraste* | 1,01 | 1,001 – 1,020 | 0,03 |
| TFG C‐G pré‐ICP | 0,99 | 0,97 – 1,02 | 0,80 |
| TFG CKD‐EPI pré‐ICP≥60ml/min* | 0,95 | 0,92 – 0,98 | 0,013220 |
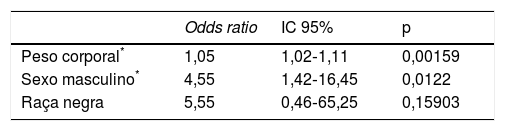
Sexo masculino, peso corporal, IMC e raça negra foram preditores de redução da TFG, quando calculada pelo CKD‐EPI em indivíduos sem disfunção renal basal significativa pelo C‐G. Quando aplicada regressão multivariada, apenas peso corporal e sexo masculinos se confirmaram preditores de TFG basal<60mL/min/1,73m2 pelo CKD‐EPI (Tabela 4). O IMC não está relacionado a redução da TFG pelo CKD, pois, conforme o princípio da colinearidade, tem alta correlação com o valor do peso corpóreo, sendo influenciado por este.
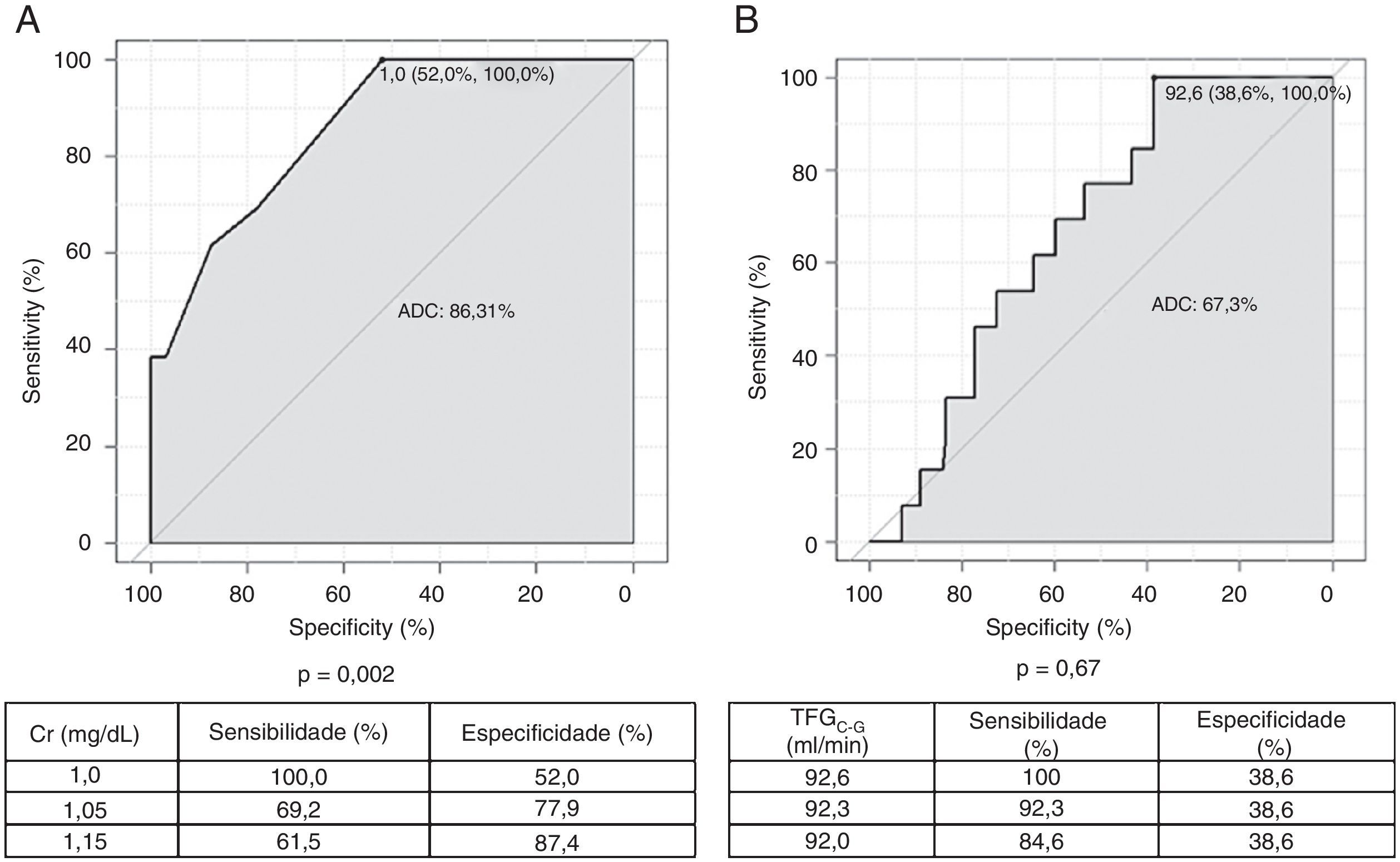
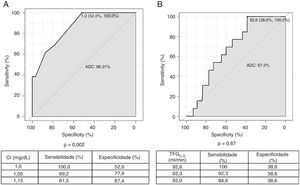
Foram plotadas duas curvas ROC utilizando como variável dependente e contínua os níveis de sCr basal e a TFG basal conforme equação de C‐G, projetando valores de corte a partir dos quais é possível encontrar TFG basal<60mL/min/1,73m2 pela equação do CKD‐EPI (Figura 2). A TFG basal por C‐G não teve associação significativa com TFG CKD‐EPI basal<60mL/min/1,73m2. Considerando os valores de sCr pré‐procedimento, um ponto de corte de 1,0mg/dL tem sensibilidade de 100,0%, com especificidade de 52,0%, para encontrar TFG CKD‐EPI basal<60ml/min/1,73m2 (p=0,002). Para valores intermediários de sensibilidade e especificidade (69,2 e 77,9%, respectivamente), um valor de corte de 1,05mg/dL de sCr é mais adequado.
Curva ROC dos valores de creatinina sérica (A) e da taxa de filtração glomerular estimada conforme a equação de Cocroft‐Gault (B), em função de TFG<60mL/min pela equação do CKD‐EPI. ADC: área dentro da curva; Cr: creatinina sérica; TFG C‐G: taxa de filtração glomerular, estimada pela pela fórmula de Cocroft‐Gault.
A análise rotineira da função renal é parte essencial da avaliação clínica prévia à ICP ou qualquer procedimento médico em que se utilize contraste iodado. A TFG é considerada o marcador mais fidedigno da função renal, seja na vigência ou na ausência de condição patológica25. Como esse índice não é medido de maneira fácil, na prática clínica nós utilizamos de equações para gerar sua estimativa, como a de C‐G, MDRD, CKD‐EPI, entre outras. Matematicamente, essas fórmulas se diferenciam entre si na maneira como combinam suas variáveis comuns, como os valores de sCr, idade, raça, sexo, peso corporal ou superfície de área corpórea. Na prática, cada uma dessas equações foi validada em populações específicas e variadas, de modo que seu uso apropriado vai se adequar ao contexto clínico em foco16,23,28,29,31,35,36.
A presença de disfunção renal prévia, com TFG estimada<60ml/min, é o preditor mais importante de NIC após ICP. Porém, a prática clínica mostra que, mesmo em populações sem disfunção renal significativa, o desenvolvimento de injúria renal aguda pós‐procedimento não é infrequente. Chong et al.24 demonstraram que idade, sexo feminino, diabetes em uso de insulina, hipotensão arterial, anemia e disfunção sistólica do ventrículo esquerdo são importantes preditores de NIC em indivíduos com sCr normal. Atualmente, parcela significativa do volume de procedimentos nos serviços de cardiologia intervencionista são realizados de maneira eletiva37,38. Em função disso, muitas vezes não temos disponível o histórico médico amplo do indivíduo, dificultando a identificação desses preditores na admissão pré‐procedimento. Esses fatos reforçam a necessidade de um maior refinamento na avaliação desses pacientes.
No presente estudo, identificamos que 9,2% dos pacientes com função renal basal pela equação de C‐G, de fato, já tinham redução da TFG ao aplicar a fórmula do CKD‐EPI. Mais que isso, deste subgrupo, 84,6% evoluiu com NIC. O modelo de regressão logística aplicado demonstrou que para os pacientes onde a equação de C‐G possivelmente superestimou a TFG, o achado de TFG<60mL/min/1,73m2 pela fórmula do CKD‐EPI foi preditor independente de evolução para injúria renal aguda. Na nossa amostra, outros fatores clássicos de NIC, independentes da função renal prévia, se confirmaram, como vigência de síndrome coronariana aguda, tipo e volume do contraste empregado. A ausência de fatores clássicos para NIC na presente análise é multifatorial, especialmente em função do tamanho reduzido da amostra (principalmente em relação a idade e prevalência de diabetes) e de informações incompletas no banco de dados utilizado (níveis de hemoglobina sérica e fração de ejeção do ventrículo esquerdo)39–41.
Particularmente, em relação ao fato de indivíduos do sexo masculino e de maior peso corporal, a TFG calculada pela equação do CKD‐EPI teve valores absolutos menores. Em relação ao peso, o impacto matemático desta variável sobre a estimativa da TFG pela fórmula do CKD‐EPI é menor do que quando aplicado à equação de C‐G. Desse modo, existe maior pré‐disposição para C‐G subestimar a TFG em indivíduos obesos e com sobrepeso, os quais foram maioria na nossa amostra. No que diz respeito ao gênero, a fórmula de C‐G usa como fator de correção o valor de 0,85 para o sexo feminino. Já no CKD‐EPI, o índice de correção é de 0,7 para homens e 0,9 para mulheres, ambos em forma de potência com expoente negativo, influenciando de maneira diretamente proporcional a estimativa de TFG13,15,25,42.
Apesar da frequência de uso de diferentes categorias de meio de contraste ter divergido significativamente entre os indivíduos que evoluíram ou não para NIC, isso não aconteceu quando categorizamos os pacientes quanto a presença de disfunção renal prévia pela fórmula do CKD‐EPI. Fato confirmado na análise multivariada, onde ratificamos a reclassificação da função renal pré‐ICP como preditor de evolução para NIC, independente do agente de contraste empregado.
Adicionalmente, a análise da curva ROC nos mostra que valores de Cr menores que 1,0mg/dL, tem sensibilidade de 100% para o achado de TFG CKD‐EPI<60mL/min/1,73m2, porém com especificidade intermediária. Desse modo, como a prevenção de NIC é baseada no melhor rastreio possível de populações de risco, um valor de Cr de 1,0mg/dL representa o ponto de corte ideal para esta variável, com ótima sensibilidade e especificidade intermediária, para que se considere aplicar a fórmula do CKD‐EPI, em conjunto ou em detrimento à de C‐G, na avaliação de pacientes pré‐ICP.
Uma das limitações deste estudo é o fato de que, independente da equação utilizada, o peso considerado no cálculo da TFG foi o peso real, não o ideal previsto para altura e idade. Além disso, as equações não foram comparadas com a medida laboratorial da TFG, de modo que não é possível afirmar que o CKD‐EPI é mais sensível que C‐G na estimativa de TFG medida<60ml/min. Adicionalmente, as estimativas de TFG, independente da equação utilizada, podem ser imprecisas quando os níveis séricos de Cr não estão estáveis, como pode acontecer após exposição a agente de contraste iodado. O uso de estimativas da TFG nesse contexto representa uma extrapolação não ideal. Por fim, as informações utilizadas nas análises foram resgatadas fundamentalmente de banco de dados eletrônico. Tal abordagem está sujeita aos vieses peculiares a este tipo de coleta de dados, sendo o subregistro de variáveis não desprezíveis o problema mais comum.
Dado o caráter retrospectivo desta pesquisa, é necessário estudo randomizado, prospectivo, estimando a TFG tanto por C‐G como CKD‐EPI, e comparando o efeito de medidas profiláticas para NIC nos indivíduos com TFG superestimada pela primeira equação, especialmente hidratação com salina isotônica antes e depois da exposição ao agente de contraste.
ConclusõesUma vez que o desenvolvimento de NIC tem implicações prognósticas importantes – incluindo mortalidade aumentada –, a estratificação acurada dos indivíduos sob maior risco dessa condição é imprescindível.
A aplicação da equação do CKD‐EPI para a avaliação da TFG, em detrimento ou mesmo conjuntamente, à de C‐G no momento da avaliação pré‐ICP, tem importante papel na prevenção da NIC. Em especial, indivíduos com sCr menor que 1,0mg/dL, do sexo masculino, obesos e aqueles cujo procedimento seja motivado por síndrome coronariana aguda podem ter maior benefício com esta abordagem.
Conflito de interessesOs autores declaram não haver conflito de interesses.