O encerramento percutâneo (EP) de defeitos do septo interauricular (SIA) é uma técnica comprovadamente eficaz para o tratamento da comunicação interauricular (CIA) e prevenção de embolia paradoxal em doentes com foramen ovale patente (FOP). A monitorização com ecocardiograma transesofágico (ETE) é o método habitualmente utilizado mas o ecocardiograma intracardíaco (EIC) constitui uma alternativa prática e segura para o controlo imagiológico destes procedimentos.
ObjetivoApresentar a experiência de um centro no EP de CIA e FOP guiado exclusivamente por EIC.
MétodosAnalisámos retrospetivamente uma série de doentes consecutivos com CIA ou FOP submetidos a EP sob controlo por EIC no período de janeiro de 2008 a dezembro de 2010. Foram todos avaliados clínica, eletro e ecocardiograficamente à data da alta e após o 1.°, 3.°, 6.° e 12.° mês para excluir shunt residual (SR) e malaposição do dispositivo.
ResultadosUm total de 127 doentes (46,6 ± 12,2 anos; 71% de mulheres) foi submetido a EP de CIA ou FOP durante o referido período. A utilização do EIC durante o EP permitiu a colocação eficaz dos dispositivos em 100% dos casos, com uma reduzida taxa de complicações, dispensando a utilização adicional de outras técnicas de imagem durante os procedimentos.
ConclusãoO EIC fornece informação anatómica detalhada da CIA/FOP e estruturas cardíacas adjacentes, facilitando assim os procedimentos de intervenção. Elimina os inconvenientes do ETE e possibilita ao cardiologista de intervenção controlar os vários aspetos do procedimento sem necessitar de apoio ecocardiográfico adicional.
Device closure of interatrial communications has become a well-established technique to treat left-to-right shunt associated with atrial septal defect (ASD) and to prevent paradoxical embolism in patients with patent foramen ovale (PFO). Guidance by transesophageal echocardiography (TEE) is the standard practice but intracardiac echocardiography (ICE) is a feasible and safe alternative for monitoring these procedures.
ObjectivesTo report our experience in the percutaneous closure of ASD and PFO guided by ICE.
MethodsWe retrospectively reviewed all patients with ASD or PFO who underwent percutaneous closure guided exclusively by ICE between January 2008 and December 2010. All patients were followed clinically with regular echocardiographic evaluation (at discharge, one month, three, six and twelve months) to exclude residual shunt and device malposition.
ResultsA total of 127 patients (mean age 46.6±12.2 years; 71% female) underwent transcatheter device closure of ASD or PFO during the study period. Device deployment with ICE monitoring was 100% successful, with a low rate of complications and eliminating the need for additional imaging techniques.
ConclusionsICE provides anatomical detail of ASD/PFO and cardiac structures, facilitating congenital cardiac interventional procedures. It eliminates the major drawbacks associated with TEE and enables the interventional cardiologist to control all aspects of the procedure without relying on additional echocardiographic support.
O encerramento percutâneo de CIA ou FOP tornou-se uma alternativa eficaz e segura ao tratamento cirúrgico. Com os dispositivos atuais e com a evolução das técnicas de implantação, mais de 80% dos defeitos do septo interauricular são passíveis de encerramento por via percutânea1. No entanto, a sua caracterização com a medição do orifício e respetivos bordos é essencial para um encerramento eficaz e sem complicações. Os métodos mais frequentemente utilizados para seleção do dispositivo e a sua colocação incluem a avaliação angiográfica com medição por balão2,3 e monitorização por ETE4,5. O ETE, sendo um método eficaz nesta monitorização, envolve na maioria dos casos anestesia geral (com ou sem intubação endotraqueal), para evitar o desconforto associado à presença da sonda durante o procedimento6. Apesar de pouco frequentes, foram relatados riscos de aspiração e obstrução da via aérea, perfuração esofágica e disfunção das cordas vocais7,8.
O desenvolvimento do ecocardiograma intracardíaco (EIC) veio trazer uma nova dimensão às técnicas de imagem disponíveis para os cardiologistas9. Com o transdutor posicionado na aurícula direita, o EIC permite a visualização direta da morfologia do septo interauricular, o tamanho do defeito e excluir a presença de defeitos adicionais. Os atuais transdutores de EIC fornecem imagens de elevada qualidade, possibilitando a aquisição de múltiplos planos através do cateter quadridirecional e estudo Doppler completo.
Com este trabalho pretendemos apresentar a experiência de um centro no encerramento percutâneo de CIA e FOP guiado exclusivamente por EIC.
Material e métodosPopulação estudadaUm total de 127 doentes consecutivos (média de idades 46,6 ± 12,2 anos; 71% de mulheres) foi referenciado para o nosso centro para encerramento percutâneo de defeitos do septo interauricular no período de janeiro de 2008 a dezembro de 2010. De acordo com o protocolo do serviço, todos os doentes foram avaliados por ETE antes do procedimento de intervenção. Os critérios de inclusão para encerramento de CIA incluíram um QP/QS > 1,5, a presença de cavidades direitas dilatadas, história prévia de acidente vascular cerebral (AVC) ou acidente isquémico transitório (AIT) criptogénico. As indicações para encerramento de FOP incluíram história prévia sugestiva de mecanismo embólico paradoxal em doentes com evidência imagiológica de múltiplos focos isquémicos ou então antecedentes de AVC/AIT criptogénico (sem causa conhecida).
Todos os doentes com AVC/AIT criptogénico e suspeita de mecanismo embólico paradoxal foram avaliados previamente pela Neurologia.
Estudo ecocardiográficoA avaliação por ETE foi realizada com o ecógrafo Vivid 7da GE (General Electric Corp, Norfolk, VA, EUA) recorrendo ao teste de microbolhas e manobra de Valsalva, procedimento que foi realizado sob anestesia local. O diagnóstico de FOP era estabelecido caso se verificasse a passagem de microbolhas para as cavidades esquerdas nos três batimentos cardíacos após opacificação das cavidades direitas. Foi ainda avaliada a presença de critérios anatómicos de alto risco para embolia paradoxal: aneurisma do septo interauricular (ASA – definido pela protusão de pelo menos 10mm para além do plano do septo interauricular), válvula de Eustáquio exuberante, túnel largo ou longo (comprimento ≥12mm) ou a presença de shunt espontâneo.
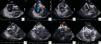
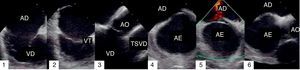
Os procedimentos de EIC foram realizados com o cateter 8F AcuNav (produzido pela Siemens Medical Solutions e distribuído pela Biosense Webster). Este cateter possui um transdutor de 64 elementos (5,5-10MHz) com penetração de 1 a 15cm de profundidade e todas as funções de Doppler (Doppler tecidular, contínuo, pulsado e codificado em cor). O estudo de imagem por EIC inicia-se avançando o cateter sob controlo fluoroscópio até à aurícula direita média com uma rotação horária de 15-30° (designada Home View). A este nível é possível visualizar a válvula tricúspide, aurícula e ventrículo direito (Figura 1.1). Após retirar ligeiramente o cateter até à aurícula direita inferior observa-se a válvula de eustáquio (Figura 1.2). Na posição de home view e com o cateter direcionado para a válvula tricúspide, rodamos 30-45° no sentido horário e visualizamos o trato de saída do ventrículo direito e válvula aórtica (Figura 1.3). A parte anterior do septo pode ser observada nesta incidência com um pouco mais de rotação horária (Figura 1.4). Fletindo posteriormente o cateter, o transdutor fica direcionado para o septo interauricular (SIA, Figura 1.5), visualizando-se assim o septo, seio coronário e veias pulmonares, dependendo da localização exata do transdutor (Septal view). Após bloquear a extremidade distal nesta posição, é possível visualizar outras incidências através da rotação ântero-posterior ou da esquerda para a direita. Avançando o cateter superiormente permite observar a veia cava superior e a sua relação com o SIA. O mesmo SIA é visualizado na sua extensão superior e inferior, correspondendo à incidência em eixo longo no ETE. O cateter é bloqueado nessa posição, seguido de rotação horária até se localizar próximo do anel da válvula tricúspide e inferiormente à válvula aórtica. Nesta incidência, com a flexão do transdutor para a direita, é possível visualizar a válvula aórtica em eixo curto e o SIA anterior (Figura 1.6).
A medição dos diâmetros da CIA, comprimento do SIA e dimensões dos bordos foi realizada em vários planos. Definiram-se como bordos insuficientes aqueles que apresentassem dimensões inferiores a 5mm (no caso do coto aórtico) e 7mm para os restantes.
Protocolo de encerramento e seleção do dispositivoFoi administrada terapêutica antibiótica profilática (cefuroxima 750mg) por via endovenosa uma hora antes do procedimento e heparina não fracionada (70U/kg) durante a intervenção. Todos os doentes iniciaram dupla antiagregação com ácido acetilsalicílico (AAS) 100mg e clopidogrel 75mg na véspera do encerramento, mantendo clopidogrel durante um mês e AAS durante seis meses no caso das CIA. Para os FOP recomendava-se AAS conforme indicação da neurologia (habitualmente por tempo indefinido).
O EIC foi a única técnica de imagem utilizada para guiar o posicionamento do dispositivo e a sua colocação. O procedimento iniciava-se com a punção bilateral de ambas as veias femorais, com colocação de introdutor 8F na veia femoral direita para realização do cateterismo direito, quando necessário, sendo substituído por um introdutor 10F ou 12F para implantação do dispositivo. Na veia femoral esquerda era colocado um introdutor longo 8F de 24cm para a sonda do EIC.
Com base nos achados do EIC, os operadores selecionaram o dispositivo da família Amplatzer (PFO occluder, Cribriform occluder, ASD occluder, AGA Medical Corporation), Occlutech Figulla PFO or ASD ocluder, Solysafe septal ocluder (Swissimplant AG) ou o Premere Closure System (St Jude Medical). Após passagem de guia 0,35/260cm e colocação de cateter Multipurpose 6F ao nível do defeito do SIA, era trocada para guia Amplatzer Super Stiff que era introduzida até à veia pulmonar superior esquerda. Era então colocada a bainha de libertação do dispositivo escolhido e retirada a guia. Após progressão do dispositivo até ao defeito do SIA era libertado o disco distal na aurícula esquerda com a retirada da bainha. Utilizando simultaneamente a fluroscopia e o EIC, o dispositivo era colocado na sua totalidade com a libertação do disco proximal na aurícula direita. Após a confirmação da boa aposição, ausência de shunt residual ou de defeitos adicionais do SIA, o dispositivo era libertado de forma definitiva. Os dispositivos que se verificavam estar mal posicionados eram retirados e novamente reposicionados.
Foram avaliados os tempos de procedimento, fluoroscopia e duração do internamento hospitalar.
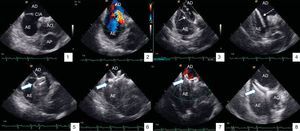
Exemplificamos na Figura 2 um caso de encerramento de CIA com Amplatzer ASD® de 22mm.
Encerramento de CIA monitorizada por ecocardiograma intracardíaco. 1) Visualização da CIA; 2) Doppler cor com shunt esquerdo-direito ao nível da CIA; 3) Medição com balão, estimando CIA em 19mm de diâmetro; 4) Baínha do dispositivo com guia colocada na VPSE; 5) Colocação inicial do dispositivo com libertação do disco distal na aurícula esquerda; 6) Libertação do disco proximal na aurícula direita; 7) Doppler de cor demonstrando ausência de shunt residual; 8) Libertação do dispositivo; AE: aurícula esquerda, AD: aurícula direita, Ao: aorta, AP: artéria pulmonar; CIA: comunicação interauricular; VPSE: veia pulmonar superior esquerda; Seta preenchida: Dispositivo Amplatzer®, Seta não preenchida: balão de medição; seta descontínua: bainha de dispositivo.
Todos os doentes foram reavaliados clínica, eletro e ecocardiograficamente com ETT à data da alta, ao 1.°, 3.°, 6.° e 12.° mês após implantação para excluir shunt residual (definido como muito ligeiro se largura do jato em Doppler côr <1mm, ligeiro se 1-2mm, moderado se 2-4mm e grave se > 4mm)10, malaposição do dispositivo ou outras complicações. Foram ainda efetuados ETE em casos de shunt residual ou em seguimentos de CIA de grandes dimensões (> 25mm).
ResultadosAs características clínicas e demográficas estão descritas na Tabelas 1 e 2, respetivamente. De um total de 127 doentes submetidos a EP, 71 (56%) tinham FOP e 56 (44%) uma CIA, 19 das quais eram multifenestradas (34%). A média de idade dos doentes com CIA foi de 44,5±14,4 anos e de 48,2±10,1 anos para os doentes com FOP. O sexo feminino era predominante em ambos os grupos.
Características clínicas
| FOP | 71 | CIA | 56 |
| História de AVC/AIT, n (%) | 62 (88%) | Dilatação das cavidades direitas ou Qp/Qs > 1,5 | 42 (75%) |
| Um único evento | 51 | História de AVC/AIT | 14 (25%) |
| Eventos recorrentes | 11 | ||
| RM ou TC positivo (sem história de AVC) | 9 (12%) | ||
AIT: acidente isquémico transitório; AVC: acidente vascular cerebral; CIA: comunicação interauricular; FOP: foramen ovale patente; RM: ressonância magnética; TC: tomografia computorizada.
As características anatómicas e de intervenção estão descritas nas Tabelas 3 e 4, respetivamente. Dos doentes com CIA, 34 (60%) tinham bordos floppy e 21 (38%) tinham pelo menos um coto insuficiente. O diâmetro médio das CIA foi de 22,6±6,8mm. Dos 71 doentes com FOP, 62 (87%) tinham pelo menos um critério anatómico de alto risco: 34 (48%) com ASA, 28 (39%) com válvula de Eustáquio exuberante e 38 (54%) tinham shunt espontâneo associado. Um total de 53 doentes (49%) apresentava morfologia de túnel longo e quatro continham simultaneamente todos os critérios de alto risco.
Características anatómicas
| CIA | FOP | ||
| Número total (n) | 56 | Número total (n) | 71 |
| Diâmetro médio (mm) | 22,6 ± 6,8 mm | ASA (%) | 48% |
| Dimensões > 25mm, n (%) | 14 (25%) | Válvula Eustáquio exuberante (%) | 39% |
| Multifenestratadas, n (%) | 19 (34%) | Shunt espontâneo (%) | 54% |
| Com bordos «floppy», n (%) | 34 (60%) | Túnel longo (%) | 49% |
| Com bordos insuficientes, n (%) | |||
| 1 | 15 (27%) | ||
| 2 | 4 (7%) | ||
| 3 | 2 (4%) | ||
ASA: aneurisma do septo interauricular; CIA: comunicação interauricular; FOP: foramen ovale patente.
Características de intervenção
| CIA | FOP | ||
| Total de dispositivos (n) | 57 | Total de dispositivos (n) | 71 |
| Dispositivo implantado | Dispositivo implantado | ||
| Amplatzer | 53 (93%) | Amplatzer, n (%) | 29 (41%) |
| ASD | 34 | Cribiform | 25 |
| Cribiform | 19 | PFO | 4 |
| Occlutech ASD | 3 (5%) | Premere, n (%) | 36 (51%) |
| Solysafe | 1 (2%) | Solysafe, n (%) | 5 (7%) |
| Occlutech PFO, n (%) | 1 (1%) |
CIA: comunicação interauricular; FOP: foramen ovale patente.
O procedimento foi bem sucedido em todos os doentes, incluindo um doente que necessitou da implantação simultânea de 2 dispositivos (Amplatzer 18mm e Amplatzer 25mm). Foi necessário mudar de dispositivo (alterando o tipo ou tamanho) em 3 casos, por presença de shunt residual peridispositivo.
No total, 82 doentes receberam dispositivos Amplatzer Septal Occluder, 36 receberam um dispositivo Premere, 6 doentes foram encerrados com Solysafe Occluder e os restantes 4 com um Occlutech. O tempo médio do procedimento foi de 43,2±10,1 minutos e o tempo médio de fluoroscopia de 7,6±3,3 minutos. A duração média do internamento foi de 2,2±0,5 dias.
SeguimentoVerificou-se um caso de hematoma femoral direito no pós procedimento imediato, resolvido apenas com medidas compressivas e vigilância, prolongando o internamento por mais 24h.
No follow-up (FUP, médio de 16±10 meses), 3 doentes apresentaram um shunt residual de grau ligeiro (confirmado por ETE) e verificou-se um caso de perturbação transitória do ritmo cardíaco (uma jovem de 28 anos com ritmo juncional no 3.° mês pós procedimento – O Holter de 24h realizado posteriormente não demonstrou recorrência de arritmias e a doente permaneceu assintomática). Houve um caso de AVC 6 meses após o encerramento de FOP, apesar de não ser visualizado shunt residual (confirmado por ETE com administração de soro agitado). Não se verificou nenhum caso de embolização de dispositivo, erosão aórtica ou trombose do dispositivo.
DiscussãoA monitorização ecocardiográfica é prática habitual durante o encerramento percutâneo de CIA e FOP, sendo o ETE o método mais utilizado para o efeito. Apresenta no entanto limitações, nomeadamente a necessidade de anestesia geral e a ocorrência de potenciais complicações associadas à manipulação da via aérea na posição de decúbito dorsal3. Vários estudos pequenos demonstraram que a utilização da ecocardiografia intracardíaca com cateter AcuNav® é uma alternativa prática e precisa para o encerramento de CIA ou FOP11–14. Embora não tenha sido objetivo deste estudo uma análise de custo-efetividade, já que é difícil o cálculo das despesas diretas e indiretas relativas ao uso de ETE associado a anestesia geral num hospital público, alguns estudos publicados sugerem também um benefício económico desta técnica para os gastos globais do procedimento15,16.
A cuidadosa avaliação do septo interauricular, aurícula direita e suas relações anatómicas revelaram-se fundamentais para um encerramento seguro e eficaz dos defeitos do septo interauricular17. O EIC demonstrou ser preciso na medição da fossa ovalis e dos bordos da CIA, facilitando a escolha adequada das dimensões do dispositivo a colocar18. Revela-se ainda uma técnica de imagem equivalente para a medição do defeito do septo e na monitorização de procedimentos com anatomia complexa12,18.
Na nossa casuística, a seleção adequada dos doentes e avaliação cuidadosa da anatomia do SIA traduziu-se numa elevada taxa de sucesso no encerramento dos defeitos do SIA, associada a uma percentagem reduzida de complicações. Verificaram-se apenas 3 casos de shunt residual no FUP, todos eles de grau ligeiro, sem repercussão clínica. Aliás, a importância prognóstica do shunt residual após encerramento parece correlacionar-se diretamente com as suas dimensões. A presença de shunt residual moderado ou grave aumenta em cerca de 4 vezes o risco de recorrência de eventos embólicos paradoxais, enquanto pequenos shunts não parecem ter significado clínico a longo prazo19,20. Registou-se ainda um pequeno número de doentes com perturbações de ritmo sem tradução clínica, documentando-se um caso de ritmo juncional transitório. Apesar de não ser objetivo deste artigo discutir as indicações para encerramento percutâneo dos defeitos do SIA, o caso de AVC recorrente que apresentamos na nossa série relembra ainda a necessidade de selecionar adequadamente os doentes para este tipo de procedimentos.
Finalmente, o ETE, apesar de não ser utilizado durante os procedimentos, é fundamental para o diagnóstico correto e para avaliar a possibilidade de encerramento por via percutânea. Com os dados obtidos intraprocedimento pelo EIC, adquirimos informação complementar importante para a implantação adequada dos dispositivos.
ConclusõesNa nossa série, o EIC forneceu excelente detalhe anatómico das CIA ou FOP, nomeadamente quanto à sua localização e tamanho, tipo de bordos e relação com estruturas adjacentes. Permitiu guiar de forma eficaz a correta implantação dos dispositivos, com baixa taxa de complicações e eliminou as principais limitações associadas ao ETE, como a necessidade de anestesia geral e problemas associados com a manipulação da via aérea. Finalmente, forneceu ao cardiologista de intervenção a possibilidade de controlar todos os aspetos do procedimento sem necessidade de suporte ecocardiográfico adicional.
Conflito de interessesOs autores declaram não haver conflito de interesses.