A cardiotoxicidade é um dos efeitos adversos mais significativos do tratamento oncológico, responsável por uma considerável morbimortalidade. Entre os eventos lesivos dos agentes/fármacos quimioterápicos no sistema cardiovascular, destaca-se, pela sua maior frequência e gravidade, a ocorrência de insuficiência cardíaca com disfunção ventricular sistólica. Outros efeitos tóxicos cardiovasculares incluem hipertensão arterial, doença tromboembólica, doenças pericárdicas, arritmias e isquemia miocárdica. Durante várias décadas, a cardiomiopatia induzida por terapêutica oncológica era quase exclusivamente associada ao uso de doses cumulativas de antraciclinas, que promovem lesões permanentes a nível celular. No entanto, o uso de novos agentes terapêuticos, como o anticorpo monoclonal trastuzumab, induz uma disfunção transitória reversível dos miócitos sem que haja relação com a dose utilizada. Atualmente, é essencial para os doentes com cancro a identificação precoce da lesão cardiovascular, o diagnóstico preciso de eventos cardiotóxicos e a implementação de planos de monitorização adequados. Neste contexto, é fulcral na prática clínica uma cooperação estreita entre cardiologistas e oncologistas, de forma a equilibrar os riscos cardiotóxicos com os benefícios da terapia antineoplásica em doentes oncológicos. Neste artigo revimos as diversas respostas cardiotóxicas ao uso de tratamentos oncológicos e a sua relação com os principais fármacos antineoplásicos usados na prática clínica. Além disso, serão abordadas as principais linhas de orientação no que respeita às estratégias de deteção/monitorização da cardiotoxicidade em indivíduos com cancro.
Cardiotoxicity is one of the most significant adverse effects of cancer treatment, and is responsible for considerable morbidity and mortality. Among the effects of chemotherapeutic agents on the cardiovascular system, the most frequent and serious is heart failure with ventricular systolic dysfunction. Other toxic effects include hypertension, thromboembolic disease, pericardial disease, arrhythmias and myocardial ischemia. For several decades, cancer therapy-induced cardiomyopathy was almost exclusively associated with the use of cumulative doses of anthracyclines, which cause permanent damage at the cellular level. However, new therapeutic agents, such as the monoclonal antibody trastuzumab, induce transient reversible myocyte dysfunction which is unrelated to the dose used. Early identification of potential cardiovascular injury, accurate diagnosis of cardiotoxic events and implementation of appropriate monitoring plans are essential in patients with cancer. Close cooperation between cardiologists and oncologists is thus crucial, in order to balance the risks and benefits of cardiotoxic anticancer therapy. In this article we review the various responses to cardiotoxic cancer treatments and their relationship with the main antineoplastic drugs used in clinical practice. In addition, we discuss the main guidelines on detection and monitoring of cardiotoxicity in patients with cancer.
Ao longo dos últimos anos, a terapêutica oncológica tem evoluído drasticamente. O desenvolvimento e a implementação de intensivos tratamentos antineoplásicos melhoraram substancialmente o prognóstico dos doentes oncológicos1. No entanto, apesar do benefício clínico inquestionável deste tipo de terapia, não se deve subestimar o perfil de segurança no seu uso. De facto, devido aos seus mecanismos de ação, muitos destes fármacos podem causar efeitos nefastos no sistema cardiovascular2,3.
Atualmente, o cancro é a segunda maior causa de morte em Portugal, logo a seguir às doenças cardiovasculares4, e o cancro colorretal a principal causa de morte oncológica5. Durante várias décadas, estas reações cardiotóxicas a tratamentos antineoplásicos eram quase exclusivamente associadas ao uso de antraciclinas. Mais recentemente, uma nova dimensão do problema surgiu quando foram reconhecidos clinicamente alguns efeitos indesejáveis, no sistema cardiovascular, de drogas que interferem na atividade de certos recetores associados a cínases da tirosina ou recetores tumor (recetores de estrogénios)3,6.
Grande parte da literatura científica sobre a cardiotoxicidade da terapêutica oncológica incide unicamente sobre a ocorrência de cardiomiopatia; no entanto, esta é apenas uma das várias condições que podem comprometer a função cardiovascular7. Outros efeitos sobre a vasculatura resultam em isquemia ou alterações na pressão arterial8 e, no pericárdio, as terapias antineoplásicas podem causar o seu espessamento ou uma instabilidade no equilíbrio do fluido pericárdico, levando a derrame9. Além disso, este tipo de tratamento aumenta o risco de arritmias em pacientes predispostos a ectopia cardíaca10.
A proteção da função cardíaca representa atualmente um desafio constante para a indústria farmacêutica, as autoridades reguladoras e para os médicos que enfrentam, na prática clínica, reações adversas a diversos agentes terapêuticos3. A avaliação de doentes expostos a fármacos antineoplásicos, a análise do risco envolvido na utilização destes para qualquer indivíduo ou grupo de doentes com cancro, a prevenção ou redução de lesão cardíaca, a monitorização da função cardíaca durante e após a terapêutica, e o tratamento da cardiotoxicidade relacionada com a quimioterapia tem gerado uma vasta área de conhecimento científico que tem sido denominada de «cárdio-oncologia»7,11.
Ao longo da presente revisão, iremos abordar as diversas respostas cardiotóxicas ao uso de tratamentos oncológicos e a sua relação com os principais fármacos antineoplásicos usados na prática clínica. Além disso, serão analisadas as últimas linhas de orientação no que respeita às estratégias de deteção/monitorização da cardiotoxicidade em indivíduos com cancro.
Definição de cardiotoxicidadeA existência de uma descrição padronizada de cardiotoxicidade é essencial para fins assistenciais e de investigação na população doente3. Uma das definições clínicas mais precisas foi formulada pelo Comité de Avaliação e Revisão Cardíaca (CREC) durante a supervisão de ensaios terapêuticos com trastuzumab (Tabela 1)12. Estes critérios não incluem as lesões cardiovasculares subclínicas que podem ocorrer no início de resposta a alguns agentes quimioterápicos13.
Critérios para confirmar ou classificar um diagnóstico preliminar de disfunção cardíaca
| i) Cardiomiopatia caracterizada por uma diminuição da FEVE, global ou mais grave no septo |
| ii) Sintomas associados a IC |
| iii) Sinais associados a IC, como o galope S3, taquicardia, ou ambos |
| iv) Redução da FEVE de pelo menos 5 para menos de 55% com sinais ou sintomas de IC, ou uma queda na FEVE de pelo menos 10 para menos de 55%, sem sinais ou sintomas |
Adaptado de: Seidman et al.12
FEVE: fração de ejeção do ventrículo esquerdo; IC: insuficiência cardíaca.
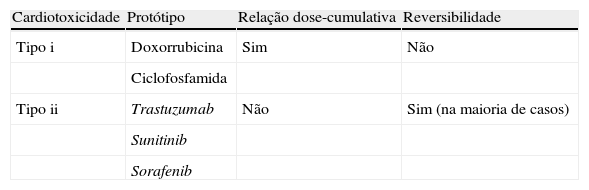
O padrão de cardiotoxicidade das terapêuticas oncológicas é a cardiomiopatia relacionada com as antraciclinas7. As primeiras evidências indicaram que a disfunção sistólica do ventrículo esquerdo (VE) estava intimamente relacionada com o uso de doses cumulativas de antraciclinas. Segundo Lefrak et al., administrações repetidas podem resultar em lesões permanentes a nível celular e intersticial, frequentemente associadas ao risco de ocorrência de insuficiência cardíaca refratária14. Mais recentemente, o uso de novos agentes terapêuticos, como o anticorpo monoclonal trastuzumab, embora também possam causar cardiomiopatia, induzem uma disfunção transitória reversível dos miócitos sem que haja relação com a dose utilizada, resultando num prognóstico clínico mais favorável12,15.
Os fármacos antineoplásicos, como as antraciclinas, que causam predominantemente lesões irreversíveis têm sido classificados como agentes tipo i, sendo os agentes tipo ii aqueles que não acarretam uma destruição celular irreversível15 (Tabela 2). As características dos agentes terapêuticos tipo ii têm permitido o seu uso durante anos até ao aparecimento de sinais de lesão cardíaca e a sua reintrodução, com risco aceitável, após a recuperação cardíaca16. No entanto, alguns ensaios clínicos têm posto em causa a reversibilidade dos efeitos cardiotóxicos deste tipo de fármacos. De facto, o uso de terapias combinadas (agentes tipo i e ii) induz uma elevada incidência de disfunção cardíaca, acima do expectável, em doentes com cancro17.
As antraciclinas, como a doxorrubicina (DOX), epirrubicina (EPI) e daunorrubicina (DNR), permanecem entre os agentes antineoplásicos mais usados no tratamento de uma ampla variedade de tumores sólidos e neoplasias hematológicas3. Infelizmente, a preocupação gerada na comunidade médica em torno da sua cardiotoxicidade ainda limita a sua utilização. Apesar de mais de 40 anos de investigação, os mecanismos de ação responsáveis pela toxicidade cardíaca inerente ao uso de doses cumulativas de antraciclinas ainda não foram completamente elucidados3,7.
Efeitos cardiotóxicos a curto e longo prazoA cardiotoxicidade pode ocorrer de forma aguda ou crónica, podendo surgir anos após a conclusão do tratamento.
A cardiotoxicidade aguda induzida pelas antraciclinas é rara, transitória e independente da dose utilizada. Caracteriza-se por alterações súbitas da repolarização ventricular, alterações eletrocardiográficas no intervalo Q-T, arritmias ventriculares e supraventriculares, síndromes coronárias agudas, pericardite e miocardite. Estas alterações são geralmente observadas desde o início do tratamento até 14 dias após o término do mesmo.
Por outro lado, a forma crónica é dependente da dose usada clinicamente e pode ser diferenciada em 2 tipos, de acordo com o início dos sintomas clínicos. O primeiro tipo ocorre no início, ao longo do primeiro ano após o término da quimioterapia, e o segundo tipo ocorre tardiamente, mais de um ano depois do tratamento. A manifestação mais característica de cardiotoxicidade crónica é a disfunção ventricular sistólica ou diastólica que pode levar a cardiomiopatia grave e, em última instância, mesmo à morte3,13.
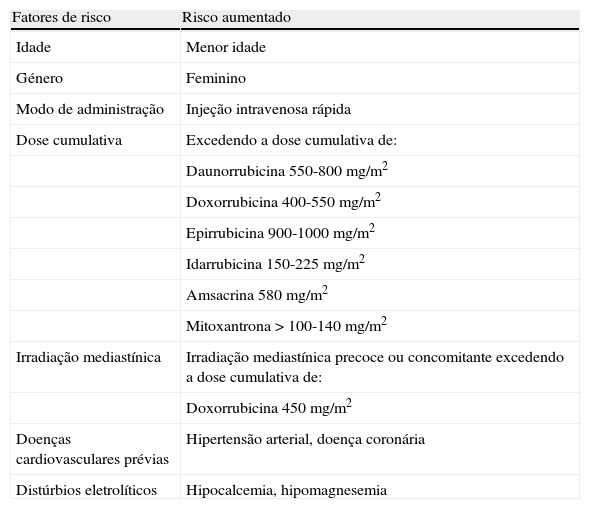
Fatores de riscoA progressão e o grau de cardiotoxicidade inerente ao uso deste tipo de fármacos são variáveis entre indivíduos. Tal deve-se à influência de diversos fatores de risco (Tabela 3), bem como à própria predisposição genética3.
Fatores de risco associados à cardiotoxidade das antraciclinas
| Fatores de risco | Risco aumentado |
| Idade | Menor idade |
| Género | Feminino |
| Modo de administração | Injeção intravenosa rápida |
| Dose cumulativa | Excedendo a dose cumulativa de: |
| Daunorrubicina 550-800 mg/m2 | |
| Doxorrubicina 400-550 mg/m2 | |
| Epirrubicina 900-1000 mg/m2 | |
| Idarrubicina 150-225 mg/m2 | |
| Amsacrina 580 mg/m2 | |
| Mitoxantrona > 100-140 mg/m2 | |
| Irradiação mediastínica | Irradiação mediastínica precoce ou concomitante excedendo a dose cumulativa de: |
| Doxorrubicina 450 mg/m2 | |
| Doenças cardiovasculares prévias | Hipertensão arterial, doença coronária |
| Distúrbios eletrolíticos | Hipocalcemia, hipomagnesemia |
A dose cumulativa total é o principal fator de risco para a ocorrência de insuficiência cardíaca congestiva relacionada com a utilização de antraciclinas18. No entanto, não existe nenhuma dose absolutamente segura a nível cardiotóxico, sendo que esta deve ser sempre equilibrada com o seu grau de eficácia antineoplásica19. Além disso, a duração da administração também poderá influenciar o risco relativo de desenvolver cardiotoxicidade durante ou após a terapia oncológica. De facto, o uso de tratamentos de administração prolongada tem reduzido o grau de lesões cardíacas20. Por outro lado, indivíduos tratados numa idade mais jovem parecem ser mais vulneráveis aos efeitos cardiotóxicos induzidos por este tipo de fármacos21.
Todos os fatores de risco estão intimamente relacionados com a cardiotoxicidade precoce e tardia, e não com a que surge de forma aguda3.
Mecanismos fisiopatológicosVários mecanismos têm sido sugeridos para explicar a fisiopatologia da cardiotoxicidade induzida pelas antraciclinas, embora ainda sejam desconhecidas as razões pelas quais estes afetam preferencialmente os cardiomiócitos. Os principais processos propostos envolvem a peroxidação lipídica e o stress oxidativo nos cardiomiócitos22. Como consequência do próprio mecanismo de ação das antraciclinas, está comprometida a síntese de DNA, RNA e proteínas23, bem como de importantes fatores de transcrição envolvidos na regulação de genes cardioespecíficos24,25. Esta diminuição na expressão proteica acoplada a um aumento da degradação de miofilamentos leva a um balanço negativo das proteínas sarcoméricas, como a titina, nas células cardíacas (sarcopenia cardíaca)26. Por outro lado, a redução miofilamentar pode ser potenciada com a utilização de terapias combinadas (antraciclinas e o anticorpo monoclonal trastuzumab)16. O uso desta terapêutica também poderá, a nível mitocondrial, afetar a bioenergética27 e induzir lesões no DNA28. Além disso, as antraciclinas causam um desequilíbrio na regulação dinâmica da função cardíaca, promovendo alterações na atividade adrenérgica, na adenilato ciclase29 e na homeostasia do cálcio27,30. Dados clínicos e experimentais sugerem como mecanismo alternativo de cardiotoxicidade a indução de morte nas células cardíacas, por apoptose ou necrose, após cada exposição às antraciclinas. Dada a capacidade limitada de regeneração do músculo cardíaco, a redução cumulativa do número de cardiomiócitos promove a remodelagem ventricular22. Mais recentemente, de Angelis et al. demonstraram que a cardiomiopatia promovida pela DOX também pode ser mediada pela redução de células estaminais cardíacas e revertida através da recuperação funcional das células progenitoras31.
Estratégias para limitar a cardiotoxicidadeEmbora não exista nenhum método clinicamente aceite, têm sido adotadas diversas estratégias com o intuito de limitar ou prevenir a cardiotoxicidade das antraciclinas. Entre elas, destacam-se a síntese de análogos de compostos naturais, o desenvolvimento de formulações específicas para determinado tumor e o uso clínico de agentes cardioprotetores32.
Síntese de análogos dos compostos naturaisA alteração estrutural de antraciclinas tem resultado em compostos com baixos níveis de cardiotoxicidade, permitindo a administração de doses terapêuticas mais elevadas22. A EPI33 e a idarrubicina (IDA)34 surgem atualmente, na terapêutica oncológica, como alternativas úteis ao uso de DOX e DNR, respetivamente. Outras antraciclinas, como a pirarrubicina e aclarrubicina, embora já tenham sido registadas em alguns países, ainda não desempenham um papel significativo em termos globais35.
Epirrubicina. A EPI é um epímero semissintético da DOX com um espectro oncológico idêntico36. Embora possua um mecanismo de ação idêntico à DOX, algumas propriedades físico-químicas e farmacocinéticas estão alteradas32. Comparada com a DOX, a cardiotoxicidade da EPI é significativamente menor quando administrada em doses que resultam em níveis idênticos de mielossupressão36.
Idarrubicina. A IDA é um análogo estrutural da DNR, que se intercala ao DNA, interage com a topoisomerase ii e tem um efeito inibidor sobre a síntese do ácido nucleico32. Este composto possui uma elevada lipofilicidade, permitindo uma elevada absorção celular32. A IDA pode ser administrada por via intravenosa ou oralmente. Contudo, atualmente têm sido postas em causa as vantagens deste agente antineoplásico na diminuição dos efeitos cardiotóxicos32,37.
Formulações específicas para determinado tumorDe forma a limitar a absorção das antraciclinas no tecido cardíaco têm sido desenvolvidas novas técnicas no transporte dos agentes antineoplásicos38.
Atualmente, a incorporação lipossómica de DOX e DNR representa o principal método de condução passiva das antraciclinas ao tumor alvo39. Este procedimento oferece uma cardioproteção substancial, aumentando o tamanho molecular do fármaco através de encapsulação e prolongando o seu tempo de eliminação, de modo a permanecer no organismo com menos efeitos adversos. Além disso, a incorporação lipossómica permite a fixação da droga longe de órgãos que possuem junções capilares normais, penetrando facilmente em locais com um sistema vascular imaturo, como nas neoplasias38.
Por outro lado, as pró-drogas de antraciclinas, ao contrário dos compostos lipossómicos, conseguem atingir o tecido tumoral por uma via ativa. Várias pró-drogas têm sido obtidas por um processo de conjugação com péptidos, hidratos de carbono, anticorpos, proteínas séricas ou polímeros sintéticos35. Estes conjugados são incapazes de penetrar em células normais, sendo ativadas especificamente por células neoplásicas35,40.
Agentes cardioprotetoresNa comunidade médica é cada vez mais premente o estabelecimento de estratégias farmacológicas que protejam o sistema cardiovascular, sem interferir com os mecanismos antineopásicos associados ao uso de antraciclinas32,41.
Atualmente, tendo em conta o papel patogénico das espécies reativas de oxigénio (ERO) e do stress oxidativo na cardiotoxicidade induzida pelas antraciclinas, têm-se estudado drogas e compostos naturais capazes de melhorar as defesas antioxidantes dos cardiomiócitos41. Várias classes de fármacos, incluindo antioxidantes, agentes quelantes de ferro e drogas hipolipemiantes, foram testadas, tanto em modelos animais como em doentes humanos41–43. No entanto, a eficácia cardioprotetora de alguns compostos é bastante questionável42,43. O dexrazoxane (Cardioxane®) é a única droga certificada para uso clínico para a prevenção dos efeitos cardiotóxicos induzidos pelas antraciclinas44. Porém, a sua utilização é atualmente controversa, tendo sido associada a um eventual comprometimento da eficácia oncológica e a um possível aumento de neoplasias secundárias, pelo que o seu uso foi restrito pela U.S. Food and Drug Administration (FDA) a doentes adultos45.
Tipo ii - TrastuzumabOs anticorpos monoclonais são um dos paradigmas da terapia-alvo oncológica e são amplamente utilizados no tratamento antineoplásico. No cancro da mama, aproximadamente 15 a 25% dos pacientes apresentam amplificação do gene HER2, resultando na sobre-expressão do recetor HER2 (recetor-2 do fator de crescimento epidérmico humano). O trastuzumab liga-se especificamente ao domínio extracelular do HER2, resultando na inibição da respetiva transdução do sinal7. Regimes de quimioterapia sem antraciclinas apresentam taxas menores de disfunção cardíaca quando comparados com regimes de uso combinado de trastuzumab e antraciclinas. Por outro lado, a associação de trastuzumab com vinorelbina, gemcitabina ou DOX lipossomal não demonstra um risco significativo de cardiotoxicidade46.
Fatores de riscoUm dos principais fatores de risco cardiotóxicos associados ao uso antineoplásico de trastuzumab é a utilização de elevadas doses cumulativas de antraciclinas (> 300mg/m2)47. Outros importantes fatores de risco incluem a disfunção ventricular esquerda associada ou não ao uso concomitante de antraciclinas, a pré-existência de hipertensão arterial sistémica, um índice de massa corporal superior a 25 e a idade avançada dos doentes. Por outro lado, o uso terapêutico simultâneo de irradiação torácica com trastuzumab é clinicamente viável48.
Além disso, dados recentes demonstraram que doentes oncológicos idosos (≥ 70 anos) com historial de doença cardíaca e/ou diabetes apresentam um aumento da incidência de efeitos cardiotóxicos associados ao uso de trastuzumab no tratamento do cancro da mama. Segundo Serrano et al., deve-se manter uma monitorização cuidada e contínua desta população49.
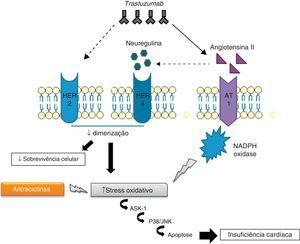
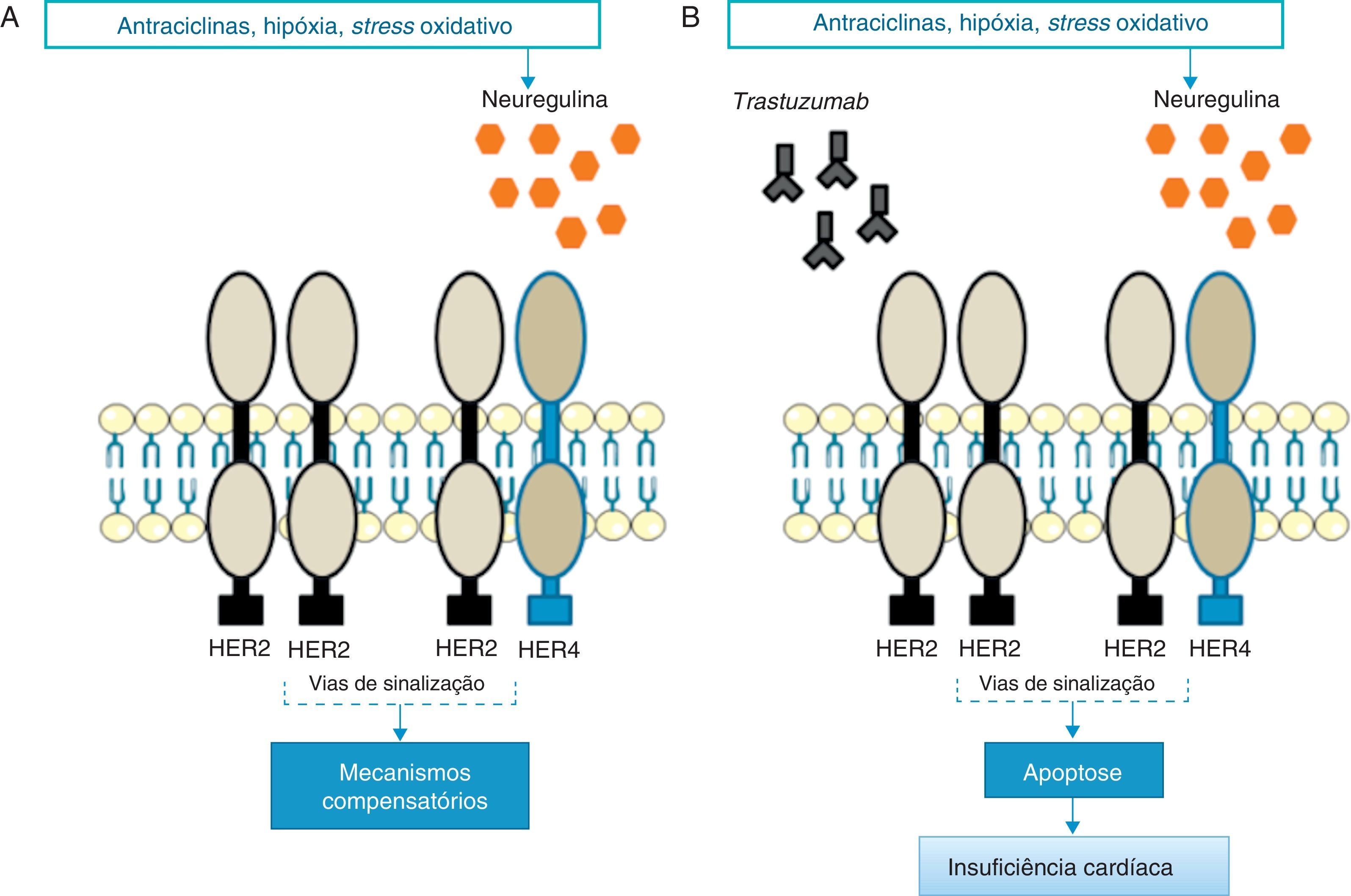
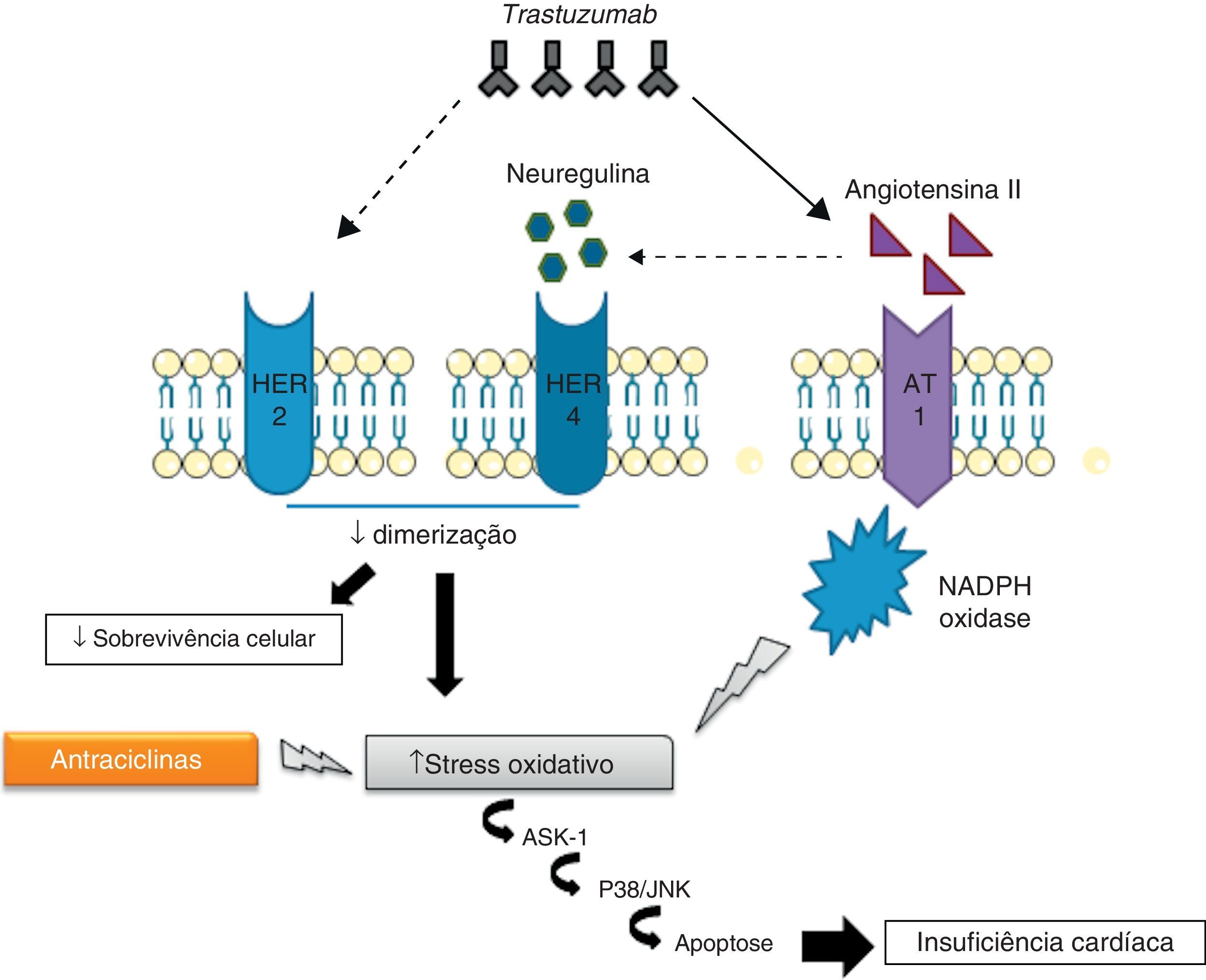
Mecanismos fisiopatológicosEmbora ainda não sejam conhecidos os mecanismos intracelulares exatos associados à ação fisiopatológica do trastuzumab, acredita-se que estes estejam intimamente relacionados com a sua ação inibitória sobre a sinalização cardíaca do HER2. Diversos estudos evidenciaram o importante papel do HER2 na sobrevivência e no desenvolvimento dos cardiomiócitos50,51. De facto, ratos manipulados geneticamente com níveis reduzidos de HER2 desenvolvem cardiomiopatia dilatada, menor capacidade adaptativa a condições de sobrecarga de pressão e maior sensibilidade à toxicidade associada ao uso de antraciclinas52,53. Por outro lado, a sobre-expressão de HER2 e/ou ativação da via de sinalização HER2/HER4 promovida pela neuregulina (NRG) confere, a nível celular, maior proteção face ao stress oxidativo e impede a ocorrência de apoptose54. Na verdade, foram determinados elevados níveis séricos de HER2 em indivíduos com insuficiência cardíaca crónica55 e, mais recentemente, foi demonstrado em ensaios clínicos que a administração de NRG-1 recombinante humana no tratamento de IC crónica estável melhora a função cardíaca, para além de ser bem tolerada pelos doentes56. De acordo com estes dados, se, por um lado, o stress cardíaco promove o aumento da expressão de HER2 e a ativação da via HER2/HER4 pela NRG, por outro, a inibição do HER2 pelo trastuzumab induz o desenvolvimento de disfunção ventricular57 (Figura 1).
Em resposta ao stress oxidativo, a NRG ativa mecanismos compensatórios através dos recetores HER2 (A); Na presença de trastuzumab, tanto os dímeros HER2/HER2 como HER2/HER4 estão bloqueados e os mecanismos compensatórios não atuam, promovendo a apoptose e IC (B) [Adaptado de: Di Cosimo57].
Contudo, o mecanismo fisiopatológico associado ao uso de trastuzumab é provavelmente mais complexo, não envolvendo apenas a inibição do HER2. De facto, dados recentes revelaram o aparecimento de níveis de toxicidade mínimos após o uso clínico de lapatinib, um inibidor da tirosina-cínase com dupla ação sobre a HER2 e o fator de crescimento epidérmico (EGF)58. Vários fatores poderão contribuir para a ocorrência de diferentes perfis cardiotóxicos entre estes dois fármacos. Estudos específicos analisaram o efeito das reações imunitárias citotóxicas promovidas pelo domínio IgG1 do trastuzumab nas lesões dos cardiomiócitos. Os dados mostraram que a indução de citotoxicidade celular dependente de anticorpos (ADCC) em células tumorais estava intimamente relacionada com a cardiotoxicidade59. Outro mecanismo proposto envolve uma resposta intracelular única após ativação do HER2 nos cardiomiócitos. Após ligar-se ao HER2, o trastuzumab regula a integridade mitocondrial através da família de proteínas BCL-X, promovendo a depleção de ATP e a consequente disfunção contrátil nos cardiomiócitos. Curiosamente, alguns estudos indicam que o lapatinib promove o efeito oposto, reduzindo a citotoxicidade do trastuzumab quando os dois fármacos são administrados concomitantemente60,61. Isto deve-se às diferentes ações que as drogas têm sobre a funcionalidade da proteína cínase ativada pelo AMP (AMPK): enquanto o trastuzumab inibe a AMPK, diminuindo a quantidade de ATP intracelular, o lapatinib, por sua vez, promove a sua atividade, aumentando a produção de ATP por vias oxidativas61.
Cardiotoxicidade trastuzumab-antraciclinasAtualmente, os mecanismos cardiotóxicos associados ao uso concomitante de trastuzumab e de antraciclinas são de particular interesse, dada a utilização frequente de terapias combinadas no tratamento do cancro da mama62. O uso deste tipo de terapia conduz a um aumento intracelular de ERO e a uma redução de compostos antioxidantes, promovendo a ocorrência de stress oxidativo que leva a disfunção cardíaca e consequente sobre-expressão de angiontensina ii (Ang II). Os níveis elevados de Ang II inibem a ação da NRG, impedindo a sua ligação aos recetores HER e a posterior ativação de vias de sinalização antiapoptóticas. Além disso, a inibição destes recetores pode contribuir para o aumento de produção de ERO. Outro efeito da Ang II prende-se com a ativação e/ou regulação positiva de NADPH oxidase63,64. A Ang II interage com o recetor AT1, associado a proteínas G, que ativam a NADPH oxidase através da proteína cínase C (PKC)63. A NADPH oxidase, por sua vez, produz radicais aniões superóxidos que são ERO potentes. Finalmente, a sinalização do recetor AT1 está relacionada com a ativação da cínase 1 reguladora do sinal apoptótico (ASK1), membro da família das MAPK, conduzindo a morte celular e disfunção cardíaca65.
Em suma, a ação do trastuzumab pode inibir diretamente as vias de sinalização antiapoptóticas, ou por outro lado, estimular a sobre-expressão de Ang II, que promove a produção de ERO e a inibição da ação da NRG66 (Figura 2).
Estratégias para limitar a cardiotoxicidadeVárias estratégias clínicas têm sido postas em prática com o objetivo de atenuar a cardiotoxicidade do trastuzumab sem comprometer significativamente a sua eficácia terapêutica. Estas incluem a utilização de combinações otimizadas de quimioterapia, o encurtamento do tratamento e o acompanhamento rigoroso dos doentes tratados57.
Trastuzumab sem antraciclinasO estudo Breast Cancer International Research Group (BCIRG) 006 foi o primeiro a testar um procedimento terapêutico adjuvante sem o uso de antraciclinas. Este ensaio comprovou que um regime quimioterapêutico com trastuzumab e sem antraciclinas, no tratamento do cancro da mama, tem uma eficácia antineoplásica equivalente e com menor incidência de eventos cardiotóxicos, quando comparado com regimes terapêuticos adjuvantes com trastuzumab e antraciclinas67. Embora outros ensaios confirmem a eficácia desta estratégia terapêutica68, atualmente, ainda existem opiniões controversas sobre o papel das antraciclinas no tratamento combinado antineoplásico69.
Conjugados trastuzumab-toxinasOs anticorpos podem ser utilizados de forma a dirigir os agentes citotóxicos para antigénios específicos de tumores alvo. Esta ligação química confere um maior controlo apoptótico a anticorpos monoclonais que são específicos do tumor, mas não suficientemente citotóxicos, para além de promover maior seletividade na sua ação70. De facto, Phillips et al. demonstraram que o uso de trastuzumab associado à toxina fúngica maitansina DM1 desenvolve baixos índices de toxicidade71. Mais recentemente, ensaios clínicos têm comprovado a eficácia e tolerância do uso terapêutico do conjugado trastuzumab-DM1 em pacientes com cancro da mama72.
Regimes de tratamento de curto prazoEste tipo de abordagem suscita grande interesse na comunidade médica, dado o perfil de segurança do seu uso e a relação custo-benefício3. O estudo FinHER (Finland Herceptin) comparou o uso de docetaxel com vinorelbina, administrados com ou sem trastuzumab, como tratamento adjuvante do cancro da mama precoce. Neste estudo, o trastuzumab foi administrado antes de outras terapias cardiotóxicas e concomitantemente com docetaxel-vinorelbina durante apenas nove semanas para testar a hipótese de que este regime iria limitar a cardiotoxicidade e manter a eficácia antineoplásica. A ocorrência de baixas taxas de cardiotoxicidade estava intimamente relacionada com o uso de regimes de tratamento curtos com trastuzumab73.
Uso individualizado de antraciclinasA topoisomerase-iiα (TOP2A) é um dos alvos moleculares da ação das antraciclinas e tem sido considerada como um possível marcador preditivo de resposta a estes agentes. A amplificação do gene TOP2A, localizado próximo do gene HER2, é mais frequente em tumores com amplificação do HER2 (34-90%) do que em tumores sem amplificação do HER2 (5-10%). Diversos relatórios e investigações clínicas retrospetivas encontraram uma taxa de eficácia adicional após o uso de regimes terapêuticos que contém antraciclinas no tratamento do cancro da mama HER2 positivo, propondo a redução do uso de antraciclinas em doentes com tumores HER2 negativo74–76. Por outro lado, resultados opostos foram obtidos em diferentes ensaios clínicos77. Assim sendo, o uso de regimes adjuvantes com antraciclinas no tratamento de doentes com coamplificação dos genes HER2 e TOP2A permanece controverso3.
Outros efeitos cardiotóxicosIsquemia miocárdicaOs indivíduos com cancro apresentam, atualmente, uma taxa de sobrevida mais favorável, o que resulta numa maior exposição a fatores de risco associados à ocorrência de doenças ateroscleróticas78. O aparecimento de doença coronária em doentes oncológicos tem sido associado ao uso terapêutico de alguns fármacos antineoplásicos, particularmente a capecitabina, 5-fluoracilo (5-FU) e bevacizumab. No entanto, outras drogas estão relacionadas com o aparecimento de eventos isquémicos como os agentes antimicrotúbulos (paclitaxel e docetaxel), os inibidores da tirosina-cínase (sorafenib, sunitinib) e os alcaloides da vinca (vincristina, vinorelbina)2,79.
O vasoespasmo coronário é o mecanismo fisiopatológico isquémico relacionado com a administração de 5-FU, ou da sua pró-droga fluoropirimidina, a capecitabina. Muitos dos indivíduos afetados possuem doença arterial coronária prévia, o que pode aumentar o potencial isquémico de 5-FU. Com o evento isquémico controlado, o tratamento deve ser realizado continuamente e com maior atenção na prevenção de recidivas80.
Além disso, o bevacizumab é um anticorpo monoclonal contra o fator de crescimento vascular endotelial (FCVE) e demonstra uma atividade antitumoral significativa quando combinado com quimioterapia. O uso deste agente terapêutico está associado, raramente, a eventos trombóticos arteriais, incluindo a ocorrência de enfarte agudo do miocárdio em 0,6-1,5% dos doentes7,81. Os mecanismos de ação responsáveis pela sua cardiotoxicidade ainda não foram completamente elucidados82.
ArritmiasA taxa de incidência de arritmias no doente oncológico ainda não está bem determinada e é variável de acordo com o tratamento antineoplásico utilizado83. Fatores de risco preponderantes incluem a idade avançada do doente, o uso de radiação cardíaca, a ocorrência de infiltrações amilóides e qualquer outra anomalia subjacente ao sistema de condução2. Por outro lado, o cancro gera por si só um ambiente pró-arritmogénico, independentemente de outros fatores de risco83. A fibrilação auricular é a arritmia mais prevalente em doentes com cancro. Segundo Onaitis et al., esta é responsável por significativa morbilidade após cirurgia oncológica, com uma taxa de incidência de até 12,6%84.
Atualmente, existe uma grande dificuldade em determinar a relação causal dos eventos arrítmicos com cada um dos fármacos utilizados clinicamente. Os quimioterápicos mais conhecidos por causar arritmias são as antraciclinas (DOX, EPI), os agentes antimicrotúbulos (paclitaxel e docetaxel), os antimetabólitos (capecitabina, 5-fluoracilo, e gemcitabina), os agentes alquilantes (cisplatina e ciclofosfamida), os inibidores da tirosina-cínase (trastuzumab e cetuximab), o trióxido de arsénio, a talidomida e a interleucina-283.
Hipertensão arterial sistémicaAlguns agentes quimioterápicos que inibem a angiogénese, como o bevacizumab, sutinib e sorafenib, vatalanib, pazopanib, mosetamib, axitinib e aflibercept agravam ou induzem o aumento da pressão arterial sistémica85,86. Antes da introdução deste tipo de fármacos, a prevalência de hipertensão arterial nos doentes oncológicos era semelhante à da população adulta em geral85. No entanto, com a maior sobrevida dos doentes e o aumento da utilização de quimioterápicos que interferem com pressão arterial sistémica, a hipertensão arterial tem sido diagnosticada mais frequentemente nestes indivíduos85,86.
Os agentes antineoplásicos inibidores da angiogénese diminuem a atividade da tirosina-cínase do recetor do fator de crescimento endotelial vascular, que é responsável pela produção de óxido nítrico, aumento da permeabilidade capilar e proliferação das células endoteliais85,86. A hipertensão arterial preexistente nos doentes com cancro é um importante fator de risco para a ocorrência, mais tarde, de graves sequelas hipertensivas. Uma forte intervenção anti-hipertensora, antes e durante o uso de fármacos antiangiogénicos, é um componente essencial no tratamento dos doentes2.
TromboembolismoO tromboembolismo venoso é uma das principais causas de morte nos doentes oncológicos. A doença tromboembólica venosa tem sido associada ao uso de drogas antiangiogénicas, talidomida, lenalidomida, bevacizumab e terapias hormonais (tamoxifeno)87.
A talidomida é o agente antineoplásico mais comummente relacionado com os eventos tromboembólicos2. O uso monoterapêutico desta droga está associado a uma incidência de 5% de fenómenos trombóticos88. Por outro lado, a lenalidomida é um análogo da talidomida com um perfil de toxicidade geral favorável. Contudo, o risco de eventos tromboembólicos relacionados com a sua utilização também é alto89. O mecanismo trombogénico destas drogas envolve uma ação direta nas células endoteliais e o aumento da agregação plaquetária2.
O tamoxifeno, antagonista do recetor do estrogénio, está associado a um aumento da incidência de complicações tromboembólicas90. Por outro lado, os inibidores da aromatase, como o anastrozol e letrozol, que bloqueiam a conversão de androgénios para estrogénio em mulheres na pós-menopausa, foram associados a uma maior incidência de efeitos nefastos a nível cardíaco91 (Tabela 4).
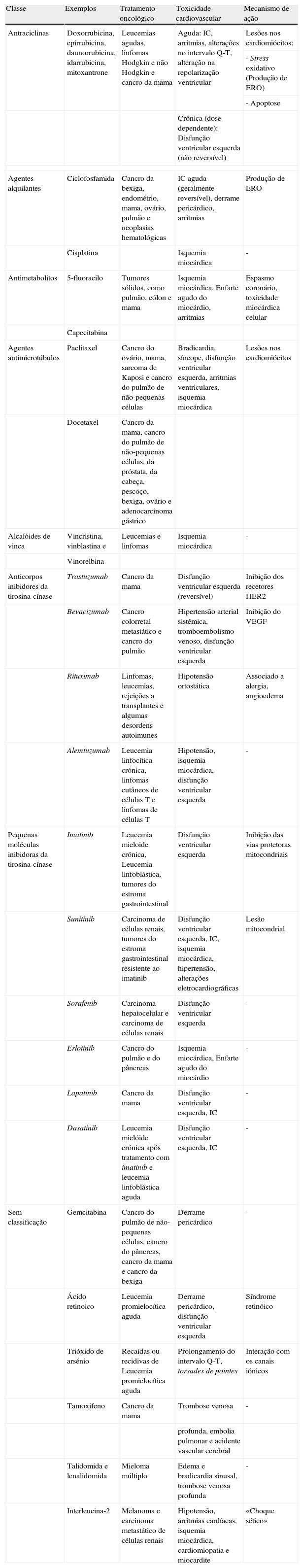
Toxicidade cardiovascular das principais classes de fármacos antineoplásicos aplicados na prática clínica
| Classe | Exemplos | Tratamento oncológico | Toxicidade cardiovascular | Mecanismo de ação |
| Antraciclinas | Doxorrubicina, epirrubicina, daunorrubicina, idarrubicina, mitoxantrone | Leucemias agudas, linfomas Hodgkin e não Hodgkin e cancro da mama | Aguda: IC, arritmias, alterações no intervalo Q-T, alteração na repolarização ventricular | Lesões nos cardiomiócitos: |
| - Stress oxidativo (Produção de ERO) | ||||
| - Apoptose | ||||
| Crónica (dose-dependente): Disfunção ventricular esquerda (não reversível) | ||||
| Agentes alquilantes | Ciclofosfamida | Cancro da bexiga, endométrio, mama, ovário, pulmão e neoplasias hematológicas | IC aguda (geralmente reversível), derrame pericárdico, arritmias | Produção de ERO |
| Cisplatina | Isquemia miocárdica | - | ||
| Antimetabolitos | 5-fluoracilo | Tumores sólidos, como pulmão, cólon e mama | Isquemia miocárdica, Enfarte agudo do miocárdio, arritmias | Espasmo coronário, toxicidade miocárdica celular |
| Capecitabina | ||||
| Agentes antimicrotúbulos | Paclitaxel | Cancro do ovário, mama, sarcoma de Kaposi e cancro do pulmão de não-pequenas células | Bradicardia, síncope, disfunção ventricular esquerda, arritmias ventriculares, isquemia miocárdica | Lesões nos cardiomiócitos |
| Docetaxel | Cancro da mama, cancro do pulmão de não-pequenas células, da próstata, da cabeça, pescoço, bexiga, ovário e adenocarcinoma gástrico | |||
| Alcalóides de vinca | Vincristina, vinblastina e | Leucemias e linfomas | Isquemia miocárdica | - |
| Vinorelbina | ||||
| Anticorpos inibidores da tirosina-cínase | Trastuzumab | Cancro da mama | Disfunção ventricular esquerda (reversível) | Inibição dos recetores HER2 |
| Bevacizumab | Cancro colorretal metastático e cancro do pulmão | Hipertensão arterial sistémica, tromboembolismo venoso, disfunção ventricular esquerda | Inibição do VEGF | |
| Rituximab | Linfomas, leucemias, rejeições a transplantes e algumas desordens autoimunes | Hipotensão ortostática | Associado a alergia, angioedema | |
| Alemtuzumab | Leucemia linfocítica crónica, linfomas cutâneos de células T e linfomas de células T | Hipotensão, isquemia miocárdica, disfunção ventricular esquerda | - | |
| Pequenas moléculas inibidoras da tirosina-cínase | Imatinib | Leucemia mieloide crónica, Leucemia linfoblástica, tumores do estroma gastrointestinal | Disfunção ventricular esquerda | Inibição das vias protetoras mitocondriais |
| Sunitinib | Carcinoma de células renais, tumores do estroma gastrointestinal resistente ao imatinib | Disfunção ventricular esquerda, IC, isquemia miocárdica, hipertensão, alterações eletrocardiográficas | Lesão mitocondrial | |
| Sorafenib | Carcinoma hepatocelular e carcinoma de células renais | Disfunção ventricular esquerda | - | |
| Erlotinib | Cancro do pulmão e do pâncreas | Isquemia miocárdica, Enfarte agudo do miocárdio | - | |
| Lapatinib | Cancro da mama | Disfunção ventricular esquerda, IC | - | |
| Dasatinib | Leucemia mielóide crónica após tratamento com imatinib e leucemia linfoblástica aguda | Disfunção ventricular esquerda, IC | - | |
| Sem classificação | Gemcitabina | Cancro do pulmão de não-pequenas células, cancro do pâncreas, cancro da mama e cancro da bexiga | Derrame pericárdico | - |
| Ácido retinoico | Leucemia promielocítica aguda | Derrame pericárdico, disfunção ventricular esquerda | Síndrome retinóico | |
| Trióxido de arsénio | Recaídas ou recidivas de Leucemia promielocítica aguda | Prolongamento do intervalo Q-T, torsades de pointes | Interação com os canais iónicos | |
| Tamoxifeno | Cancro da mama | Trombose venosa | - | |
| profunda, embolia pulmonar e acidente vascular cerebral | ||||
| Talidomida e lenalidomida | Mieloma múltiplo | Edema e bradicardia sinusal, trombose venosa profunda | - | |
| Interleucina-2 | Melanoma e carcinoma metastático de células renais | Hipotensão, arritmias cardíacas, isquemia miocárdica, cardiomiopatia e miocardite | «Choque sético» | |
ERO: espécies reativas de oxigénio; FCVE: fator de crescimento vascular endotelial; HER2: recetor-2 do fator de crescimento epidérmico humano; IC: insuficiência cardíaca.
Atualmente, estima-se que mais de 50% dos doentes oncológicos sejam tratados com radioterapia. Juntamente com o desenvolvimento de novos agentes quimioterápicos, a radioterapia tem revolucionado o prognóstico de indivíduos com vários tipos de cancro. No entanto, são detetados frequentemente efeitos tardios a nível cardiovascular após o uso deste método terapêutico92. A maioria das informações clínicas obtidas sobre a cardiotoxicidade da irradiação torácica é baseada em estudos de indivíduos com cancro da mama ou doença de Hodgkin, que desenvolveram doença sintomática durante o tratamento ou monitorização93. As doenças pericárdicas são manifestações patológicas frequentemente associadas ao uso de radioterapia. Contudo, outras poderão surgir, meses ou anos após a irradiação, como a fibrose miocárdica e a cardiomiopatia, a doença arterial coronária acelerada, as irregularidades no sistema de condução e a disfunção valvular (Figura 3). A ocorrência e manifestação dos fenómenos cardiotóxicos dependem essencialmente da dose de radiação utilizada, da área do coração exposta e da técnica específica de aplicação. Outros fatores de risco, tais como a idade do doente no momento da exposição, também têm um papel fulcral neste contexto, sendo os doentes jovens (< 20 anos) mais suscetíveis a lesões cardíacas94.
Monitorização e deteção precoceDurante o desenvolvimento de fármacosAntes da autorização comercial de todos os compostos, é geralmente aceite pela comunidade médica que os dados pré-clínicos obtidos deverão orientar a monitorização cardíaca durante os estudos subsequentes em humanos3. No entanto, ainda não se conhecem os mecanismos moleculares exatos associados à cardiotoxicidade de certos fármacos, o que dificulta a sua previsão e deteção precoce durante a fase de pré-comercialização. As culturas primárias de células cardíacas são frequentemente usadas como modelos em testes toxicológicos. Por outro lado, os cardiomiócitos derivados de células estaminais embrionárias representam modelos promissores neste contexto, que poderão ampliar recursos e melhorar a preditividade dos testes não-clínicos95. Embora tenham sido desenvolvidas várias abordagens alternativas, os modelos animais apenas esclarecem a base molecular inerente ao aparecimento de disfunção cardíaca, não prevendo resultados clínicos96.
Durante a aplicação clínicaEm doentes tratados com um regime de antraciclinas, a necessidade de monitorização, mesmo após o término da terapia, depende de aspetos específicos que os médicos possam enfrentar na prática clínica, como a idade do doente oncológico, a dose de radiação utilizada e a dose cumulativa de antraciclinas97. Além disso, deve avaliar-se a suscetibilidade individual (p. ex. background genético) de forma a identificar os doentes oncológicos mais vulneráveis e usar um tratamento personalizado. A identificação de subgrupos de risco e a sua incorporação nos sistemas de monitorização é fortemente recomendada3,98.
Relativamente a fármacos como o trastuzumab, pouco se sabe sobre os seus efeitos cardíacos a longo prazo e a reversibilidade do fenómeno cardiotóxico. A principal limitação está associada ao seguimento a médio prazo (2 a 3anos para o trastuzumab), em que não existem dados que indiquem se o tratamento da insuficiência cardíaca crónica promove uma recuperação permanente do doente ou diminui o risco de disfunção cardíaca tardia. Além disso, não tem sido realizada uma análise e identificação sistemática dos fatores de risco associados à cardiotoxicidade deste tipo de compostos. Contudo, é recomendada uma cuidadosa avaliação da função cardíaca em todos os doentes elegíveis, especialmente em casos clínicos de reserva miocárdica reduzida3.
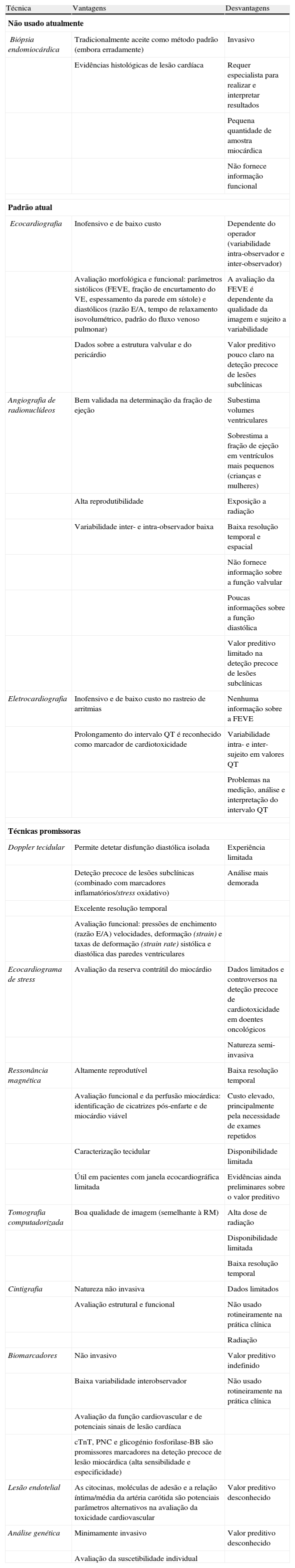
A FEVE, avaliada por angiografia de radionuclídeos ou ecocardiografia, é o índice mais comummente utilizado para a monitorização da função cardíaca durante o tratamento oncológico99. No entanto, esta pode subestimar a lesão cardiotóxica, dada a capacidade adaptativa do miocárdio, que permite manter este parâmetro dentro dos limites da normalidade, mesmo na presença de disfunção miocárdica100. Assim sendo, outros métodos de monitorização alternativos têm sido estudados para avaliar a função cardíaca durante a terapêutica oncológica. A análise prévia da suscetibilidade individual, a deteção de eventos cardiotóxicos temporários (p. ex. libertação de peptídeos natriuréticos) ou a identificação de alterações subclínicas, tais como variações nos parâmetros diastólicos, poderão ser úteis na deteção precoce de cardiotoxicidade99 (Tabela 5).
Principais técnicas usadas na monitorização da cardiotoxicidade na prática clínica: vantagens e desvantagens
| Técnica | Vantagens | Desvantagens |
| Não usado atualmente | ||
| Biópsia endomiocárdica | Tradicionalmente aceite como método padrão (embora erradamente) | Invasivo |
| Evidências histológicas de lesão cardíaca | Requer especialista para realizar e interpretar resultados | |
| Pequena quantidade de amostra miocárdica | ||
| Não fornece informação funcional | ||
| Padrão atual | ||
| Ecocardiografia | Inofensivo e de baixo custo | Dependente do operador (variabilidade intra-observador e inter-observador) |
| Avaliação morfológica e funcional: parâmetros sistólicos (FEVE, fração de encurtamento do VE, espessamento da parede em sístole) e diastólicos (razão E/A, tempo de relaxamento isovolumétrico, padrão do fluxo venoso pulmonar) | A avaliação da FEVE é dependente da qualidade da imagem e sujeito a variabilidade | |
| Dados sobre a estrutura valvular e do pericárdio | Valor preditivo pouco claro na deteção precoce de lesões subclínicas | |
| Angiografia de radionuclídeos | Bem validada na determinação da fração de ejeção | Subestima volumes ventriculares |
| Sobrestima a fração de ejeção em ventrículos mais pequenos (crianças e mulheres) | ||
| Alta reprodutibilidade | Exposição a radiação | |
| Variabilidade inter- e intra-observador baixa | Baixa resolução temporal e espacial | |
| Não fornece informação sobre a função valvular | ||
| Poucas informações sobre a função diastólica | ||
| Valor preditivo limitado na deteção precoce de lesões subclínicas | ||
| Eletrocardiografia | Inofensivo e de baixo custo no rastreio de arritmias | Nenhuma informação sobre a FEVE |
| Prolongamento do intervalo QT é reconhecido como marcador de cardiotoxicidade | Variabilidade intra- e inter-sujeito em valores QT | |
| Problemas na medição, análise e interpretação do intervalo QT | ||
| Técnicas promissoras | ||
| Doppler tecidular | Permite detetar disfunção diastólica isolada | Experiência limitada |
| Deteção precoce de lesões subclínicas (combinado com marcadores inflamatórios/stress oxidativo) | Análise mais demorada | |
| Excelente resolução temporal | ||
| Avaliação funcional: pressões de enchimento (razão E/A) velocidades, deformação (strain) e taxas de deformação (strain rate) sistólica e diastólica das paredes ventriculares | ||
| Ecocardiograma de stress | Avaliação da reserva contrátil do miocárdio | Dados limitados e controversos na deteção precoce de cardiotoxicidade em doentes oncológicos |
| Natureza semi-invasiva | ||
| Ressonância magnética | Altamente reprodutível | Baixa resolução temporal |
| Avaliação funcional e da perfusão miocárdica: identificação de cicatrizes pós-enfarte e de miocárdio viável | Custo elevado, principalmente pela necessidade de exames repetidos | |
| Caracterização tecidular | Disponibilidade limitada | |
| Útil em pacientes com janela ecocardiográfica limitada | Evidências ainda preliminares sobre o valor preditivo | |
| Tomografia computadorizada | Boa qualidade de imagem (semelhante à RM) | Alta dose de radiação |
| Disponibilidade limitada | ||
| Baixa resolução temporal | ||
| Cintigrafia | Natureza não invasiva | Dados limitados |
| Avaliação estrutural e funcional | Não usado rotineiramente na prática clínica | |
| Radiação | ||
| Biomarcadores | Não invasivo | Valor preditivo indefinido |
| Baixa variabilidade interobservador | Não usado rotineiramente na prática clínica | |
| Avaliação da função cardiovascular e de potenciais sinais de lesão cardíaca | ||
| cTnT, PNC e glicogénio fosforilase-BB são promissores marcadores na deteção precoce de lesão miocárdica (alta sensibilidade e especificidade) | ||
| Lesão endotelial | As citocinas, moléculas de adesão e a relação íntima/média da artéria carótida são potenciais parâmetros alternativos na avaliação da toxicidade cardiovascular | Valor preditivo desconhecido |
| Análise genética | Minimamente invasivo | Valor preditivo desconhecido |
| Avaliação da suscetibilidade individual | ||
Adaptado de: Raschi et al.3
cTnT: troponina T cardíaca; FEVE: fração de ejeção do ventrículo esquerdo; PNC: peptídeo natriurético cerebral; RM: ressonância magnética.
Embora existam diretrizes disponíveis para a monitorização dos efeitos cardiotóxicos, o tempo necessário para acompanhamento médico, após o término da terapia, permanece desconhecido99.
Assim sendo, há uma necessidade cada vez mais premente na monitorização cardiovascular dos indivíduos com cancro, a fim de detetar precocemente efeitos cardiotóxicos da terapêutica antineoplásica.
ConclusãoO uso extensivo de agentes quimioterápicos e radioterapia, na prática clínica, tem vindo a gerar uma enorme controvérsia, devido aos seus potenciais efeitos adversos a nível cardiovascular nos doentes oncológicos tratados que sobrevivem. Estes efeitos incluem cardiomiopatia, isquemia, arritmias, hipertensão arterial, doenças pericárdicas e doença tromboembólica. No entanto, não existe um consenso na comunidade médica que permita padronizar a monitorização da função miocárdica nesses doentes, assim como ainda não foram desenvolvidos modelos preditivos precisos que possibilitem estimar esse mesmo risco de toxicidade com maior eficácia.
De uma perspetiva farmacológica e conforme recomendado por muitos especialistas da área, há uma necessidade urgente em compreender os mecanismos responsáveis pela cardiotoxicidade. Uma boa gestão e avaliação do perfil de segurança cardíaco destes doentes são essenciais, sendo necessário um estudo mais rigoroso dos efeitos a longo prazo das várias estratégias terapêuticas. Neste contexto, é cada vez mais importante o estabelecimento de uma parceria dinâmica entre a área da Oncologia e da Cardiologia, de forma a reduzir o risco de mortalidade e melhorar a qualidade de vida destes indivíduos, sem interferir, se possível, no tratamento específico antineoplásico.
Em suma, a cardiotoxicidade induzida por tratamentos antineoplásicos deve ser encarada como um problema multidisciplinar, com uma abordagem que engloba a ciência básica, oncológica e cardiovascular.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
FinanciamentoEste trabalho foi financiado por Fundos FEDER através do Programa Operacional Fatores de Competitividade – COMPETE e por Fundos Nacionais através da FCT – Fundação para a Ciência e a Tecnologia no âmbito do projeto «n.° FCOMP-01-0124-FEDER-011051 (Ref. FCT PTDC/SAU-FCF/100442/2008)», pela Bolsa de Estudo João Porto 2008 e pelos Projetos Pluridisciplinares para Estímulo à Iniciação à Investigação na Universidade do Porto/Santander Totta, edições 2009 e 2010. Carmen Brás-Silva é investigadora ao abrigo Programa Ciência 2008.
Conflito de interessesOs autores declaram não haver conflito de interesses.
Este trabalho foi financiado por Fundos FEDER através do Programa Operacional Fatores de Competitividade – COMPETE e por Fundos Nacionais através da FCT – Fundação para a Ciência e a Tecnologia no âmbito do projeto «n.° FCOMP-01-0124-FEDER-011051 (Ref. FCT PTDC/SAU-FCF/100442/2008)», pela Bolsa de Estudo João Porto 2008 e pelos Projetos Pluridisciplinares para Estímulo à Iniciação à Investigação na Universidade do Porto/Santander Totta, edições 2009 e 2010. Carmen Brás-Silva é investigadora ao abrigo Programa Ciência 2008.




![Em resposta ao stress oxidativo, a NRG ativa mecanismos compensatórios através dos recetores HER2 (A); Na presença de trastuzumab, tanto os dímeros HER2/HER2 como HER2/HER4 estão bloqueados e os mecanismos compensatórios não atuam, promovendo a apoptose e IC (B) [Adaptado de: Di Cosimo57]. Em resposta ao stress oxidativo, a NRG ativa mecanismos compensatórios através dos recetores HER2 (A); Na presença de trastuzumab, tanto os dímeros HER2/HER2 como HER2/HER4 estão bloqueados e os mecanismos compensatórios não atuam, promovendo a apoptose e IC (B) [Adaptado de: Di Cosimo57].](https://static.elsevier.es/multimedia/08702551/0000003200000005/v1_201308021350/S0870255113000334/v1_201308021350/pt/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w9znTMwFdb/TnkS0koegILxs=)