A não compactação isolada do miocárdio ventricular é uma causa rara de miocardiopatia congénita primária, caracterizada morfologicamente por dilatação do ventrículo esquerdo, padrão multitrabecular proeminente e recessos profundos intertrabeculares no miocárdio ventricular, na ausência de outras cardiopatias estruturais. Parece resultar da cessação intrauterina do processo de compactação miocárdica durante a embriogénese. Clinicamente, apresenta‐se com sintomas ou manifestações de insuficiência cardíaca, eventos cardioembólicos, disritmias ou morte súbita. Os critérios de diagnóstico baseiam‐se em achados clínicos e imagiológicos, sendo o ecocardiograma bidimensional e Doppler o meio complementar de diagnóstico de eleição. Não existe tratamento específico para esta entidade, sendo dirigido às comorbilidades associadas. O transplante cardíaco poderá ser uma possibilidade terapêutica em casos refratários ao tratamento médico.
Os autores descrevem um caso clínico de insuficiência cardíaca refratária como forma de apresentação inaugural de não compactação do miocárdio ventricular numa criança do sexo masculino previamente saudável, submetida com sucesso a transplantação cardíaca.
Isolated left ventricular noncompaction is a rare congenital cardiomyopathy, characterized morphologically by a dilated left ventricle, prominent trabeculations and deep intertrabecular recesses in the ventricular myocardium, with no other structural heart disease. It is thought to be secondary to an arrest of normal myocardial compaction during fetal life. Clinically, the disease presents with heart failure, embolic events, arrhythmias or sudden death. Current diagnostic criteria are based on clinical and imaging data and two‐dimensional and color Doppler echocardiography is the first‐line exam. There is no specific therapy and treatment is aimed at associated comorbidities. Cases refractory to medical therapy may require heart transplantation.
The authors describe a case of severe and refractory heart failure, which was the initial presentation of isolated left ventricular noncompaction in a previously healthy male child, who underwent successful heart transplantation.
A não compactação isolada do miocárdio ventricular ou ventrículo esquerdo não compactado isolado (VENCI) é uma causa rara de miocardiopatia congénita primária1, atingindo tipicamente o ventrículo esquerdo (VE)2. Parece resultar da cessação intrauterina do processo de compactação miocárdica durante a embriogénese e caracteriza‐se morfologicamente por dilatação do VE, e por apresentar um padrão multitrabecular proeminente com recessos profundos intertrabeculares, conferindo ao miocárdio um aspeto esponjoso3,4.
É descrito como um achado isolado ou, mais frequentemente, em associação a outras patologias cardíacas primárias, particularmente cardiopatias congénitas cianóticas4,5.
A história natural é muito diversa. O doente pode permanecer assintomático ou progredir para um quadro de insuficiência cardíaca congestiva. Em idade pediátrica, a evolução para disfunção sisto‐diastólica do VE é quase inevitável, desenvolvendo‐se em cerca de 90% das crianças. Já as complicações da doença, como o tromboembolismo sistémico e arritmias, que se associam a elevada morbilidade e mortalidade, e a morte súbita, predominam em idade adulta3,6.
Tratando‐se de uma doença rara e de difícil reconhecimento, os autores descrevem o caso clínico de uma criança do sexo masculino com VENCI, submetida com sucesso a transplantação cardíaca.
Caso clínicoDoente do sexo masculino, previamente saudável, de dez anos de idade, caucasiano, admitido no serviço de urgência por tosse, vómitos incoercíveis e abdominalgias. Referência a cansaço para médios e grandes esforços (classe funcional II da NYHA), com um mês de evolução. Filho de pais não consanguíneos, com história familiar de morte súbita, nomeadamente da mãe, tio, avô e tia‐avó da linhagem materna, sem diagnóstico.
À admissão apresentava‐se apirético, normotenso (tensão arterial: 100/66mmHg), taquicárdico (frequência cardíaca: 150bpm) e taquipneico (frequência respiratória: 37cpm). Evidenciava palidez mucocutânea, auscultação cardíaca com sopro sistólico grau II/VI audível no bordo esquerdo do esterno e hepatomegalia, com bordo hepático palpável a cerca de 3cm do rebordo costal direito. Não se observaram dismorfismos faciais ou alterações neuromusculares.
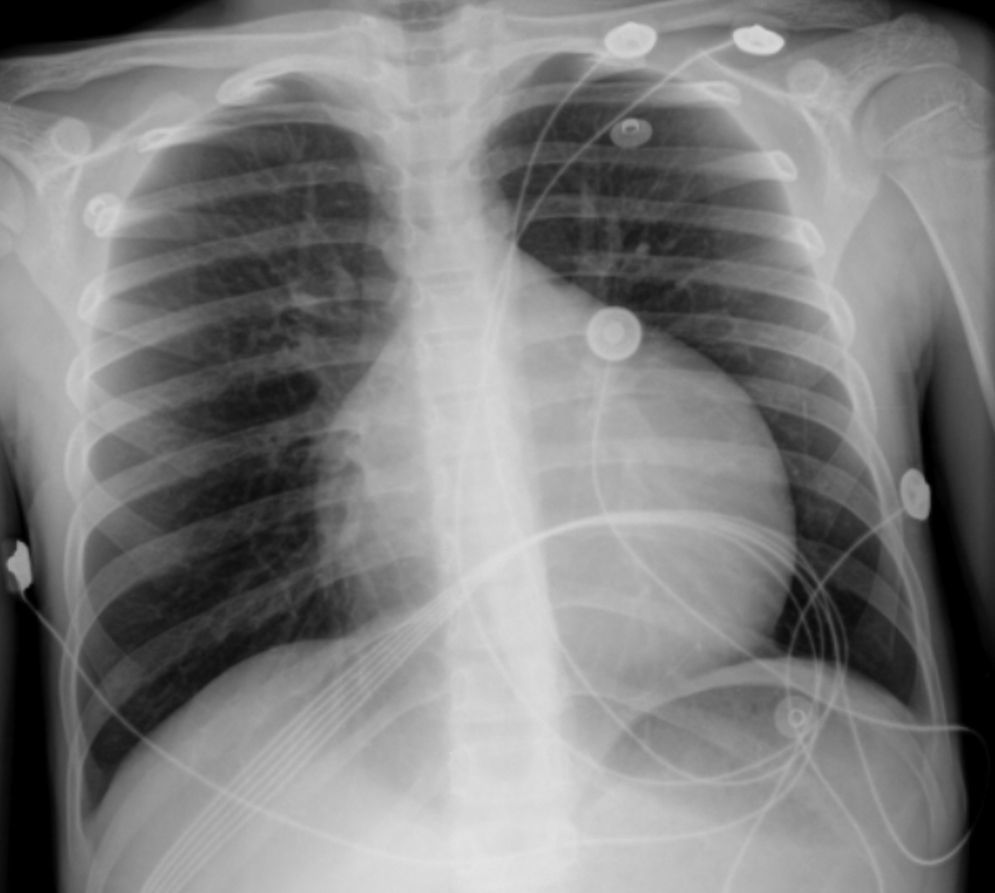
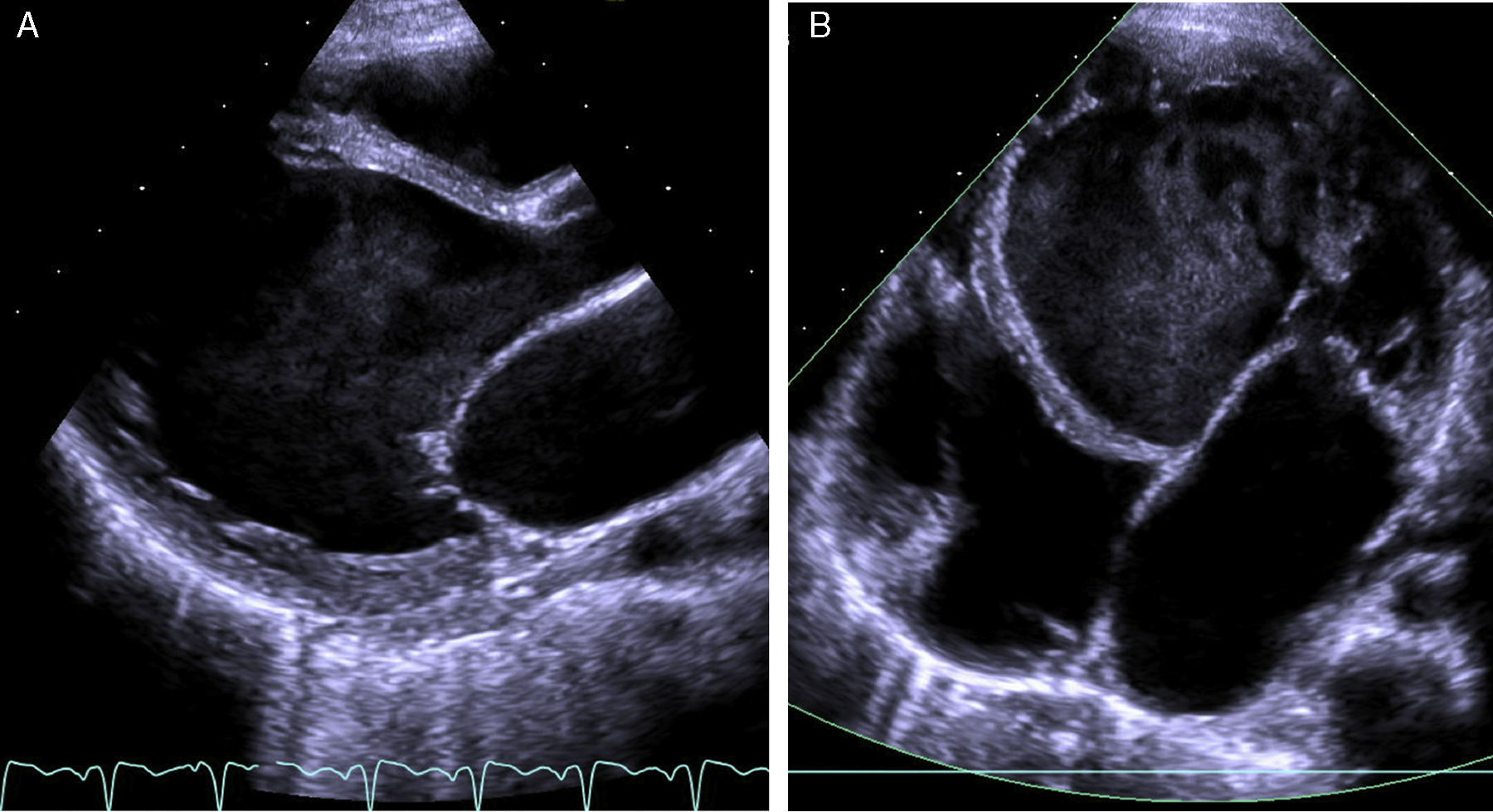
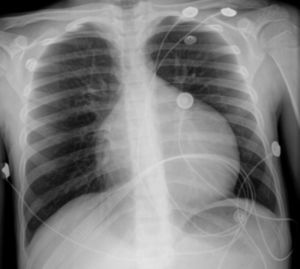
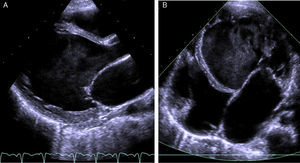
O eletrocardiograma (ECG) mostrou taquiarritmia de complexos estreitos, com frequência cardíaca entre 150‐180bpm, não revertida com adenosina, compatível com taquicardia ventricular. A telerradiografia torácica revelou cardiomegalia (índice cardiotorácico >0,6, Figura 1) e o estudo analítico, elevação das transaminases (TGO 94UI/L, TGP 72UI/L), do BNP (742pg/ml) e hiponatremia (133mEq/L). Os marcadores de necrose miocárdica foram negativos. O ecocardiograma transtorácico (Figura 2 A e B) mostrou dilatação e disfunção sistólica grave do VE (diâmetro telediastólico do VE de 65mm: z‐score+7,8; diâmetro telessistólico do VE de 60mm: z‐score+12,3, fração de ejeção do VE de 20% e fração de encurtamento do VE de 12%). Visualizou‐se trabeculação exuberante e recessos intertrabeculares profundos preenchidos por sangue das paredes lateral e região apical do VE, e a relação entre a espessura da camada não compactada e a espessura da camada compactada foi superior a 2, medido em incidência paraesternal eixo curto, em telessístole (segundo critérios de Jenni et al.).
A: ecocardiograma transtorácico – incidência paraesternal eixo longo – mostra trabéculas proeminentes separadas por recessos profundos na parede lateral do ventrículo esquerdo. B: ecocardiograma transtorácico – incidência apical quatro câmaras – visualiza‐se padrão trabecular da parede lateral e apical do ventrículo esquerdo.
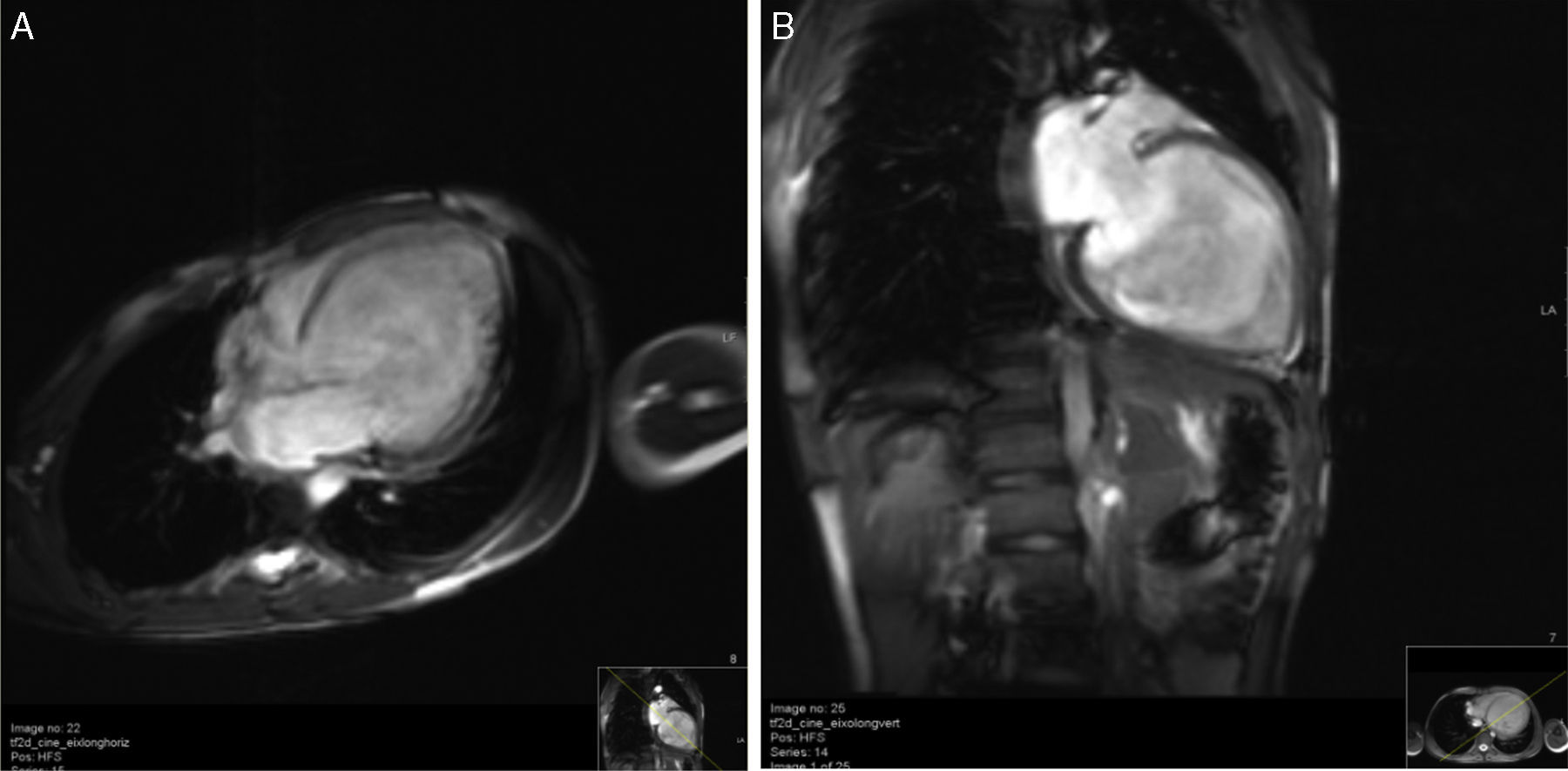
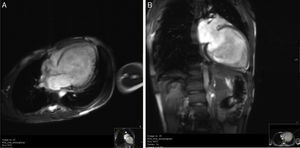
A ressonância magnética cardíaca confirmou o diagnóstico de VENCI, revelando hipertrabeculação endomiocárdica da parede lateral e apical do VE, hipocinésia global e ausência de realce tardio após administração de gadolínio (Figura 3 A e B). A relação entre a espessura da camada não compactada e camada compactada foi superior a 2,3, medido em telediástole (segundo critérios de Petersen et al.).
Perante o diagnóstico imagiológico, realizou estudo genético para pesquisa de mutações associadas a miocardiopatia dilatada, não compactação do VE e miocardiopatia dilatada associada a doenças neuromusculares ou de condução, sem qualquer identificação. O estudo metabólico foi negativo. O rastreio ecocardiográfico dos familiares em primeiro grau foi positivo, tendo‐se identificado miocardiopatia dilatada no irmão.
O cateterismo cardíaco mostrou pressão média na artéria pulmonar de 28mmHg, pressão capilar pulmonar de 18mmHg e índice de resistência vascular pulmonar de 3,5 unidades Wood.
Iniciou terapêutica para insuficiência cardíaca com diuréticos, inibidores da enzima de conversão da angiotensina e antiagregação plaquetar.
Após a admissão, teve agravamento clínico que motivou internamento durante dois dias em cuidados intensivos, com necessidade de suporte hemodinâmico, inicialmente com milrinona e, posteriormente, com levosimendam. Iniciou hipocoagulação com enoxaparina por imagem sugestiva de trombo intracardíaco na aurícula direita, sem evidência de tromboembolismo sistémico. Durante o internamento apresentou curtos episódios de taquicardia ventricular de complexos estreitos, sem repercussão hemodinâmica. No estudo eletrofisiológico, a estimulação ventricular programada induziu período breve de taquicardia ventricular lenta (frequência cardíaca máxima de 140bpm), autossustentada. Foi decidido iniciar terapêutica com amiodarona e colocação de cardioversor desfibrilhador implantável (CDI). A evolução clínica foi favorável, tendo tido alta ao 36.° dia, com melhoria clínica e analítica, mas sobreponível do ponto de vista imagiológico e medicado com terapêutica anticongestiva, antiarrítmica e anticoagulação oral.
Um mês e meio após a alta, deu entrada no serviço de urgência em choque cardiogénico, tendo tido paragem cardiorrespiratória e necessidade de manobras de reanimação durante 20 minutos.
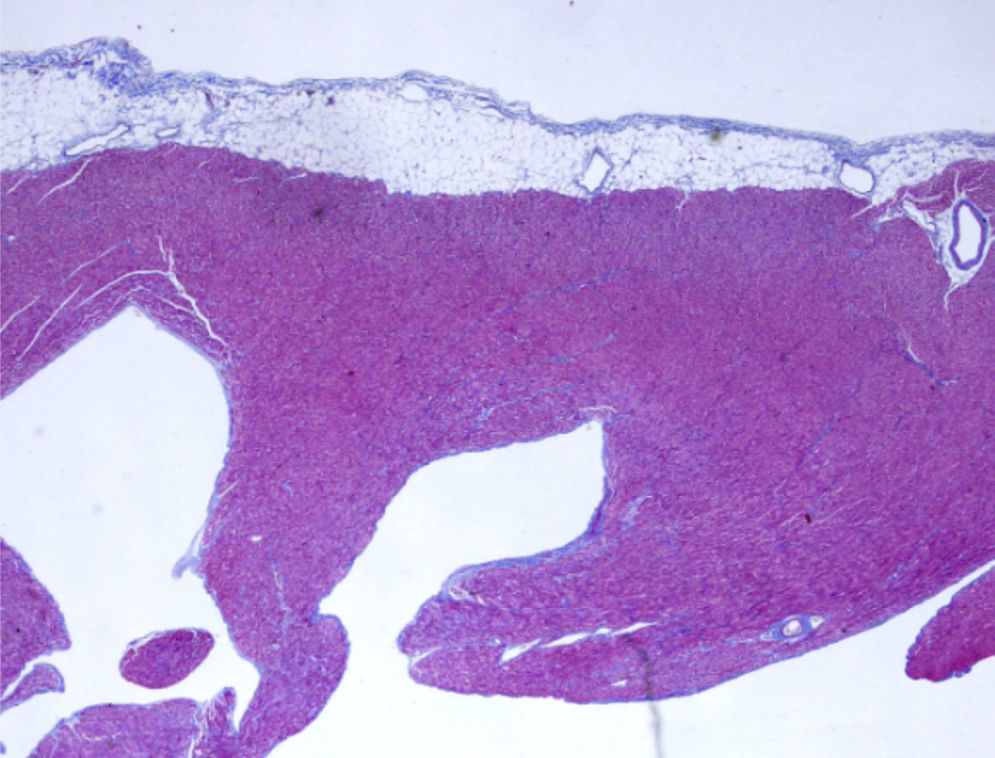
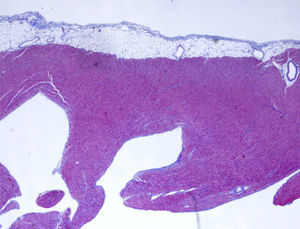
Devido ao severo compromisso da função ventricular foi colocado em lista ativa para transplante cardíaco, tendo sido transplantado quatro dias depois, sem intercorrências. A técnica cirúrgica adotada foi a transplantação cardíaca ortotópica pela técnica biauricular, de acordo com a experiência do cirurgião cardiotorácico, tendo‐se removido o CDI e as sondas cardíacas. Suspendeu suporte inotrópico no segundo dia de pós‐operatório e foi extubado no terceiro dia de pós‐operatório. Iniciou terapêutica imunossupressora com ciclosporina, azatioprina e prednisolona. No sétimo dia de pós‐operatório, observaram‐se crises tónico‐clónicas generalizadas com posterior perda parcial da acuidade visual. O eletroencefalograma revelou traçado muito anormal, com atividade epileptiforme, tendo iniciado terapêutica com fenitoína. A tomografia computorizada cranioencefálica mostrou lesões isquémicas subagudas cortico‐subcorticais fronto‐parieto‐occipito‐temporais e cerebelosas bilaterais. Dado a posterior melhoria do quadro neurológico e recuperação total da visão, foi estabelecido como diagnóstico provável síndrome de encefalopatia posterior reversível. O estudo anatomopatológico do órgão removido mostrou trabeculação marcada da parede do VE, ocupando cerca de dois terços internos da espessura da parede dos ventrículos, com recessos que comunicavam com a cavidade ventricular e, nesses, identificavam‐se ocasionais trombos e focos de fibrose, confirmando o diagnóstico de VENCI (Figura 4). Teve alta ao 21.° dia de pós‐operatório, estável sob o ponto de vista hemodinâmico e imagiológico, mantendo terapêutica anticonvulsivante, imunossupressora e profilática de infeções oportunistas. Os controlos clínicos, com auxílio de exames complementares e estudo hemodinâmico com biópsia endomiocárdica, revelaram rejeição aguda de grau 2R (moderada), tendo alterado o esquema imunossupressor instituído inicialmente para tacrolimus e micofenolato de mofetil, medicação que mantém à data.
DiscussãoO VENCI é uma doença rara, dificilmente reconhecida, de etiologia ainda por esclarecer, com uma incidência na população pediátrica de 0,01%, de acordo com vários estudos ecocardiográficos3,4,7,8. Parece ser mais frequente no sexo masculino, responsável por 56‐82% dos casos6,7,9,10. A idade de diagnóstico é muito variável, podendo ser afirmado tanto no feto11,12 como em idosos. Em idade pediátrica é mais frequente na pequena infância4.
Foi relatado pela primeira vez por Chin et al.9, em 1990, e, desde então, tem vindo a ser amplamente estudado, tendo sido classificado como miocardiopatia genética em 2006, pela American Heart Association (AHA)1.
Durante o normal desenvolvimento embrionário, o miocárdio corresponde a uma rede esponjosa de fibras, que limitam uma série de recessos intertrabeculares3,10,13,14. A morfogénese endomiocárdica, que ocorre entre a 5.a e a 8.a semanas de desenvolvimento intrauterino, é caracterizada pelo processo de compactação do futuro miocárdio ventricular e, simultaneamente, pela transformação dos sinusoides primitivos em capilares sanguíneos e pelo desenvolvimento da circulação coronária3,15,16.
É globalmente aceite que o VENCI é consequente a uma interrupção do processo de compactação miocárdica, na ausência de outras doenças cardíacas estruturais, alterações hemodinâmicas ou funcionais primárias3,9. É caracterizado pela presença de múltiplas e proeminentes trabeculações e recessos intertrabeculares, que penetram profundamente na parede muscular das áreas afetadas e que comunicam apenas com a cavidade ventricular6,17. Deverá distinguir‐se da forma não isolada, entidade muito mais frequente e associada a outras patologias cardíacas primárias como comunicações interventriculares, lesões obstrutivas do trato de saída esquerdo e direito, cardiopatias congénitas cianóticas complexas e anomalias das coronárias4,5,10,12,14, em que o padrão de não compactação é histologicamente diferente e poderá ser antes consequência das malformações7. É importante realçar que a morfologia trabecular miocárdica pode ser observada em situações não patológicas, como em casos de hipertrabeculação do ventrículo direito ou VE em corações saudáveis15, ou coexistir com outras miocardiopatias, nomeadamente miocardiopatia dilatada, miocardiopatia hipertrófica e miocardiopatia restritiva4,8,18. Algumas alterações podem estar presentes noutras entidades, como na miocardiopatia hipertrófica apical, displasia arritmogénica do ventrículo direito, fibroelastose endocárdica, metástases cardíacas ou trombos intraventriculares3,6,13. Foram também identificadas associações desta patologia com doenças neuromusculares, metabólicas e dismorfismos faciais6,9.
Pode apresentar‐se sob a forma esporádica ou ter carácter familiar4,19 Nesta forma, responsável por 20‐50% dos casos, foram descritos vários padrões de hereditariedade, como transmissão autossómica dominante ou ligado ao X, tendo sido identificado nesta última uma mutação no gene G4.5 no cromossoma Xq2820,21.
O espectro clínico é muito heterogéneo e inespecífico22, sendo proporcional à extensão dos segmentos cardíacos atingidos6. Inicialmente, os doentes podem estar assintomáticos ou apresentar insuficiência cardíaca, arritmias, eventos cardioembólicos ou mesmo morte súbita3,9,10. Gradualmente, e na maior parte dos casos, o VENCI evolui para insuficiência cardíaca e disfunção sistodiastólica do VE6. A disfunção sistólica provavelmente é consequente a uma diminuição do aporte de oxigénio por defeitos da microcirculação coronária, e a disfunção diastólica parece resultar de fibrose secundária à isquemia e ao novo rearranjo histológico do miocárdio3,13,23. Na população pediátrica, a história natural é a evolução para disfunção sistólica ventricular em quase 90% dos casos, mas, contrariamente à população adulta, as complicações e morte são menos frequentes3,6.
As arritmias mais frequentes são fibrilhação auricular e taquiarritmias ventriculares, responsáveis por quase metade da mortalidade3,7,10. São também achados frequentes na população pediátrica as taquidisritmias paroxísticas supraventriculares, o bloqueio auriculoventricular de 3.° grau e a síndrome de Wolff‐Parkinson‐White6.
Menos frequentemente descritas, as complicações cardioembólicas, como tromboembolismo pulmonar, acidente vascular cerebral, acidente isquémico transitório e enfartes mesentéricos, parecem decorrer da conjugação da disfunção miocárdica, da estase sanguínea ao nível dos sinusoides e de eventos arrítmicos3,7,9,10.
Os critérios morfológicos para o diagnóstico de VENCI são baseados em achados imagiológicos, sendo o ecocardiograma bidimensional e Doppler o meio complementar de diagnóstico de eleição para o reconhecimento desta entidade4,7,9,11,15. Os critérios mais utilizados são baseados em estudos ecocardiográficos realizados em adultos e foram definidos por Jenni et al. Definem‐se por uma relação superior a dois entre a maior espessura da camada não compactada endocárdica e a compactada epicárdica, medições efetuadas em telessístole e paraesternal eixo curto3,15. Em idade pediátrica, há autores que têm usado uma relação superior a 1,44. Incluem‐se ainda a presença de numerosas e proeminentes trabeculações e recessos intertrabeculares, localizados preferencialmente na região apical e parede inferior e lateral do VE7,15,18, a visualização por Doppler com cor de fluxo sanguíneo da cavidade ventricular para os recessos profundos3,4,11 e a ausência de outras anomalias cardíacas, sendo estas as principais características do VENCI. Concomitantemente, observa‐se disfunção sistólica, diastólica e hipocinésia difusa da totalidade do VE, e não apenas dos segmentos não compactados7,10,16. Em cerca de 40% dos casos parece haver atingimento do ventrículo direito, mas questiona‐se o seu envolvimento, uma vez que o componente trabecular é frequente7,15.
A ecocardiografia transtorácica tem algumas limitações e, quando não permite afirmar ou excluir o diagnóstico de VENCI, são opções outros exames imagiológicos como o ecocardiograma transesofágico ou de contraste3, a angioTC24 ou a ressonância magnética cardíaca8,20.
Petersen et al.8 realizaram um estudo recente sobre a aplicação de ressonância magnética cardíaca nesta patologia e propuseram como critério diagnóstico o quociente superior a 2,3 entre a camada não compactada e a camada compactada, medições efetuadas em telediástole. Este exame tem boa correlação com o ecocardiograma, mas parece ser mais vantajoso na identificação e localização deste padrão, principalmente se localizado na região apical, ecocardiograficamente de mais difícil visualização8,25.
No caso clínico descrito, o diagnóstico foi efetuado primariamente por ecocardiograma, obedecendo aos critérios de diagnóstico ecocardiográficos estabelecidos e confirmado por ressonância magnética cardíaca e exame anatomopatológico.
O tratamento é conservador e orientado para as principais complicações. Em doentes com insuficiência cardíaca preconiza‐se o uso de terapêutica anticongestiva, incluindo diuréticos, inibidores da enzima de conversão da angiotensina e β‐bloqueadores3,4. Os eventos arrítmicos deverão ser ativamente pesquisados e, em caso de arritmias ventriculares, deve ser considerada a colocação de pacemaker biventricular ou CDI. Recomenda‐se antiagregação plaquetar para a prevenção de eventos embólicos sistémicos ou hipocoagulação, em caso de evidência de trombos3,4,7,10.
O prognóstico é reservado e as causas mais comuns de morte são insuficiência cardíaca refratária, taquicardia ventricular, eventos tromboembólicos e morte súbita7. Nos estudos publicados até à data, a taxa de mortalidade em adultos pode exceder os 35%2 e em idade pediátrica os 22%26, dependendo dos anos de seguimento clínico. Em casos refratários ou terminais, o transplante cardíaco poderá ser uma possibilidade terapêutica27,28, como descrito no nosso caso.
Pelo seu carácter familiar e associação a distúrbios neuromusculares, torna‐se imperativo efetuar avaliação neurológica e rastreio por ecocardiograma dos familiares mais próximos.
ConclusãoOs autores descrevem um caso de miocardiopatia dilatada por não compactação do VE, etiologia com rara indicação para transplante cardíaco em idade pediátrica. Deverá colocar‐se esta entidade como hipótese de diagnóstico perante uma criança com insuficiência cardíaca, eventos arrítmicos ou embólicos, uma vez que poderá ser tratada com sucesso com transplante cardíaco.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflito de interessesOs autores declaram não haver conflito de interesses.