A prevalência da insuficiência cardíaca tem vindo a aumentar nas últimas décadas, causando uma importante sobrecarga nos serviços de saúde, mas também económica. A qualidade de vida dos doentes fica muito comprometida e é uma das principais causas de morte em Portugal. A organização funcional das equipas multidisciplinares que seguem estes doentes é fundamental para a otimização dos cuidados prestados e melhoria dos resultados, em particular com redução da mortalidade, redução dos internamento e melhoria da qualidade de vida. Descrevem‐se em seguida a abordagem contemporânea da insuficiência cardíaca, bem como uma discussão sobre a organização e articulação das unidades de insuficiência cardíaca entre si e com outras valências.
The prevalence of heart failure has increased over the past decades and is a major social and economic burden on healthcare services. Patient quality of life is severely impaired and heart failure is one of the main causes of death in Portugal. The functional organization of multidisciplinary teams engaged in the treatment of these patients is essential to improve health care provision and outcomes, specifically reducing mortality, hospital admissions, and improving quality of life.
We describe current approaches to heart failure management and discuss the organization of heart failure units and cooperation among these units and also with other healthcare professionals.
A insuficiência cardíaca (IC) é uma síndroma com elevada prevalência, morbilidade e mortalidade em todo o mundo, incluindo Portugal1,2. Segundo dados da Direção‐Geral de Saúde, em 2014 a IC foi a segunda maior fonte de produção hospitalar, com quase 19 000 internamentos, com duração média de internamento de cerca de 10 dias e elevada mortalidade hospitalar2. Os internamentos hospitalares por IC têm elevado consumo de recursos e as readmissões a 30 dias são também muito significativas3–5. A IC representa, assim, uma elevada sobrecarga económica e social para o país, sendo por isso um problema grave de saúde pública6. Sendo a IC resultado de um contínuo que se inicia nos fatores de risco cardiovasculares, que têm vindo a aumentar, a expectativa é que o peso da IC venha progressivamente a aumentar, agravado pelo envelhecimento da população, onde esta síndroma é mais prevalente. Em países desenvolvidos, a prevalência estimada de IC é de cerca de 2% da população geral adulta1. Em 2002, o estudo EPICA realizado em Portugal obteve uma prevalência na população adulta de 4,36%, com valores superiores a 10% nas faixas etárias mais avançadas, não existindo contudo dados mais atuais7. Estimativas recentes e baseadas nas alterações demográficas esperadas em Portugal prevêem um aumento de cerca de 30% em 2035 e 33% em 2060 comparativamente com 2011, correspondendo a mais de 450.000 indivíduos com IC8. As mesmas estimativas para os números de hospitalização apontam para valores que ultrapassarão os 20.000 internamentos8. Estudos económicos realizados em Portugal apontam também para aumento de carga da IC de 2014 para 2036 de 28%, atingindo 27 059 Disability Adjusted Life Years (DALYs) perdidos e 8112 mortes, o que reforça a necessidade de tornar a IC uma prioridade de saúde em Portugal9. Os doentes hospitalizados por IC mantêm significativo risco de readmissões e mortalidade3,4. As hospitalizações associam‐se a um pior prognóstico e são responsáveis por aproximadamente 70% de todos os custos associados com esta doença10.
O desenvolvimento e implantação de unidades especializadas na avaliação e tratamento da IC estão preconizadas nas recomendações internacionais para a IC e podemos designá‐las por clínicas ou unidades de IC11. São compostas pelas unidades de internamento por IC aguda (que deve incluir uma organização adequada e sistemática dos cuidados de transição para a alta), protocolos de articulação com os cuidados de saúde primários, consultas de ambulatório de IC, hospitais de dia de IC e a telemonitoração (com monitoração remota do doente em ambulatório). Estas equipas dedicadas devem ser multidisciplinares, compostas por médicos (cardiologistas e internistas), enfermeiros especializados, bem como fisioterapeutas, nutricionistas, técnicos cardiopneumologistas, psicólogos, assistentes sociais e farmacêuticos. Todos os profissionais envolvidos devem ter formação específica. Esta abordagem multidisciplinar tem benefícios já demonstrados em estudos prévios, com bom custo‐efetividade, em particular com melhorias da qualidade de vida dos doentes, reduções dos internamentos e reinternamentos, recurso aos serviços de urgência e mortalidade12. A educação do doente e do cuidador é fundamental em todo este processo integrado.
Por outro lado, um acesso facilitado a vários meios complementares de diagnóstico, como a ecocardiografia avançada e as provas de esforço cardiorrespiratórias, é fundamental no seguimento destes doentes, bem como acesso a reabilitação cardíaca, presentemente ainda muito escasso, segundo dados nacionais13. Um bom acesso a terapias mais avançadas, com apoio da arritmologia (com os cardioversores‐desfibrilhadores e terapêutica de ressincronização cardíaca), da cardiologia de intervenção coronária e estrutural, da cirurgia cardíaca coronária ou valvular e a transplantação cardíaca ou os dispositivos de assistência ventricular de longa duração são também importantes para a abordagem destes doentes. O tratamento de IC aguda requer técnicas avançadas e complexas, por equipas experientes. Estes programas devem ter como alvo principal os doentes sintomáticos e de alto risco e permitir uma abordagem otimizada (em termos farmacológicos, mas também de dispositivos), com envolvimento do doente e do seu cuidador nos cuidados individuais e na vigilância, com visitas regulares de seguimento (presenciais, por contacto telefónico ou por telemonitoração), com acesso facilitado nos episódios de descompensação e acesso a tratamentos avançados. Um pouco menos debatida é a necessidade de bom suporte e acesso a cuidados paliativos e de fim de vida.
O objetivo da presente revisão é o de descrever o diagnóstico e tratamento contemporâneo da IC, particularmente para os menos familiarizados com esta área, mas também alertar e discutir a importância de uma adequada articulação e rede de referenciação dos cuidados, extensão da rede presentemente existente e a necessidade de uma abordagem integrada e dentro dos padrões internacionais de qualidade. Não se pretende apresentar uma revisão sistemática da literatura ou meta‐análise, e sim abordar diretamente a abordagem recomendada internacionalmente e suportada em documentos de consenso que foram já eles redigidos com recurso a uma extensa revisão bibliográfica.
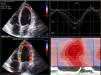
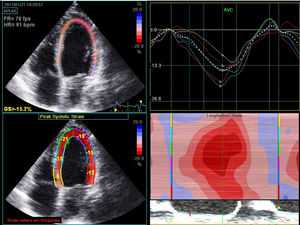
Métodos de diagnósticoUm acesso facilitado a métodos de imagem é fundamental no diagnóstico, estudo etiológico, avaliação prognóstica, escolha de tratamento e seguimento de doentes com IC. Entre todos os métodos disponíveis, a ecocardiografia, pelo baixo custo, elevada disponibilidade e portabilidade, bem como pela ampla informação que permite obter, surge com o método de eleição. Assim, a ecocardiografia é fundamental para diagnosticar a presença de disfunção sistólica ou diastólica, doença valvular significativa, doença miocárdica e envolvimento do ventrículo direito11,14. Para além da ecocardiografia transtorácica clássica, as novas tecnologias permitem melhorar a capacidade diagnóstica. Por exemplo, a avaliação do strain miocárdico por tecnologia de speckle‐tracking permite deteção precoce de disfunção ventricular em fase subclínica e a ecocardiografia tridimensional permite uma avaliação mais fidedigna da função ventricular esquerda e direita, muito próxima dos resultados obtidos com ressonância magnética cardíaca (Figura 1). Do mesmo modo, a ecocardiografia de sobrecarga permite detetar a presença de isquémia miocárdica, viabilidade, reserva contrátil e em alguns casos avaliação mais detalhada de patologia valvular. Embora os estudos clínicos não tenham demonstrado benefício na avaliação de dessincronia para decisão sobre implantação de terapêutica de ressincronização cardíaca, a avaliação ecocardiográfica completa prévia a implantação desta terapêutica continua a ter um papel importante, bem como na otimização dos parâmetros do ressincronizador. Estudos recentes têm valorizado o papel da ecocardiografia de sobrecarga na avaliação do potencial de resposta à terapêutica de ressincronização cardiaca. Especificamente, parâmetros como a resposta cronotrópica à sobrecarga com dobutamina, a presença de reserva contráctil e a associação de viabilidade + reserva contráctil parecem ser promissores e associados a resposta favorável ao tratamento de ressincronização15–17.
A ressonância magnética cardíaca continua a ser o gold‐standard na avaliação da função ventricular esquerda, mas, dado o seu elevado custo e a baixa acessibilidade e disponibilidade, tem sido utilizada sobretudo em situações mais selecionadas, particularmente quando a avaliação por ecocardiografia não é esclarecedora11,14. É particularmente útil para avaliação de viabilidade e na identificação de algumas etiologias menos habituais na insuficiência cardíaca pela técnica de realce tardio.
As técnicas de medicina nuclear podem ser também úteis em situações particulares, como no diagnóstico de isquémia e viabilidade e por exemplo no diagnóstico de amiloidose cardíaca11. A tomografia computadorizada cardíaca permite a avaliação de anatomia coronária em doentes com probabilidade pré‐teste baixa a intermédia para doença coronária11,14.
O recurso a métodos mais invasivos como a coronariografia pode ser necessário quando o diagnóstico de isquémia miocárdica é equívoco com recurso aos testes não invasivos ou quando a probabilidade pré‐teste é elevada11. Em fases mais avançadas da doença é igualmente importante um estudo completo hemodinâmico para averiguar as condições e eventuais contraindicações para tratamentos mais avançados, como a transplantação cardíaca11,18.
A seleção de doentes com IC crónica avançada que possam beneficiar de terapêuticas avançadas como a transplantação cardíaca e a colocação de dispositivos de assistência ventricular requerem uma avaliação holística dos doentes. Apesar de não poder ser utilizada como único factor de decisão para referenciação para estas terapêuticas, a prova de esforço cardiorrespiratória é um exame fulcral e que permite uma avaliação da fisiologia e do funcionamento em conjunto de diversos sistemas de órgãos. Assim, várias sociedades científicas (American Heart Association/American College of Cardiology e International Society for Heart Lung Transplantation) recomendam como um dos principais critérios a considerar para referenciação para transplantação cardíaca ou implantação de assistência ventricular esquerda o consumo de oxigénio de pico obtido na prova de esforço cardiorrespiratória inferior a 12ml/kg/min11,18. Outros parâmetros como o declive da rampa VE/VCO2 e a percentagem de consumo de oxigénio máximo previsto podem ser importantes para a decisão em doentes que não conseguiram atingir um esforço máximo e em mulheres ou homens com menos de 50 anos, respetivamente11,18. Estes parâmetros poderão ser superiores na discriminação do risco e possivelmente mais adequados para listar doentes para transplante do que outros parâmetros.Na Tabela 1 são apresentados os critérios de mau prognóstico da prova de esforço cardiorrespiratória.
Critérios de mau prognóstico da prova de esforço cardiorrespiratória18
| Se prova esforço cardiorrespiratória máxima (RER > 1,05 e atinge o limiar anaeróbio) |
| Peak VO2 ≤ 14 ml/Kg/min se não estiver com bloqueadores betaPeak VO2 ≤ 12 ml/Kg/min se estiver com bloqueadores betaJovens (< 50 anos) e mulheres, associar % prevista do Peak VO2≤ 50% |
| Se prova esforço cardiorespiratória submáxima (RER ≤1,05 ou sem atingir limiar anaeróbio) |
| Utilizar declive de equivalente ventilatório de CO2 (VE/VCO2) > 35 |
RER – Respiratory Exchange Ratio; Peak VO2 – consumo máximo de O2.
Sendo uma área de permanente investigação clínica, as possibilidades de tratamento desta patologia têm evoluído exponencialmente ao longo dos últimos 30 anos, com um arsenal terapêutico comprovado em estudos que incluem terapêutica farmacológica e não farmacológica. As clínicas de IC devem acompanhar esta evolução e oferecer o tratamento mais atual possível a estes doentes, que têm um alto risco de eventos cardíacos.
A necessidade de equipas especialmente dedicadas e com formação específica na área da IC é essencial, face ao mau prognóstico da IC19. Estas equipas permitem otimizar o tratamento destes doentes e têm benefícios já demonstrados em diversos estudos e revisões sistemáticas da literatura, com otimização do tratamento até cinco vezes comparativamente ao tratamento no inicio da implantação destas unidades para as terapêuticas recomendadas e redução muito significativa das hospitalizações por IC, que em algumas séries atingem quase os 50%, embora globalmente sejam mais próximas dos 25%3,20–24. Os dados da experiência em Portugal são escassos24. Dados da vizinha Espanha, de 2011, mostram que apenas 37% dos hospitais tinham unidades de IC, a maioria em hospitais de nível 3 (com laboratório de hemodinâmica, eletrofisiologia e cirurgia cardíaca)25. A maioria era liderada por cardiologista (84%) e 78% eram unidades gerais e não avançadas25. Encontraram também uma grande variabilidade nos programas, organização e atividades realizadas, bem como na definição das atividades dedicadas à enfermagem25. Das atividades realizadas, 45% das unidades tinham reabilitação cardíaca, 20% telemedicina (por contactos telefónicos, telemonitoração de dispositivos implantados ou vigilância de dados biométricos a distância) e 64% com hospital de dia. Esta realidade analisada em 2011 não era contudo muito diferente da registada em 2006, o que denotava a necessidade de melhoria desta vertente25. Assim, dadas as evidências e a recomendação como standard of care para estes doentes, em especial os recentemente internados por descompensação, deverá haver uma ampla implantação destes programas de cuidados multidisciplinares específicos.
Terapêutica farmacológicaA terapêutica farmacológica está comprovada em vários grupos de fármacos nos doentes com IC com fração de ejeção reduzida. O arsenal terapêutico disponível começou a crescer em 1987, altura em que foi publicado o estudo Consensus, que pela primeira vez demonstrou o benefício dos inibidores da enzima de conversão da angiotensina na redução de mortalidade destes doentes26. Posteriormente, em 1999, dois novos grupos farmacológicos (bloqueadores beta, com o estudo CIBIS‐II, e antagonistas dos recetores mineralocorticoides, com o estudo RALES) mostraram também reduzir a mortalidade destes doentes27,28. Após um hiato de 15 anos, em 2014 e 2019 dois novos grupos farmacológicos demonstraram uma redução adicional na mortalidade: sacubitril‐valsartan com o estudo PARADIGM‐HF e inibidores da SGTL‐2 com o estudo DAPA‐HF29,30.
Como resultado, estes quatro grupos de fármacos (o estudo com inibidores da SGTL‐2 é posterior à publicação das mais recentes recomendações da Sociedade Europeia de Cardiologia) receberam uma classe de recomendação I para o seu uso nos doentes com IC com fração de ejeção reduzida11. Infelizmente, estes grupos farmacológicos tiveram até agora resultados neutros nos doentes com IC e fração de ejeção preservada.
Outros grupos farmacológicos encontram‐se recomendados em subpopulações específicas por se associarem à redução dos internamentos por IC (diuréticos em doentes com IC e sintomas congestivos) ou por terem demonstrado reduzir a mortalidade (ivabradina em doentes em ritmo sinusal com frequência cardíaca superior a 70 bpm e hidralazina + dinitrato de isossorbida em doentes de raça negra)31,32.
No tratamento a curto‐prazo, de fase aguda, os inotrópicos melhoram o perfil hemodinâmico, permitindo recuperação da disfunção de órgão‐alvo33. Contudo, não existem benefícios demonstrados no prognóstico, não tendo por isso indicação no tratamento de rotina destes doentes, sendo a sua utilização mais limitada como ponte para outras opções terapêuticas mais avançadas33. A sua utilização está assim recomendada na presença de baixo débito, evidência de disfunção de órgão‐alvo e durante a descongestão. Os vasopressores não têm igualmente benefício no prognóstico, pelo que se utilizam sobretudo em situações com valores tensionais baixos e evidência de hipoperfusão de órgãos33. Para a abordagem da congestão, habituamente agravada pelo síndrome cardio‐renal e resistência aos diuréticos, devem ser utilizados os diuréticos de ansa, preferencialmente por via endovenosa, e se necessário associar outros diuréticos como os antagonistas dos mineralocorticoides e a metolazona33. A ultrafiltração pode ser uma alternativa a considerar, bem como a diálise peritoneal, esta última com a vantagem de ser exequível em regime de ambulatório33. Contudo, o tratamento da congestão melhora essencialmente a qualidade de vida e reduz as hospitalização, não melhorando o prognóstico33.
Terapêutica não farmacológicaAs várias técnicas associadas a benefício nos doentes com IC demonstram que o tratamento destes doentes não pode passar apenas por um médico especialista na área da IC, necessitando de apoio de várias valências da cardiologia e da cirurgia cardíaca.
Doentes com IC de etiologia isquémica e hipótese de revascularização ou com etiologia valvular tratável por cirurgia requerem uma estreita colaboração com a equipa de cirurgia cardíaca. Dados do estudo Surgical Treatment for Ischemic Heart Failure (STICH) e dos seus subestudos mostram que, na presença de doença multivaso, a revascularização cirúrgica ou percutânea (esta na possibilidade de revascularização completa) reduz significativamente a mortalidade comparativamente com terapêutica medica34,35. Com efeito, na presença de disfunção ventricular esquerda, a revascularização cirúrgica pode ser realizada com uma mortalidade a 30 dias aceitável, mantendo‐se o beneficio a longo‐prazo34,35. É, contudo, importante a avaliação prévia de viabilidade para melhor seleção dos doentes que podem beneficiar desta estratégia36. A revascularização de territórios viáveis associa‐se a melhor prognóstico. No entanto, em análise multivariável esse benefício não se mantém. Apesar disto, é opinião generalizada de peritos que a avaliação de viabilidade permanece fundamental.
A evolução nos dispositivos à disposição da equipa de arritmologia criou um arsenal de possibilidades terapêuticas para os doentes com IC, em que se incluem a implantação do cardioversor‐desfibrilhador implantável (CDI), a terapêutica de ressincronização cardíaca (TRC), terapêuticas de modulação cardíaca, ablação de fibrilhação auricular e a ablação de extrassistolia ventricular associada a disfunção ventricular esquerda11.
A cardiologia de intervenção, que tinha já um papel preponderante nos doentes com etiologia isquémica e possibilidade de revascularização percutânea, conseguiu, através do tratamento da insuficiência mitral funcional, demonstrar um benefício na mortalidade destes doentes, para além da sua participação ativa na implantação de dispositivos de monitoração invasiva11,37.
As equipas de reabilitação cardíaca demonstraram que, para além de ser segura, a realização de exercício nestes doentes permite melhorar a sua qualidade de vida, capacidade funcional e reduzir os internamentos hospitalares11. Estas equipas multidisciplinares que incluem também enfermeiros, psicólogos, dietistas e assistentes sociais permitem educar de uma forma mais intensa estes doentes, garantindo um grande envolvimento dos doentes com os programas de tratamento e facilitando o acesso ao tratamento durante episódios de descompensação11. Nos últimos anos, tem havido aumento dos centros com acesso a reabilitação cardíaca, contudo continua a ser subutilizada. Dados de 2013‐2014 mostram que apenas 8% dos indivíduos com enfarte do miocárdio foram referenciados para reabilitação cardíaca de fase 2 e que, de todos os doentes referenciados para reabilitação, apenas 12,7% tiveram como motivo principal a insuficiência cardíaca, embora com números melhorados comparativamente com registos anteriores13.
Hospitais de dia de insuficiência cardíacaApesar do desenvolvimento recente dos tratamentos endovenosos (ev) em ambulatório para a IC, já existia alguma evidência da exequibilidade, benefício, segurança e custo‐benefício. Num estudo que incluiu mais de 100 doentes com IC descompensada, a administração em ambulatório de diurético ev foi segura, custo‐efetiva e reduziu as hospitalizações38. Outro estudo também demonstrou que a administração ambulatória ev de diuréticos de ansa com protocolos estandardizados é eficaz no alivio da congestão em doentes com IC descompensada em todo o seu espectro de fracção de ejecção39.
Para além dos diuréticos ev, outras terapêuticas ambulatórias ev têm sido estudadas para melhoria dos sintomas de IC e evitar hospitalizações. As infusões pulsadas de levosimendan em doentes ambulatórios com IC avançada foram analisadas em dois ensaios clínicos aleatorizados. No estudo LevoRep, levosimendan (0,2μg/kg/min) vs. placebo administrados durante seis horas com duas semanas de intervalos durante seis semanas não mostraram diferenças significativas na capacidade funcional e qualidade de vida relacionada com a doença após 24 semanas40. Contudo, deram algumas indicações sobre a sua exequibilidade e segurança, incluindo a possibilidade de melhorar a sobrevivência livre de eventos com o levosimendan. No ensaio LION‐Heart, uma infusão ev de seis horas de levosimendan (0,2 g/kg/min) cada duas semanas durante 12 semanas associou‐se a uma melhoria das concentrações plasmáticas de NT‐proBNP, qualidade de vida e hospitalizações por IC quando comparado com placebo41. Assim, o uso intermitente de levosimendan mostrou redução de hospitalização e melhoria da qualidade de vida, mas sem demonstração clara de beneficio na mortalidade. Está assim indicado para melhoria sintomática ou como medida paliativa, mas são necessários estudos mais alargados para uma melhor definição do seu papel.
Em doentes com IC e deficiência de ferro, uma meta‐análise de quatros ensaios clínicos aleatorizados mostrou que, comparado com os que receberam placebo, a administração de carboximaltose férrica ev permitiu reduzir as hospitalizações recorrentes cardiovasculares, constituindo assim outra possibilidade de tratamento ev em ambulatório42.
Como parte integrante do tratamento em clínica ambulatória (Figura 2), é fundamental o reforço da educação do doente e dando‐lhe as ferramentas necessárias para a automonitoração, com ênfase para a importância da aderência farmacológica, dieta saudável e conhecimentos dos factores que causam as descompensações.
Monitoração dos doentes com insuficiência cardíacaO conceito teórico dos potenciais benefícios da monitoração dos doentes na redução dos internamentos por IC foi progressivamente trazido para a clínica através de um crescimento exponencial na tecnologia capaz de transmitir dados em tempo real. Assim, as unidades de IC têm atualmente ao seu dispor várias estratégias, que com uma resposta atempada podem melhorar os outcomes desta população.
Apesar de resultados díspares em diferentes estudos clínicos, a telemonitoração com uma equipa que receba a informação e seja capaz de dar respostas atempadas pode reduzir os internamentos por IC e reduzir a mortalidade por todas as causas, como demonstrado no recente estudo TIM‐HF243.
A monitoração pode ainda ser feita através de dispositivos implantados como os CDI e os TRC, permitindo um reconhecimento mais rápido de arritmias, problemas relacionados com os dispositivos e de agravamento dos sinais de IC, encontrando‐se actualmente recomendada sempre que se implanta um destes dispositivos44,45. Embora as alterações captadas por estes dispositivos forneçam informação valiosa, a avaliação direta das pressões de enchimento cardíacas podem fornecer informação adicional. Isto foi demonstrado no estudo Champion, através de um dispositivo (CardioMEMS®) que avalia diretamente a pressão na artéria pulmonar e que demonstrou uma redução nos internamentos por IC41.
Tratamento avançadoAssistência ventricular mecânicaOs sistemas de assistência ventricular mecânica são opções terapêuticas life‐saving na IC crónica e aguda11,46,47. Na IC crónica avançada, constituem uma alternativa em indivíduos que não têm como opção a transplantação (destination therapy), em indivíduos que aguardam transplante cardíaco, mas se prevê morbimortalidade elevada até ao mesmo (bridge to transplant), e em alguns indivíduos que não são temporariamente aptos para o transplante, mas poderão sê‐lo futuramente (bridge to candidacy)11.
A implantação de sistemas de assistência ventricular mecânica reduz significativamente a mortalidade e morbilidade em doentes com IC crónica avançada46. No entanto, pode associar‐se a problemas específicos como o tromboembolismo do dispositivo ou sistémico, complicações hemorrágicas multifatoriais, infeções do dispositivo, falência do sistema, falência ventricular direita, entre outras46,47. Exige, pois, vigilância específica e regular por equipas de IC multidisciplinares.
O desenho dos sistemas de assistência tem sido progressivamente aperfeiçoado, incluindo a mudança de paradigma de dispositivos de fluxo pulsátil para fluxo contínuo47. Mais recentemente, o dispositivo HeartMate 3® introduziu um desenho de levitação magnética com fluxo centrífugo, traduzindo‐se em menor taxa de disfunção do sistema e necessidade de remoção48. Prevê‐se que o aperfeiçoamento progressivo dos sistemas de assistência ventricular mecânica e a sua maior acessibilidade, no futuro, contribuam cada vez mais para colmatar o número crescente de doentes com IC crónica avançada, num contexto de reconhecida falta de dadores para transplante cardíaco ou com contraindicações para o mesmo47–49.
Em contexto agudo, de choque cardiogénico, podem ser utilizados dispositivos de suporte circulatório mecânico de curta duração33. Trata‐se de dispositivos habitualmente colocados por via percutânea e que podem ser utilizados durante algumas semanas até recuperação cardíaca e dos órgãos‐alvo ou como ponte para suporte circulatório mecânico de longa‐duração ou transplante cardíaco, sendo a escolha determinada pelas características de cada dispositivo, mas também pela experiência local. Os dispositivos atualmente disponíveis são o balão intra‐aórtico, a Extracorporeal Membrane Oxygenation (ECMO), TandemHeart® e o Impella®33. O suporte circulatório fornecido por cada um dos dispositivos é variável e todos requerem experiência para a sua implantação. O balão intra‐aórtico é o que tem uma implantação mais fácil, mas o contributo no débito cardíaco é o mais baixo de entre todos os dispositivos referidos, pelo que a sua utilização se tem limitado sobretudo ao contexto de doença isquémica cardíaca aguda, para suporte de angioplastia de alto risco, embora com evidência limitada33.
Transplantação cardíacaPassados mais de 50 anos desde a primeira cirurgia de transplante cardíaco em humanos, esta é atualmente uma opção terapêutica estabelecida em doentes com IC avançada com fração de ejeção ventricular esquerda reduzida35. Envolve uma equipa multidisciplinar que inclui a cirurgia cardíaca, cardiologia, medicina interna, medicina física e reabilitação, equipa de enfermagem especializada, psicologia e nutricionista, entre outras valências50.
Um dos maiores desafios das equipas é a seleção adequada dos candidatos a transplante: deve pesar‐se em simultâneo a história natural da doença de base e a morbimortalidade associada ao transplante51. São candidatos, em contexto de IC aguda doentes em choque cardiogénico refractário, dependentes de aminas ou de dispositivos de assistência para perfusão adequada52. Na IC crónica, são considerados para transplante os doentes com compromisso funcional significativo e indicadores de prognóstico desfavorável, tais como a prova de esforço cardiorrespiratória (conforme referido anteriormente), apesar de toda a terapêutica farmacológica, percutânea, cirúrgica e com dispositivos ter sido previamente instituída51,52. No entanto, é necessário interpretar corretamente este parâmetro, conhecer as suas limitações e enquadrá‐lo no contexto clínico53,54. Em situações de difícil decisão, outros parâmetros, eventualmente integrados em scores de risco, como o Seattle Heart Failure Model ou o Heart Failure Survival Score, são ferramentas úteis na tomada de decisão55,56.
Adicionalmente, o estudo para transplante inclui uma avaliação complementar exaustiva a fim de excluir contraindicações ou condições que aumentem o risco após o transplante além do razoável, como sejam infeções, neoplasias, lesões de outros órgãos alvo ou resistências vasculares pulmonares aumentadas51. É de igual importância avaliar o contexto social, o grau de motivação do doente e a sua adesão à terapêutica e seguimento51. Observamos que, fruto dos melhores resultados da transplantação, se tem modificado a lista de contraindicações, considerando‐se atualmente como candidatos doentes com risco crescente, previamente excluídos deste tratamento18. Tal evolução é refletida nas recomendações atualizadas da International Society for Heart Lung Transplantation, incluindo a aceitação de doentes com idade mais avançada, maior índice de massa corporal e maior grau de disfunção renal18. Por outro lado, a falta de dadores é reconhecida mundialmente e o problema poderá ser crescente, não colmatado no presente com o desenvolvimento de terapêuticas de assistência ventricular como terapêuticas de destino, nem com a utilização de dadores marginais49.
Atualmente, a sobrevida média ao fim de um ano pós‐transplante ronda os 80 a 90%, sendo a sobrevida mediana superior a 11 anos, associada a uma qualidade de vida favorável53,57. Na fase inicial após o transplante, as principais causas de mortalidade incluem disfunção primária do enxerto, infeções e rejeição; a longo prazo incluem a doença vascular do enxerto e neoplasias50,57. São frequentes diabetes, dislipidémia, hipertensão arterial e insuficiência renal crónica50,57. O seguimento pós‐transplante é, pois, bastante específico e exige domínio de competências que se estendem muito além de cuidados estritamente cardíacos.
Para além da melhoria da técnica cirúrgica, a terapêutica imunossupressora, profilaxia antimicrobiana e os métodos de vigilância têm sido aperfeiçoados49. Os esquemas de imunossupressão variam consideravelmente entre centros49. Genericamente, a imunossupressão de manutenção inclui um inibidor da calcineurina (tacrolimus ou ciclosporina), um agente antiproliferativo (maioritariamente o micofenolato de mofetil) e corticosteroide50,58. Os inibidores do mTOR (everolimus, sirolimus), introduzidos mais recentemente, têm demonstrado benefícios na redução de doença neoplásica, insuficiência renal e doença vascular do enxerto50,58. O objetivo global é a utilização de esquema de imunossupressão com a menor potência possível, a fim de evitar os seus efeitos adversos, como infeções, neoplasias, nefrotoxicidade e desregulação metabólica, mas suficiente para evitar rejeição celular aguda49,50,58. Esquemas com supressão de corticoides são utlizados em alguns casos; inclusive, já foi testado esquema de monoterapia com tacrolimus, com resultados promissores49,50,58,59.
O método padrão para deteção de rejeição aguda continua a ser a biópsia endomiocárdica, que é realizada regularmente durante o primeiro ano após o transplante50. Além da rejeição celular aguda, a rejeição humoral é atualmente uma entidade estabelecida, requerendo pesquisa específica49,50. Tem sido realizada investigação extensa sobre a aplicação de métodos não invasivos para deteção de rejeição. Incluem técnicas imagiológicas, como métodos diferentes de ecocardiografia e ressonância magnética, e biomarcadores, como o perfil de expressão genética em células mononucleares circulantes49,60,61. Os resultados são promissores, mas a acuidade diagnóstica de cada um destes métodos não substitui a biópsia endomiocárdica49,60,61.
Pelo risco de doença vascular do enxerto, uma das principais causas de morte a longo prazo, é necessária vigilância regular através de coronariografia invasiva, idealmente complementada com técnicas de imagem como a ecografia intracoronária, atendendo à apresentação específica deste tipo de doença coronária49,50. Têm sido estudados métodos não invasivos, mas à data não substituem a necessidade de vigilância invasiva regular49,50.
Em suma, a transplantação cardíaca exige um envolvimento multidisciplinar, em particular na seleção de candidatos e no complexo seguimento após o transplante, exigindo competências além dos cuidados estritamente cardíacos, que por si só têm especificidade própria.
Questões em abertoA terapêutica paliativa tem sido geralmente pouco abordada ou discutida. Numa altura em que novas formas de tratamento têm surgido, permitindo alargar as opções de tratamento e melhorar os resultados e a qualidade de vida destes doentes, continuam, contudo, a permanecer situações com evolução desfavorável, nos quais um acesso facilitado a cuidados paliativos é fundamental e por esse motivo a articulação com essas unidades é essencial. A maioria dos doentes rejeita ou não reconhece o carácter terminal da IC, focando‐se essencialmente na abordagem diária, apesar da deterioração clínica óbvia. Nesse período de fim de vida, deverá ser realizada uma abordagem e discussão com a equipa multidisciplinar, incluindo equipa especializada em cuidados paliativos e psicólogos, para que o doente tenha um plano bem estabelecido e definido de fim de vida62.
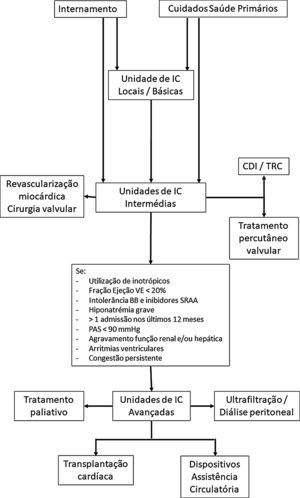
Face aos diferentes padrões de evolução clínica e de necessidades de cuidados muito variáveis, estes doentes vão precisar de diferentes níveis de cuidados ao longo da evolução da sua doença, com necessidades diferentes, em termos de apoio médico e de enfermagem, mas também tecnológico para a sua abordagem. Estas questões têm já sido debatidas para outras patologias, em particular aguda/crítica, como o trauma, mas também, por exemplo, os cuidados intensivos cardíacos. Para isso, relativamente a estas patologias agudas, está recomendada a classificação dos doentes em três níveis de gravidade e as unidades de cuidados intensivos estão também classificadas em Nível I (Básico), II (intermédio) e III (avançado) em função do pessoal e das técnicas disponíveis em cada unidade63. Esta abordagem permite melhor conhecimento da abordagem destes doentes, uma alocação mais eficiente de recursos e melhorias nos resultados. No contexto do tratamento da IC, a caracterização dos centros em função dos recursos disponíveis (humanos e técnicos) em conjunto com a definição dos cuidados que o doente necessita, poderá permitir o enquadramento numa rede de referenciação para o tratamento da IC entre hospitais terciários e os restantes hospitais, facilitando um uso mais eficiente dos recursos (Figura 3), com definição já bem estabelecida de quando referenciar para uma unidade de tratamento avançado de IC33.
Algoritmo de orientação abordagem de doentes com IC.
Legenda: BB – bloqueadores beta: IC – insuficiência cardíaca; PAS – pressão arterial sistólica; SRAA – sistema renina‐angiotensina‐aldosterona; VE – ventrículo esquerdo.
A referenciação para os tratamentos especificados para as unidades de IC intermédias pode ser também realizada a partir das unidades de IC básicas (por protocolos previamente estabelecidos com outros hospitais) ou pelas unidades de IC avançadas.
Para uma maior eficiência na abordagem dos doentes com IC, é particularmente importante a existência de documentos orientadores, nomeadamente um «processo assistencial integrado de manejo de IC» e a definição de indicadores de qualidade para avaliação de desempenho relativo à assistência médica aos doentes com IC, para melhoria construtiva dessa assistência, à semelhança do que ocorre em outros países, como a Espanha64. Com efeito, uma abordagem segundo os padrões recomendados internacionalmente e claramente definidos é essencial para uniformizar a prática clínica nacional. A definição de uma rede de referenciação nacional para o tratamento da IC crónica e aguda poderá permitir uma maior rapidez na orientação adequada destes doentes. Finalmente, a realização de auditorias internas e externas permite identificar os pontos que requerem melhoria a nível local ou nacional, permitindo uma utilização mais adequada de recursos que podem em muitos locais ser escassos.
Conflitos de interesseOs autores declaram não haver conflito a reportar.