A síndrome de Marfan é uma doença autossómica dominante do tecido conjuntivo, com uma incidência estimada de um em 5000 indivíduos. Em 90% dos casos resulta de mutações do gene da fibrilina‐1, principal componente das microfibrilas da matriz extracelular. Estudos em modelos animais da síndrome de Marfan demonstraram que as mutações da fibrilina‐1 interferem com a via de sinalização do TGF‐β, além de comprometer a integridade do tecido conjuntivo. As principais manifestações envolvem os sistemas cardiovascular, ocular e esquelético. O diagnóstico da síndrome de Marfan é feito de acordo com a nova revisão da nosologia de Ghent. Um diagnóstico precoce e tratamento adequado são fundamentais para os doentes com síndrome de Marfan que estão sujeitos às complicações cardiovasculares potencialmente fatais dos aneurismas da aorta e da disseção aórtica. O tratamento padrão inclui β‐bloqueantes profiláticos para diminuir a taxa de dilatação da aorta ascendente e cirurgia profilática da aorta. O sucesso do tratamento médico e cirúrgico atual da patologia aórtica da síndrome de Marfan melhorou substancialmente a esperança média de vida, estendendo‐a acima dos 72 anos. Esta revisão visa proporcionar uma visão global desta doença hereditária.
Marfan syndrome is an autosomal dominant connective tissue disease with an estimated incidence of 1 in 5000 individuals. In 90% of cases it is caused by mutations in the gene for fibrillin‐1, the main constituent of extracellular microfibrils. Studies on animal models of Marfan syndrome have revealed that fibrillin‐1 mutations interfere with local TGF‐β signaling, in addition to impairing tissue integrity. The cardinal features involve the cardiovascular, ocular and skeletal systems. The diagnosis of Marfan syndrome is made according to the revised Ghent nosology. Early identification and appropriate management are critical for patients with Marfan syndrome, who are prone to the life‐threatening cardiovascular complications of aortic aneurysms and aortic dissection. The standard treatment includes prophylactic beta‐blockers in order to slow down dilation of the ascending aorta, and prophylactic aortic surgery. The success of current medical and surgical treatment of aortic disease in Marfan syndrome has substantially improved mean life expectancy, extending it above 72 years. This review aims to provide an overview of this hereditary disorder.
A síndrome de Marfan (SM) é uma doença multissistémica do tecido conjuntivo, com transmissão autossómica dominante. Apresenta uma incidência de um caso por cada 5000 indivíduos1,2. Exibe uma penetrância completa, expressividade variável intra e interfamiliar, pleiotropia e não demonstra predileção por género, etnia ou distribuição geográfica1,3. Aproximadamente 25% dos casos resultam de uma mutação de novo, sendo que os restantes 75% herdam a condição de um parente afetado3,4.
O diagnóstico clínico foi estabelecido em 1986 de acordo com os critérios de Berlim, substituídos em 1996 pelos critérios Ghent, que em 2010 foram atualizados para a mais recente versão5,6.
GenéticaMutações no gene fibrilina‐1 (FBN1) são responsáveis por mais de 90% dos casos de SM clássico7,8. Este gene localiza‐se no cromossoma 15q21.1, está organizado em 65 exões e codifica uma glicoproteína, a FBN1, principal componente das microfibrilas da matriz extracelular9.
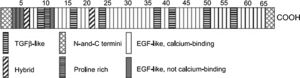
A FBN1 está presente na pele, pulmões, rins, vasos sanguíneos, cartilagem, tendões, músculos, córnea, e zónula ciliar10. É constituída pela repetição de 47 domínios homólogos ao fator de crescimento epidérmico, 43 dos quais são domínios do fator de crescimento epidérmico ligado ao cálcio (cbEGF)9. Cada domínio contém seis resíduos de cisteína que formam três pontes de sulfeto, entre C1 e C3, C2 e C4, e C5 e C6, conferindo estabilidade à sua conformação tri‐dimensional10. Os domínios cbEGF têm um papel relevante na proteção contra a proteólise da FBN1, na promoção da interação entre os monómeros de FBN1 e os outros componentes das microfibrilas e na estabilização da estrutura das microfibrilas11,12. A FBN1 contém também sete domínios homólogos aos encontrados nas proteínas latentes de ligação ao fator de crescimento beta‐1 (LTBPs) e ainda um módulo híbrido com características dos domínios cbEGF e LTBPs (Figura 1)9,11–13.
Representação esquemática da organização do gene fibrilina‐1. Adaptado de What is new in the Marfan syndrome?, Nollen GJ, Mulder BJM, Int J Cardiol, 97:103‐8, 2004. EGF‐like, domínios homólogos ao fator de crescimento epidérmico; TGF‐β‐like, domínios homólogos aos encontrados nas proteínas latentes de ligação ao fator de crescimento beta‐1.
O tipo de mutação do gene FBN1 mais frequentemente encontrado é a mutação pontual, registando‐se 60% de mutações missense e 10% de mutações nonsense. A mutação missense mais comum resulta da substituição de resíduos de cisteína, interferindo com a normal formação das pontes de sulfeto ao nível dos domínios cbEGF e LTBPs9,13.
As mutações distribuídas ao longo do gene FBN1 não apresentam uma correlação aparente genótipo/fenótipo10,13–15. Este alto grau de variabilidade intra e interfamiliar sugere que fatores ambientais, fatores estocásticos ou ainda a presença de genes modificadores influenciam a expressão fenotípica da doença. O nível de expressão do alelo normal da FBN1 e a hiper‐homocisteinemia associada ao polimorfismo da C677T metilenotetra‐hidrofolato redutase têm sido propostos como fatores modificadores da severidade do quadro clínico da SM13.
Vários estudos têm procurado documentar correlações genótipo‐fenótipo, sendo que a mais forte estabelecida até ao momento relaciona‐se com a SM neonatal, associada a mutações nos exões 24‐32 do gene FBN1, e que surge como a forma mais grave da doença, manifestando‐se logo após o nascimento. Estes recém‐nascidos exibem características comuns da SM como aracnodactilia e escoliose e ainda algumas particularidades próprias deste fenótipo, como deformação das orelhas, contraturas congénitas em flexão, enfisema pulmonar e descamação da pele. A sua sobrevida para além dos 24 meses é muito rara, sendo a principal causa de morte a insuficiência cardíaca congestiva associada à regurgitação mitral e tricúspide16,17.
Mutações do gene FBN1 estão também descritas em indivíduos que apresentam fenótipos clinicamente semelhantes à SM, mas sem preencher os critérios nosológicos de Ghent, contando‐se entre essas fibrilinopatias a ectopia lentis, o fenótipo MASS (miopia, prolapso da válvula mitral, dilatação da raiz da aorta sem disseção e alterações cutâneas e esqueléticas), a síndrome de craniossinostose Shprintzen‐Goldberg, a associação familiar de aneurismas e disseções da aorta torácica, entre outras13,16.
A heterogeneidade genética da SM foi descrita em 1994 no decorrer do estudo de uma família com mais de 170 indivíduos, originária do sul de França, que apresentava um fenótipo sobreponível ao da SM clássica. Investigações excluíram alterações nos genes FBN1 e fibrilina‐2 e confirmaram a existência de um segundo locus para a SM localizado na região cromossómica 3p24.2‐p257,13,18. Posteriormente, em 2004, foram identificadas, em indivíduos com fenótipo sobreponível à SM, mutações no gene do recetor do fator beta de transformação do crescimento II (TGFβRII), mapeado na região cromossómica descrita, estabelecendo‐se assim a heterogeneidade genética. Estas mutações estão na base da SM tipo II, caracterizada por um envolvimento mais agressivo do sistema cardiovascular, nomeadamente disseções da aorta em idades mais jovens e para diâmetros menores da aorta, lesões do sistema esquelético e envolvimento oftalmológico raro ou mesmo inexistente7,8,10,19–23. Em 2006 foram documentadas em indivíduos com fenótipo sobreponível à SM a presença de várias mutações pontuais do gene do recetor do fator beta de transformação do crescimento I (TGFβRI), que passou a estar também ele associado à SM tipo II7,20,22. Alguns autores estudaram a possibilidade de mutações no gene do recetor do fator beta de transformação do crescimento III (TGFβRIII) estarem também associadas à SM, não obtendo até ao momento resultados esclarecedores7.
Estão registadas na Universal Mutation Database 3077 mutações no gene FBN1, 123 no TGFβRI e 203 no TGFβRII24. Recorrendo à Genome Aggregation Database encontram‐se descritas 3905 mutações no gene FBN1, 607 no TGFβRI e 647 no TGFβRII25.
Na presença de um diagnóstico e seguimento adequados, o prognóstico de um indivíduo com SM é semelhante, quer esteja relacionado a uma mutação do gene FBN1 ou TGFβRII. No entanto, como as mutações do gene TGFβRII estão frequentemente associadas a manifestações menos pronunciadas, acontece frequentemente que nestes casos o diagnóstico da SM é feito mais tardiamente e muitas vezes na sequência de uma complicação cardiovascular, com pior prognóstico para estes indivíduos10.
PatogénesePensou‐se inicialmente que na origem da SM estaria em causa uma perda de integridade do tecido conjuntivo secundária a mutações do gene FBN1, causadoras de perturbações na estrutura e função das microfibrilas que compõem a matriz extracelular26–28.
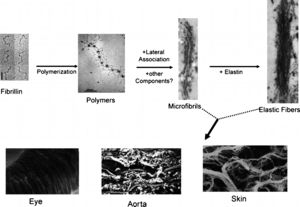
As microfibrilas intervêm no processo da elastogénese, dispondo‐se espacialmente em torno do núcleo central de elastina e em menor quantidade dentro do núcleo amorfo, representando o componente fibrilar das fibras elásticas (Figura 2)10,13,29.
Representação esquemática das principais etapas subjacentes à formação das microfibrilas e fibras elásticas, presentes, por exemplo, no olho, artéria aorta e pele. Adaptado de Fibrillin microfibrils: multipurpose extracellular networks in organismal physiology, Ramirez F, Sakai LY, Dietz HC, et al., Physiol Genomics, 19(2): 151‐4, 2004.
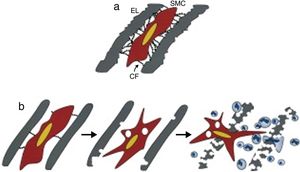
Ao nível da túnica média da aorta as microfibrilas associam‐se à elastina formando lâminas concêntricas que separam individualmente as camadas de células musculares lisas, assegurando uma estrutura que confere elasticidade à parede da aorta. Além disso, as microfibrilas desempenham um importante papel na estabilização mecânica da aorta através da interligação das lâminas elásticas às células musculares lisas e à membrana basal subendotelial28,30. As sequências de aminoácidos arginina‐glicina‐aspartato da FBN1 ao interagir com as αvβ3 integrinas asseguram a adesão e fixação das células musculares lisas, possibilitando a coordenação das forças contrácteis e elásticas31,32. As αvβ3 integrinas regulam ainda a atividade das células musculares lisas, incluindo a sua migração, proliferação e sobrevivência.
Mutações ao nível do gene FBN1 aumentam a susceptibilidade da FBN1 à proteólise, conduzindo à fragmentação das microfibrilas e consequente desorganização das fibras elásticas ao nível da túnica média da aorta, sendo esta uma marca histológica da SM, conhecida por degenerescência da média3. Este desarranjo e fragmentação das fibras elásticas da túnica média da aorta induz um aumento da rigidez e uma diminuição da elasticidade/distensibilidade da parede da aorta, fatores preditores de dilatação e disseção aórtica2,33. Tardiamente, observa‐se calcificação difusa da túnica média, que se deve ao facto de as fibras elásticas desprovidas da rede microfibrilar ficarem mais suscetíveis à deposição de cálcio. Ao mesmo tempo, a quebra da interacção entre a FBN1 e as células musculares lisas resulta na perda da capacidade de estas secretarem moléculas que conferem proteção ativa contra a calcificação local, como a osteoprotegerina e a proteína GLA da matriz31,33.
A perda de filamentos de FBN1 conduz, por outro lado, a uma alteração fenotípica das células musculares lisas que passam de um estádio contráctil quiescente para um estádio proliferativo, ocorrendo uma alteração no seu programa morfológico e sintético13,30–32,34. As células musculares lisas perdem a sua função contráctil, importante na prevenção da dilatação aórtica em cada ciclo cardíaco, contribuindo assim para progressiva dilatação da aorta33. As células musculares lisas fenotipicamente modificadas iniciam a secreção de múltiplos componentes da matriz extracelular (colagénio, proteoglicanos e elastina) e ainda de mediadores da elastólise, incluindo as metaloproteinases (MMPs) ‐2 e ‐9 (Figura 3) 13,30,32. Estas enzimas induzem a perda e fragmentação das fibras elásticas, causando uma extensa remodelação vascular com progressiva destruição do tecido conjuntivo e desenvolvimento de aneurismas da aorta torácica e lesões valvulares31,33,35. Trata‐se de um ciclo vicioso, em que a fragmentação da FBN1 leva a um aumento das MMPs, as quais, por sua vez, detentoras de propriedades elastolíticas geram mais fragmentos de FBN133. O tipo de MMP predominante parece correlacionar‐se com o estádio de desenvolvimento do aneurisma, sendo a MMP‐2 expressa em níveis elevados em aneurismas de pequenas dimensões, enquanto a MMP‐9 se encontra elevada em aneurismas de maiores dimensões ou em risco de rutura36. Vários estudos mostraram a existência de um desequilíbrio entre a razão MMP/inibidor tecidual da MMP em amostras de tecido aneurismático da aorta31,33,36. A modulação fenotípica das células musculares lisas produz alterações no seu estádio de diferenciação, resultando na sua proliferação e migração para a túnica íntima da aorta, onde ocorre uma acumulação ectópica, exuberante e desorganizada de colagénio e elastina, cursando com o espessamento e hiperplasia desta camada (formação da neoíntima), achado característico da parede do aneurisma da aorta nos doentes com SM31,37,38.
(a) Mecanismo de ligação da célula muscular lisa às lâminas elásticas circundantes por intermédio de filamentos de conexão compostos por fibrilina‐1. (b) Modelo de elastólise na síndrome de Marfan, mostrando que o défice de filamentos de fibrilina‐1 origina uma alteração no programa sintético da célula muscular lisa que contribui para uma elastólise precoce, à qual se associa uma infiltração de células inflamatórias na túnica média do vaso sanguíneo precipitando o seu colapso estrutural. Adaptado de Phenotypic Alteration of Vascular Smooth Muscle Cells Precedes Elastolysis in a Mouse Model of Marfan Syndrome, Bunton TE, Biery NJ, Myers L, et al., Circ Res, 88:37‐43, 2001.
CF, filamento de conexão; EL, lâmina elástica; SMC, célula muscular lisa.
A degradação da FBN1 e consequente deterioração da lâmina limitante elástica interna ou externa da parede da aorta promove a quimiotaxia de macrófagos, ocorrendo a infiltração de células inflamatórias para a túnica média, com aumento da atividade local de enzimas proteolíticas, as quais intensificam a elastólise, contribuindo para o colapso estrutural da parede da aorta e consequente formação aneurismática e disseção da aorta13,30,31,33,39.
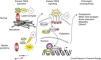
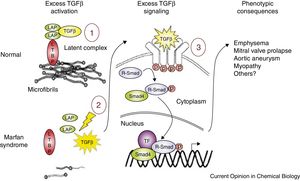
Investigações recentes em modelo animal da SM permitiram demonstrar outras funções fisiológicas das microfibrilas, para além do seu papel estrutural, nomeadamente na modulação da sinalização pelo fator beta de transformação do crescimento (TGF‐β)4,10,23,28,40–42. O TGF‐β, citocina secretada por vários tipos de células da parede vascular, está implicado na regulação da proliferação, migração, diferenciação e sobrevivência celular8,12,42. É secretado sob a forma de um complexo latente grande (LLC), composto pelo TGF‐β, pelo peptídeo associado à latência (LAP) e por uma de três LTBPs. Métodos imunoquímicos demonstraram que este complexo se liga por meio da LTBP apropriada a locais específicos da matriz extracelular, os domínios da FBN1 homólogos aos encontrados nas LTBPs. Esta interação permite estabilizar o complexo latente de TGF‐β suprimindo a libertação e ativação do TGF‐β12,43–45.
A presença de mutações ao nível do gene FBN1 resulta num inadequado sequestro do LLC pela matriz extracelular, conduzindo à ativação do TGF‐β2,4,12,23,30,41–45. Este TGF‐β livre e ativo interage com o TGFβRII encontrado à superfície celular, o qual através de um processo de transfosforilação activa o TGFβRI. Este último por sua vez recruta e fosforila um recetor regulado Smad (small mothers against decapentaplegic), o qual se liga ao Smad4 penetrando em seguida no núcleo da célula, onde, combinado com fatores de transcrição, forma um complexo transcricional ativo capaz de induzir ou reprimir numerosos genes, resultando daí várias características da SM, nomeadamente o desenvolvimento de enfisema pulmonar, alterações mixomatosas e prolapso da válvula mitral, formação de aneurismas aórticos e miopatias (Figura 4)4,12,42.
Esquema ilustrativo da normal regulação do fator beta de transformação do crescimento pelas microfibrilas e das repercussões associadas ao défice de microfibrilas em portador de Marfan. Adaptado de Marfan syndrome: from molecular pathogenesis to clinical treatment, Ramirez F, Dietz HC, Curr Opin Genet Dev, 17(3):252‐8, 2007.
LAP, peptídeo associado à latência; LTBP, proteína latente de ligação ao fator de crescimento beta‐1; p, fosforilação; R‐Smad, recetor regulado small mothers against decapentaplegic; Smad4, small mothers against decapentaplegic 4; TF, fatores de transcrição; TGF‐β, fator beta de transformação do crescimento.
As alterações morfofuncionais das válvulas auriculoventriculares correlacionam‐se com aumento da atividade do TGF‐β e da expressão de genes regulados pelo TGF‐β (βIGH3, endotelina‐1, TIMP1), envolvidos no aumento da proliferação celular e na redução da apoptose ao nível dos folhetos das válvulas, contribuindo desta forma para as alterações mixomatosas valvulares46,47.
Alguns estudos implicam o TFG‐β na degradação da matriz extracelular, atuando através da indução da expressão de MMPs, cujo papel na progressão do aneurisma é conhecido12. Por sua vez, estas MMPs, sobretudo a ‐2 e a ‐9, ativam o TGF‐β latente, originando um ciclo vicioso34. O TGF‐β ativo tem também um papel na promoção da proliferação celular e transdiferenciação do fenótipo das células musculares lisas, fatores implicados na patogénese da SM38.
A identificação de mutações ao nível dos genes TGFβRI e TGFβRII, relacionadas com doenças fenotipicamente semelhantes à SM, constituiu mais uma evidência do contributo da ativação excessiva da via de tradução do sinal do TGF‐β na patogénese da SM4,7,10,12,23,28,32,41,44,48.
Manifestações clínicasA SM é uma doença multissistémica, atingindo tipicamente os sistemas cardiovascular, esquelético e ocular, podendo também envolver o sistema nervoso central, o aparelho respiratório e a pele5,6.
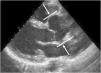
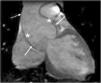
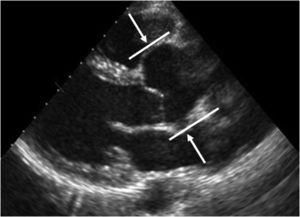
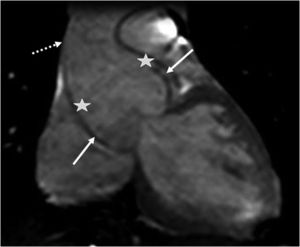
A principal manifestação cardiovascular da SM consiste na dilatação da raiz da aorta e da aorta ascendente proximal com apagamento da junção sino‐tubular, presente em 80% dos doentes, e conduzindo eventualmente à disseção da aorta, principal causa de morte prematura nestes doentes (Figuras 5 e 6) 3,12,41,49–51. A aorta ascendente é, neste contexto, a porção da árvore arterial mais afetada pelo desenvolvimento aneurismático devido ao seu maior conteúdo em fibras elásticas e à exposição ao stress hemodinâmico repetitivo da ejeção do ventrículo esquerdo2,50,52,53.
A SM está presente em 50% dos doentes com uma disseção aórtica e idade inferior a 40 anos e em apenas 2% das disseções que ocorrem em doentes mais velhos3. A disseção da aorta tipo A da classificação de Stanford pode progredir no sentido anterógrado envolvendo o arco da aorta e os segmentos aórticos distais ou no sentido retrógrado envolvendo a válvula aórtica, as artérias coronárias ou rompendo para o pericárdio ou a pleura1,41. No SM são fatores de risco para a disseção aórtica: diâmetro da aorta superior a 5cm, rápida progressão da dilatação aórtica (mais de 0,5cm por ano), antecedentes familiares de disseção, reduzida distensibilidade da aorta e presença de insuficiência aórtica moderada a severa2,41,54–56. O diâmetro da aorta é considerado o fator preditivo com maior impacto10. Constata‐se que a disseção da aorta é extremamente rara em crianças, independentemente das dimensões do vaso41. Apesar de a aorta ascendente ser a mais afetada, a dilatação e disseção da aorta distal e dos seus ramos (tipo B da classificação de Stanford) representam importante complicação da SM3. A disseção da aorta descendente associa‐se à da aorta ascendente em 43% dos casos e aparece isolada em 20% dos casos57. Demonstrou‐se que após a realização da cirurgia eletiva da aorta ascendente, o arco aórtico e a descendente tornam‐se as regiões suscetíveis à ocorrência de eventos aórticos, sendo importante a sua vigilância imagiológica de modo a prevenir a ocorrência de disseção a este nível57,58. A disseção da aorta abdominal foi observada em alguns doentes com SM3.
Nos indivíduos com SM, a insuficiência da válvula aórtica é habitualmente uma ocorrência tardia, secundária à dilatação da raiz da aorta1,41. O risco de regurgitação aórtica está relacionado com o diâmetro da aorta, sendo rara quando o diâmetro da aorta é inferior a 40mm e estando quase sempre presente para diâmetros superiores a 60mm59. Regista‐se também frequentemente o espessamento, alongamento e redundância das válvulas mitral e tricúspide, muitas vezes associado a prolapso valvular, sendo variável o grau de regurgitação12,41,47. A válvula mitral presumivelmente devido à sua localização num sistema de pressão mais elevada tem maior tendência a prolapsar do que a tricúspide59.
O diagnóstico da SM na infância é muitas vezes difícil, dado que certas manifestações clínicas só se tornam evidentes com a idade. Crianças com características que façam suspeitar da SM devem ser seguidas a longo prazo. A maioria das crianças com SM apresenta dilatação da raiz da aorta, prolapso da válvula mitral ou ambos antes dos 18 anos3,60,61. As crianças com um início precoce e grave da SM apresentam frequentemente prolapso da válvula mitral com regurgitação valvular, conduzindo a dilatação e compromisso da função ventricular esquerda e hipertensão pulmonar. Esta insuficiência da válvula mitral representa a principal causa de morbilidade e mortalidade nestas crianças, assumindo‐se que neste grupo etário a disfunção da válvula mitral é mais comum do que a dilatação da aorta12,41,60,62.
Arritmias cardíacas são comuns nos doentes com SM e são uma potencial causa de morte súbita entre estes62. O aumento da prevalência do prolongamento do intervalo QT no eletrocardiograma tem sido descrito em doentes com SM41,63.
A dilatação da artéria pulmonar ocorre frequentemente em indivíduos com SM, sendo mais proeminente ao nível da raiz arterial. A disseção desta artéria ocorre muito raramente, podendo, no entanto, vir a tornar‐se mais relevante com o aumento da longevidade destes doentes6,52,64. A regurgitação valvular pulmonar tem sido descrita em doentes com SM50.
A anomalia esquelética mais evidente da SM, e que conduz frequentemente à suspeição diagnóstica, é o crescimento desproporcional dos ossos dos membros superiores e inferiores, resultando numa estatura alta, num segmento inferior maior do que o superior e em uma envergadura 1,05 vez maior do que a estatura. O aumento do crescimento longitudinal das costelas pode produzir deformidades no tórax: pectus escavatum ou pectus carinatum. A aracnodactilia é uma característica subjetiva, mas assente em sinais do exame físico12,41. A escoliose toracolombar afeta cerca de 60% dos doentes65. A protusão acetabular é geralmente assintomática em adultos jovens41. Os pés planos estão frequentemente presentes enquanto alguns doentes apresentam pés cavos. A camptodactilia é frequentemente observada, especialmente nas crianças com grave e rápida progressão da doença. Várias características faciais estão tipicamente presentes: dolicocefalia, palato ogival, apinhamento dentário, retrognatismo ou micrognatia, osso malar achatado e fissuras palpebrais inclinadas para baixo6,41.
Relativamente às manifestações oculares da SM, a mais comum é a luxação do cristalino (ectopia lentis), presente em aproximadamente 60% dos casos. Podem ocorrer miopia precoce e severa, descolamento da retina, início precoce de cataratas ou glaucoma, córnea achatada, hipoplasia da íris, entre outras12,41.
Entre outras alterações sistémicas, a ectasia da dura‐máter ocorre em 60% a 90% dos doentes, com alargamento do canal raquidiano ao nível da região lombo‐sagrada12. O envolvimento pulmonar na SM pode resultar da deformação grave do esterno ou da coluna vertebral, condicionando padrão ventilatório restritivo. É comum a ocorrência de estrias cutâneas e de hérnias inguinais, tanto na altura do nascimento como na adolescência, com risco elevado de recorrência após cirurgia41.
DiagnósticoO carácter progressivo e potencialmente fatal das manifestações clínicas da SM justifica a importância de um diagnóstico precoce66.
O diagnóstico torna‐se muitas vezes difícil devido a: extensa variabilidade fenotípica inter e intrafamiliar; ao facto de certas manifestações clínicas serem dependentes da idade; ao elevado grau de mutações espontâneas; à sobreposição clínica com várias outras doenças do tecido conjuntivo4,65–68. Os critérios de Ghent de 1996 compreendiam um conjunto de manifestações major e minor envolvendo os vários sistemas e a história familiar/genética. Contudo, estes critérios apresentavam algumas limitações, pelo que em 2010 foi proposta uma nova revisão da nosologia de Ghent, tendo daí resultado novos critérios de diagnóstico da SM, criados de modo a assegurar um diagnóstico precoce da doença, evitar diagnósticos ambíguos e facilitar o seguimento/acompanhamento dos doentes (Tabelas 1 e 2)5,6.
Revisão dos critérios de Ghent para o diagnóstico da síndrome de Marfan e condições relacionadas
| Na ausência de história familiar:Ao (Z ≥ 2) e EL = SM*Ao (Z ≥ 2) e mutação do gene FBN1 = SMAo (Z ≥ 2) e Sist (≥ 7 pontos) = SM*EL e mutação do gene FBN1 identificada em um indivíduo com aneurisma da aorta = SMEL com ou sem Sist e com mutação do gene FBN1 previamente não associada a aneurisma/disseção da raiz da aorta ou sem mutação do gene FBN1 = ELSAo (Z <2) e Sist (≥ 5 com pelo menos uma característica do sistema esquelético) sem EL = MASSMVP e Ao (Z < 2) e Sist (< 5) sem EL = MVPSNa presença de história familiar:EL e história familiar de SM (como definido acima) = SMSist (≥ 7 pontos) e história familiar de SM (como definido acima) = SM*Ao (Z ≥ 2 acima de 20 anos, ≥ 3 abaixo de 20 anos) e história familiar de SM (como definido acima) = SM** Advertência: sem características discriminatórias de síndrome de Shprintzen‐Goldberg, síndrome de Loeys‐Dietz ou síndrome de Ehlers‐Danlos tipo vascular e depois de realizados testes genéticos apropriados (TGFβRI/II, bioquímica do colagénio, COL3A1). Outras condições/genes surgirão com o tempo. |
Ao, diâmetro da aorta nos seios de Valsalva acima do Z‐score indicado ou disseção da raiz da aorta; COL3A1, gene COL3A1; EL, ectopia lentis; ELS, síndrome da ectopia lentis; FBN1, gene fibrilina‐1; MASS, miopia, prolapso da válvula mitral, dilatação borderline da raiz da aorta (Z < 2), estrias, achados esqueléticos; MVP, prolapso da válvula mitral; MVPS, síndrome do prolapso da válvula mitral; Sist, score sistémico; SM, síndrome de Marfan; TGFβRI/II, gene recetor do fator beta de transformação do crescimento I/II; Z, Z‐score.
Adaptado com a permissão do BMJ Publishing Group Limited. [The revised Ghent nosology for the Marfan syndrome, Loeys BL, Dietz HC, Braverman AC, et al., J Med Genet, 47:476‐85, 2010]
Score de características sistémicas
| ▶ Sinal do punho e do polegar – 3 (sinal do punho ou do polegar – 1)▶ Pectus carinatum – 2 (pectus escavatum ou assimetria do tórax – 1)▶ Desvio em valgo do retropé – 2 (pés planos ‐1)▶ Pneumotórax – 2▶ Ectasia dural – 2▶ Protusão acetabular – 2▶ Redução ratio segmento superior/segmento inferior e aumento da altura/comprimento dos braços e escoliose não severa ‐1▶ Escoliose ou cifose toracolombar – 1▶ Redução da extensão do cotovelo – 1▶ Características faciais (3/5) – 1 (dolicocefalia, enoftalmia, fissuras palpebrais inclinadas para baixo, hipoplasia malar, retrognatismo)▶ Estrias da pele – 1▶ Miopia > 3 dioptrias – 1▶ Prolapso da válvula mitral (todos os tipos) – 1Total máximo: 20 pontos. Score ≥ 7 indica envolvimento sistémico |
Adaptado com a permissão do BMJ Publishing Group Limited. [The revised Ghent nosology for the Marfan syndrome, Loeys BL, Dietz HC, Braverman AC, et al., J Med Genet, 47:476‐85, 2010].
A nova nosologia atribui maior peso ao aneurisma da raiz da aorta/disseção da aorta e à ectopia lentis, passando as restantes manifestações clínicas características a contribuir para um score sistémico6,69.
A avaliação inicial de um doente com SM deve incluir os antecedentes pessoais e familiares, exame físico completo e uma série de testes necessários para averiguar a presença de critérios diagnósticos.
O estudo cardiovascular é efetuado habitualmente recorrendo a um ecocardiograma transtorácico, validando‐se o maior valor do diâmetro da raiz da aorta registado ao nível do seio de Valsalva, de entre pelo menos três imagens transtorácicas. O valor medido da raiz da aorta deve ser corrigido de acordo com a idade e a área de superfície corporal e interpretado de acordo com o Z‐score. Roman et al. criaram um nomograma para definição do diâmetro da raiz da aorta em relação com a área de superfície corporal e a idade6,70,71. Se o ecocardiograma transtorácico não permitir uma visualização precisa da aorta proximal, deve realizar‐se ecocardiograma transesofágico, tomografia computadorizada ou ressonância magnética, que também são indicados para o estudo da aorta distal. O uso do mesmo nomograma está indicado para se determinar o valor correto do diâmetro da raiz da aorta6. A ecocardiografia é também importante para a avaliação das alterações morfológicas e funcionais das válvulas mitral e tricúspide.
A avaliação oftalmológica, esquelética e de outros sistemas recorre aos métodos que lhe são apropriados.
O diagnóstico diferencial da SM inclui várias doenças que apresentam aneurismas da aorta (síndrome de Loeys‐Dietz, válvula aórtica bicúspide, aneurisma da aorta torácica familiar, síndrome de Ehlers‐Danlos, síndrome de tortuosidade arterial), ectopia lentis (síndrome da ectopia lentis, síndrome Weil‐Marchesani, homocisteinuria, síndrome Stickler) ou manifestações sistémicas da SM (síndrome Shprintzen‐Goldberg, aracnodactilia contratural congénita, síndrome de Loeys‐Dietz, fenótipo MASS e síndrome do prolapso da válvula mitral)6.
Os familiares de primeiro grau dos doentes com SM devem ser submetidos a um exame físico cuidadoso, avaliação oftalmológica e avaliação ecocardiográfica da raiz da aorta e da válvula mitral. Se um ou mais destes apresentar dilatação ou aneurisma da aorta torácica ou disseção aórtica, deve ponderar‐se a avaliação imagiológica da aorta nos familiares de segundo grau. Se o estudo genético permitir identificar o gene mutante (FBN1, TGFβRI, TGFβRII) num indivíduo com SM, os familiares de primeiro grau devem ser submetidos a aconselhamento e testes genéticos e apenas os que forem detentores da mutação do gene deverão ser submetidos à avaliação imagiológica da aorta3,62,72.
TratamentoMédicoO tratamento padrão para a prevenção das complicações aórticas da SM é constituído pelos beta‐bloqueantes6,72. O seu papel benéfico é atribuído à diminuição da frequência cardíaca e da fração de ejeção ventricular esquerda, resultando num menor stress hemodinâmico sobre a parede aórtica, à redução da rigidez da aorta, com menor taxa de dilatação da raiz da aorta, de risco de disseção e de outras complicações cardiovasculares (regurgitação aórtica, necessidade de cirurgia) e culminando num aumento da sobrevida3,40,61,65,73–76. Estes fármacos devem ser titulados de modo que em indivíduos acima dos cinco anos se obtenham valores de frequência cardíaca <100 bpm após exercício físico submáximo6. Os beta‐bloqueantes devem ser prescritos a todos os doentes com SM, incluindo aqueles com diâmetros da raiz da aorta < 4cm e crianças6,72.
Experiências em modelos de ratinhos com SM revelaram que a administração de losartan, antagonista do receptor tipo I da angiotensina II, previne a progressão da dilatação da parede da aorta6,77. O mesmo resultado promissor foi alcançado numa experiência piloto envolvendo crianças com SM grave6,78. O seu efeito benéfico parece dever‐se à ação anti‐hipertensora e à capacidade de induzir decréscimo dos níveis plasmáticos de TGF‐β, da transcrição de genes que respondem ao TGF‐β e dos mediadores intracelulares da cascata de sinalização do TGF‐β (Smad2). Além disso, o losartan não interfere com o recetor tipo II da angiotensina II, o qual, em oposição ao receptor tipo I, produz efeitos anti‐inflamatórios e antiproliferativos que são benéficos à homeostase da parede da aorta77–79. Uma metanálise recente concluiu não existirem diferenças entre o losartan e o atenolol relativamente ao seu efeito na taxa de dilatação da raiz da aorta e aorta ascendente e complicações aórticas, considerando não existir superioridade relativa80. Um estudo em população pediátrica com SM demonstrou que o tratamento simultâneo com beta‐bloqueante e losartan foi seguro e mais efetivo na redução ou mesmo reversão da dilatação da raiz da aorta comparado com o tratamento exclusivo com beta‐bloqueante. No entanto este efeito benéfico aditivo carece de maior evidência81,82.
Com o objetivo de estabilizar a doença aneurismática têm sido investigadas substâncias com atividade inibitória sobre as MMPs. A doxiciclina, através de mecanismos distintos dos que lhe conferem atividade antibiótica, é um inibidor inespecífico das MMPs, com atividade inibitória máxima sobre as MMPs ‐2 e ‐9. Num estudo em modelos animais com SM a doxiciclina mostrou‐se mais eficaz que o atenolol na prevenção da formação de aneurismas, preservando a integridade das fibras elásticas, normalizando a função vasomotora e suprimindo a ativação do TGF‐β83.
Aconselha‐se estes doentes a evitar o uso de tabaco e a monitorar a pressão arterial, que se deve manter em valores inferiores a 120/80mmHg3. Atletas com SM não devem participar em desportos que envolvam exercício físico intenso ou potencial de contacto físico. No entanto, é razoável que estes doentes realizem desporto competitivo de baixa intensidade dinâmica e de baixa/moderada intensidade estática, na ausência de um ou mais dos seguintes: dilatação da raiz da aorta (Z‐score >2, ou diâmetro aórtico > 40mm, ou > 2 desvios padrão da média relativamente à área de superfície corporal em crianças ou adolescentes < 15 anos), regurgitação mitral moderada a severa, disfunção sistólica do ventrículo esquerdo (fração de ejeção < 40%) e história familiar de disseção aórtica com diâmetro aórtico < 50mm84.
CirúrgicoA ocorrência de disseção da aorta tipo A na SM conduz a indicação para cirurgia aórtica de emergência, que se associa a uma mortalidade operatória de 20% e uma taxa de sobrevida em 10 anos de aproximadamente 50% a 70%. Por outro lado, o risco de morte associado à cirurgia profilática da aorta é de 1‐2% e a sobrevida dos doentes submetidos a procedimento eletivo é superior à dos doentes tratados por cirurgia de emergência, aproximando‐se da população geral. Estes dados realçam a importância da realização de cirurgia profilática aórtica, na presença de dilatação da raiz da aorta6,68,85–88.
A cirurgia profilática da aorta em indivíduos com SM foi introduzida em 1968 por Bentall e Bono e consiste na substituição da raiz da aorta, válvula aórtica e aorta ascendente por uma prótese combinada, vascular e valvular mecânica, procedendo‐se à reimplantação das artérias coronárias na prótese vascular. A segurança, reprodutibilidade, e durabilidade a longo prazo deste procedimento cirúrgico está bem documentada61,89,90. Posteriormente surgiu em 1979 o procedimento de remodelação por Yacoub e em 1988 o procedimento de reimplantação por David, estratégia cirúrgica conservadora consistindo na substituição da raiz da aorta com preservação da válvula aórtica nativa. Estudos recentes indicam que este procedimento cirúrgico está associado a reduzido risco operatório e de substituição tardia da válvula aórtica e a excelente sobrevida tardia, quando realizado em válvulas aórticas estruturalmente normais90–94. De acordo com as recomendações mais recentes, os doentes com SM, que apresentam aneurisma da raiz da aorta, com um diâmetro aórtico máximo ≥ 5cm, devem ser submetidos à cirurgia profilática de reimplantação de David ou alternativamente ao procedimento de Yacoub e caso estes não sejam tecnicamente viáveis à cirurgia de Bentall. A cirurgia deve ser igualmente considerada nos doentes com diâmetro máximo da aorta ascendente ≥ 4,5cm e com algum dos seguintes fatores de risco: história familiar de disseção aórtica, aumento da dimensão da aorta > 3mm/ano (em medições repetidas utilizando a mesma técnica de imagem, ao mesmo nível da aorta e confirmadas por outra técnica), regurgitação aórtica ou mitral grave ou planeamento de gravidez95.
A cirurgia convencional mantém‐se como o tratamento de eleição em doentes com SM e patologia da aorta torácica, no entanto o desenvolvimento de técnicas de reparação endovascular da aorta torácica (TEVAR) permitiu uma abordagem menos invasiva. Segundo um consenso europeu, a TEVAR não está recomendada como abordagem de primeira linha em doentes com doenças do tecido conjuntivo, devendo ser utilizada apenas como procedimento de recurso ou ponte para uma cirurgia definitiva ou após uma reparação cirúrgica aórtica prévia, com implantação da endoprótese sob o enxerto prostético previamente colocado96. As últimas guidelines europeias do diagnóstico e tratamento de doenças aórticas advogam que, em doentes com SM, a cirurgia deve ser preferida à TEVAR, com exceção de situações de emergência com o objetivo de estabilização inicial, como ponte para posterior tratamento cirúrgico95.
SeguimentoAos seis meses após o diagnóstico da SM, é recomendada a realização de um ecocardiograma destinado a avaliar a taxa de dilatação da aorta. Na presença de um valor estável do diâmetro da aorta aconselha‐se controlo anual ecocardiográfico. Um número de exames mais frequente deverá ser considerado se o diâmetro da aorta nos adultos for ≥ 4,5cm (menos bem definido nas crianças), o diâmetro da aorta registar um rápido aumento (≥ 0,5cm por ano) ou ainda para melhor esclarecimento da função cardíaca ou valvular. Indivíduos com idade inferior a 20 anos e achados sistémicos sugestivos da SM, mas sem envolvimento cardiovascular, devem realizar anualmente um ecocardiograma face à rápida evolução do fenótipo. Adultos com repetidas medições normais da raiz da aorta podem ser seguidos ecocardiograficamente em intervalos de dois a três anos6,72.
Os portadores de Marfan podem vir a desenvolver dilatação ou disseção da aorta em segmentos distantes da raiz da aorta. A frequência destas complicações, em particular a nível da descendente proximal e da abdominal, parece estar a crescer, em relação com o aumento da sobrevida verificada pelo manejo eficaz da doença da raiz da aorta. Embora não faça parte das recomendações, poderá ser uma opção a realização intermitente de estudos de imagem de forma a detetar atempadamente patologia da aorta distal6. O estudo imagiológico periódico de toda a aorta é recomendado nos casos de dilatação ou disseção da aorta distal e ainda, anualmente, após cirurgia de reparação da raiz da aorta, em particular se a dilatação é rapidamente progressiva e/ou a aorta tem dimensão > 4,5cm72.
PrognósticoAs complicações cardíacas da SM, em particular a dilatação da aorta, a disseção e o envolvimento patológico das válvulas aórtica e mitral, conduzem a redução significativa da esperança de vida. Este prognóstico comprometido foi comprovado num estudo envolvendo 257 doentes com SM, realizado antes de 1972, em que a média de idade no momento da morte, para os 72 indivíduos falecidos, foi de 32 anos. De entre as 56 mortes de causa conhecida, 52 delas deveram‐se a problemas cardiovasculares, com a dilatação da aorta e suas complicações (disseção aórtica e insuficiência aórtica) representando 80% das causas de morte. A insuficiência cardíaca congestiva, o enfarte agudo do miocárdio e a endocardite infeciosa foram outras causas de morte cardíaca56,88,97.
A expectativa de vida média dos doentes com SM aumentou significativamente com a introdução da terapêutica médica beta‐bloqueante e da reparação cirúrgica eletiva da aorta, subindo para mais de 72 anos, de acordo com séries recentes3,61,72,98,99.
ConclusãoA SM trata‐se de uma doença genética rara, mas com elevada morbilidade. Os atuais recursos diagnósticos e terapêuticos permitiram não só a sua melhor compreensão patogénica, mas sobretudo beneficiar de forma marcante o seu prognóstico.