A hemofilia A é uma doença hereditária da coagulação caracterizada por uma deficiência de fator VIII (FVIII) e que, principalmente nas suas formas graves, está associada a um risco hemorrágico elevado. Com o aumento da esperança média de vida destes doentes, a prevalência de eventos coronários agudos tem aumentado, mas a experiência na abordagem destes permanece escassa. A estratégia de atuação nos eventos coronários agudos em doentes hemofílicos, como demonstrado no presente caso, representa um verdadeiro desafio, não só pela necessidade de terapêutica anti‐agregante plaquetária (a qual, sendo indispensável para prevenção de trombose de stent, aumenta o risco hemorrágico), como também pela inexistência de recomendações específicas relacionadas com a terapêutica substitutiva mais adequada e segura nestas situações. Os autores descrevem o caso de um homem de 48 anos, com angina instável e diagnóstico prévio de hemofilia A grave, submetido a intervenção coronária percutânea sob terapêutica com FVIII sem complicações hemorrágicas.
Hemophilia A is an inherited coagulation disease characterized by a factor VIII (FVIII) deficiency and is associated with high hemorrhagic risk, especially in its severe forms. As the average life expectancy of patients with hemophilia has increased, so has the prevalence of acute coronary events. There is however limited experience in dealing with them. The strategy of acting on acute coronary events in patients with hemophilia, as demonstrated in the present case, is a real challenge, not only due to the need for antiplatelet therapy (which is essential in the prevention of stent thrombosis, but increases hemorrhagic risk), but also due to the lack of specific recommendations related to the most adequate and safe replacement therapy in these situations. The authors describe the case of a 48‐year‐old man with unstable angina and a previous diagnosis of severe hemophilia A who underwent percutaneous coronary intervention under FVIII therapy without hemorrhagic complications.
A hemofilia A é um distúrbio hereditário grave da coagulação caracterizado pela deficiência de atividade coagulante do FVIII e que se associa a um risco hemorrágico importante. Esta doença está associada a alterações no gene do FVIII, localizado no braço longo do cromossoma X pelo que afeta quase exclusivamente homens, sendo as mulheres habitualmente apenas portadoras da mutação.
A gravidade da doença depende do nível de FVIII classificando‐se em ligeira (FVIII > 5%) moderada (FVIII 2‐5%) e grave (FVIII < 1%), sendo a prevalência destes três graus de gravidade respetivamente de 50%, 10% e 40%.1
O quadro clínico da hemofilia é caracterizado por episódios hemorrágicos, espontâneos ou relacionados com traumatismos, principalmente a nível articular (hemartroses) e muscular. As hemorragias articulares repetidas levam a uma progressiva incapacidade funcional (artropatia hemofílica), enquanto outros tipos de hemorragia, como é o caso das hemorragias do sistema nervoso central, podem ser fatais se não corretamente tratadas. Os procedimentos cirúrgicos constituem um risco nas pessoas com esta patologia, pelo que qualquer manobra invasiva implica uma terapêutica adequada e acompanhamento por uma equipa multidisciplinar.
Nas últimas décadas, verificou‐se um notável avanço nas opções terapêuticas para a hemofilia com a crescente disponibilidade de concentrados de fator, eficazes na prevenção e tratamento dos episódios hemorrágicos. Estas terapêuticas permitiram um aumento da esperança média de vida destes doentes de < 30 anos para cerca de 70 anos2, sendo semelhante à da população em geral. No entanto, a terapêutica com o fator em falta é igualmente responsável pela complicação iatrogénica mais grave nestes doentes, o desenvolvimento de anticorpos (inibidores) contra o fator em défice. Estes anticorpos, que se desenvolvem em 30‐40% dos doentes e, na maioria dos casos, nos primeiros 20 dias de exposição à terapêutica3, tornam a terapêutica ineficaz e comprometem gravemente as opções terapêuticas e o prognóstico destes doentes. A etiopatogenia do desenvolvimento de inibidores parece ser multifactorial e depende de fatores genéticos e não genéticos4. No caso destes últimos, a intensidade do tratamento (definido como mais de cinco dias de tratamento) constitui um fator de risco bem estabelecido5.
Relativamente ao risco de eventos trombóticos, e ao contrário do que faria sentido pensar, este mantém‐se apesar do elevado risco hemorrágico destes doentes. Independentemente de qualquer efeito protetor que se possa associar ao defeito da coagulação, os mesmos fatores que contribuem para as doenças cardiovasculares na população geral apresentam também impacto na população hemofílica. Os indivíduos com hemofilia são particularmente vulneráveis ao desenvolvimento de síndrome metabólica, dada a prevalência de obesidade e inatividade resultante da artropatia hemofílica6. A hipertensão arterial parece ser igualmente mais frequente em doentes hemofílicos do que na população em geral7 e embora o mecanismo ainda não esteja completamente esclarecido, supõe‐se que exista uma associação com doença renal microangiopática8.
As doenças cardiovasculares são uma importante causa de morbilidade e mortalidade em todo o mundo. Nos últimos anos, e com o já referido aumento da longevidade dos doentes hemofílicos e inerente presença de comorbilidades associadas ao envelhecimento, tem‐se assistido a um aumento dos eventos cardiovasculares nesta população6.
O tratamento da síndrome coronária aguda (SCA) em doentes hemofílicos é um verdadeiro desafio porque, se por um lado a anticoagulação e a antiagregação aumentam o risco hemorrágico (já elevado por si só nestes doentes), por outro lado a correção da anticoagulação com o fator em défice aumenta o risco de trombose.
O presente caso clínico descreve uma situação de SCA em doente com hemofilia A grave submetido a manobra invasiva, sem complicações hemorrágicas ou trombóticas e demonstra a importância da abordagem destas situações por uma equipa multidisciplinar.
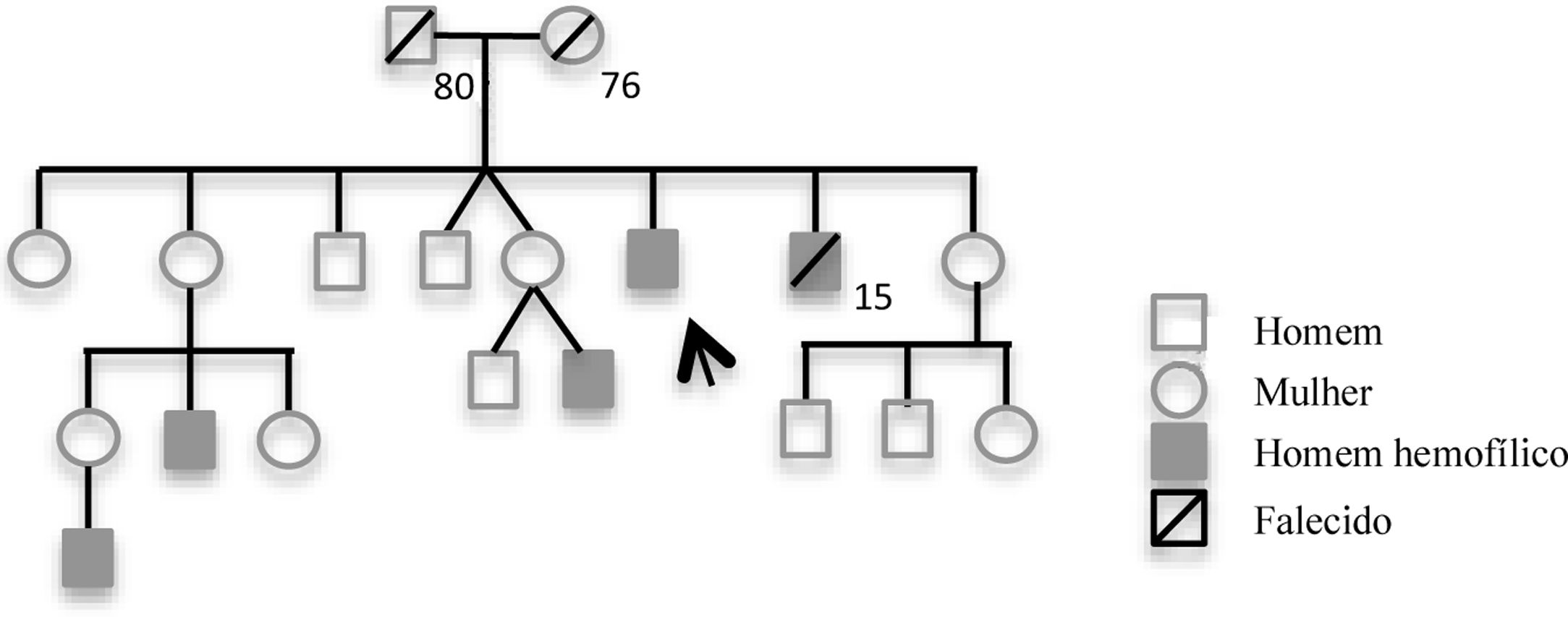
Caso clínicoOs autores descrevem o caso de um homem de 48 anos, natural de Cabo Verde, evacuado do país de origem por angina instável. O doente tinha como antecedentes pessoais conhecidos diabetes tipo 2 e hemofilia A grave. Para além da terapêutica com antidiabéticos orais encontrava‐se medicado com ácido acetilsalicílico (AAS) 100mg/dia. Apesar de referir inúmeros episódios de hemartrose e apresentar já alterações articulares crónicas, nunca tinha efetuado qualquer terapêutica para esta patologia. Nos antecedentes familiares havia referência a três sobrinhos e um irmão (que faleceu por hemorragia intracraniana aos 15 anos), com o diagnóstico de hemofilia A grave (figura 1).
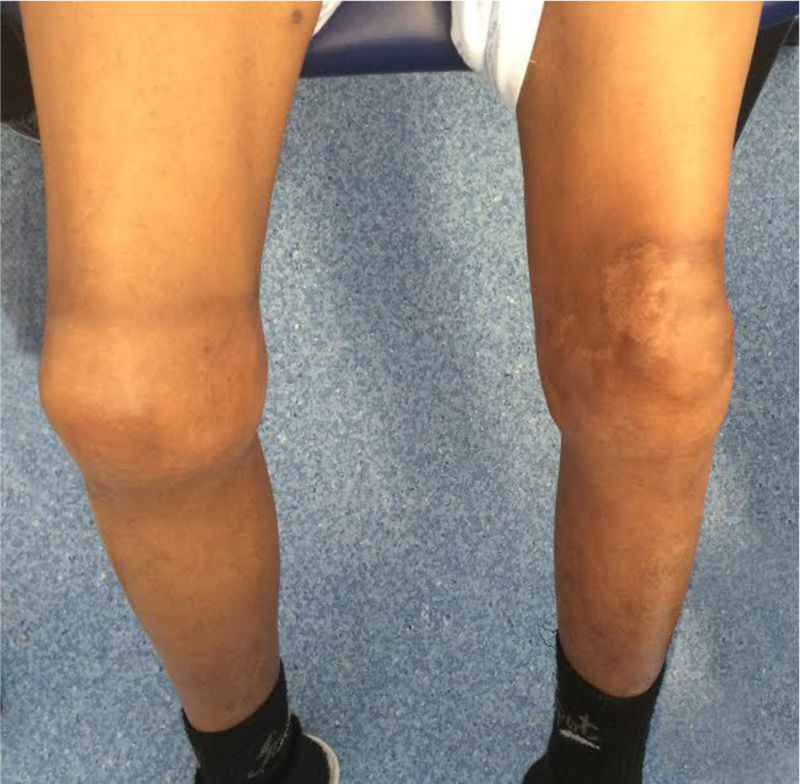
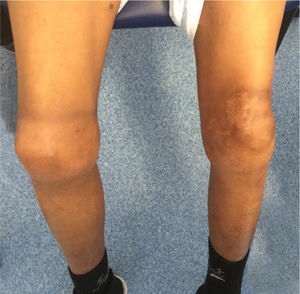
O doente referia queixas de angor de esforço com cerca de 6 meses de evolução, de agravamento progressivo, que evoluiu para dor em repouso (classe IV da Canadian Cardiology Society [CCS]). Iniciou ácido acetilsalicílico 100mg/dia em Cabo Verde. No momento da avaliação encontrava‐se assintomático. O exame objetivo não apresentava outras alterações, para além de evidência de artropatia bilateral ao nível dos joelhos (figura 2). Analiticamente apresentava tempo de protrombina e contagem de plaquetas normais, tempo de tromboplastina parcial ativada > 100 segundos, FVIII < 1% e pesquisa de inibidores do FVIII negativa. Os marcadores de necrose miocárdica eram negativos e não apresentava outras alterações analíticas à exceção de hemoglobina de 9,1g/dL. O eletrocardiograma mostrava ritmo sinusal, onda Q em aVL, sem outras alterações da repolarização e o ecocardiograma era normal.
A situação clínica foi discutida em reunião multidisciplinar, constituída por hematologista especializado em hemofilia, cardiologista clínico e cardiologista de intervenção, tendo sido decidido internamento no Serviço de Cardiologia para ser submetido a coronariografia.
Previamente a este exame invasivo, foram administradas 50 UI/Kg de FVIII, sendo o valor de FVIII pré‐cateterismo de 66%. Previamente à coronariografia, foi ainda realizada uma transfusão de uma pool de plaquetas tendo em conta estudo de agregação plaquetária efetuado por tromboelastometria (ROTEM PLATELET) que indicou uma marcada inibição plaquetária.
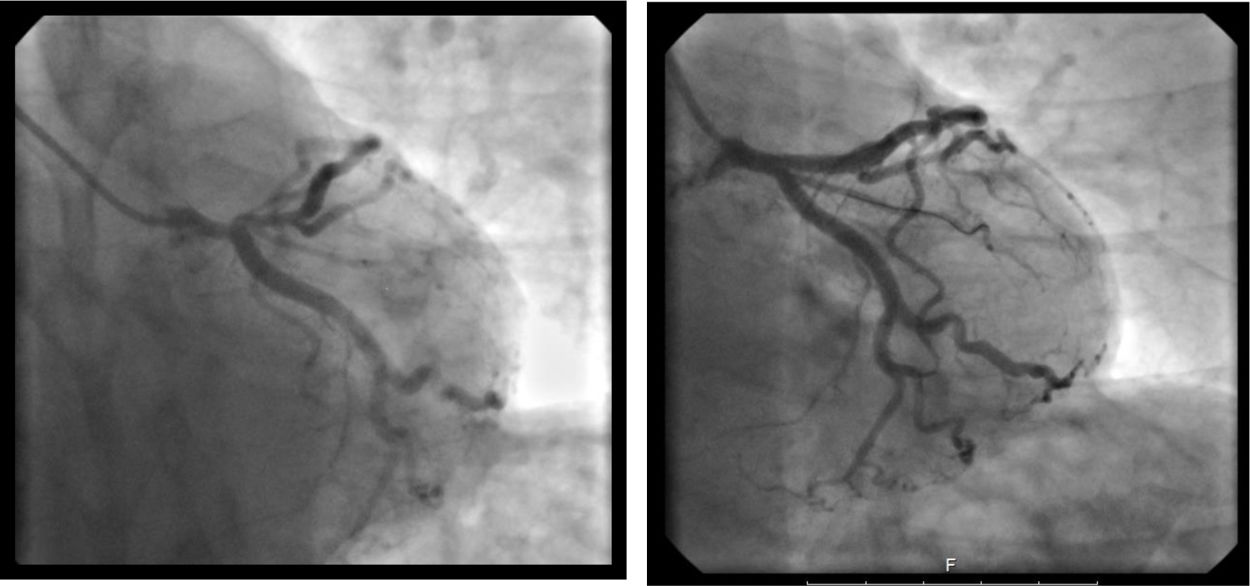
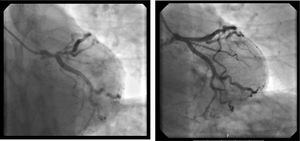
A coronariografia revelou doença importante na artéria descendente anterior – estenose ostial de 85% e estenose proximal de 70% até à emergência da primeira diagonal, não tendo os restantes vasos lesões angiograficamente significativas. Foi realizada pré‐dilatação com balão da lesão proximal e ostial da descendente anterior e implantado seguidamente um stent com antiproliferativo 3,5 x 28mm com bom resultado angiográfico final (figura 3).
Foi realizada a dose de carga com 600mg de clopidogrel durante o procedimento e posteriormente foi mantida antiagregação dupla com clopidogrel 75mg e AAS 100mg. Nas 72H após a coronariografia a terapêutica com FVIII foi mantida com intervalos entre 8 e 12H, tendo os níveis de FVIII variado entre 38 e 46%.
Não se verificaram quaisquer complicações hemorrágicas e o internamento decorreu sem intercorrências. O doente teve alta sob AAS e clopidogrel, com indicação para manter a terapêutica dupla durante três meses, interromper posteriormente clopidogrel e manter AAS ad eternum.
Nos primeiros 10 dias efetuou terapêutica substitutiva diária, mantendo níveis de FVIII de cerca de 10%. Posteriormente, e de acordo com os resultados da farmacocinética e com a decisão de manter níveis de FVIII entre 3 e 5%, passou a efetuar terapêutica profiláctica em dias alternados (40 UI/ Kg). Neste doente, e apesar do tratamento intensivo, a pesquisa de inibidores foi sempre negativa.
DiscussãoA abordagem de eventos coronários agudos em doentes hemofílicos, como demonstrado no presente caso, representa um verdadeiro desafio. O risco hemorrágico, já de si elevado nestes doentes, é agravado não só pela hipocoagulação, que é necessária durante a angioplastia, como também pela terapêutica antiagregante plaquetária que é indispensável no tratamento da SCA e na prevenção de trombose de stent. Por outro lado, não existem recomendações acerca dos níveis de fator mais adequados e seguros neste tipo de intervenções e durante o período de antiagregação, o que obriga a uma abordagem multidisciplinar e a monitoração rigorosa.
De acordo com a Associação Europeia de Hemofilia, está recomendada uma adequada correção com concentrado de FVIII antes da intervenção coronária percutânea (ICP) e nas 48h seguintes, não especificando o valor alvo mínimo ideal. Assim, pouco está definido para além das linhas orientadoras propostas por um consenso de peritos publicado em 20139 – onde é sugerido que a ICP seja realizada o mais precocemente possível, sob adequada proteção com FVIII, idealmente para valores de FVIII > 80% e que nas primeiras 24h após ICP os níveis sejam ∼ 50%. Este documento propõe também níveis de FVIII entre 5 e 15% durante o tempo de realização de terapêutica antiagregante dupla e > 1% quando sob monoterapia.
No caso deste doente, estes valores propostos pré‐ICP não foram atingidos, mas mesmo assim não se verificaram quaisquer complicações hemorrágicas, tendo os níveis de FVIII > 60% demonstrado ser suficientes e seguros. A decisão de manter terapêutica diária durante apenas 10 dias e, posteriormente, em dias alternados deveu‐se a diversas razões. Se por um lado, e apesar de se tratar de um adulto, os acessos venosos se revelaram uma dificuldade inesperada, o risco de desenvolvimento de inibidores constituía, neste doente, uma complicação a considerar. A experiência relacionada com antiagregação e com anticoagulação na hemofilia, além de escassa, diz respeito a doentes tratados há muitos anos com concentrados de fator e nos quais o risco de desenvolvimento de inibidores é praticamente nulo10. No caso deste doente, o risco de aparecimento de inibidores era elevado dado a primeira exposição ao FVIII exógeno ser efetuada no âmbito de um período de tratamento intensivo, onde o risco de desenvolvimento de anticorpos é máximo5,11.
Apesar da ausência de recomendações para a realização de estudo de agregação plaquetária nestas situações, dado o elevado risco hemorrágico e o facto de o doente já estar medicado com antiagregante previamente, foi ainda decidido realizar tromboelastometria, que mostrou significativa inibição plaquetária e motivou o tratamento com suporte plaquetário.
Durante o cateterismo foram administradas 10500 UI de heparina não fracionada. Apesar de se encontrarem na literatura alguns relatos em que houve preferência pela bivalirudina em doentes hemofílicos12,13,uma vez que esta se associa a uma menor taxa de complicações hemorrágicas, a heparina não fracionada continua a ser o anticoagulante preferido tendo em conta uma sobrevida relativamente curta e a possibilidade de reversibilidade se necessário.
A terapêutica antiagregante dupla está recomendada após angioplastia para prevenir a trombose de stent. Relativamente à escolha dos fármacos antiagregantes, o ticagrelor e prasugrel mostraram superioridade na redução de complicações isquémicas após SCA, quando comparados com clopidogrel, mas também estão associados a maior taxa de hemorragia espontânea14,15. Estes fármacos são fortemente recomendados nas orientações europeias de cardiologia para o tratamento do SCA na população geral. No entanto, não existem estudos em doentes hemofílicos, pelo que não devem ser usados nestes doentes.
No presente caso optou‐se por medicar com terapêutica dupla com AAS e clopidogrel durante três meses, após o qual o doente manteve AAS apenas.
No passado, os stents não revestidos (bare metal stents – BMS) precisavam de dupla antiagregação durante 4‐6 semanas enquanto os stents revestidos com fármaco (drug eluting stents – DES) de primeira geração necessitavam de terapia dupla entre seis a 12 meses. Assim, em doentes com risco hemorrágico elevado, eram sempre preferidos os BMS16. No entanto, atualmente, para os DES de nova geração a duração de terapêutica dupla é semelhante àquela exigida para o BMS. Nos estudos RESET17 e OPTIMIZE18 a utilização de dupla‐antiagregação durante três meses mostrou não ser inferior em termos de segurança durante um período de seguimento de um ano.
No presente caso optou‐se por utilização de DES, apesar dos poucos relatos existentes até agora da sua utilização em doentes hemofílicos, depois de definidos níveis mínimos de segurança de FVIII. Não se verificaram complicações hemorrágicas provavelmente pela monitoração laboratorial rigorosa e pela vigilância multidisciplinar.
De acordo com as recomendações europeias, em doentes com risco hemorrágico elevado a duração da dupla antiagregação deve ser mantida durante o mínimo tempo possivel19. No entanto, não existe evidência relativa a doentes com discrasias hemorrágicas, visto que estes são excluídos da maioria dos estudos. No consenso de peritos publicado pelo ADVANCE Working Group é sugerida a manutenção de dupla antiagregação durante um mês, contudo apenas mencionada a utilização de BMS9. Também a utilização de dupla antiagregação durante um mês com DES já foi avaliada mas apenas com stents específicos – Endeavour sprint e BioFreedom20,21. Apesar de estes estudos terem incluído doentes com SCA, as guidelines europeias consideram que a terapia dupla durante um mês deve ser restrita a doentes com doença coronária estável e risco hemorrágico elevado (classe IIb)19. Assim, neste caso, tratando‐se de uma síndrome coronária aguda, risco significativo de trombose de stent associado a uma lesão crítica da DA, para além da indisponibilidade dos stents acima mencionados e uma vez que o doente iria manter seguimento rigoroso em Hospital de Dia de Imuno‐Hemoterapia foi decidido manter antiagregação dupla durante três meses”.
Quanto à terapêutica adjuvante, para além da medicação habitual para controlo dos fatores de risco e dos fármacos modificadores de prognóstico, a adição de inibidor da bomba de protões também está recomendado nestes doentes9,19.
Apesar de a maioria das angioplastias descritas em doentes hemofílicos terem sido realizadas por via femoral com segurança, neste doente a coronariografia foi realizada por via radial direita. Este é o acesso recomendado, se tecnicamente possível, uma vez que é um vaso de menor calibre e periférico, permitindo uma hemostase mais fácil e minimizando complicações hemorrágicas, sem comprometer o sucesso do procedimento.
Em conclusão, os autores descrevem o caso clínico de um doente com angina instável e diagnóstico de hemofilia A grave, o qual foi submetido a ICP da artéria descendente anterior com sucesso, sob terapêutica com FVIII, tendo tido a possibilidade de fazer terapêutica médica convencional com dupla antiagregação sem qualquer complicação hemorrágica.
Apesar das recomendações publicadas pela Sociedade Europeia de Cardiologia se basearem em estudos que excluíram doentes com discrasias hemorrágicas, este caso é exemplo de que doentes hemofílicos, se adequadamente avaliados, tratados e monitorados, e apesar do elevado risco hemorrágico, podem ter acesso às mesmas intervenções terapêuticas dos doentes não hemofílicos e de acordo com o estado da arte para o SCA.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.