O valor prognóstico da deterioração da função renal é indiscutível nos doentes com insuficiência cardíaca aguda. No contexto nacional sabe‐se pouco acerca do peso relativo da síndrome cardiorrenal no internamento destes doentes. Este trabalho pretende avaliar a prevalência, fatores preditores e consequências desta entidade em doentes internados por insuficiência cardíaca aguda.
MétodosAnálise retrospetiva de 155 doentes internados por insuficiência cardíaca aguda. Síndrome cardiorrenal definida como um aumento ≥ a 26,5umol/L na creatinina sérica relativamente ao valor da admissão. Avaliados e comparados dados clínicos, analíticos e ecocardiográficos. Feito seguimento, referente a mortalidade, aos 30 e 90 dias.
ResultadosA síndrome cardiorrenal ocorreu em 46 (29,7%) doentes, 5,4±4,4 dias após a admissão; 66,7% (n=24) não recuperaram a função renal basal. Associaram‐se ao desenvolvimento desta entidade: idades mais avançadas; antecedentes de insuficiência renal crónica; insuficiência mitral moderada/grave; níveis na admissão mais elevados de ureia, creatinina e troponina I; e mais baixos de taxa de filtração glomerular. Os doentes com síndrome cardiorrenal tiveram internamentos mais longos; necessitaram de doses diárias máximas de furosemida mais elevadas; mais frequentemente necessitaram de inotrópicos e de terapêutica de substituição renal. A sua mortalidade no internamento e aos 30 dias foi superior, sendo a síndrome cardiorrenal um fator preditor independente de mortalidade intra‐hospitalar.
ConclusõesA disfunção renal é comum em doentes com insuficiência cardíaca aguda, com impacto claramente negativo no prognóstico, devendo a prevenção da lesão renal ser um objetivo primário passando por novas estratégias terapêuticas e identificação de novos biomarcadores.
Worsening renal function has an unquestionably negative impact on prognosis in patients with acute heart failure (HF). In Portugal there is little information about the importance of this entity in HF patients admitted to hospital. The objective of this work was to assess the prevalence of cardiorenal syndrome and to identify its key predictors and consequences in patients admitted for acute HF.
MethodsThis was a retrospective study of 155 patients admitted for acute HF. Cardiorenal syndrome was defined as an increase in serum creatinine of ≥26.5 μmol/l. Clinical, laboratory and echocardiographic parameters were analyzed and compared. Mortality was assessed at 30 and 90 days.
ResultsCardiorenal syndrome occurred in 46 patients (29.7%), 5.4±4.4 days after admission; 66.7% (n=24) did not recover baseline creatinine levels. The factors associated with cardiorenal syndrome were older age, chronic renal failure, moderate to severe mitral regurgitation, higher admission blood urea nitrogen, creatinine and troponin I, and lower glomerular filtration rate. Patients who developed cardiorenal syndrome had longer hospital stay, were treated with higher daily doses of intravenous furosemide, and more often required inotropic support and renal replacement therapy. They had higher in‐hospital and 30‐day mortality, and multivariate analysis identified cardiorenal syndrome as an independent predictor of in‐hospital mortality.
ConclusionsRenal dysfunction is common in acute HF patients, with a negative impact on prognosis, which highlights the importance of preventing kidney damage through the use of new therapeutic strategies and identification of novel biomarkers.
Com uma prevalência superior a cinco milhões de casos e quase um milhão de altas hospitalares por ano, a insuficiência cardíaca (IC) representa um desafio terapêutico crescente na era da cardiologia moderna1.
A disfunção renal é um achado frequente nos doentes com IC, sendo um fator independente de prognóstico, mesmo em doentes com pequenas alterações na função renal2–4. Várias análises retrospetivas e registos prospetivos investigaram o impacto prognóstico da disfunção renal na IC aguda5–8.
Numa análise do registo Acute Decompensated Heart Failure National Registry (ADHERE), apenas 9% dos 118 465 doentes internados por IC aguda apresentavam função renal normal (definida como uma taxa de filtração glomerular [TFG] ≥90ml/min/1,73m2)7. Já a disfunção moderada a grave foi relatada em 30‐35% dos casos3,5,9.
Os internamentos por IC acompanham‐se de deterioração da função renal em 30‐50% dos casos, dependendo da definição utilizada, associando‐se esta intercorrência a internamentos mais prolongados, despesas de saúde mais elevadas, maior taxa de mortalidade intra‐hospitalar, de reinternamentos e de mortalidade após a alta3,5,6,9.
Apesar da sólida evidência existente quanto ao impacto negativo do agravamento da função renal durante o tratamento da IC aguda, a fisiopatologia da síndrome cardiorrenal (SCR) permanece não esclarecida. De igual modo, a ausência de uma definição consensual contribui para alguma falta de clareza no diagnóstico e tratamento desta entidade10.
Recentemente foi defendida uma definição de SCR mais articulada11, tendo sido proposta uma nova classificação etiológica12. Foi feita uma subdivisão da SCR em cinco tipos, tentando promover uma abordagem mais concisa e lógica12. O nosso estudo aborda o tipo 1 de SCR (SCR agudo), caracterizado por uma deterioração rápida da função cardíaca, levando à lesão renal aguda12. Os mecanismos pelos quais a IC aguda causa agravamento da função renal são múltiplos e complexos13. Num sentido lato, as causas de disfunção renal durante a terapêutica anticongestiva podem ser divididas em: pré‐renais (IC de baixo débito ou hipotensão); renais (exposição a produto de contraste, ateroembolismo, drogas nefrotóxicas, diuréticos) e pós‐renais (nefropatia obstrutiva ou hipertensão intra‐abdominal)14. A importância clínica de cada um destes mecanismos varia com o doente e com a situação clínica.
Doentes com IC aguda e disfunção renal são um desafio clínico singular e exigente para o médico.
Assim, o objetivo deste trabalho foi avaliar a incidência de SCR, definido como um aumento absoluto na creatinina sérica, o momento em que ocorre, os fatores de risco e o seu valor prognóstico, numa série consecutiva de doentes internados por IC aguda. Este trabalho visou ainda fazer uma análise descritiva, pormenorizada, da evolução da função renal durante o internamento. Foram excluídos doentes com doença renal crónica terminal.
População e métodosDoentesAnálise retrospetiva de 155 doentes consecutivos (50,3% do sexo masculino; idade 74,1±10,7 anos), internados num serviço de cardiologia de um hospital central por IC aguda, satisfazendo os critérios de diagnóstico desta entidade estabelecidos pelas Guidelines da Sociedade Europeia de Cardiologia15. Foram excluídos doentes com doença renal crónica terminal (em programa de hemodiálise regular ou com TFG <15ml/min/1,73m2).
Dados clínicos e valores laboratoriais analisadosDos registos médicos dos doentes foram obtidos os seguintes valores: ureia e creatinina da admissão e da alta; valor máximo de ureia e de creatinina durante o internamento, bem como o dia em que foi atingido. A TFG (à admissão, à alta e a correspondente ao valor máximo de creatinina) foi calculada usando a fórmula Modification of Diet in Renal Disease (MDRD), que foi demonstrada como sendo o melhor método de avaliação indireta da função renal nos doentes com IC16.
Adicionalmente às características clínicas padrão, foram colhidos à admissão os seguintes dados para análise estatística: classe da New York Heart Association (NYHA), classificação clínica da apresentação (definida de acordo com as Guidelines da Sociedade Europeia de Cardiologia)15, ritmo e frequência cardíacos, pressão arterial sistólica; etiologia e fator precipitante da insuficiência cardíaca. Para além dos parâmetros de função renal, foram obtidos os seguintes valores à admissão: hemoglobina; NT‐pro‐BNP; troponina I; sódio; potássio; ácido úrico; albumina; TGO; TGP e bilirrubina total. Nos doentes que realizaram ecocardiograma transtorácico, avaliámos a função sistólica global (com determinação da fração de ejeção), as dimensões do ventrículo esquerdo, a pressão sistólica da artéria pulmonar (PSAP) e a presença de insuficiência mitral. Do tratamento a que estes doentes foram submetidos registaram‐se os seguintes parâmetros: a dose diária máxima de furosemida; uso de vasodilatadores endovenosos, inotrópicos (dopamina e/ou dobutamina), levosimendan; recurso a ventilação não invasiva e a técnica de substituição da função renal (ultrafiltração/hemodiálise). Foi ainda registada a medicação da alta e o número de dias de internamento.
Foi feito um seguimento por contacto telefónico para avaliar a sobrevida dos doentes aos 30 e aos 90 dias.
Definição de síndrome cardiorrenalDe acordo com estudos anteriores3,5,6, definimos SCR como um aumento ≥ a 26,5umol/L na creatinina sérica relativamente ao valor da admissão. Este valor já demonstrou ter a maior sensibilidade e especificidade para mortalidade intra‐hospitalar e tempo de internamento em trabalhos anteriores5. O agravamento da função renal foi definido como transitório quando os níveis de creatinina voltaram aos valores basais antes da alta.
Análise estatísticaA análise estatística foi realizada com SPSS para Windows, versão 17.0. As variáveis nominais foram expressas como contagens e percentagens. Foi feita comparação de variáveis nominais (combinação de frequências) com o teste χ2. As variáveis contínuas foram expressas como média±desvio‐padrão, aplicou‐se o teste t de Student para comparar variáveis com distribuição normal e o teste Mann‐Whitney U para comparar variáveis que não respeitam uma distribuição normal. Foi elaborado um modelo preditor de SCR através de regressão logística binária, que incluiu todas as variáveis que apresentaram associação com SCR em análise univariada. Foram considerados dois endpoints: número de dias de internamento e mortalidade (intra‐hospitalar, aos 30 e aos 90 dias). Um valor de p <0,05 foi considerado estatisticamente significativo.
ResultadosCaracterísticas da população do estudoA população do estudo consistiu em 155 doentes; 50,3% do sexo masculino, com idade 74,1±10,7 anos.
Antecedentes pessoais: 67,1% hipertensão arterial; 30,3% diabetes mellitus; 29,7% doença coronária; 37,4% doença pulmonar obstrutiva crónica e 34,2% doença renal crónica.
A função sistólica estava preservada (fração de ejeção ≥50%) em 48,4% dos doentes.
A etiologia mais frequente da insuficiência cardíaca foi doença valvular (42,6%), seguida de doença coronária (27,1%) e hipertensão arterial (18,7%). Os dois fatores precipitantes mais frequentes foram: taquiarritmia supraventricular (23,9%) e infeção respiratória (18,7%); não tendo sido identificado em 29,7% dos doentes. Na admissão, a maioria dos doentes (66,5%) encontrava‐se em classe III da NYHA, sendo a insuficiência cardíaca crónica descompensada a forma clínica de apresentação mais frequente (81,9%).
Na altura do internamento, a pressão arterial sistólica (PAS) era de 127±28mmHg; a frequência cardíaca de 93±20bpm, estando 43,9% dos doentes em ritmo sinusal e 56,1% em fibrilhação auricular.
Desenvolveram SCR 46 doentes (29,7%); 5,4±4,4 dias após a admissão, com um aumento médio da creatinina nestes doentes de 62,1±50,8umol/L.
A duração do internamento foi de 11,6±7,3 dias. A mortalidade intra‐hospitalar foi de 9% (n=14) e durante o seguimento faleceram mais 14 doentes. Foram perdidos no seguimento quatro (2,6%) doentes.
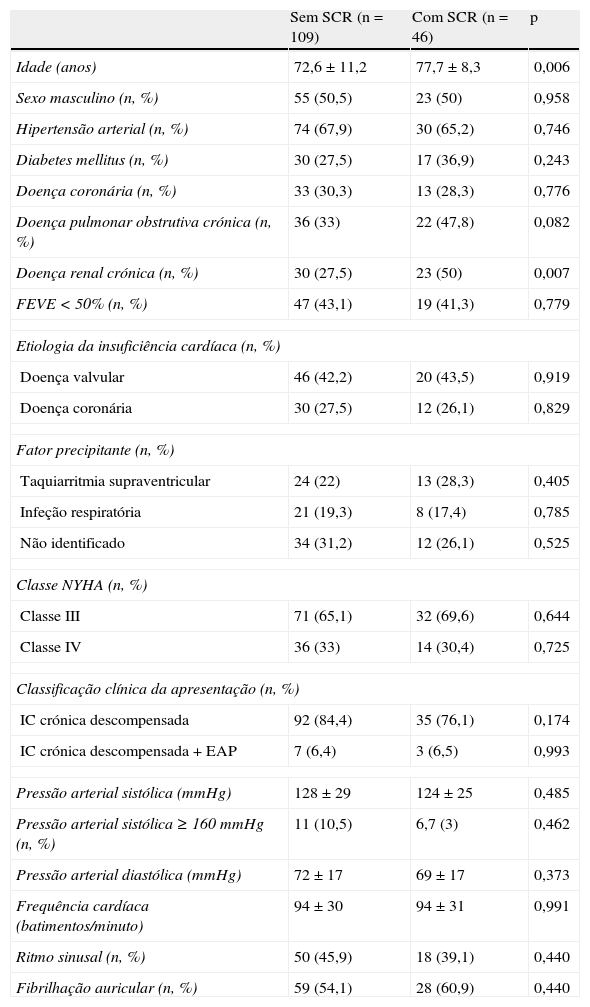
Características dos doentes com síndrome cardiorrenalNa Tabela 1 mostra‐se uma análise comparativa das características de base dos doentes, divididos consoante o desenvolvimento ou não de SCR.
Análise comparativa das características de base dos doentes
| Sem SCR (n=109) | Com SCR (n=46) | p | |
| Idade (anos) | 72,6±11,2 | 77,7±8,3 | 0,006 |
| Sexo masculino (n, %) | 55 (50,5) | 23 (50) | 0,958 |
| Hipertensão arterial (n, %) | 74 (67,9) | 30 (65,2) | 0,746 |
| Diabetes mellitus (n, %) | 30 (27,5) | 17 (36,9) | 0,243 |
| Doença coronária (n, %) | 33 (30,3) | 13 (28,3) | 0,776 |
| Doença pulmonar obstrutiva crónica (n, %) | 36 (33) | 22 (47,8) | 0,082 |
| Doença renal crónica (n, %) | 30 (27,5) | 23 (50) | 0,007 |
| FEVE<50% (n, %) | 47 (43,1) | 19 (41,3) | 0,779 |
| Etiologia da insuficiência cardíaca (n, %) | |||
| Doença valvular | 46 (42,2) | 20 (43,5) | 0,919 |
| Doença coronária | 30 (27,5) | 12 (26,1) | 0,829 |
| Fator precipitante (n, %) | |||
| Taquiarritmia supraventricular | 24 (22) | 13 (28,3) | 0,405 |
| Infeção respiratória | 21 (19,3) | 8 (17,4) | 0,785 |
| Não identificado | 34 (31,2) | 12 (26,1) | 0,525 |
| Classe NYHA (n, %) | |||
| Classe III | 71 (65,1) | 32 (69,6) | 0,644 |
| Classe IV | 36 (33) | 14 (30,4) | 0,725 |
| Classificação clínica da apresentação (n, %) | |||
| IC crónica descompensada | 92 (84,4) | 35 (76,1) | 0,174 |
| IC crónica descompensada+EAP | 7 (6,4) | 3 (6,5) | 0,993 |
| Pressão arterial sistólica (mmHg) | 128±29 | 124±25 | 0,485 |
| Pressão arterial sistólica ≥160mmHg (n, %) | 11 (10,5) | 6,7 (3) | 0,462 |
| Pressão arterial diastólica (mmHg) | 72±17 | 69±17 | 0,373 |
| Frequência cardíaca (batimentos/minuto) | 94±30 | 94±31 | 0,991 |
| Ritmo sinusal (n, %) | 50 (45,9) | 18 (39,1) | 0,440 |
| Fibrilhação auricular (n, %) | 59 (54,1) | 28 (60,9) | 0,440 |
EAP: edema agudo do pulmão; FEVE: fração de ejeção do ventrículo esquerdo; IC: insuficiência cardíaca; NYHA: New York Heart Association; SCR: síndrome cardiorrenal.
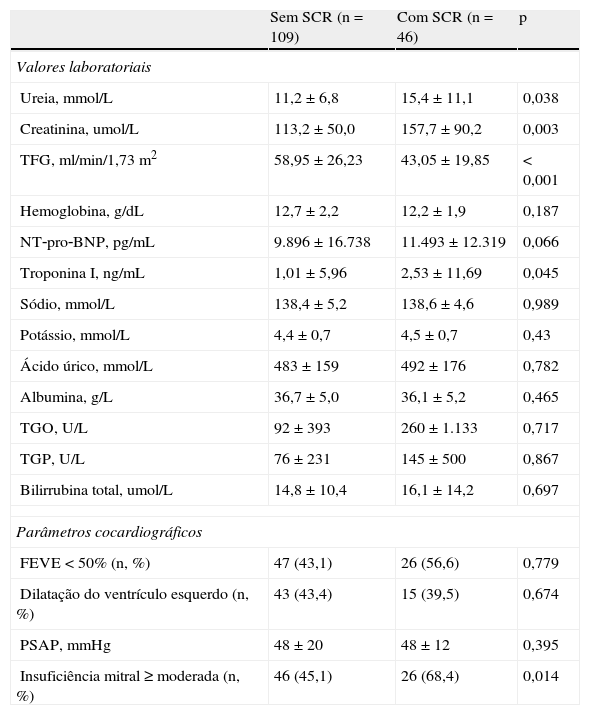
Na Tabela 2 encontra‐se a análise comparativa dos valores laboratoriais na admissão e dados ecocardiográficos entre os dois grupos de doentes.
Análise comparativa de valores laboratoriais na admissão e parâmetros ecocardiográficos
| Sem SCR (n=109) | Com SCR (n=46) | p | |
| Valores laboratoriais | |||
| Ureia, mmol/L | 11,2±6,8 | 15,4±11,1 | 0,038 |
| Creatinina, umol/L | 113,2±50,0 | 157,7±90,2 | 0,003 |
| TFG, ml/min/1,73m2 | 58,95±26,23 | 43,05±19,85 | <0,001 |
| Hemoglobina, g/dL | 12,7±2,2 | 12,2±1,9 | 0,187 |
| NT‐pro‐BNP, pg/mL | 9.896±16.738 | 11.493±12.319 | 0,066 |
| Troponina I, ng/mL | 1,01±5,96 | 2,53±11,69 | 0,045 |
| Sódio, mmol/L | 138,4±5,2 | 138,6±4,6 | 0,989 |
| Potássio, mmol/L | 4,4±0,7 | 4,5±0,7 | 0,43 |
| Ácido úrico, mmol/L | 483±159 | 492±176 | 0,782 |
| Albumina, g/L | 36,7±5,0 | 36,1±5,2 | 0,465 |
| TGO, U/L | 92±393 | 260±1.133 | 0,717 |
| TGP, U/L | 76±231 | 145±500 | 0,867 |
| Bilirrubina total, umol/L | 14,8±10,4 | 16,1±14,2 | 0,697 |
| Parâmetros cocardiográficos | |||
| FEVE <50% (n, %) | 47 (43,1) | 26 (56,6) | 0,779 |
| Dilatação do ventrículo esquerdo (n, %) | 43 (43,4) | 15 (39,5) | 0,674 |
| PSAP, mmHg | 48±20 | 48±12 | 0,395 |
| Insuficiência mitral ≥ moderada (n, %) | 46 (45,1) | 26 (68,4) | 0,014 |
FEVE: fração de ejeção do ventrículo esquerdo; PSAP: pressão sistólica na artéria pulmonar; SCR: síndrome cardiorrenal; TFG: taxa de filtração glomerular.
Durante o internamento o grupo de doentes com SCR foi medicado com doses diárias mais elevadas de furosemida (dose diária máxima – 163±114mg versus 104±70mg; p<0,001); necessitou mais frequentemente de inotrópicos (26,1 versus 7,3%; p=0,002) e de técnica de substituição da função renal (15,2 versus 0%; p<0,001). Não foram detetadas diferenças no uso de vasodilatadores endovenosos (24,8 versus 23,9%; p=0,392), levosimendan (3,7 versus 6,5%; p=0,435) e ventilação não invasiva (7,3 versus 15,2%; p=0,130).
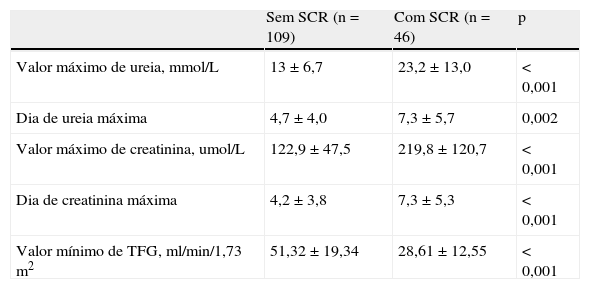
A Tabela 3 caracteriza e compara, nos dois grupos de doentes, os valores extremos dos parâmetros de função renal.
Caracterização e comparação dos valores extremos da função renal
| Sem SCR (n=109) | Com SCR (n=46) | p | |
| Valor máximo de ureia, mmol/L | 13±6,7 | 23,2±13,0 | <0,001 |
| Dia de ureia máxima | 4,7±4,0 | 7,3±5,7 | 0,002 |
| Valor máximo de creatinina, umol/L | 122,9±47,5 | 219,8±120,7 | <0,001 |
| Dia de creatinina máxima | 4,2±3,8 | 7,3±5,3 | <0,001 |
| Valor mínimo de TFG, ml/min/1,73m2 | 51,32±19,34 | 28,61±12,55 | <0,001 |
SCR: síndrome cardiorrenal; TFG: taxa de filtração glomerular.
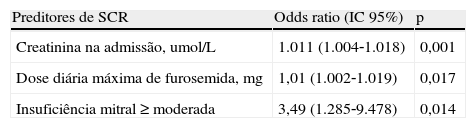
A regressão logística permitiu obter um modelo preditor de SCR que inclui a creatinina na admissão, a dose máxima diária de furosemida e a presença de insuficiência mitral, que se ajusta bem aos dados (Hosmer and Lemeshow test p=0,340) e que explica 31,8% da variabilidade da presença de SCR (Nagelkerke R square) – Tabela 4.
Fatores preditores de SCR determinados por regressão logística binária
| Preditores de SCR | Odds ratio (IC 95%) | p |
| Creatinina na admissão, umol/L | 1.011 (1.004‐1.018) | 0,001 |
| Dose diária máxima de furosemida, mg | 1,01 (1.002‐1.019) | 0,017 |
| Insuficiência mitral ≥ moderada | 3,49 (1.285‐9.478) | 0,014 |
SCR: síndrome cardiorrenal.
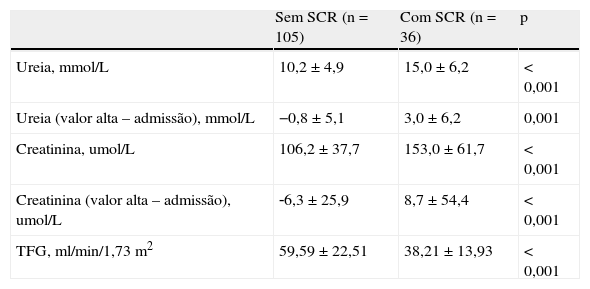
A duração do internamento foi maior nos doentes que desenvolveram SCR (14,1±10,2 versus 10,5±5,4; p=0,008). Dos doentes que desenvolveram SCR e que não faleceram, 66,7% (n=24) não recuperaram os níveis basais de creatinina. Na Tabela 5 caracteriza‐se a função renal à data da alta e a diferença com os valores da admissão, dos doentes que não faleceram.
Função renal à data da alta dos doentes que não faleceram e comparação com a admissão
| Sem SCR (n=105) | Com SCR (n=36) | p | |
| Ureia, mmol/L | 10,2±4,9 | 15,0±6,2 | <0,001 |
| Ureia (valor alta – admissão), mmol/L | −0,8±5,1 | 3,0±6,2 | 0,001 |
| Creatinina, umol/L | 106,2±37,7 | 153,0±61,7 | <0,001 |
| Creatinina (valor alta – admissão), umol/L | ‐6,3±25,9 | 8,7±54,4 | <0,001 |
| TFG, ml/min/1,73m2 | 59,59±22,51 | 38,21±13,93 | <0,001 |
SCR: síndrome cardiorrenal; TFG: taxa de filtração glomerular.
Na altura da alta ambos os grupos foram medicados com doses semelhantes de furosemida (70±26mg versus 66mg±28mg; p=0,370) e a proporção de doentes que recebeu IECA/ARA (81,7 versus 82,9%; p=0,881), beta‐bloqueante (44,2 versus 28,6%; p=0,102) e digoxina (30,8 versus 17,1%; p=0,118) não foi significativamente diferente. Observou‐se uma tendência para os doentes com SCR serem menos medicados com antagonistas da aldosterona (56,7 versus 40%; p=0,086).
Os doentes com SCR apresentaram maior mortalidade no internamento (19,6 versus 3,7%; p=0,001; OR=6,4) e aos 30 dias (22,7 versus 6,5%; p=0,004; OR=4,2), mantendo‐se com esta tendência aos 90 dias (27,3 versus 15%; p=0,077). Em análise multivariada, a ocorrência de SCR permaneceu como um fator independente associado a maior mortalidade intra‐hospitalar.
DiscussãoCaracterísticas dos doentes e prevalência de síndrome cardiorrenalQuanto às características de base dos doentes, contrariamente às casuísticas mais atuais dos países desenvolvidos1 a nossa principal etiologia da IC foi a doença valvular e não a doença coronária. Esta diferença provavelmente dever‐se‐á à idade da nossa população e ao facto de a causa isquémica só ter sido considerada na presença de antecedentes de síndrome coronária aguda ou isquemia documentada. Assim, em alguns casos a presença de insuficiência mitral poderá ser consequência de doença coronária não documentada.
O presente estudo adiciona força à crescente evidência de que a SCR é comum entre os doentes internados com IC aguda e que se associa a pior prognóstico (internamentos mais longos e maior taxa de mortalidade)3,5,6,9.
Neste trabalho os achados mais relevantes foram os seguintes:
- 1)
Cerca de um terço dos doentes desenvolveu SCR, definido como um aumento da creatinina sérica ≥ a 26,5umol/L.
- 2)
Algumas características de base associam‐se e predizem o desenvolvimento de SCR.
- 3)
SCR permanece como um poderoso preditor de mortalidade intra‐hospitalar.
Comparativamente com estudos anteriores3,5,6, obtivemos uma incidência semelhante de SCR; ocorrendo também numa fase relativamente precoce do internamento (por volta do quinto dia)5,6. Este achado sugere que o agravamento da função renal se relaciona mais com mecanismos inerentes à IC ou com o impacto da terapêutica administrada durante a admissão do que com um agravamento clínico progressivo durante um internamento prolongado6.Este estudo também confirmou a associação de certas características de base com o desenvolvimento de SCR, nomeadamente idades mais avançadas e antecedentes de doença renal crónica (traduzidos numa pior função renal à admissão)3,6,13. Curiosamente, o grupo de doentes que desenvolveu SCR apresentou valores de TFG à admissão significativamente mais baixos do que os encontrados noutros estudos8,17. Contrariamente a estudos prévios, no nosso trabalho não se verificou associação de desenvolvimento de SCR com: antecedentes de insuficiência cardíaca6; diabetes mellitus prévia3,6; pressão sistólica elevada na admissão3,6; taquicardia3 ou sexo feminino3. Estas diferenças podem estar relacionadas com a pequena dimensão da nossa amostra.
Quanto aos parâmetros ecocardiográficos é relevante referir que também no nosso estudo a SCR foi igualmente prevalente em doentes com IC e fração de ejeção normal versus fração de ejeção diminuída6. Na revisão feita da literatura, apenas foi encontrado um estudo18 que relacionou disfunção renal com insuficiência mitral, realizado em doentes com IC crónica, tendo identificado esta valvulopatia como um fator preditor de insuficiência renal, independente da idade.
Apesar de evidência recente13 ter demonstrado que a TFG, determinada pela fórmula MDRD, é um melhor avaliador da função renal nos doentes com IC, comparativamente com a creatinina sérica que muitas vezes sobrestima a função renal, particularmente nas mulheres idosas, no nosso estudo foi, contudo, a creatinina sérica da admissão que se mostrou como fator preditor de SCR.
Causas de síndrome cardiorrenalOs mecanismos que podem causar SCR em doentes com IC aguda são múltiplos e incompletamente compreendidos4,19. A redução da perfusão renal secundária à diminuição do débito cardíaco é um mecanismo intuitivo e largamente defendido20. Contudo, o desenvolvimento de SCR, mais frequentemente ocorre numa fase precoce do tratamento da IC aguda, quando os doentes ainda se encontram francamente hipervolémicos5, como foi mostrado no nosso estudo. Também Ljungman et al.21 mostraram que o fluxo sanguíneo renal é preservado até o débito cardíaco ser inferior a 1,5L/m2. Assim, a hipótese simplista de que o agravamento da função renal é uma consequência da depleção de volume intravascular, provavelmente é imprecisa e certamente não identifica uma estratégia terapêutica satisfatória (reposição de volume) em doentes persistentemente congestivos com SCR13. Evidência recente14 tem vindo a enfatizar a importância da hipertensão venosa renal na fisiopatologia da SCR. No nosso trabalho não foi verificada qualquer associação entre a pressão arterial sistólica da artéria pulmonar e SCR. Infelizmente, terapêutica com efeito demonstrado nas pressões de enchimento (p. ex. nitroglicerina, nesiritide, nitroprussiato de sódio) não mostrou impacto na diminuição da incidência de SCR durante o tratamento da IC aguda22.
As terapêuticas instituídas nos doentes com IC aguda são outra causa potencial de SCR, com hipovolemia associada a diurese excessiva, introdução precoce de IECA e hipotensão.
Consistente com os nossos resultados, os estudos em que foi avaliada a associação entre a medicação intra‐hospitalar e o desenvolvimento de SCR constataram que doses mais elevadas de diuréticos da ansa eram usadas em doentes com SCR3,6,17. É um facto que o tratamento com doses mais elevadas de furosemida se associa a pior prognóstico23 e o desenvolvimento de SCR pode ser um mecanismo potencial. Por outro lado, não podemos excluir a possibilidade da administração de doses mais elevadas de diuréticos ser uma consequência, e não uma causa, de IC mais avançada com insuficiência renal coexistente. Neste caso, seria apenas um marcador de pior prognóstico, mais do que um mecanismo.
Significado clínico e prognóstico de síndrome cardiorrenalTal como foi mostrado no registo ADHERE, também o nosso estudo revelou que foi no grupo de doentes que desenvolveu agravamento da função renal que se observou a utilização de doses mais elevadas de diuréticos, escalonamento terapêutico (com uso de inotrópicos e técnicas de substituição renal) e maior risco de mortalidade intra‐hospitalar. Não existem dados prospetivos sobre o benefício clínico da «dose renal» de dopamina na IC aguda e os dados retrospetivos demonstram um efeito adverso da utilização de inotrópicos na morbilidade e mortalidade24.
De acordo com estudos anteriores3,5,6, mostrámos que a SCR se associa a internamentos mais prolongados, podendo isto ser importante tanto no que se refere à qualidade de vida como às despesas de saúde. Esta maior duração do internamento pode dever‐se à necessidade de adiar a introdução do IECA/ARA ou do beta‐bloqueante, e de permitir a recuperação da função renal antes da alta. Consistentemente, os valores de creatinina sérica à data da alta foram menores do que o valor máximo atingido nos doentes que desenvolveram SCR, embora a maioria dos doentes não tenha chegado a recuperar os níveis basais de creatinina.
Também no nosso estudo o desenvolvimento de SCR foi um fator preditor de mortalidade intra‐hospitalar3,5,6. Confirmámos ainda que a SCR se associa a pior prognóstico após a alta3,6,9.
Independentemente destes resultados, ainda não está completamente esclarecido se o agravamento da função renal em si contribui para o aumento da mortalidade ou se é apenas um marcador de disfunção cardíaca e/ou renal mais severa6,13.
Limitações do estudoO nosso estudo é limitado pelo número relativamente pequeno de doentes. Contudo, como salientou o cálculo do poder estatístico, o tamanho do grupo foi suficiente para identificar a SCR como um fator preditor de prognóstico, que era um dos principais objetivos deste trabalho.
Outra limitação foi o facto de não termos investigado, durante o internamento, a escolha de certos medicamentos (p. ex. IECA/ARA, beta‐bloqueante, antagonistas da aldosterona), bem como o momento da sua introdução e respetiva dose.
Como em qualquer estudo retrospetivo fomos limitados pela informação que se encontra disponível nos ficheiros clínicos dos doentes.
ConclusõesApós a admissão por IC aguda, o desenvolvimento de SCR é frequente, mesmo após a exclusão de doentes com doença renal crónica terminal.
A creatinina sérica da admissão, doses mais altas de furosemida e a presença de insuficiência mitral moderada/severa foram identificadas como fatores preditores de SCR.
O grupo de doentes que desenvolveu SCR foi tratado com doses diárias máximas mais elevadas de furosemida, mais frequentemente necessitou de inotrópicos e de técnica de substituição da função renal. O desenvolvimento de SCR associou‐se a internamentos mais prolongados, maior mortalidade intra‐hospitalar e a médio prazo.
Embora existam várias estratégias terapêuticas plausíveis para abordagem da SCR, nenhum estudo aleatorizado mostrou impacto positivo nesta intercorrência.
Assim, vários estudos (alguns dos quais dinamizados pelo National Heart, Lung, and Blood Institute¿s Heart Failure Network25) estão a decorrer no sentido de avaliar estratégias terapêuticas neste grupo de doentes, bem como identificar novos biomarcadores de lesão renal passíveis de serem utilizados na identificação precoce dos doentes em risco de desenvolver SCR.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos de seu centro de trabalho acerca da publicação dos dados de pacientes e que todos os pacientes incluídos no estudo receberam informações suficientes e deram o seu consentimento informado por escrito para participar nesse estudo.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesOs autores declaram não haver conflito de interesses.