O sacubitril/valsartan (LCZ696) é um complexo supramolecular de sal de sódio do pró‐fármaco sacubitril, inibidor da neprilisina, e do valsartan, um antagonista dos recetores da angiotensina (ARB), administrado por via oral, recentemente aprovado no tratamento da insuficiência crónica (classes II‐IV NYHA) com fração de ejeção reduzida (IC‐FER). A inibição neuro‐hormonal é um elemento central no tratamento da insuficiência cardíaca. No entanto, os benefícios obtidos com o aumento de outros sistemas, tais como os péptidos natriuréticos, foram muito parcelares (e inconsistentes). O desenvolvimento do sacubitril/valsartan e os resultados do PARADIGM‐HF mudaram a situação e abriram uma alternativa no tratamento da insuficiência cardíaca crónica. O PARADIGM‐HF foi um grande estudo prospetivo aleatorizado, com dupla ocultação, que demonstrou que a morbimortalidade na insuficiência cardíaca pode ser melhorada com o sacubitril/valsartan, com redução significativa da morte cardiovascular ou da hospitalização por agravamento da insuficiência cardíaca. O sacubitril/valsartan foi também superior ao enalapril na redução da mortalidade total e na limitação da progressão da insuficiência cardíaca. O novo ARNi foi geralmente bem tolerado, sem incremento dos eventos adversos potencialmente fatais (apesar da maior incidência de hipotensão sintomática, mas com uma baixa ocorrência de angioedema). Por essa razão, o sacubitril/valsartan deve substituir o ACEi (ou o ARB) no tratamento da IC‐FER, afirmação já expressa em muitas das novas recomendações terapêuticas.
Sacubitril/valsartan (LCZ696), a supramolecular sodium salt complex of the neprilysin inhibitor prodrug sacubitril and the angiotensin receptor blocker (ARB) valsartan, was recently approved in the EU and the USA for the treatment of chronic heart failure (HF) with reduced ejection fraction (HFrEF) (NYHA class II‐IV). Inhibition of chronically activated neurohormonal pathways (the renin‐angiotensin‐aldosterone system [RAAS] and sympathetic nervous system [SNS]) is central to the treatment of chronic HFrEF. Furthermore, enhancement of the natriuretic peptide (NP) system, with favorable cardiovascular (CV) and renal effects in HF, is a desirable therapeutic goal to complement RAAS and SNS blockade. Sacubitril/valsartan represents a novel pharmacological approach that acts by enhancing the NP system via inhibition of neprilysin (an enzyme that degrades NPs) and by suppressing the RAAS via AT1 receptor blockade, thereby producing more effective neurohormonal modulation than can be achieved with RAAS inhibition alone. In the large, randomized, double‐blind PARADIGM‐HF trial, replacement of an angiotensin‐converting enzyme inhibitor (ACEI) (enalapril) with sacubitril/valsartan resulted in a significant improvement in morbidity and mortality in patients with HFrEF. Sacubitril/valsartan was superior to enalapril in reducing the risk of CV death or HF hospitalization (composite primary endpoint) and all‐cause death, and in limiting progression of HF. Sacubitril/valsartan was generally well tolerated, with a comparable safety profile to enalapril; symptomatic hypotension was more common with sacubitril/valsartan, whereas renal dysfunction, hyperkalemia and cough were less common compared with enalapril. In summary, sacubitril/valsartan is a superior alternative to ACEIs/ARBs in the treatment of HFrEF, a recommendation that is reflected in many HF guidelines.
Os avanços obtidos na prevenção, diagnóstico e tratamento da doença cardiovascular (DCV), nas últimas décadas, têm sido muito relevantes, propiciando reduções muito significativas nas taxas de mortalidade por DCV, ajustadas à idade. A taxa de mortalidade padronizada por doenças do aparelho circulatório, por 100000 habitantes, em Portugal continental (de 2008 a 2012) diminuiu 15,5% (e é, em 2013, de 144,7 por 100000 residentes)1.
Contudo, a insuficiência cardíaca (IC) é uma exceção a esta propensão. A prevalência – apesar de proceder da definição aplicada – atinge cerca de 1‐2% da população adulta, com valores≥10% nos adultos>70 anos. Aos 55 anos, o risco de IC, ao longo da vida, é de 33% nos homens e 28% mas mulheres (e é ainda maior nos hipertensos)2,3. Naturalmente, por isso, esta patologia afeta primariamente os idosos e é uma causa frequente de hospitalização. Nos Estados Unidos, a IC é responsável por mais de um milhão de internamentos anuais2. Apesar da escassez de dados recentes, a prevalência de IC, em Portugal, foi estimada em 4,4%, com valores similares nos homens (4,33%) e nas mulheres (4,38%). A incidência aumenta com a idade e a maioria da carga de doença sobrevém nos doentes com mais de 65 anos (a prevalência, entre nós, atinge 12,67% no grupo etário de 70‐79 anos e mais de 16% depois dos 80 anos)4. Os dados sobre o internamento por IC, entre nós, são limitados, mas alvitram que as taxas de hospitalização tendem, como seria conjeturável, a aumentar significativamente com a idade5.
A sobrevivência após o diagnóstico de IC melhorou claramente durante os últimos 30 anos e a taxa de mortalidade ajustada à idade também diminuiu6. Apesar disso, persiste o paradoxo da IC6: o incremento, iterado e progressivo, da entidade, embora os fatores contributivos individuais (e.g. síndrome coronária aguda, hipertensão arterial [HTA], cardiopatias valvulares e congénitas) tenham tido melhorias prognósticas substanciais. Possivelmente, esta contradição redunda da constância de morbilidade arrolada a cada um destes fatores, ainda que a redução de mortalidade seja incontestável; além disso, a maior expetativa de vida torna mais consequentes os efeitos da idade avançada (e.g. o aumento da frequência de morte e/ou apoptose dos miócitos e as sequelas adversas cardíacas de diversas comorbilidades: HTA, diabetes mellitus tipo 2, doença renal crónica, doença pulmonar obstrutiva crónica e arritmias, especialmente a fibrilação auricular [FA]). Logicamente, também a melhoria prognóstica – lenta, mas progressiva – da IC acaba por concorrer para o aumento da prevalência desta condição6.
Fruto da reconhecida interação – variável, mas constante, ao longo da história natural – entre a função cardíaca e os sistemas neuro‐humorais (e inflamatórios), a abordagem atual da IC com fração de ejeção reduzida (IC‐FER) centra‐se no bloqueio do sistema renina‐angiotensina‐aldosterona (RAAS) e do sistema nervoso simpático (SNS), com recurso a inibidores da enzima de conversão da angiotensina (ACEi) – ou antagonistas dos recetores da angiotensina (ARB), quando os ACEi não são tolerados –, bloqueadores adrenérgicos β (β‐B) e antagonistas dos recetores mineralocorticoides (MRA)3,7–9. Contudo, mesmo com a otimização da intervenção farmacológica sublinhada, a taxa de mortalidade aos cinco anos detém‐se perto de 50%5, pelo que se torna elementar identificar os indivíduos em risco de IC (e.g. maior índice de massa corporal e de obesidade visceral, elevação da glicemia em jejum, aumento da pressão arterial sistólica, dislipidemia e alteração do rácio apolipoproteína B/apolipoproteína A e tabagismo)6 e fundamentar novas vias de intervenção farmacológica capazes de minimizar o prognóstico desta síndrome clínica.
De forma sumária, tendemos a considerar a IC como uma síndrome clínica na qual um conjunto de adaptações locais e sistémicas intentam manter – e, ao mesmo tempo, desregular – a homeostasia cardiovascular (CV). Será, muito naturalmente, esta complexidade e dualidade fisiopatológica que torna a definição e o desenvolvimento da melhor estratégia terapêutica desafiante, não inteiramente exclusiva e frequentemente individualizada. A multiplicidade, interrelação e enunciação dos processos arrolados na progressão e manutenção da IC constituem‐se, assim, alvos potenciais de intervenção terapêutica – complementares, idealmente, aditivos – no alívio sintomático, na melhoria da qualidade de vida e na redução da morbilidade e mortalidade associadas.
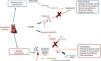
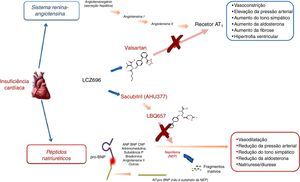
A compreensão do papel do sistema dos peptídeos natriuréticos (NP) – a par do RAAS – na regulação da pressão arterial e do volume de fluidos, tanto na atividade normal, como em estados patológicos (e, em particular, nos doentes com IC) constitui um paradigma elementar da colaboração interdisciplinar e tutelar10,11 que culminou, mais recentemente, no desenvolvimento e introdução no arsenal terapêutico do primeiro antagonista do recetor da angiotensina‐inibidor da neprilisina (ARNi): o sacubitril/valsartan (LCZ696) (Figura 1). A neprilisina (NEP) – também conhecida como endopeptídase neutra, CD10, encefalinase, antigénio da leucemia linfoblástica aguda comum e endopeptídase 24.11 – é uma enzima responsável pela clivagem dos NP (Figura 2), os efeitos e principais características dos quais estão sumariados na Tabela 18.
Mecanismo de ação da neprilisina e dos péptidos natriuréticos, em paralelo com o sistema renina‐angiotensina (e recetor AT1) – de acordo com Bayes‐Genis et al13.
Sumário do sistema de péptidos natriuréticos14–19
| Péptidos natriuréticos | ANP | BNP | CNP |
|---|---|---|---|
| Localização | Aurícula | Ventrículos | Células endoteliais vasculares |
| Desencadeadores | Distensão auricular | Aumento do volume ventricular | Aumento da tensão de cisalhamento |
| Recetor | NPR‐A | NPR‐A | NPR‐B |
| Efeitos fisiológicos | Natriurese e diurese Vasodilatação ↓ RAAS e SNS ↑ Fluxo sanguíneo renal e da TFG ↑ Relaxamento miocárdico Mobilização lipídica, efeitos metabólicos Anti‐hipertrófico Antifibrótico ↑ Permeabilidade endotelial Anti‐inflamatório | Natriurese e diurese Vasodilatação ↓ RAAS e SNS ↑ Fluxo sanguíneo renal e da TFG ↑ Relaxamento miocárdico Mobilização lipídica, efeitos metabólicos Antifibrótico | Vasodilatação Anti‐hipertrófico Antifibrótico Anti‐inflamatório Antitrombótico Regulação do crescimento ósseo |
| Depuração do NP/degradação enzimática | Depuração via NPR‐C/degradação pela NEP | Depuração via NPR‐C/degradação pela NEP | Depuração via NPR‐C/degradação pela NEP |
ANP: péptido natriurético auricular; BNP: péptido natriurético cerebral; CNP: péptido natriurético tipo C; NEP: neprilisina; NPR‐A: recetor de peptídeo natriurético de tipo A; NPR‐B: recetor de peptídeo natriurético de tipo B; NPR‐C: recetor de peptídeo natriurético de tipo C; RAAS: sistema renina‐angiotensina‐aldosterona; SNS: sistema nervoso simpático; TFG: taxa de filtração glomerular.
Ao longo dos anos, fruto de défices de compreensão fisiopatológica e funcional, de opções menos corretas nas doses e nas vias de administração, e de preferências «desajustadas» na opção das combinações terapêuticas, a inibição da NEP (NEPI) foi menos conseguida, acumulando alguns desaires, amontoando perplexidades, mas, ao mesmo tempo, permitindo aperfeiçoamentos e progressos2,10–13,20,21.
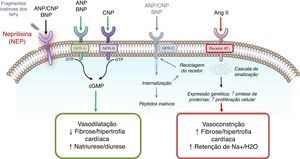
O primeiro NEPI sintético disponível foi o tiorfano, o metabolito ativo do racecadotril. Em voluntários saudáveis – assim como na HTA e na IC –, os NEPI determinam aumento das concentrações plasmáticas do peptídeo natriurético auricular (ANP) e peptídeo natriurético tipo‐B (BNP) endógeno, um incremento do monofosfato cíclico de guanosina (cGMP), circulante e urinário, e uma resposta salutar hemodinâmica, de curto prazo, com um efeito hipotensor discreto e efémero13,22–24, sem efeitos significativos na IC grave. A investigação farmacológica foi prosseguindo, do candoxatril passou pelo ecadotril, sem eficácia comprovada e descontinuidade do seu aperfeiçoamento. A monoterapia com NEPI evolveu para a combinação com ACEi: os inibidores das vasopeptidases. Foi, então, o tempo do omapatrilato (e dos estudos IMPRESS e OVERTURE), do fasidotril, do sampatrilato e do mixanpril13. Os benefícios potenciais anotados foram ensombrados pelo risco de angioedema grave25 – motivado pelo excesso de bradicinina, des‐Arg9‐bradicinina e, possivelmente, substância P22,26 –, o que levou à interrupção do desenvolvimento dos inibidores das vasopeptidases. A inibição das três enzimas arroladas à degradação das bradicininas (por ordem de ponderação: ACE>aminopeptídase P>>NEP)22 motiva a acúmulo de bradicininas bastantes para a provocação de angioedema, um efeito adverso potencialmente fatal, quando há compromisso das vias aéreas superiores. A perceção do risco e o acerto de doses (não conseguida, e.g., no caso do omapatrilato), no contexto da IC, sustentou o passo seguinte: a combinação de um ARB a um NEPI, administrada em duas tomas diárias (BID). Estava chegada a hora do LCZ696, dos ARNi24,27 (Figura 3). Os efeitos fisiológicos esperados com as diversas formas de modulação da NEP e do RAAS são compendiados na Tabela 213
Mecanismo de ação farmacológica do LCZ696 (adaptado de Vardeny et al.2).
Efeitos fisiológicos da inibição isolada da neprilisina e da combinação com moduladores de sistema renina‐angiotensina (de acordo com Bayes‐Genis et al13.)
| NEPI | ACEi | NEPI+ACEi | ARNI | |
|---|---|---|---|---|
| Efeitos nos níveis plasmáticos dos péptidos | ||||
| Angiotensina II | ↑ | ↓ | ↓ | ↔ ↓ |
| Renina | ↓ | ↔ | ↔ ↑ | ↑ |
| Aldosterona | ↓ | ↔ | ↓ | ↓ |
| NP ou cGMP | ↑ | ↔ | ↑ | ↑ |
| ET‐1 | ↑ | ↔ | ↑ | ↓ |
| Big ET‐1 | ↑ | ↑ | ||
| Bradicinina | ↑ | ↑ | ↑↑ | ↑ |
| Efeitos fisiológicos | ||||
| Pressão arterial | ↔ | ↓ | ↓ | |
| Excreção de sódio | ↑ | ↑ | ↑ | ↑↑ |
| Hipertrofia CV | ↔ ↓ | ↓ | ↓↓ | ↓↓ |
| Fibrose CV | ↓ | ↓ | ↓↓ | ↓↓ |
cGMP: monofosfato cíclico de guanosina; CV: cardiovascular; ET‐1: endotelina 1; NP: péptidos natriuréticos.
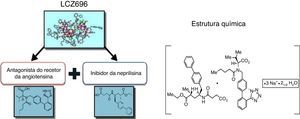
O sacubitril/valsartan, ao contrário do que o nome poderia fazer supor, não é uma combinação fixa de medicamentos. O sacubitril/valsartan é um complexo supramolecular de sal de sódio do pró‐fármaco NEPI sacubitril (AHU377) e do ARB diprótico valsartan numa razão molecular de 1:123,24,27–30. Com uma estrutura cristalina estável, altamente hidrossolúvel, contém seis moléculas aniónicas de sacubitril e seis de valsartan complexadas com catiões de sódio e água (Figura 1). Após a administração oral, o complexo dissocia‐se em sacubitril e valsartan (cada comprimido de 200mg – administrado BID, dose alvo de manutenção na IC‐FER – contém 97mg de sacubitril e 103mg de valsartan).
Sacubitril (pró‐fármaco) é metabolizado in vivo (clivagem enzimática do éster etílico) em sacubitrilato (LBQ657) (ativo), que inibe a NEP, mas sem inibir a aminopeptídase P. Logicamente, o valsartan inibe o RAAS ao ligar‐se e ao bloquear o recetor AT1 da angiotensina II21,23–25.
Do ponto de vista farmacodinâmico, o sacubitril/valsartan condiciona um incremento não sustentado da natriurese e do cGMP urinário (que advém como biomarcador da NEPI) e uma diminuição do pró‐ANP fração regional média (MR‐proANP) e do NT‐proBNP no plasma23. Estas variações são consistentes com uso mais iterado com aumento, na urina do ANP e do cGMP (também no plasma) e redução do NT‐proBNP, aldosterona e ET‐1 no plasma (Figura 3). Num estudo de escalonamento de dose, em voluntários saudáveis, houve um acréscimo máximo de 40% nos níveis médios de cGMP às quatroh – ainda significativa 12h após a toma – e que atingiu o valor máximo 12 dias da administração continuada, com retorno aos valores basais 24h após a administração de LCZ69623,31. Ao mesmo tempo, fruto da porção valsartan, há um aumento significativo dependente de dose da concentração de renina, da atividade da renina plasmática e da angiotensina II, que permanecem elevados durante 24h. Acresce‐se que, face à farmacodinâmica exposta, o BNP não é um mais biomarcador adequado na IC, em doentes tratados com sacubitril/valsartan, enquanto o NT‐proBNP, como não é um substrato da NEP, parece manter a conformidade.
Propriedades farmacocinéticasA Tabela 3 resume os principais parâmetros farmacocinéticos2. Após a administração oral, o complexo é rapidamente absorvido (sem variação na presença de alimentos) e, como já referimos, dissociado em valsartan e sacubitril; este é, posteriormente, metabolizado por carboxilesterases inespecíficas 1b e 1c no metabolito ativo sacubitrilato. No conjunto, atingem as concentrações máximas (Cmax) em 90, 30‐60 e 120min, respetivamente. A biodisponibilidade oral absoluta do sacubitril é mais de 60% e a do valsartan cerca de 23%2,23,24,28,29,32. O sal de valsartan no complexo é diverso do da monoterapia. A biodisponibilidade plasmática do valsartan com 400mg de LCZ696 é equivalente a 320mg em monoterapia, correspondente a uma exposição sistémica cerca de 40% mais elevada (imputada à presença da forma iónica em vez do ácido livre presente no LCZ696)33. Assim, a dose de 97/103mg de sacubitril/valsartan, BID, é bioequivalente a 160mg de valsartan, BID.
Sumário da farmacocinética do sacubitril/valsartan (adaptado de Mills e Vardeny2)
| Valsartan | Sacubitril (AHU377) | Sacubitrilato (LBQ657) | |
|---|---|---|---|
| Biodisponibilidade (%) | 23 | >60 | |
| Distribuição (litros, l) | 75 | 103 | |
| Ligação às proteínas (%) | 94‐97 | ||
| Tmax (horas) | 1,5 | 0,5 | 2 |
| Metabolismo | Mínimo (≈20%) (<10% como metabolito hidroxil) | Metabolizado em sacubitrilato por esterases | Sem metabolismo significativo |
| Excreção | Renal (≈13%) Fezes (86%) | Renal (52‐68%), primariamente como sacubitrilato | Fezes (37‐48%), primariamente |
| t½ (horas) | 9,9 | 1,4 | 11,5 |
l: litro;Tmax: tempo para atingir a concentração máxima (Cmax) no plasma; t½: semivida plasmática de eliminação.
Com BID, os níveis estacionários farmacocinéticos são atingidos em três dias, sem acumulação significativa do sacubitril e do valsartan (mas de 1,6 vezes para o metabolito ativo NEPI). Tanto o sacubitril e o sacubitrilato, como o valsartan, ligam‐se fortemente às proteínas plasmáticas (94‐97%), com um volume de distribuição aparente médio do valsartan e do sacubitril de 75 e 103l, respetivamente. O sacubitrilato atravessa a barreira hematoencefálica numa extensão limitada (a exposição no líquido cefalorraquídeo é 0,28% da plasmática)23,28.
À parte da bioativação do pró‐fármaco, o sacubitrilato não é mais biotransformado. O valsartan é parcialmente metabolizado (≈20%), principalmente num metabolito hidroxil (valeril‐4‐hidroxi valsartan) – identificado em baixas concentrações (<10%), no plasma – presumivelmente pelo CYP2C9. Cerca de 52‐68% do sacubitril (primariamente como sacubitrilato) e de 13% do valsartan são excretados na urina; 37‐48% do sacubitril (primordialmente como sacubitrilato) e 86% do valsartan são excretados nas fezes. A semivida de eliminação é aproximadamente de 1,43h para o sacubitril, de 11,48h para o sacubitrilato e de 9,90h para o valsartan23,24,28,32.
A farmacocinética do sacubitril/valsartan não é afetada pelo género, mas, nos idosos, a exposição ao sacubitrilato e ao valsartan aumenta em 42 e 30%, respetivamente, presumivelmente como resultado da disfunção renal e/ou hepática. Ao contrário do valsartan, há correlação entre a função renal e a exposição sistémica ao sacubitrilato em doentes com compromisso renal ligeiro a grave (podendo duplicar com maior afetação da taxa de filtração glomerular [15ml/min/1,73m2≤TFG<30ml/min/1,73m2]). Da mesma forma, há também um aumento da exposição sistémica ao sacubitril, sacubitrilato e valsartan nos doentes com compromisso hepático ligeiro a moderado23,24,28.
Interações medicamentosasO sacubitril inibe os polipéptidos transportadores dos aniões orgânicos (OATP), nomeadamente o OATP1B1 e o OATP1B3, expressos na membrana basolateral do hepatócito e arrolados à depuração hepática de vários fármacos (e.g. estatinas e furosemida). A coadministração de sacubitril/valsartan aumentou a exposição sistémica à atorvastatina e aos seus metabolitos. É, por isso, desejável precaução com o uso concomitante com inibidores da redutase do HMG‐CoA13,28.
O uso concomitante de furosemida levou a uma redução da sua Cmax e da AUC em 50 e 28%, respetivamente24,27, com decremento da excreção urinária de sódio. O sacubitril/valsartan diminui também a exposição sistémica à hidroclorotiazida e à metformina (≈23%). A relevância clínica destes resultados é desconhecida13,28. Naturalmente, e como é previsível, nos idosos, nos doentes com depleção de volume ou quando há um compromisso da função renal comprometida, o uso concomitante de sacubitril/valsartan e anti‐inflamatórios não esteroides pode levar a um maior risco de agravamento da função renal, sendo recomendável, neste caso, monitorizar adequadamente a função renal.
Sacubitril/valsartan no tratamento da insuficiência cardíacaInsuficiência cardíaca com fração de ejeção reduzidaO sacubitril/valsartan encontra‐se aprovado e indicado «em doentes adultos para o tratamento da IC crónica sintomática com FER», desde novembro de 2015, pela Agência Europeia do Medicamento (EMA)28,34. Esta aprovação foi fundamentada nos resultados do estudo The Prospective Comparison of ARNI With ACEI to Determine Impact in Global Mortality and Morbidity in Heart Failure (PARADIGM‐HF)35.
O estudo PARADIGM‐HF foi desenhado em dupla‐ocultação para avaliar a superioridade de sacubitril/valsartan 200mg BID, em comparação com o enalapril 10mg BID na redução de morte CV e hospitalização por IC (objetivo primário composto) nos doentes com IC‐FER (≤35%)36. Os doentes incluídos eram seguidos em ambulatório, com um diagnóstico de IC crónica estabelecido, em classe II‐IV da New York Heart Association (NYHA) e fração de ejeção ventricular esquerda (FEVE)≤40% (alterada para≤35%, posteriormente, quando estavam incluídos 961 doentes), com um BNP≥150pg/ml (NT‐proBNP≥600pg/ml) OU BNP≥100pg/ml (NT‐proBNP≥400pg/ml) e hospitalização por IC nos últimos 12 meses. No global, 4,6% estavam em classe I da NYHA, 70,5% em classe II, 24% em classe III e só 0,7% em classe IV. Os doentes teriam de estar medicados com um ACEi (ou um ARB), na dose diária≥10mg de enalapril (ou equivalente), estável, pelo menos, quatro semanas antes do início do estudo. A idade média dos doentes foi de 64 anos e 87% eram homens, maioritariamente caucasianos (66%) e asiáticos (18%). Era ainda obrigatória a medicação com um β‐B, exceto se contraindicado ou não tolerado, numa dose estável durante, pelo menos, quatro semanas antes do início do estudo35,36. O PARADIGMA‐HF contemplou um período de run‐in de avaliação sequencial do enalapril e do sacubitril/valsartan (com uma mediana de exposição ao fármaco de 15 e 29 dias, respetivamente) antes do período aleatorizado, em dupla ocultação, que confirmou a tolerabilidade dos doentes a cada um dos tratamentos em análise.
O estudo veio a ser parado precocemente, ao fim de um período médio de acompanhamento de 27 meses, porque se atingiram os critérios pré‐especificados para uma diferença entre grupos considerada irrefutável: nas três análises interinas (a última com dois terços dos eventos necessários) confirmou‐se uma redução muito significativa da morte por causas CV (e também do objetivo primário composto)36,37. A medicação dos doentes cumpria as recomendações internacionais, sendo que 82% dos doentes tomavam um diurético, mais de 90% um β‐B, mais de 50% faziam um MRA, 30% com digoxina 15% tinham um cardioversor desfibrilhador implantável (CDI) e 7% terapêutica de ressincronização cardíaca (TRC), na data da aleatorização38. Na última avaliação, a dose média de sacubitril/valsartan foi de 375mg e a de enalapril de 18,9mg23.
O sacubitril/valsartan foi significativamente superior ao enalapril, reduzindo em 20% o risco do objetivo primário composto (hazard ratio [HR]: 0,80; intervalo de confiança a 95% [IC 95%]: 0,73‐0,87; p<0,0001), assim como o dos seus componentes individuais, nomeadamente uma redução de 20% do risco de morte CV (HR: 0,80; IC 95%: 0,71‐0,89; p<0,0001) e de 21% do risco de hospitalização por IC (HR: 0,79; IC 95%: 0,71‐0,89; p<0,0001). A redução do risco de morte CV foi atribuída essencialmente à redução do risco de morte súbita (HR: 0,80; IC 95%: 0,68‐0,94; p=0,008) e de morte por agravamento da IC (HR: 0,79; IC 95%: 0,64‐0,98; p=0,034)39. Em termos absolutos, o número de indivíduos necessário tratar (NNT) para evitar um evento de morte CV ou hospitalização por IC foi de 21. Os NNT para evitar um evento de morte CV e um evento de hospitalização por IC foram 32 e 36, respetivamente, num período de tratamento com duração média de 27 meses34. As reduções do risco de morte CV e do risco do objetivo primário composto foram consistentes em todos os subgrupos de doentes analisados35 e independente da idade, dos níveis de FEVE, da pressão arterial sistólica, do grau de risco basal (pelo score MAGGIC) e dos níveis de hemoglobina glicada (HBA1c)23.
Nos objetivos secundários, o sacubitril/valsartan reduziu a mortalidade por todas as causas em 16% (HR: 0,84; IC 95%: 0,76‐0,93; p=0,0005), com um incremento da esperança de vida estimado em 1,3 anos (IC 95%: 0,3‐2,4) nos doentes com 65 anos do estudo (a esperança de vida foi de dez anos nos tratados com enalapril e 11,4 anos com sacubitril/valsartan). Significativo, o sacubitril/valsartan reduziu também a morte súbita cardíaca em comparação com o enalapril (HR 0,80; p=0,008)39. O ARNi melhorou também significativamente os sintomas e as limitações físicas, quer segundo o Kansas City Cardiomyopathy Questionnaire (KCCQ), quer pela classe funcional NYHA40. Não houve diferenças entre os tratamentos no risco de agravamento da função renal ou de FA de novo. A utilização de recursos de saúde arrolada ao tratamento foi menor com o sacubitril/valsartan, tendo‐se verificado reduções significativas dos números totais de hospitalizações por IC (risco relativo [RR]: 0,77; IC 95%: 0,67‐0,89; p<0,001), hospitalizações CV (RR: 0,84; IC 95%: 0,76‐0,92; p<0,001), hospitalizações por todas as causas (RR: 0,84; IC 95%: 0,78‐0,91; p<0,001), um menor número de dias de hospitalização em unidade de cuidados intensivos (UCI) por qualquer causa (RR: 0,79; IC 95%: 0,63‐0,99; p=0,0434), e um menor número de episódios de urgência por IC (RR: 0,70; IC 95%: 0,52‐0,94; p=0,0170)40. Além disso, o novo tratamento reduziu a necessidade de intensificação do tratamento (520 versus 604; HR 0,84; p=0,003), de recorrerem a fármacos inotrópicos positivos intravenosos (redução de risco [RRR] de 31%, p<0,001) e de serem submetidos à implantação de dispositivos ou transplantação cardíaca (RRR de 22%, p=0,07)40.
A redução incremental da mortalidade obtida neste estudo foi similar à verificada no Studies of Left Ventricular Dysfunction – Treatment Arm (SOLVD‐T), contra placebo, que estabeleceu os ACEi como tratamento imperativa, de primeira linha, na IC41. De assinalar que a dose de enalapril (10mg, BID), no PARADIGM‐HF, é maior que a alcançada no SOLVD‐T. O PARADIGM‐HF avulta pelo seu caráter prospetivo, aleatorizado e controlado, justeza de comparador, relevância e consistência de RRR («ensaio dos 20%»)42 (Tabela 4) e poder e adequação estatística para adjudicação de diferenças clinicamente relevantes em objetivos bem definidos.
PARADIGM‐HF: sumário dos resultados obtidos no objetivo primário composto (e componentes) e na mortalidade total
| Objetivo | Razão de risco HR (IC95%) | Redução de risco relativo (%) | p |
|---|---|---|---|
| Objetivo composto primário de morte CV e hospitalização por IC | 0,80 (0,73‐0,87) | 20 | <0,001 |
| Componentes individuais do objetivo composto primário | |||
| Morte CV | 0,80 (0,71‐0,89) | 20 | <0,001 |
| 1.ª hospitalização por IC | 0,79 (0,71‐0,89) | 21 | <0,001 |
| Objetivos secundários | |||
| Mortalidade total | 0,84 (0,76‐0,93) | 16 | 0,0005 |
CV: cardiovascular; HR: hazard ratio (razão de risco); IC: insuficiência cardíaca; IC95%: intervalo de confiança a 95%.
O sacubitril/valsartan contribuiu para um menor número de eventos adversos (EA) graves e uma menor de descontinuação do tratamento por EA (10,7 versus 12,2%)35. A hipercaliemia (11,6 versus 14%), a tosse (8,8 versus 12,6%) e a disfunção renal (10,1 versus 11,5%) foram significativamente menos reiteradas nos doentes tratados com sacubitril/valsartan. No entanto, a hipotensão sintomática foi significativamente maior nos doentes com sacubitril/valsartan (14,0 versus 9,2%), mas raramente conduziu à descontinuação do fármaco35. O angioedema ocorreu em 29 doentes com sacubitril/valsartan e em 25 doentes com enalapril. De notar que nenhum foi ponderado como risco de vida, não tendo havido compromisso das vias aéreas35. Um subestudo de biomarcadores afirmou o já esperado acréscimo dos níveis plasmáticos do BNP e urinários do cGMP (fruto da NEPI). Os doentes tratados com sacubitril/valsartan sustentaram níveis consistentemente mais baixos de NT‐proBNP (como reflexo da menor stress miocárdico) e de troponina (por menor lesão cardíaca). Enquanto substrato da NEP, os níveis plasmáticos de BNP refletem a ação do fármaco e os níveis de NT‐proBNP resultarão do seu efeito cardioprotetor, pelo que a aparente discrepância evolutiva destes biomarcadores (ao contrário do habitual curso em paralelo durante a história natural da IC), registada com o sacubitril/valsartan, é interessante e merecedora de atenção acrescida13,40.
Insuficiência cardíaca com fração de ejeção preservadaA IC com fração de ejeção preservada (IC‐FEP) é ainda um repto diagnóstico e terapêutico3. A FEVE é normal (≥50%) e os sinais e sintomas IC são, frequentemente, pouco específicos e difíceis de descriminar de outras condições clínicas, por vezes coexistentes. A perceção diagnóstica é mais usual nos idosos, com comorbilidades e sem sinais óbvios de sobrecarga de volume fluido central, mas deve ser sustentada na objetivação de disfunção cardíaca, em repouso ou durante o esforço3. O diagnóstico de IC‐FEP demanda: a presença de sintomas e/ou sinais de IC; a presença de uma FEVE «preservada»; níveis elevados de NP (BNP>0,35pg/ml e/ou NT‐proBNP>0,125pg/ml); e a comprovação de alterações – funcionais e estruturais – cardíacas.
O plano de investigação do sacubitril/valsartan abrange também a IC‐FEP. Como é reconhecido, não há, até à data, nenhum fármaco disponível com evidência sustentada na modificação do seu curso e história natural3,7. O estudo de fase IIProspective Comparison of ARNI With ARB on Management of Heart Failure With Preserved Ejection Fraction (PARAMOUNT) avaliou a segurança e eficácia do sacubitril/valsartan 200mg BID versus valsartan 160mg BID em doentes com IC‐FEP43. A aleatorização foi precedida de um período run‐in de duas semanas com placebo. O estudo incluiu 301 doentes com idade≥40 anos, história de IC sintomática medicados com diurético, FEVE≥45%, NT‐proBNP>400pg/ml, TFG≥30ml/min/1,73m2 e um potássio sérico≤5,2mmol/l, que foram tratados e seguidos durante 36 semanas43. A idade média foi de 71 anos e 57% eram mulheres; 94% tinham HTA e 38% diabetes mellitus; 42% com antecedentes de hospitalização por IC; 42% tinham história de FA e 21% de enfarte do miocárdio. A pressão arterial estava bem controlada nos dois braços (mediana 136/79mm Hg) e sem dissemelhanças na medicação basal (93% dos doentes estavam com ACEi [54%]/ARB [39%], 79% com β‐B e 21% com MRA). A avaliação ecocardiográfica inicial exibiu, em média, uma elevação da relação E/e’ e um aumento do volume indexado da aurícula esquerda, consistentes com a elevação ligeira das pressões de enchimento ventricular esquerdo.
O objetivo primário do PARAMOUNT: variação do NT‐ProBNP às 12 semanas foi significativamente superior nos doentes tratados com sacubitril/valsartan (p=0,005); o valor médio do NT‐proBNP desceu de 783 para 605pg/ml com o ARNi e de 862 para 835pg/ml com o valsartan; a diferença entre grupos reduziu‐se às 36 semanas (p=0,20). Às 36 semanas, notou‐se reversão da remodelagem auricular esquerda com sacubitril/valsartan, patenteada pela redução significativa da dimensão (p=0,03) e do volume indexado da aurícula esquerda (p=0,007), regressão não observada com o valsartan e que foram mais acentuadas nos doentes sem FA.
O declínio da TFG estimada (ao contrário do rácio de albumina/creatinina) foi significativamente menor com sacubitril/valsartan (‐1,5 versus ‐5,2ml/min/1,73m2; P=0,002). O agravamento da função renal, definido como um aumento da creatininemia>0,3mg/dl e/ou>25% entre visitas, foi menos frequente com o ARNi, embora a diferença não seja estatisticamente significativa44. Embora a redução tensional tenha sido mais pronunciada com o sacubitril/valsartan (em média, 9mm Hg na sistólica e 5mm Hg na diastólica versus 3 e 2mm Hg, respetivamente, com valsartan), não se encontrou correlação entre a variação da pressão sistólica e as alternações, observadas às 12 semanas, do NT‐proBNP e, às 36 semanas, na TFG, classe funcional NYHA e volume auricular esquerdo45. No PARAMOUNT, a dose desejada de sacubitril/valsartan e de valsartan foi alcançada em 81 e 78% dos doentes, respetivamente (o recurso a diuréticos de ansa foi maior com o valsartan). O sacubitril/valsartan foi bem tolerado. A incidência de EA graves, hipotensão, disfunção renal ou hipercaliemia não diferiu entre os dois grupos (com só um caso de angioedema com o sacubitril/valsartan)43.
Apesar do PARAMOUNT não estar dimensionado para estimar objetivos clínicos, perspetivou potenciais mercês do sacubitril/valsartan na IC‐FEP, que estudos futuros poderão ou não afirmar. Nesse sentido, foi desenhado o estudo Prospective Comparison of ARNI With ARB Global Outcomes in Heart Failure With Preserved Ejection Fraction (PARAGON‐HF), com o objetivo de avaliar o efeito de sacubitril/valsartan comparativamente ao valsartan na redução de morte CV e hospitalização por IC em doentes com IC‐FEP (NCT0192071146). A recolha de dados teve início em julho de 2014 e está prevista terminar em maio de 2019.
Perfil de segurança (tolerabilidade e efeitos adversos) e posologia do sacubitril/valsartanAs reações adversas mais frequentes (hipotensão, hipercaliemia e compromisso renal) foram já referidas e estão largamente documentadas23,24,26–28,35. No entanto, alguns aspetos merecem ser referidos e pensados42,47 e são a base do plano de gestão de risco aprovado pela EMA34,48 (Tabela 5).
Riscos relevantes potenciais e informação não disponível com sacubitril/valsartan (adaptado do sumário da EMA e de Bayes‐Genis et al13.)
| Riscos relevantes potenciais | ||
|---|---|---|
| Risco | Conhecido | Recomendado |
| Hepatotoxicidade | Metabolização hepática limitada, sugerindo risco baixo de lesão hepática | Precaução nos doentes com compromisso hepático moderado (Child‐Pugh B) ou com AST/ALT 2xLSN Contraindicado com compromisso hepático grave, cirrose biliar ou colestase (Child‐Pugh C) |
| Alteração cognitiva | NEP: uma das protéases que degradam o Aβ, componente das placas de amiloide da doença de Alzheimer* Sem evidência em macacos tratados com 300mg/kg/dia durante 39 semanas Sem maior incidência de EA cognitivos ou demência49 nos estudos realizados Em voluntários saudáveis, o sacubitrilato alcançou concentrações inibitórias da NEP no LCR, mas não causou alterações das isoformas agregáveis de Aβ (apesar do aumento da Aβ 1‐38 solúvel)51 | Avaliação da função cognitiva no PARAGON‐HF Avaliação cognitiva compreensiva e deposição cerebral de placas amiloides, por PET, no estudo na IC‐FEP |
| Interação com estatinas | Pode aumentar os níveis plasmáticos das estatinas, condicionando a ocorrência possível de efeitos adversos | Recomenda‐se precaução na coadministração com estatinas Estudo de segurança pós‐autorização de avaliação do risco de eventos relacionados em associação com estatinas na IC |
| Angioedema | Casos de angioedema (quando associado a edema da laringe pode ser fatal): 0,5 (sem compromisso das vias aéreas) versus 0,2% com enalapril (ter em conta período de run‐in e possível viés de seleção) Não foram estudados doentes com antecedentes de angioedema (e risco maior na raça negra – só≈5% nos estudos clínicos) | Se ocorrer angioedema, descontinuar imediatamente o tratamento e dar terapêutica e acompanhamento apropriados até à resolução completa e sustentada dos sinais e sintomas Contraindicado nos doentes com antecedentes de angioedema arrolado a ACEi/ARB ou com angioedema hereditário ou idiopático |
| Gravidez e aleitamento | Não há dados sobre o uso em mulheres grávidas. Estudos em animais com mostraram toxicidade reprodutiva Desconhece‐se se é excretado no leite humano (comprovado em ratos) Sem dados sobre o efeito na fertilidade humana | Uso não recomendado no 1.° trimestre e contraindicado durante o 2.°‐3.° trimestres de gravidez Não recomendado durante a amamentação pelo risco potencial para em recém‐nascidos e lactentes |
| Informação não disponível | ||
| Uso em crianças | PD/PK, segurança e eficácia não foram estabelecidas em crianças e adolescentes<18 anos com IC | Sem indicação em crianças<18 anos Estudo de dose única de fases II e III de avaliação da PK, segurança e tolerabilidade do LCZ696, seguido de estudo de 52 semanas, em comparação com enalapril, em crianças com IC |
| Compromisso renal grave | Experiência clínica muito limitada nos doentes com compromisso renal grave (TFGe<30ml/min/1,73m2) Maior risco de hipotensão com compromisso renal Não existe experiência nos doentes com doença renal terminal Pode estar associado a agravamento da função renal, que pode condicionar a titulação da dose | Avaliação e monitorização da função renal nos doentes com IC Sem ajuste posológico compromisso renal ligeiro (TFGe 60‐90ml/min/1,73m2) Considerar a dose inicial de 24mg/26mg BID com TFGe 30‐60ml/min/1,73m2 Com TFGe<30ml/min/1,73m2 usar com precaução, na dose inicial de 24mg/26mg BID Não recomendado na doença renal terminal O risco de agravamento significativo da função renal é maior com desidratação ou uso concomitante de AINE |
| Doentes naïve de ACEi/ARB | Só alguns doentes sem tratamento prévio com ACEi/ARB foram incluídos nos estudos Segurança e tolerabilidade similares nestes doentes | Dose inicial de 24/26mg BID e titulação lenta da dose (cada 3‐4 semanas) |
| Doentes com classe IV da NYHA (e outras populações) | Experiência clínica limitada (só 0,7% no PARADIGM‐HF) Sem dados robustos nos doentes hospitalizados e nos doentes com IC no contexto do enfarte do miocárdio | Precaução no início do tratamento dos doentes com classe IV da NYHA Ter em conta os critérios de inclusão e exclusão do PARADIGM‐HF, tendo em conta que os critérios dos biomarcadores não fazem parte da informação de prescrição da EMA (ou da FDA) |
| Duplo bloqueio do RAAS | Risco de angioedema na associação com ACEi Efeito desconhecido combinado com aliscireno Complexo supramolecular do NEPI e valsartan | Contraindicada a associação com ACEI Iniciar>36h após a última dose de ACEI (ou de sacubitril/valsartan); pode ser desejável um washout mais longo porque ACEi podem ter uma duração de ação prolongada Não recomendado com inibidores diretos da renina e contraindicado em doentes com diabetes mellitus ou com compromisso renal Não deve ser coadministrado com outro ARB |
| Hipotensão | Evento adverso mais comum nos estudos clínicos, sem diferença significativa como causa de interrupção do tratamento Hipotensão sintomática, especialmente em doentes≥65 anos, com doença renal ou com PAS<112mm Hg | Não iniciar o tratamento com PAS<100mm Hg e monitorização da PA no início do tratamento (ou durante o ajuste da dose) Se ocorrer hipotensão, é justificável a redução temporária ou descontinuação do tratamento e o ajuste posológico de diuréticos e de outros anti‐hipertensores e o tratamento de outras causas de hipotensão Depleção de volume e/ou de sódio deve ser corrigida antes do início do tratamento (ponderada com o risco potencial de sobrecarga de volume) |
| Alterações do K+: hipercaliemia | Pode haver um risco aumentado de hipercaliemia Também pode ocorrer hipocaliemia | Não iniciar com K+>5,4mmol/l Recomendável a monitorização do K+, especialmente nos doentes com fatores de risco (e.g. compromisso renal, diabetes mellitus, hipoaldosteronismo ou dieta rica em K+) Uso concomitante de fármacos poupadores de K+ aumenta o risco de hipercaliemia |
Aβ: amiloide beta; ACEi: inibidor da enzima de conversão da angiotensina; AINE: anti‐inflamatório não esteroide; ALT: alanina aminotransferase; AST: aspartato de aminotransferase; ARB: antagonista do recetor da angiotensina II; BID: duas tomas diárias; K+: potássio sérico; LSN: limite superior do normal; IC‐FEP: insuficiência cardíaca com fração de ejeção preservada; NEP: neprilisina; NEPI: inibidor da neprilisina; PAS: pressão arterial sistólica; PD: farmacodinâmica; PK: farmacocinética; TFGe: taxa de filtração glomerular estimada.
A enzima conversora da angiotensina (ACE) também degrada os péptidos β amiloides, pelo que a ACEi pode também – teoricamente – favorecer a acumulação da Aβ23.
A dose inicial habitual recomendada de sacubitril/valsartan é de 49/51mg BID. A dose deve ser duplicada cada 2‐4 semanas até se atingir à dose alvo de 97/103mg BID, de acordo com o tolerado34,50. Nos doentes com PAS≤95mm Hg, hipotensão sintomática, hipercaliemia ou disfunção renal, é desejável o ajuste posológico da medicação concomitante, a redução temporária da dose ou mesmo a eventual descontinuação do tratamento (nos doentes com PAS≥100‐110mm Hg e, em alguns casos, nos idosos é útil ponderar a dose inicial de 24/26mg, BID). O tratamento com sacubitril/valsartan não deve ser encetado nos doentes com um potássio sérico>5,4mmol/l ou com uma pressão arterial sistólica (PAS)<100mm Hg (Tabela 5). Da mesma forma, o tratamento não deve ser coadministrado com um ACEi ou ARB e também só deve ser começado, pelo menos, 36h após a paragem do ACEi (devido ao risco potencial de angioedema, que não deve ser desvalorizado, disfunção renal e hipercaliemia)52.
Sacubitril/valsartan no puzzle terapêutico atual: conclusãoA evidência clínica sustenta as indicações aprovadas, pelos organismos tutelares28,34,53–55, para o sacubitril/valsartan. Parece, no entanto, limitativa a afirmação categórica dos critérios de inclusão e de exclusão aplicados no PARADIGM‐HF na decisão terapêutica. O sacubitril/valsartan é um medicamento inovador que alarga e abona o princípio da modulação farmacológica neuro‐hormonal na IC e que vem preencher uma lacuna, com valor acrescentado, da melhor terapêutica disponível na IC‐FER crónica sintomática (na certeza que se devem manter as outras classes farmacológicas [β‐B, MRA, ivabradina e digoxina] e dispositivos [CDI, TRC], conforme apropriado, de acordo com as recomendações científicas)3,7–9. Na Tabela 6 sumariamos as indicações aprovadas e as diretrizes internacionais para o uso de sacubitril/valsartan no tratamento da IC‐FER.
Indicações aprovadas e advogadas nas recomendações científicas para o uso do sacubitril/valsartan no tratamento da IC‐FER
| Organismo | Indicação | Referência |
|---|---|---|
| European Medicines Agency (EMA) | (…) indicado em doentes adultos para o tratamento da insuficiência cardíaca crónica sintomática com fração de ejeção reduzida | (28) |
| U S Food and Drug Administration (FDA) | (…) indicado na redução do risco de morte cardiovascular e hospitalização por insuficiência cardíaca em doentes com insuficiência cardíaca crónica (NYHA classe II‐IV) e fração de ejeção reduzida (…) normalmente administrado em conjunção com outros tratamento da insuficiência cardíaca, substituindo um ACEi ou outro ARB | (53) |
| The National Institute for Health and Care Excellence (NICE) | (…) recomendado como opção no tratamento da IC‐FER sintomática, só em doentes: • com classe II ‐ IV NYHA e • com FEVE≤35% e • que já estão com dose estável de ACEi ou ARB (…) encetado por um especialista em IC, integrado numa equipa multidisciplinar, que deve realizar a titulação da dose e a sua monitorização | (54) |
| 2016 European Society of Cardiology (ESC, com Heart Failure Association (HFA) da ESC | (…) recomendado em substituição de um ACEi para maior redução do risco de hospitalização por IC e de morte em doentes com IC‐FER em ambulatório, que permanecem sintomáticos apesar do tratamento otimizado com ACEi, bloqueador beta‐adrenérgico e MRA (nível de evidência: I‐B) | (3) |
| 2016 American College of Cardiology (ACC)/American Heart Association (AHA) Task Force on Clinical Practice Guidelines and the Heart Failure Society of America (HFSA) | A estratégia clínica de inibição do RAAS com ACEi (nível de evidência: A) ou ARB (nível de evidência: A) ou ARNi (nível de evidência: B‐R), em conjunto com β‐B e antagonistas da aldosterona, em doentes selecionados, é recomendado nos doentes IC‐FER crónica na redução da morbilidade e da mortalidade – classe de recomendação 1 Nos doentes com IC‐FER crónica sintomática classe II ou III NYHA, que toleram um ACEi/ARB, a substituição pelo ARNi é recomendado para maior redução da morbilidade e da mortalidade – classe de recomendação 1 | (8) |
| 2014‐16 Canadian Cardiovascular Society | (…) nos doentes com IC ligeira a moderada, FEVE<40%, NP elevados ou hospitalização por IC nos últimos 12 meses, K+<5,2mmol/l e TFG 30ml/min, tratados com doses adequadas otimizada, devem ser tratados com sacubitril/valsartan em vez de ACEi/ARB (…) (recomendação condicional; evidência alta) Depois da titulação da terapêutica tripla na IC com FEVE<40%, a presença de níveis aumentados de NP pode levar à mudança do ACEi (ou ARB) terapia para sacubitril/valsartan | (9,55) |
ACEi: inibidor da enzima de conversão da angiotensina; ARB: antagonista do recetor da angiotensina II; ARNi: antagonista do recetor da angiotensina‐inibidor da neprilisina; β‐B: bloqueadores beta‐adrenérgicos; FEVE: fração de ejeção do ventrículo esquerdo; K+:potássio sérico; IC‐FER: insuficiência cardíaca com fração de ejeção reduzida; NP: péptidos natriuréticos; NYHA: New York Heart Association; TFG: taxa de filtração glomerular.
A morbilidade e mortalidade associadas à IC‐FER – mesmo em doentes discretamente sintomáticos e com terapêutica médica adequada e estabilizada – permanecem elevadas. A taxa de sobrevivência aos cinco anos por IC é maior do que a registada com muitos dos cancros e os custos anuais, económicos, sociais e humanos, muito elevados. Há, assim, um imperativo ético de alterar esta situação, tanto a nível da prevenção primária como da secundária (e terciária). Recentemente, o Programa Nacional para as Doenças Cérebro Cardiovasculares, em parceria com a Fundação para a Ciência e a Tecnologia, anunciou o seu apoio à primeira Joint Transnational Call (JTC2016) do projeto europeu ERA‐CVD: ERA‐Net on Cardiovascular Diseases que versará, entre outros, o reconhecimento precoce e prognóstico da IC e as abordagens inovadoras de prevenção e tratamento (e de reversão ao processo de remodelação cardíaca)56. Eis um bom momento para refletirmos e inscrevermos na nossa prática clínica os resultados do PARADIGM‐HF. A maior subtileza e celeridade na adoção do sacubitril/valsartan no armamentário terapêutico da IC‐FER (e, no futuro, talvez da IC‐FEP) dependem, naturalmente, de fatores muito diversos – que passam também por análises de custo efetividade justas e fundadas. Este artigo de revisão é só um pequeno contributo.
ContribuiçõesApós a aprovação do projeto do artigo, proposto por PMS, os autores participaram, igualmente, no desenvolvimento, redação e aceitação do manuscrito final para publicação.
Conflito de interessesOs autores declaram não haver conflito de interesses.
AgradecimentosOs autores agradecem a colaboração do Departamento Médico da Novartis Farma – Produtos Farmacêuticos S.A, na pessoa do Dr. Daniel Brás, no apoio a toda a pesquisa bibliográfica necessária.
Diz‐se do ácido que pode libertar dois protões por molécula (Dicionário da Língua Portuguesa. Porto: Porto Editora, 2003‐2016) [consultado em 16 de julho de 2016]. Disponível na Internet: http://www.infopedia.pt/dicionarios/lingua‐portuguesa/diprótico).