O feocromocitoma é um tumor originário do tecido cromafim. Habitualmente apresenta‐se por sinais e sintomas de excesso de catecolaminas, tais como hipertensão arterial, taquicardia, cefaleias e sudorese. Das manifestações cardiovasculares inclui‐se a miocardiopatia induzida por catecolaminas, que pode apresentar‐se sob a forma de disfunção ventricular esquerda grave e insuficiência cardíaca congestiva. Relatamos o caso de um homem a quem foi diagnosticado feocromocitoma na investigação de um quadro de miocardiopatia dilatada. Realça‐se neste doente a dramática reversão da miocardiopatia, com melhora sintomática e recuperação da função do ventrículo esquerdo após o tratamento.
Pheochromocytoma is a tumor originating from chromaffin tissue. It commonly presents with symptoms and signs of catecholamine excess, such as hypertension, tachycardia, headache and sweating. Cardiovascular manifestations include catecholamine‐induced cardiomyopathy, which may present as severe left ventricular dysfunction and congestive heart failure. We report a case of pheochromocytoma which was diagnosed following investigation of dilated cardiomyopathy. We highlight the dramatic symptomatic improvement and reversal of cardiomyopathy, with recovery of left ventricular function after treatment.
Homem de 40 anos, aparentemente saudável até cerca de três meses antes da ida ao serviço de urgência (SU), quando inicia tosse noturna não produtiva, emagrecimento (cerca de 10‐15 kg durante os três meses), anorexia e dispneia para esforços progressivamente menores. Dos antecedentes pessoais destacam‐se apenas, desde há vários anos, esporádicas determinações de hipertensão arterial ligeira que não valorizava, hipersudorese e frequência cardíaca (FC) persistentemente elevada.
Recorreu ao seu médico assistente que o referenciou para o centro de diagnóstico pneumológico da área de residência por suspeita de patologia pulmonar, entre as quais tuberculose ou pneumonia atípica. Efetuou exames complementares que foram inconclusivos e iniciou antibioterapia com ausência de resposta a vários antibióticos (amoxicilina com ácido clavulânico, claritromicina e levofloxacina), apesar de apenas um episódio de febre documentada (39,0°C de temperatura axilar) sob antibioterapia. O doente manteve as queixas e iniciou crises de dispneia paroxística noturna, ortopneia, palidez, aperto torácico e intensa diaforese, com agravamento progressivo que motivaram a ida ao SU e consequente internamento hospitalar.
Ao exame objetivo apresentava‐se ansioso, apirético mas hipersudorético, pálido, hidratado e anictérico. A pressão arterial era 178/119mmHg, FC de 113bpm, frequência respiratória de 20cpm, saturação periférica de oxigénio de 92% com oxigenoterapia por óculos nasais a 2L/min, sem ingurgitamento jugular a 45°. À auscultação cardiopulmonar apresentava‐se taquicárdico, sem sopros cardíacos audíveis, com fervores crepitantes na metade inferior de ambos os hemitórax. Abdómen sem alterações. Membros inferiores sem sinais de edema ou trombose venosa profunda.
O eletrocardiograma (ECG) apresentava taquicardia sinusal com FC de 104bpm e prolongamento do intervalo QT (QTc=488ms). A telerradiografia torácica mostrava infiltrado intersticial bilateral com apagamento do seio costofrénico direito.
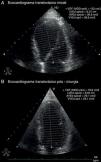
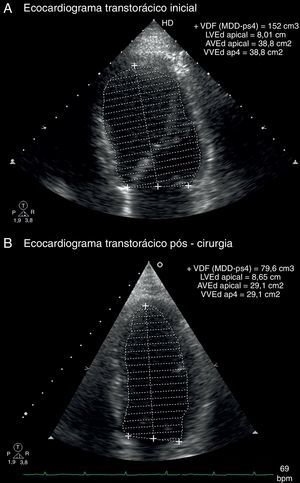
O ecocardiograma transtorácico revelou um ventrículo esquerdo dilatado e globalmente hipocinético com fração de ejeção de 37%, com aurícula esquerda ligeiramente dilatada (Tabela 1 e Figura 1). O valor de NT‐proBNP na admissão era de 7.678pg/mL.
Parâmetros ecocardiográficos: antes da terapêutica e dois meses pós‐cirurgia
| Parâmetro | Pré‐terapêutica | Dois meses pós‐cirurgia |
| DDVE/ASC (cm/m2) | 3,3 | 2,8 |
| DSVE/ASC (cm/m2) | 2,7 | 2,0 |
| VTS/ASC (mL/m2) | 84 | 39 |
| VTS/ASC (mL/m2) | 53 | 16 |
| FEj (%) | 37 | 58 |
DDVE/ASC: dimensão diastólica do ventrículo esquerdo indexado à área de superfície corporal; DSVE/ASC: diâmetro sistólico do ventrículo esquerdo indexado à área de superfície corporal; FEj: fração de ejeção ventricular esquerda; VTD/ASC: volume telediastólico do ventrículo esquerdo indexado à área de superfície corporal; VTS/ASC: volume telesisstólico do ventrículo esquerdo indexado à área de superfície corporal.
Após instituição da terapêutica farmacológica para a insuficiência cardíaca, com inibidores da enzima conversora de angiotensina, diuréticos e nitratos endovenosos, verificou‐se melhoria ligeira do quadro clínico, nomeadamente da dispneia, ortopneia e dispneia paroxística noturna. Apesar da terapêutica, não se obteve controlo dos níveis de pressão arterial e da FC, mantendo‐se com hipertensão arterial e taquicardia sinusal.
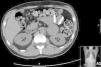
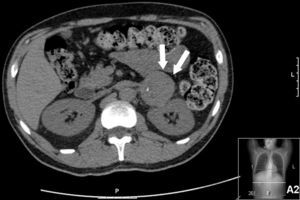
Fez tomografia axial computadorizada (TAC) tóraco‐abdominal que demonstrou ligeiras alterações esclerofibróticas apicais, infiltrados em vidro despolido disseminados, com espessamento dos septos interlobulares, adenopatia subcarinal com 1,5cm de diâmetro, engurgitamento hilar bilateral, derrame pleural bilateral com componente intercisural e massa sólida hipodensa em contiguidade com a glândula suprarrenal esquerda, com calcificação no interior, de limites relativamente bem definidos embora com ligeira densificação estriada da gordura adjacente, medindo cerca de 4,5x5,5cm (Figura 2).
Perante a suspeita diagnóstica de feocromocitoma, efetuou doseamento das catecolaminas plasmáticas e urinárias e seus metabolitos. A avaliação analítica demonstrou aumento de todas as catecolaminas plasmáticas e na urina de 24 horas verificou‐se aumento das normetanefrinas urinárias e da adrenalina, com metanefrinas normais (Tabela 2).
Valores dos doseamentos das catecolaminas plasmáticas e urinárias e dos seus metabolitos na avaliação inicial
| Análise | Resultado | Valor de referência |
| Catecolaminas plasmáticas | ||
| Adrenalina (pg/mL) | 160,2 | <100 |
| Noradrenalina (pg/mL) | 10.058,0 | <600 |
| Dopamina (pg/mL) | 827,7 | <100 |
| Catecolaminas totais | 11.045,9 | <800 |
| Catecolaminas urinárias | ||
| Adrenalina (μg/24h) | Abaixo do nível deteção | |
| Noradrenalina (μg/24h) | 1.943,9 | 12,1‐85,5 |
| Dopamina (μg/24h) | 187,8 | 0‐498 |
| Normetanefrina (μg/24h) | 6.002,9 | 105‐354 |
| Metanefrina (μg/24h) | 180,6 | 74‐297 |
| Ácido vanilmandélico (mg/24h) | 24,9 | 1,8‐6,7 |
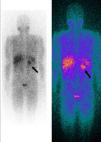
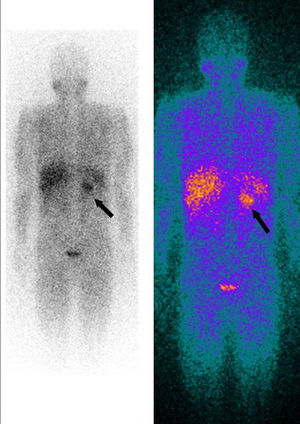
A cintigrafia de corpo com I123‐metaiodobenzilguanidina (MIBG) revelou a existência de hiperfixação nodular com aproximadamente de 3‐4cm de diâmetro a nível da suprarrenal esquerda, na mesma localização da massa observada na TAC abdominal, consistente com o diagnóstico de feocromocitoma. Não se detetavam outras zonas de hiperfixação anómalas (Figura 3).
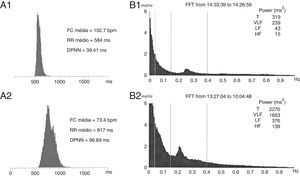
Efetuou um ECG de Holter de 24 horas (Figura 4) que demonstrou ritmo de base sinusal com FC variando entre 74‐123bpm, com FC média do registo de 103bpm e variabilidade da FC muito diminuída (desvio‐padrão dos intervalos RR normais [DPNN]=39ms). Na análise da variabilidade da FC no domínio da frequência verifica‐se quase abolição do componente de alta frequência (HF) (HF=15ms2) e de baixa frequência (LF) (LF=43ms2).
A) Histograma dos intervalos RR de ECG de Holter 24 horas: A1) inicial e A2) pós‐cirurgia. B) Variabilidade da FC no domínio da frequência: B1) inicial e B2) pós‐cirurgia. DPNN: desvio‐padrão dos intervalos RR normais. Verifica‐se um aumento do DPNN de 39ms para 97ms entre os dois exames. Verifica‐se ainda que previamente à cirurgia havia uma quase abolição com componente de HF (HF=15ms2) e da LF (LF=43 ms2). Após a cirurgia registou‐se uma recuperação do componente de HF (HF=139 ms2) e da LF (LF=376ms2).
A monitorização ambulatória da pressão arterial (MAPA) demonstrou elevação dos valores tensionais médios sisto‐diastólicos das 24 horas (pressão arterial sistólica média das 24 horas de 143mmHg e pressão arterial diastólica média de 92mmHg), com perfil circadiano não dipper (descida da pressão arterial noturna de 7%).
O doente iniciou tratamento médico pré‐operatório com hidratação e bloqueio farmacológico dos recetores alfa e beta‐adrenérgicos. O bloqueio alfa‐adrenérgico pré‐operatório fez‐se com titulação progressiva da fenoxibenzamina (até à dose de 90mg/dia). Posteriormente adicionou‐se bisoprolol (5mg) com controlo tensional e redução marcada da sudorese.
O doente foi submetido a adrenalectomia esquerda por via laparoscópica, sem alterações hemodinâmicas significativas durante a cirurgia. Foi removida uma peça nodular de 7x4x3,7cm, revestido por tecido adiposo com 0,4‐1,3cm de espessura. O exame anatomopatológico confirmou o tumor suprarrenal como feocromocitoma. Apesar do procedimento operatório decorrer sem intercorrências, no pós‐operatório, o doente teve hipotensão que reverteu com terapêutica com cristaloides endovenosos. Teve alta medicado com furosemida 40mg/dia, espironolactona 25mg/dia, carvedilol 18,75mg/dia e enalapril 2,5mg/dia.
No seguimento, não se registou evidência bioquímica ou radiológica de feocromocitoma. Do ponto de vista analítico verificou‐se normalização dos valores séricos de NT‐proBNP para valores inferiores a 20pg/mL. O ECG de Holter de 24 horas efetuado duas semanas após a cirurgia (Figura 4) demonstrou ritmo de base sinusal com FC média bastante inferior (73bpm) à do exame prévio e variabilidade da FC aumentada em relação ao basal (DPNN=97ms). Na análise da variabilidade da FC no domínio da frequência havia recuperação do componente de HF (HF=139ms2) e de LF (LF=376ms2). O ecocardiograma transtorácico efetuado dois meses depois da cirurgia revelou uma normalização das dimensões da cavidade do ventrículo esquerdo e recuperação da função sistólica ventricular esquerda (Tabela 1; Figura 3). Perante a reversibilidade do quadro clínico de miocardiopatia e encontrando‐se o doente assintomático, foi possível suspender toda a medicação em ambulatório.
DiscussãoOs feocromocitomas são tumores neuroectodérmicos secretores de catecolaminas, de localização mais frequente na medula suprarrenal, sendo a localização extra‐adrenal designada por paraganglioma. A incidência é de aproximadamente 1‐8 por milhão na população em geral, de 0,1% nos idosos e de 0,1‐0,6% na população geral de doentes com hipertensão arterial. É uma causa comum de «incidentaloma» suprarrenal, responsável por 4‐6,5% desses tumores. Os feocromocitomas podem ser esporádicos ou familiares. Os esporádicos são geralmente diagnosticados entre os 40‐50 anos, enquanto as formas hereditárias, por exemplo as associadas à neoplasia endócrina múltipla tipo 2, à neurofibromatose tipo 1 ou à síndrome de Von Hippel‐Lindau, apresentam‐se na infância ou na idade adulta e na maioria dos casos exigem testes genéticos. Os feocromocitomas podem ser isolados ou múltiplos. São habitualmente benignos havendo também formas malignas1,2.
Os feocromocitomas tinham anteriormente uma mortalidade muito elevada (25‐40%) que foi reduzida a menos de 2% na atualidade, principalmente devido à compreensão da fisiologia das catecolaminas e a uma preparação pré‐operatória adequada1.
A hipertensão arterial, a taquicardia, a palidez, as cefaleias e a ansiedade habitualmente dominam o quadro clínico, embora nem todos os doentes sejam sintomáticos. Tem sido postulado que a ausência de hipertensão em certos doentes com feocromocitoma é secundária a secreção predominante de adrenalina, a inativação de noradrenalina no interior do tumor ou a tolerância dos recetores teciduais para as catecolaminas circulantes3. No nosso doente, as catecolaminas plasmáticas eram ambas elevadas, mas mais acentuadamente a noradrenalina.
Os feocromocitomas têm sido associados a diversas complicações cardiovasculares, incluindo a hipertrofia ventricular esquerda, doença isquémica cardíaca, enfarte do miocárdio, arritmias cardíacas, miocardiopatia de stress do tipo síndrome de Takotsubo, insuficiência cardíaca por miocardiopatia dilatada e choque. As complicações cardiovasculares graves e potencialmente letais destes tumores são devidas aos potentes efeitos das catecolaminas, especialmente da noradrenalina, o principal neurotransmissor libertado dos terminais dos nervos simpáticos4.
Nos doentes com feocromocitoma podem ocorrer diversas alterações do ritmo, da condução e da repolarização ventricular no ECG. O nosso doente apresentava a nível eletrocardiográfico taquicardia sinusal e prolongamento do intervalo QT. As anormalidades paroxísticas marcantes da repolarização ventricular, consistindo no prolongamento acentuado do intervalo QT, bem como ondas T invertidas, são frequentemente observadas em doentes com feocromocitoma, podendo dar origem a arritmias ventriculares malignas4,5.
A avaliação da variabilidade da FC fornece informação sobre a função do sistema nervoso autónomo, de forma não invasiva, nos doentes com feocromocitoma. O desvio‐padrão dos intervalos RR normais (DPNN) é um dos parâmetros que refletem a atividade autonómica. O valor baixo do DPNN bem como a quase abolição dos componentes de HF e de LF explicam‐se pela inibição do sistema nervoso simpático central com o aumento prolongado das catecolaminas plasmáticas6.
O achado mais ecocardiográfico mais comum nos doentes com feocromocitoma é uma função sistólica ventricular esquerda normal ou elevada, sendo a prevalência de miocardiopatia induzida por catecolaminas nestes doentes apenas de cerca de 10%7. No final dos anos 80 foram pela primeira vez relatadas as características ecocardiográficas da miocardiopatia induzida por catecolaminas associada ao feocromocitoma8. Os mecanismos potenciais propostos para o balonismo ventricular esquerdo transitório incluem: disfunção microvascular das artérias coronárias, espasmo multiarterial epicárdico, alteração do metabolismo de ácidos gordos, miocardite e disfunção do miocárdio mediada por catecolaminas7. Estão descritos vários casos em que a primeira manifestação de feocromocitoma é a miocardiopatia de stress do tipo síndrome de Takotsubo com a reversibilidade das alterações da motilidade segmentar após a ressecção do tumor, sendo recomendado que, perante um quadro de síndrome de Takotsubo, se deva excluir a presença de feocromocitoma9.
O prognóstico da miocardiopatia induzida por catecolaminas associada a feocromocitoma depende da identificação precoce e do tratamento médico e cirúrgico atempado. Os exames para diagnóstico em doentes com suspeita de feocromocitoma incluem determinações das catecolaminas urinárias e plasmáticas e das metanefrinas urinárias (normetanefrina e metanefrina). No entanto, uma vez que a libertação de catecolaminas é muitas vezes paroxística, uma única determinação pode dar uma falsa sensação de segurança. A sensibilidade pode ser melhorada através da repetição das análises, duas ou mais vezes, e, especialmente, na sequência de um episódio paroxístico.
A localização pré‐operatória do feocromocitoma pode ser realizada por uma variedade de estudos de imagiologia, tais como TAC, ressonância magnética (RM) ou cintigrafia com I123‐MIBG. A TAC tem sensibilidade e especificidade superiores a 90% na localização primária do feocromocitoma suprarrenal, no entanto, é menos precisa na deteção destes tumores noutras localizações. A RM ponderada em T2, com 91‐100% de sensibilidade e 50‐97% de especificidade, fornece detalhes anatómicos excelentes e é mais precisa do que a TAC na localização de paragangliomas. A I123‐MIBG radiomarcada, que é estruturalmente semelhante à noradrenalina, é seletivamente absorvida e concentra‐se no tecido cromafim. Com uma sensibilidade de 77‐91% e uma especificidade de 96‐100%, é o teste de escolha para a localização de tumores fora da suprarrenal, não detetados em TAC ou RM10.
A cirurgia eletiva é o tratamento de escolha para o feocromocitoma e deve ser acompanhada por um tratamento pré‐operatório médico adequado durante cerca de 10‐14 dias. No entanto, em condições extremas (por exemplo, choque devido a uma necrose hemorrágica ou rutura de um feocromocitoma), onde a estabilização hemodinâmica e o pré‐tratamento médico adequado não são possíveis, a ressecção de emergência do tumor pode ser a única opção11.
A preparação farmacológica pré‐operatória e a correta hidratação para expansão do volume intravascular são os fatores‐chave para a melhoria do prognóstico da doença, tendo permitido reduzir a mortalidade perioperatória do feocromocitoma para menos de 2%. A estratégia habitual inclui o bloqueio inicial dos recetores adrenérgicos alfa. A fenoxibenzamina é o fármaco alfa‐bloqueante mais frequentemente utilizado, uma vez que bloqueia os recetores adrenérgicos alfa de forma não competitiva. Os beta‐bloqueantes são adicionados após os primeiros dias de bloqueio dos recetores adrenérgicos alfa, especialmente necessários quando ocorrem taquiarritmias induzidas pelas catecolaminas. Os beta‐bloqueantes nunca devem ser administrados na ausência de um bloqueio alfa‐adrenérgico eficaz porque podem agravar os episódios hipertensivos ao exacerbar a vasoconstrição em virtude da inibição da vasodilatação mediada pelos recetores adrenérgicos beta‐2. Atualmente são mais utilizados os beta‐bloqueantes cardiosseletivos, com atividade predominante sobre os recetores adrenérgicos beta‐110.
A adrenalectomia por via laparoscópica tornou‐se a abordagem habitual para a patologia benigna da glândula suprarrenal, uma vez que reduz a morbilidade pós‐operatória, os dias de internamento e os custos, em comparação com laparotomia. Um estudo recente demonstrou que a adrenalectomia laparoscópica dos feocromocitomas de dimensões superiores a 6cm em doentes sem evidência radiológica de neoplasia maligna é viável e segura, com resultados comparáveis aos de menores dimensões. Não houve diferenças significativas nas complicações intraoperatórias, perda estimada de sangue, diagnóstico de neoplasia maligna ou recorrência entre os dois grupos. O tempo de internamento foi comparável e não houve incidentes de invasão capsular ou eventos cardiovasculares adversos12.
Após a cirurgia, os doentes precisam de estar sob vigilância apertada durante as primeiras 24 horas. As duas principais complicações pós‐operatórias são a hipotensão e a hipoglicemia. A hipotensão pós‐operatória é devida à queda abrupta das catecolaminas circulantes após a remoção do tumor na presença contínua de bloqueio dos recetores adrenérgicos alfa, tal como aconteceu com o doente do caso clínico. O risco de hipoglicemia está relacionado com a hiperinsulinemia pela recuperação da libertação de insulina após a remoção do tumor.
Os doentes que se apresentam com insuficiência cardíaca aguda têm a possibilidade de experimentar um pior prognóstico em consequência de lesões focais extensas do miocárdio. No entanto, tem sido demonstrado que a miocardiopatia induzida por catecolaminas é potencialmente reversível após a remoção cirúrgica de um feocromocitoma13,14.
ConclusõesO diagnóstico diferencial rápido num doente jovem apresentando um quadro de insuficiência cardíaca congestiva por miocardiopatia dilatada grave conduziu a procedimentos diagnósticos analíticos e imagiológicos que revelaram um feocromocitoma.
A preparação farmacológica pré‐operatória e a abordagem cirúrgica por via laparoscópica permitiram a remoção com êxito do tumor e, em poucas semanas, houve reversão completa do quadro clínico, normalização progressiva da função ventricular esquerda e da disfunção do sistema nervoso autónomo, evidenciada pela recuperação da variabilidade da FC avaliada por ECG de Holter de 24 horas. Destacamos por isso a importância de incluir o feocromocitoma no diagnóstico diferencial nos doentes jovens com miocardiopatia de etiologia não esclarecida e sinais e sintomas de excesso de catecolaminas.
Responsabilidades éticasProteção dos seres humanos e animaisOs autores declaram que os procedimentos seguidos estavam de acordo com os regulamentos estabelecidos pelos responsáveis da Comissão de Investigação Clínica e Ética e de acordo com os da Associação Médica Mundial e da Declaração de Helsinki.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos de seu centro de trabalho acerca da publicação dos dados de pacientes e que todos os pacientes incluídos no estudo receberam informações suficientes e deram o seu consentimento informado por escrito para participar nesse estudo.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesOs autores declaram não haver conflito de interesses.