Atualmente, não existem estudos prospetivos aleatorizados que permitam definir a estratégia de revascularização ideal quanto ao tipo e timing da sua realização, em doentes com síndrome coronária aguda (SCA) sem supradesnivelamento do segmento ST (SCAsSST) e doença coronária multivaso (DCMV).
ObjetivosComparar os eventos adversos a curto e a longo prazo da revascularização multivaso versus revascularização apenas da artéria culprit em doentes com SCAsSST e DCMV.
MétodosEste estudo observacional retrospetivo incluiu todos os doentes com SCAsSST e DCMV submetidos a intervenção coronária percutânea (ICP), entre janeiro de 2010 e junho de 2013 (n=232). Após exclusão dos doentes com história de cirurgia de revascularização miocárdica (n=30), a estratégia de revascularização multivaso foi adotada em 35,1% (n=71) dos doentes; nos restantes 64,9% (n=131) procedeu‐se à revascularização apenas da artéria culprit. Após propensity score matching (PSM), obtiveram‐se dois grupos de 66 doentes, emparelhados de acordo com a estratégia de revascularização.
ResultadosDurante o seguimento (1543±545 dias), após PSM, os pacientes submetidos a revascularização multivaso tiveram menores taxas de reenfarte (4,5 versus 16,7%; log‐rank p=0,018), revascularização não planeada (RVNP; 6,1 versus 16,7%; log‐rank p=0,048), ICP não planeada (3,0 versus 13,6%; log‐rank p=0,023) e do endpoint combinado de morte, reenfarte e RVNP (16,7 versus 31,8%; log‐rank p=0,046).
ConclusãoNesta população de pacientes do mundo real com SCAsSST e DCMV, a revascularização multivaso associou‐se a menores taxas de reenfarte, RVNP e ICP não planeada, bem como a uma redução do endpoint combinado de morte, reenfarte e RVNP.
There have been no prospective randomized trials that enable the best strategy and timing to be determined for revascularization in patients with non‐ST‐segment elevation acute coronary syndrome (NSTE‐ACS) and multivessel coronary artery disease (CAD).
ObjectivesTo compare short‐ and long‐term adverse events following multivessel vs. culprit‐only revascularization in patients with NSTE‐ACS and multivessel CAD.
MethodsThis was a retrospective observational study that included all patients diagnosed with NSTE‐ACS and multivessel CAD who underwent percutaneous coronary intervention (PCI) between January 2010 and June 2013 (n=232). After exclusion of patients with previous coronary artery bypass grafting (n=30), a multivessel revascularization strategy was adopted in 35.1% of patients (n=71); in the others (n=131, 64.9%), only the culprit artery was revascularized. After propensity score matching (PSM), two groups of 66 patients were obtained, matched according to revascularization strategy.
ResultsDuring follow‐up (1543±545 days), after PSM, patients undergoing multivessel revascularization had lower rates of reinfarction (4.5% vs. 16.7%; log‐rank p=0.018), unplanned revascularization (6.1% vs. 16.7%; log‐rank p=0.048), unplanned PCI (3.0% vs. 13.6%; log‐rank p=0.023) and the combined endpoint of death, reinfarction and unplanned revascularization (16.7 vs. 31.8%; log‐rank p=0.046).
ConclusionsIn real‐world patients presenting with NSTE‐ACS and multivessel CAD, a multivessel revascularization strategy was associated with lower rates of reinfarction, unplanned revascularization and unplanned PCI, as well as a reduction in the combined endpoint of death, reinfarction and unplanned revascularization.
A prevalência de doença coronária multivaso (DCMV) significativa nos doentes com síndrome coronária aguda sem supradesnivelamento do segmento ST (SCAsSST) foi reportada como sendo cerca de 50%1. Segundo as atuais recomendações, os doentes com SCAsSST e DCMV deverão ser preferencialmente revascularizados de forma completa, embora o conhecido impacto prognóstico negativo da revascularização incompleta se baseie apenas em estudos observacionais2–4. Nos doentes com anatomia coronária complexa, a revascularização completa, quer seja percutânea, quer seja cirúrgica, pode comportar riscos excessivos e, por isso, a sua realização deve ser ponderada de acordo com a idade, comorbilidades e condição clínica geral do paciente.
Atualmente, não existem estudos prospetivos aleatorizados que permitam definir uma estratégia de revascularização ideal quanto ao tipo (multivaso versus apenas da artéria culprit; completa versus incompleta) e timing da sua realização (revascularização em tempo único versus revascularização faseada), nos doentes com SCAsSST e DCMV2. Embora não seja possível realizar uma extrapolação direta, foram recentemente publicados alguns estudos clínicos que mostraram um benefício da revascularização completa versus revascularização apenas da artéria culprit em doentes com DCMV e síndrome coronária aguda com supradesnivelamento do segmento ST5–8, sugerindo que pelo menos essa estratégia deva também ser avaliada de forma prospetiva nos doentes com SCAsSST.
O principal objetivo deste estudo foi comparar o prognóstico e os eventos adversos a curto e a longo prazo da revascularização multivaso versus revascularização da artéria culprit, antes e após a realização de um propensity score matching (PSM), numa população do mundo real com SCAsSST e DCMV.
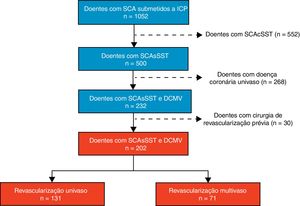
MétodosEste foi um estudo observacional, de desenho longitudinal retrospetivo, que incluiu pacientes com o diagnóstico de síndrome coronária aguda (SCA) que foram submetidos a intervenção coronária percutânea (ICP) no Laboratório de Hemodinâmica do Hospital de Braga e registados no Registo Nacional de SCA, desde janeiro de 2010 até junho de 2013 (n=1052), de forma a se poder realizar um seguimento clínico mínimo de três anos. A apresentação clínica dos doentes foi sensivelmente bipartida entre a SCAsSST (n=500, 47,5%) e a SCA com elevação do segmento ST (n=552, 52,5%). Dos doentes com SCAsSST, cerca de 94% (n=470) apresentaram enfarte agudo do miocárdio sem supradesnivelamento do segmento ST e os restantes 6% (n=30) angina instável. Entre os doentes com SCAsSST, a prevalência de DCMV foi de 46,4% (n=232); os restantes 53,6% (n=268) tinham apenas doença coronária de um vaso.
População de estudo e seguimentoDe forma a analisar o impacto da revascularização multivaso versus revascularização da artéria culprit (ou univaso), os pacientes com DCMV e história prévia de cirurgia de revascularização miocárdica (n=30), pela complexidade anatómica que apresentam, foram excluídos, como ilustrado na Figura 1. A população de estudo consistiu em 202 doentes com SCAsSST e DCMV, dos quais 35,1% (n=71) foram submetidos a revascularização multivaso (70 foram revascularizados por ICP e apenas um por cirurgia de revascularização do miocárdio) e 64,9% (n=131) foram submetidos a revascularização apenas da artéria culprit (todos eles através de ICP). A decisão de realizar revascularização coronária de artérias não‐culprit e o seu timing foram determinados pelo cardiologista de intervenção e pelo cardiologista clínico, ou pela Heart Team quando apropriado.
A ICP foi realizada de acordo com as orientações da Sociedade Europeia de Cardiologia e a prática clínica dos intervencionistas, e incluiu a administração de heparina de baixo peso molecular ou heparina não fracionada, o uso de inibidores da glicoproteína IIb/IIIa e, em raros casos, a trombectomia de aspiração. A terapêutica antiplaquetária incluiu a aspirina e um inibidor P2Y12 (na maioria dos casos clopidogrel).
Foi colhida informação referente à estratégia de revascularização, incluindo o tipo (multivaso versus univaso; completa versus incompleta), a realização de teste de isquemia, os motivos para efetuar ou não efetuar revascularização multivaso, o timing da revascularização e as artérias coronárias revascularizadas ou por revascularizar.
Foram colhidos e registados, numa base de dados computorizada, dados demográficos, clínicos, laboratoriais, ecocardiográficos e angiográficos. Esta informação foi obtida através do processo clínico do doente, com recurso aos sistemas informáticos de gestão de informação médica Glintt®, SimmaCardio®, SClínico® e PDS®. Foram também obtidos e assinalados dados relativamente ao prognóstico e aos eventos adversos a curto (mortalidade intra‐hospitalar, angor residual ou de novo, reenfarte, bloqueio auriculoventricular≥2.° grau, acidente vascular cerebral, trombose intra‐sent e complicações mecânicas) e a longo prazo (mortalidade, reenfarte, revascularização não planeada, ICP não planeada, acidente vascular cerebral e insuficiência cardíaca).
O seguimento foi efetuado através da consulta do processo clínico do doente, com recurso aos sistemas informáticos descritos acima. Todas as avaliações médicas e registos hospitalares foram revistos. O seguimento médio foi de 1542±554 dias, a mediana de 1520 dias e a variação interquartil de 704 dias.
DefiniçõesO diagnóstico de SCAsSST foi feito de acordo com as recomendações atuais2. A DCMV foi definida pela presença de pelo menos duas lesões consideradas angiograficamente significativas (estenose igual ou superior a 50% do diâmetro intraluminal) em territórios arteriais coronários diferentes. A artéria responsável pelo enfarte (culprit) foi definida pelo cardiologista de intervenção, de acordo com a integração dos dados clínicos, eletrocardiográficos, ecocardiográficos e angiográficos. Definiu‐se como revascularização da artéria culprit ou revascularização univaso a intervenção apenas sobre a artéria considerada responsável pelo enfarte, enquanto a revascularização multivaso foi definida como a intervenção (percutânea ou cirúrgica) sobre duas ou mais lesões em territórios arteriais coronários diferentes, durante o procedimento inicial (revascularização em 1.° tempo) ou planeada nos 30 dias seguintes (revascularização em 2.° tempo). Definiu‐se insuficiência cardíaca durante o seguimento, como a presença de dispneia de esforço superior ou igual à classe II da NYHA9 ou internamento por insuficiência cardíaca. Utilizou‐se a classificação de Killip e os scores de risco The Global Registry of Acute Coronary Events (GRACE) e Can Rapid risk stratification of Unstable angina patients Suppress ADverse outcomes with Early implementation of the ACC/AHA guidelines (CRUSADE), segundo as definições descritas na literatura10–13. Calculou‐se a clearance de creatinina segundo a fórmula de Cockroft‐Gault. Os eventos cardiovasculares adversos major (major adverse cardiovascular events [MACE]) foram compostos por mortalidade, enfarte agudo do miocárdio, insuficiência cardíaca e acidente vascular cerebral.
Análise estatísticaA análise estatística foi realizada com recurso ao SPSS® versão 23.0, considerando um valor de p≤0,05 para determinar as diferenças estatisticamente significativas.
Para as variáveis categóricas calculou‐se a distribuição de frequências e a respetiva percentagem. Utilizou‐se o teste quiquadrado (χ2), tendo sido reportados os valores da correção de continuidade nas tabelas de contingência 2x2 e o quiquadrado de Pearson para as tabelas de contingência superiores a 2x2; sempre que a percentagem de células da tabela, com frequência esperada inferior a cinco, era superior a 20%, foi utilizado o teste exato de Fisher14.
Para as variáveis contínuas analisadas com um teste paramétrico, determinou‐se a média e o desvio padrão, enquanto para as variáveis contínuas analisadas com um teste não paramétrico, determinou‐se a mediana e a amplitude interquartil. Para comparar as variáveis contínuas entre os dois grupos (revascularização multivaso versus revascularização da artéria culprit), foram realizados os seguintes testes: teste T para amostras independentes (teste paramétrico) e teste de Mann‐Whitney (teste não paramétrico), após se ter comprovado se a variável dependente mostrava ou não uma distribuição normal, respetivamente.
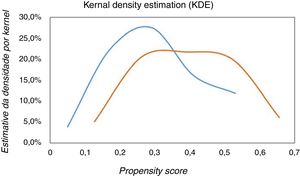
Atendendo ao facto de se tratar de um estudo observacional não aleatorizado de um único centro e considerando os múltiplos fatores que podem influenciar a escolha do tipo de revascularização em doentes com SCAsSST e DCMV, decidiu‐se realizar um PSM para emparelhar as populações em estudo (pacientes submetidos a revascularização multivaso versus revascularização da artéria culprit) e reduzir o viés devido a variáveis confundidoras que poderiam influenciar as decisões de tratamento e os resultados clínicos. Mediante o propensity score avaliou‐se a probabilidade de cada indivíduo ser selecionado para uma estratégia de revascularização, de acordo com as suas características basais. Posteriormente, realizou‐se um emparelhamento por propensity score, que é uma técnica estatística que iguala as características dos grupos de acordo com as variáveis definidas e, assim, permite analisar o efeito de uma variável, neste caso a estratégia de revascularização (multivaso versus univaso). Para o emparelhamento por propensity score, utilizou‐se a técnica do vizinho mais próximo sem substituição, aceitando um desvio padronizado ótimo de 0,03. Esta análise realizou‐se mediante uma regressão logística binária, considerando a variável dependente a estratégia de revascularização (multivaso versus artéria culprit) e as seguintes variáveis explicativas: idade, género, índice de massa corporal, diabetes mellitus, história de enfarte agudo do miocárdio, ICP prévia, fração de ejeção ventricular esquerda, pico de troponina I, clearance de creatinina (pela fórmula de Cockroft‐Gault), classe de Killip máxima, hemoglobina mínima, acesso vascular arterial para a realização da coronariografia, doença do tronco comum significativa, doença da descendente anterior significativa, doença da circunflexa significativa e doença da coronária direita significativa. O grau de sobreposição do propensity score entre ambos os grupos foi elevado, como ilustrado na Figura 2. Desta forma, obtiveram‐se dois grupos de 66 pacientes igualados para a decisão do tipo de revascularização (multivaso versus univaso). A capacidade preditiva do modelo usado para produzir o propensity score foi de 0,69, com uma calibração adequada (Homer‐Lemeshow, p=0,81).
Na coorte emparelhada, para a análise da sobrevivência livre de eventos clínicos durante o seguimento (morte, reenfarte, revascularização não planeada, ICP não planeada e MACE), efetuaram‐se curvas de Kaplan‐Meier, comparando os grupos através do teste de log‐rank.
ResultadosCaracterísticas basais da populaçãoA população de estudo foi composta por 202 pacientes com SCAsSST e DCMV; a idade média foi de 65,3±12,5 anos, sendo 77,2% do sexo masculino. Quanto aos fatores de risco cardiovascular, 34,7% tinha diabetes mellitus, 71,3% hipertensão arterial, 59,4% dislipidemia, 23,3% eram fumadores atuais e 22,3% ex‐fumadores; no que respeita aos antecedentes, 16,3% referia história de enfarte agudo do miocárdio prévio, 20,3% angina prévia e 12,4% ICP prévia.
Os doentes submetidos a revascularização multivaso eram tendencialmente mais novos do que os submetidos a revascularização da artéria culprit (64,1±12,5 versus 66,0±12,4, p=0,639), sem diferença estatística significativa, como mostra a Tabela 1. Adicionalmente, estes doentes tinham tendencialmente um índice de massa corporal superior relativamente ao grupo da revascularização da artéria culprit (28,9±3,9 versus 27,7±4,2, p=0,725), no limiar da significância estatística e com efeito pequeno.
Características demográficas, clínicas, laboratoriais, ecocardiográficas e angiográficas dos grupos de estudo antes e após o emparelhamento
| Características | Grupos não emparelhados | Grupos emparelhados | ||||
|---|---|---|---|---|---|---|
| RV multivaso (n=71) | RV culprit (n=131) | p | RV multivaso (n=66) | RV culprit (n=66) | p | |
| Demográficas | ||||||
| Idade, anos | 64,1±12,5 | 66,0±12,4 | 0,304 | 64,6±12,3 | 65,6±12,5 | 0,639 |
| Género masculino | 78,9% (56) | 76,3% (100) | 0,814 | 77,3% (51) | 72,7% (48) | 0,668 |
| IMC, kg/m2 | 28,9±3,9 | 27,7±4,2 | 0,051 | 28,6±3,82 | 28,8±4,50 | 0,725 |
| Clínicas | ||||||
| FRCV | ||||||
| Diabetes mellitus | 36,6% (26) | 33,6% (44) | 0,781 | 36,4% (24) | 36,4 (24) | 1,000 |
| HTA | 74,6% (53) | 69,5% (91) | 0,539 | 74,2% (49) | 75,8% (50) | 1,000 |
| Dislipidemia | 56,3% (40) | 61,1% (80) | 0,615 | 57,6% (38) | 60,6% (40) | 0,859 |
| Tabagismo | 19,7% (14) | 25,2% (33) | 0,481 | 18,2% (12) | 22,7% (15) | 0,666 |
| Antecedentes | ||||||
| IRC | 7,0% (5) | 6,1% (8) | 0,772‡ | 6,1% (4) | 7,6% (5) | 1,000‡ |
| EAM | 11,3% (8) | 19,1% (25) | 0,217 | 12,1% (8) | 12,1% (8) | 1,000 |
| Angina | 19,7% (14) | 20,6% (27) | 1,000 | 19,7% (13) | 21,2% (14) | 1,000 |
| AVC/AIT | 5,6% (4) | 7,6% (10) | 0,774‡ | 4,5% (3) | 9,1% (6) | 0,492‡ |
| DAP | 2,8% (2) | 3,8% (5) | 1,000‡ | 1,5% (1) | 3,0% (2) | 1,000‡ |
| Doença carotídea | 0% (0) | 2,3% (3) | 0,553‡ | 0% (0) | 4,5% (3) | 0,244‡ |
| ICP | 11,3% (8) | 13,0% (17) | 0,898 | 10,6% (7) | 12,1% (8) | 1,000 |
| Medicação prévia | ||||||
| AAS | 32,4% (23) | 29,0% (38) | 0,734 | 33,3% (22) | 28,8% (19) | 0,707 |
| IECA/ARA | 52,1% (37) | 51,1% (67) | 1,000 | 54,5% (36) | 42,4% (28) | 0,223 |
| B‐bloqueador | 23,9% (17) | 27,5% (36) | 0,705 | 24,2% (16) | 25,8% (17) | 1,000 |
| Estatina | 36,6% (26) | 43,5% (57) | 0,423 | 37,9% (25) | 42,4% (28) | 0,723 |
| Diurético | 22,5% (16) | 22,1% (29) | 1,000 | 22,7% (15) | 24,2% (16) | 1,000 |
| Classe Killip máxima | 0,751 | 0,496 | ||||
| Classe I | 73,2% (52) | 74,0% (97) | 74,2% (49) | 66,7% (44) | ||
| Classe II | 18,3% (13) | 19,8% (26) | 16,7% (11) | 25,8% (17) | ||
| Classe III | 7,0% (5) | 3,8% (5) | 7,6% (5) | 4,5% (3) | ||
| Classe IV | 1,4% (1) | 2,3% (3) | 1,5% (1) | 3,0% (2) | ||
| Score CRUSADE | 25,9±18,4 | 28,4±18,7 | 0,547 | 25,5±18,1 | 27,2±19,0 | 0,713 |
| Score GRACE alta | 127±40,8 | 134±44,8 | 0,247 | 128±41,3 | 134±45,2 | 0,446 |
| Laboratoriais | ||||||
| Trop I pico, ng/ml | 4,88 (22,65) | 6,56 (15,46) | 0,571 | 5,32 (21,90) | 6,56 (10,96) | 0,915 |
| Creat pico, mg/dL | 0,90 (0,40) | 0,90 (0,40) | 0,882 | 0,90 (0,40) | 0,90 (0,40) | 0,579 |
| ClCr, ml/min | 93,7±38,6 | 86,3±36,2 | 0,181 | 91,6±37,5 | 90,8±37,2 | 0,909 |
| PBNP, pg/mL | 691 (1966) | 1088 (2108) | 0,024 | 729 (2029) | 937 (2074) | 0,187 |
| Hg mínima, g/dL | 14,1±1,67 | 13,7±1,66 | 0,183 | 14,1±1,66 | 13,8±1,57 | 0,217 |
| Ecocardiográficas | ||||||
| FEVE, % | 50,1±9,6 | 48,7±9,3 | 0,293 | 50,0±9,83 | 50,0±9,67 | 0,831 |
| Angiográficas | ||||||
| Acesso vascular | 0,499‡ | 1,000‡ | ||||
| Radial | 97,2% (69) | 93,9% (123) | 97,0% (64) | 95,5% (63) | ||
| Femoral | 2,8% (2) | 6,1% (8) | 3,0% (2) | 4,5% (3) | ||
| Doença coronária | ||||||
| TC significativo | 2,8% (2) | 3,8% (5) | 1,000‡ | 3,0% (2) | 1,5% (1) | 1,000‡ |
| DA significativa | 88,7% (63) | 80,2% (105) | 0,174 | 87,9% (58) | 87,9% (58) | 1,000 |
| Cx significativa | 81,7% (58) | 76,3% (100) | 0,483 | 80,3% (53) | 78,8% (52) | 1,000 |
| CD significativa | 76,1% (54) | 71,0% (93) | 0,544 | 74,2% (49) | 74,2% (49) | 1,000 |
teste exato de Fisher; AAS: ácido acetilsalicílico; AIT: acidente isquémico transitório; ARA: antagonista do recetor da angiotensina; AVC: acidente vascular cerebral; CD: coronária direita; ClCr: clearance de creatinina; Creat: creatinina; Cx: circunflexa; DA: descendente anterior; DAP: doença arterial periférica; EAM: enfarte agudo do miocárdio; FEVE: fração de ejeção ventricular esquerda; FRCV: fatores de risco cardiovascular; Hg: hemoglobina; HTA: hipertensão arterial; ICP: intervenção coronária percutânea; IECA: inibidor da enzima de conversão da angiotensina; IMC: índice de massa corporal; IRC: insuficiência renal crónica; PBNP: pró‐peptídeo natriurético cerebral; RV: revascularização; TC: tronco comum; trop: troponina.
Quanto às características clínicas dos grupos de estudo, não se verificaram diferenças estatisticamente significativas, como se observa na Tabela 1.
Relativamente às características laboratoriais, não houve diferenças estatisticamente significativas entre os grupos antes do emparelhamento, à exceção do PBNP, tendo‐se verificado uma diferença estatisticamente significativa entre os doentes submetidos a revascularização multivaso e aqueles submetidos a revascularização da artéria culprit (1088 [2108] versus 691 [1966], p=0,024).
Quanto às características ecocardiográficas e angiográficas dos grupos de estudo, não se verificaram diferenças estatisticamente significativas entre os grupos, como se verifica na Tabela 1.
Após o emparelhamento, não se verificou qualquer diferença entre os grupos de estudo relativamente às características descritas.
Estratégia de revascularizaçãoComo se pode ver na Tabela 2, a revascularização multivaso foi realizada principalmente de forma percutânea durante o mesmo procedimento (1.° tempo; 66,2%, n=47); 32,4% dos doentes foram revascularizados percutaneamente em 2.° tempo. Nesta população, apenas um doente foi revascularizado de forma cirúrgica (sete doentes foram recusados por apresentarem um risco cirúrgico elevado). Em 18,3% (n=13) dos casos, a decisão de revascularizar mais do que um vaso baseou‐se na realização de um teste de isquemia. A revascularização completa foi conseguida em 52,1% (n=37) dos doentes submetidos a revascularização multivaso; entre os motivos para não revascularizar de forma completa, destaca‐se a presença de doença de doença difusa, de pequenos vasos ou de elevada complexidade anatómica (ex. oclusões crónicas). A decisão de não realizar ICP das artérias não‐culprit foi influenciada por diversos fatores, entre os quais, o mais comum foi a presença de lesões moderadas, isto é, com estenoses inferiores a 70% (n=46, 35,1%). As artérias mais revascularizadas no grupo de doentes submetidos a revascularização da artéria culprit foram a artéria circunflexa (35,9%, n=47) e a descendente anterior (n=35,1%, n=46); em 35,9% (n=47) destes pacientes, ficou mais do que uma artéria por revascularizar, como se pode constatar pela análise da Tabela 2.
Fatores relacionados com a estratégia de revascularização
| Grupos não emparelhados | |||
|---|---|---|---|
| Revascularização multivaso (n=71) | Revascularização univaso (n=131) | p | |
| Tipo de revascularização | |||
| ICP univaso | 0% (0) | 100% (131) | |
| ICP multivaso em 1.° tempo | 66,2% (47) | 0% (0) | |
| ICP multivaso em 2.° tempo | 32,4% (23) | 0% (0) | |
| CRM planeada | 1,4% (1) | 0% (0) | |
| Teste de isquemia | 0,013 | ||
| Positivo | 18,3% (13) | 5,3% (7) | |
| Negativo | 1,4% (1) | 2,3% (3) | |
| Não realizado | 80,3% (57) | 92,4% (121) | |
| Motivo de não revascularização MV | |||
| Teste de isquemia negativo | 3,8% (5) | ||
| Lesões moderadas (<70%) | 35,1% (46) | ||
| Complexidade anatómica | 17,6% (23) | ||
| Oclusão crónica | 8,4% (11) | ||
| Idade e comorbilidades | 2,3% (3) | ||
| Mais do que um dos anteriores | 32,8% (43) | ||
| Motivo de revascularização MV | |||
| Teste de isquemia positivo | 18,3% (13) | ||
| Anatómico | 81,7% (58) | ||
| Revascularização completa | <0,001 | ||
| Não | 47,9% (34) | 100% (131) | |
| Sim | 52,1% (37) | 0% (0) | |
| Artéria revascularizada em 1.° tempo | <0,001 | ||
| TC | 0% (0) | 2,3% (3) | |
| DA | 9,9% (7) | 35,1% (46) | |
| Cx | 8,5% (6) | 35,9% (47) | |
| CD | 15,5% (11) | 24,4% (32) | |
| Mais do que uma artéria | 66,2% (47) | 0% (0) | |
| Artéria revascularizada em 2.° tempo | |||
| TC | 0% (0) | ||
| DA | 12,7% (9) | ||
| Cx | 7,0% (5) | ||
| CD | 7,0% (5) | ||
| Mais do que uma artéria | 7,0% (5) | ||
| Artéria ou ramo por revascularizar | <0,001 | ||
| TC | 0% (0) | 0% (0) | |
| DA | 12,7% (9) | 26,2% (34) | |
| Cx | 9,9% (7) | 17,6% (23) | |
| CD | 14,1% (10) | 21,5% (28) | |
| Mais do que uma artéria | 0% (0) | 35,1% (46) | |
| Características dos stents utilizados | |||
| Número de stents por doente | 2,3±0,9 | 1,0±0,4 | <0,001 |
| Longitude total (mm) | 48±23 | 18±8 | <0,001 |
| % de stents revestidos | 81,6% | 55,2% | <0,001 |
CD: coronária direita; CRM: cirurgia de revascularização do miocárdio; Cx: circunflexa; DA: descendente anterior; MV: multivaso; TC: tronco comum.
Relativamente aos eventos clínicos adversos intra‐hospitalares, não se verificaram diferenças estatisticamente significativas entre os dois grupos (revascularização multivaso versus revascularização da artéria culprit) antes e após PSM, como constatado na Tabela 3.
Eventos clínicos adversos intra‐hospitalares antes e após o emparelhamento
| Eventos adversos intra‐hospitalares | Grupos não emparelhados | Grupos emparelhados | ||||
|---|---|---|---|---|---|---|
| RV multivaso (n=71) | RV culprit (n=131) | p | RV multivaso (n=66) | RV culprit (n=66) | p | |
| Morte | 0% (0) | 1,5% (2) | 0,542‡ | 0% (0) | 1,5% (1) | 1,000‡ |
| Angor* | 7,0% (5) | 8,4% (11) | 0,946 | 7,6% (5) | 6,1% (4) | 1,000‡ |
| Reenfarte | 7,0% (5) | 4,6% (6) | 0,522‡ | 7,6% (5) | 4,5% (3) | 0,718‡ |
| BAV≥2 | 4,2% (3) | 3,1% (4) | 0,698‡ | 4,5% (3) | 3,0% (2) | 1,000‡ |
| AVC | 2,8% (2) | 0% (0) | 0,122‡ | 3,0% (2) | 0% (0) | 0,496‡ |
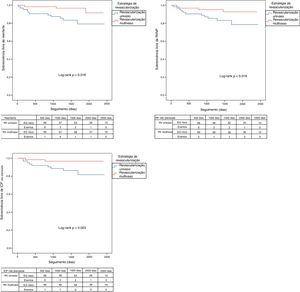
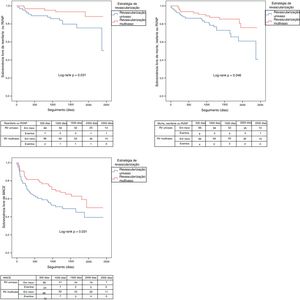
Os eventos clínicos adversos durante o seguimento estão demonstrados na Tabela 4. Após PSM, os pacientes submetidos a revascularização multivaso apresentaram uma incidência inferior de reenfarte (4,5 versus 16,7%; log‐rank p=0,018 [Figura 3]), revascularização não planeada (6,1 versus 16,7%; log‐rank p=0,048 [Figura 3]), ICP não planeada (3,0 versus 13,6%; log‐rank p=0,023 [Figura 3]), do endpoint combinado de reenfarte e revascularização não planeada (7,6 versus 21,2%; log‐rank p=0,031 [Figura 4]) e do endpoint combinado de morte, reenfarte e revascularização não planeada (16,7 versus 31,8%; log‐rank p=0,046 [Figura 4]). De salientar ainda que a incidência de MACE nestes doentes foi significativamente inferior antes mas não após o emparelhamento, embora se mantivesse essa tendência (39,4 versus 53,0%; log‐rank p=0,056 [Figura 4]).
Eventos clínicos adversos durante o seguimento antes e após o emparelhamento
| Eventos adversos durante o seguimento | Grupos não emparelhados | Grupos emparelhados | ||||
|---|---|---|---|---|---|---|
| RV multivaso (n=71) | RV culprit (n=131) | Log‐rank p | RV multivaso (n=66) | RV culprit (n=66) | Log‐rank p | |
| Morte | 11,3% (8) | 16,0% (21) | 0,307 | 12,1% (8) | 18,2% (12) | 0,248 |
| Reenfarte | 5,6% (4) | 16,8% (22) | 0,018 | 4,5% (3) | 16,7% (11) | 0,018 |
| AVC | 5,6% (4) | 3,8% (5) | 0,619 | 6,1% (4) | 3,0% (2) | 0,495 |
| IC | 29,6% (21) | 34,4% (45) | 0,426 | 30,3% (20) | 31,8% (21) | 0,767 |
| RV não planeada | 5,6% (4) | 15,3% (20) | 0,040 | 6,1% (4) | 16,7% (11) | 0,048 |
| ICP não planeada | 2,8% (2) | 12,2% (16) | 0,022 | 3,0% (2) | 13,6% (9) | 0,023 |
| CRM não planeada | 2,8% (2) | 3,1% (4) | 0,900 | 3,0% (2) | 3,0% (2) | 0,945 |
| Reenfarte ou RVNP | 8,5% (6) | 19,8% (26) | 0,027 | 7,6% (5) | 21,2% (14) | 0,031 |
| Morte, reenfarte ou RVNP | 16,9% (12) | 31,3% (41) | 0,034 | 16,7% (11) | 31,8% (21) | 0,046 |
| MACE (morte, reenfarte, AVC ou IC) | 39,4% (28) | 53,4% (70) | 0,031 | 39,4% (26) | 53,0% (35) | 0,056 |
AVC: acidente vascular cerebral; CRM: cirurgia de revascularização do miocárdio; IC: insuficiência cardíaca; ICP: intervenção coronária percutânea; RV: revascularização; RVNP: revascularização não planeada.
Curvas de Kaplan‐Meier para a sobrevivência livre combinada do endpoint combinado de reenfarte ou revascularização não planeada, do endpoint combinado de morte, reenfarte ou revascularização não planeada e de MACE.
MACE: major cardiovascular adverse events; RV: revascularização; RVNP: revascularização não planeada.
Neste estudo, a prevalência de DCMV em doentes com SCAsSST foi de 46,4%, resultados comparáveis com outros estudos e meta‐análises, em que a prevalência ronda os cerca de 50% naqueles submetidos a angiografia15–20.
O presente estudo evidencia um efeito protetor da revascularização multivaso relativamente à revascularização apenas da artéria culprit, no que respeita à ocorrência de eventos clínicos adversos a longo prazo, após ajuste das características basais com o PSM. Neste estudo com doentes do mundo real, reporta‐se uma redução significativa da ocorrência de reenfarte, revascularização não planeada, ICP não planeada, do endpoint combinado de reenfarte e revascularização não planeada e do endpoint combinado de morte, reenfarte e revascularização não planeada. Outros estudos21–25 e uma meta‐análise26 também demonstraram uma redução da necessidade de revascularização durante o seguimento e, nalguns, isto significava uma redução também nos MACE. Shishehbor et al.27, numa análise de PSM em 1240 doentes com SCA e DCMV, observaram que a revascularização coronária completa estava associada a menor taxa do endpoint combinado de morte, reenfarte ou revascularização. No entanto, uma meta‐análise recente20 não confirma a redução de revascularização durante o seguimento e sugere mesmo que, nalguns casos, acaba por haver um aumento da morte, reenfarte ou risco de MACE com a estratégia de revascularização multivaso, o que vai contra os resultados deste e de outros estudos.
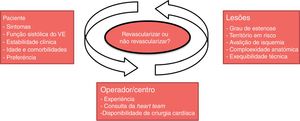
No presente estudo, a decisão de realizar revascularização multivaso foi determinada pelo cardiologista clínico e pelo cardiologista de intervenção ou pela Heart Team, sempre que apropriado. Isto reflete a prática no mundo real, onde a decisão de como, quando e quais as artérias coronárias que devem ou não ser revascularizadas, é individualizada, atendendo às características anatómicas das próprias lesões, aos sintomas, aos resultados dos testes de isquemia, ao território miocárdico em risco, à função sistólica ventricular esquerda, ao risco de complicações, à experiência do centro/operador, e à idade do paciente, comorbilidades e preferência28.
A maior morbimortalidade em pacientes com SCAsSST e DCMV comparados com aqueles com doença de apenas um vaso29,30, pode ser explicada por diversos mecanismos, incluindo a instabilização de múltiplas placas, alterações da perfusão ou da contractilidade miocárdica, que poderão acarretar enfarte, arritmias e morte. As potenciais vantagens da revascularização multivaso, neste contexto, incluem a prevenção de isquemia ou enfarte do miocárdio recorrente e as suas complicações associadas, a redução do território miocárdico em risco e o incremento da função miocárdica devido a um maior fluxo sanguíneo às áreas perienfarte.
Contudo, a revascularização multivaso também pode trazer algumas desvantagens, tais como: maior tempo de procedimento, com maior uso de contraste e maior dose de radiação; e a um aumento nas complicações associadas ao stent (trombose e reestenose intra‐stent), por maior implantação de stents. No entanto, a utilização de novos agentes antiplaquetários, do acesso radial e de stents revestido com fármacos de nova geração podem contribuir para uma maior segurança do procedimento para operadores experientes. Neste estudo, os pacientes submetidos a revascularização multivaso tiveram uma taxa similar de trombose intra‐stent quando comparados com os submetidos a revascularização univaso, assim como taxas similares dos restantes eventos adversos intra‐hospitalares. Portanto, neste estudo, a revascularização multivaso, não se associou, a curto prazo, a pior prognóstico relativamente à revascularização da artéria culprit, à semelhança de outros estudos, em que não se verificaram diferenças estatisticamente significativas nas complicações periprocedimento entre os grupos (multivaso versus univaso). Desta forma, é possível afirmar igual ou, nalguns casos, mesmo maior segurança da revascularização multivaso relativamente à revascularização da artéria culprit29,31,32.
Neste estudo, a revascularização multivaso foi principalmente realizada durante o procedimento inicial (66,2%). A intervenção de uma lesão não‐culprit durante o procedimento inicial pode resultar em compromisso hemodinâmico desnecessário, numa altura em que o doente poderá ter um compromisso regional miocárdico considerável devido ao enfarte; além disso, as lesões não‐culprit podem estar sobrestimadas e a sua significância fisiológica pode ser difícil de avaliar, o que poderá conduzir a uma ICP desnecessária33. A revascularização eletiva permite uma melhor avaliação da significância fisiológica das lesões não‐culprit, através de testes de isquemia invasivos ou não‐invasivos, e proporciona mais tempo para a discussão da estratégia de revascularização, pelo que poderá ser mais segura. No entanto, num recente estudo randomizado (estudo SMILE34), em que se comparou a estratégia de revascularização multivaso durante o procedimento inicial com a estratégia de revascularização estadiada, verificou‐se uma redução dos eventos cardiovascular major com a primeira estratégia, sobretudo à custa da redução de revascularizações não planeadas.
Resumindo, os dados dos artigos publicados nesta área sugerem que o balanço dos benefícios e riscos relacionados com futuros procedimentos invasivos deve ser baseado na análise da condição geral do paciente, nos fatores de risco cardiovasculares, na possibilidade de identificação da artéria culprit, na exequibilidade técnica da realização de revascularização multivaso e na localização, grau de estenose e severidade das lesões; além disso, é também relevante a estabilidade clínica do doente, a experiência do operador, a consulta da Heart Team e a disponibilidade de um centro de cirurgia cardíaca32, como se sintetiza na Figura 5.
Tendo em conta os resultados não uniformes obtidos em meta‐análises e estudos observacionais, são necessários estudos prospetivos aleatorizados com um elevado número de doentes, de forma a poder definir a estratégia de revascularização mais adequada nos doentes com SCAsSST e DCMV.
LimitaçõesHá várias limitações a serem consideradas na interpretação deste estudo. Em primeiro lugar, este foi um estudo observacional retrospetivo e não aleatorizado, realizado num único hospital e com um número relativamente reduzido de doentes, portanto, tem as limitações e os vieses inerentes aos estudos retrospetivos unicêntricos. Embora se tenha realizado um PSM entre os grupos e este aumente a força da análise estatística, é impossível corrigir para fatores de confundimento não medidos e todos os vieses de seleção relacionados com a decisão de tratamento, o que não permite tirar conclusões definitivas. Em segundo lugar, a definição do tipo de lesão (culprit versus não‐culprit) não obedeceu a um protocolo, pelo que é provável que essa seleção tenha variado de acordo com a interpretação angiográfica do cardiologista de intervenção no momento da coronariografia. Atendendo à dificuldade por vezes associada à identificação da artéria culprit, também não é possível excluir a presença de erros que possam ter influenciado os resultados (ex. identificação errónea mais frequente da lesão culprit no grupo submetido a revascularização univaso). Em terceiro lugar, é difícil definir de forma simplista os fatores que levaram à realização da revascularização multivaso em cada caso, pelo que não é possível estabelecer uma abordagem padrão para os pacientes com SCAsSST e DCMV. Em quarto lugar, não foram colhidos os dados de avaliação funcional das estenoses coronárias em todos os doentes submetidos a revascularização multivaso; na realidade, a maioria das lesões não‐culprit foi avaliada como significativa apenas a partir da angiografia coronária. Em quinto lugar, os grupos de tratamento foram definidos após a realização da ICP, pelo que alguns doentes que seriam alocados inicialmente à estratégia de revascularização multivaso poderão ter sido submetidos a revascularização apenas da artéria culprit, devido a fatores técnicos ou anatómicos que poderão ter impedido a realização de uma revascularização mais completa.
ConclusãoA decisão de revascularização multivaso versus revascularização apenas da artéria culprit em doentes com SCAsSST e DCMV continua a ser tema de grande debate e onde não há, ainda, consensos.
Contudo, este estudo apoia a hipótese da revascularização multivaso em doentes com SCAsSST e DCMV reduzir a ocorrência de eventos clínicos adversos durante o seguimento, nomeadamente reenfarte, revascularização não planeada, ICP não planeada, do endpoint combinado de reenfarte e revascularização não planeada e do endpoint combinado de morte, reenfarte e revascularização não planeada, antes e após a realização de um PSM.
Conflito de interessesOs autores declaram não haver conflito de interesses.