A transposição congenitamente corrigida das grandes artérias é uma cardiopatia rara associada a disfunção do ventrículo sistémico e perturbações da condução.
A utilização de terapia de ressincronização cardíaca em doentes com cardiopatia congénita ainda não está totalmente estabelecida.
Os autores reportam um caso de ressincronização cardíaca numa paciente de 31 anos, com história de transposição congenitamente corrigida das grandes artérias e insuficiência cardíaca, já submetida a duas cirurgias cardíacas e portadora de pacemaker DDDR.
Do nosso conhecimento, trata‐se do primeiro caso descrito em Portugal de terapêutica de ressincronização cardíaca, por acesso transvenoso, numa paciente com transposição congenitamente corrigida das grandes artérias.
Congenitally corrected transposition of the great arteries is a rare heart defect that can be associated with systemic ventricular dysfunction and conduction disturbances.
The use of cardiac resynchronization therapy in patients with congenital heart disease is not fully established.
The authors report a case of cardiac resynchronization therapy in a 31‐year‐old woman with a history of congenitally corrected transposition of the great arteries and heart failure, who had undergone two heart surgeries and had a DDDR pacemaker implanted.
To our knowledge this is the first case reported in Portugal of cardiac resynchronization therapy by transvenous access in a patient with congenitally corrected transposition of the great arteries.
A transposição congenitamente corrigida das grandes artérias (cc‐TGA) é uma cardiopatia muito rara, correspondendo a menos de 1% de todas as formas de cardiopatias congénitas. Nesta anomalia, a aurícula morfologicamente direita (AD) relaciona‐se com o ventrículo morfologicamente esquerdo (VE), que por sua vez dá origem à artéria pulmonar (AP). A aurícula morfologicamente esquerda (AE) está relacionada com o ventrículo morfologicamente direito (VD), do qual se origina a artéria aorta. Existe, assim, uma dupla discordância, isto é, auriculoventricular (AV) e ventrículo‐arterial1.
A disfunção do ventrículo sistémico é comum em pacientes com cardiopatia congénita do adulto (CCA) e está relacionada com a dessincronia eletromecânica2. Mais de 25% destes pacientes progride para insuficiência cardíaca (IC) sintomática, ocasionalmente refratária aos fármacos e associada a morbilidade e mortalidade significativas3. Assim, é importante a identificação e utilização de novas estratégias terapêuticas neste grupo de doentes.
A terapia de ressincronização cardíaca (CRT) em pacientes com miocardiopatia dilatada, associada a disfunção sistólica grave do VE, dessincronia eletromecânica e insuficiência cardíaca, sob terapêutica farmacológica otimizada, demonstrou em ensaios aleatorizados reduzir a mortalidade global e as hospitalizações por eventos cardíacos major4,5, bem como melhorar a qualidade de vida, a classe funcional e os parâmetros ecocardiográficos6,7. No entanto, a indicação para CRT em pacientes com cardiopatia congénita ainda não está totalmente estabelecida.
Caso clínicoOs autores apresentam o caso de uma doente do sexo feminino, de 31 anos, caucasiana, com diagnóstico de cc‐TGA, estenose pulmonar e comunicação interventricular (CIV). A doente tinha história de duas cirurgias cardíacas: a primeira paliativa aos 15 meses de idade com implantação de um shunt Blalock‐Taussig; e a segunda aos 15 anos de idade com encerramento da CIV, interposição de um conduto entre o VE morfológico e a AP e laqueação do shunt Blalock‐Taussig. Por bloqueio auriculoventricular (BAV) completo após a cirurgia foi implantado um sistema de pacing DDDR, com ambos os eletrocateteres por via subclávia esquerda e o gerador em loca pré‐peitoral esquerda. Posteriormente, por disfunção do elétrodo ventricular implantou novo elétrodo, de fixação ativa, por via subclávia esquerda. Nos antecedentes salienta‐se ainda a ocorrência de um acidente cerebral isquémico transitório aos 16 anos de idade.
Durante o seguimento a doente manteve‐se em classe II da NYHA, incluindo durante a gravidez da sua filha. No início do ano de 2012, apesar de terapêutica médica otimizada com ramipril, carvedilol, furosemida e digoxina, a paciente apresentou um agravamento do quadro clínico com desenvolvimento de IC classe III da NYHA.
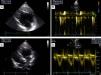
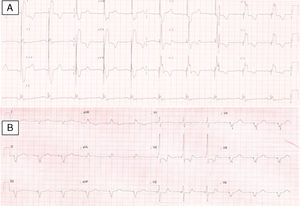
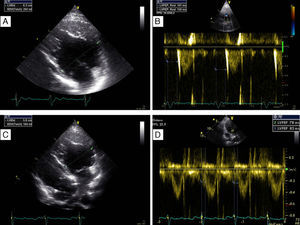
Apresentava em consulta uma pressão arterial de 96‐65mmHg e um sopro sistólico, grau II‐III/VI audível no 4.° espaço intercostal junto ao bordo esquerdo do esterno. O eletrocardiograma (ECG) de 12 derivações mostrava ritmo sinusal, 60bpm e pacing ventricular com sincronia AV mantida. A duração do QRS era de 196ms (Figura 1A). O ecocardiograma transtorácico (ETT) revelava um ventrículo sistémico (VD morfológico) dilatado (63mm) (Figura 2A), com função sistólica global deprimida (≤35% por método de Teicholz [não aplicabilidade do método de Simpson devido à morfologia do VD], relação dP/dt de 379mmHg/s), regurgitação aórtica moderada, regurgitação da válvula AV sistémica (morfologicamente tricúspide) moderada e uma pressão na AP estimada em 40mmHg. Não apresentava dessincronia AV (tempo de enchimento diastólico >40%, com uma boa separação das ondas E e A, sem truncagem da onda A); para a análise da dessincronia interventricular, apenas foi possível a quantificação do período de pré‐ejeção sistémico significativamente prolongado – 161ms (Figura 2B).
Ecocardiograma transtorácico realizado em paciente com transposição congenitamente corrigida das grandes artérias, antes (A, B) e após (C,D) a implantação do sistema de ressincronização cardíaca. Observa‐se uma redução da dimensão diastólica do ventrículo sistémico, de 63mm (A) para 58mm (C) – marcador de possível remodelagem reversa, bem como o desaparecimento do atraso eletromecânico sistémico quantificado pelo período de pré‐ejeção de 161ms (B) para 83ms (D).
Dado o quadro de IC classe III, apesar de terapêutica médica otimizada, numa doente com história de cc‐TGV, disfunção sistólica do ventrículo sistémico, ritmo de pacemaker com dessincronia mecânica do ventrículo sistémico, foi decidido implantar um sistema de CRT‐P.
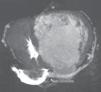
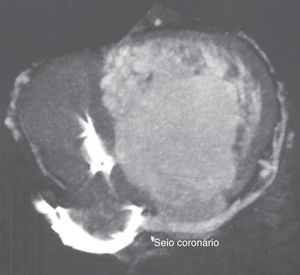
Realizou previamente uma tomografia computorizada (Figura 3) que revelou um seio coronário (SC) a drenar para a aurícula direita e com várias veias tributárias, bem como a ausência de lesões ateroscleróticas na circulação arterial coronária.
Face à presença de três elétrodos à esquerda – não passíveis de serem utilizados no novo sistema (elétrodos antigos unipolares) – optou‐se por implantação do sistema à direita.
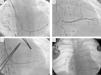
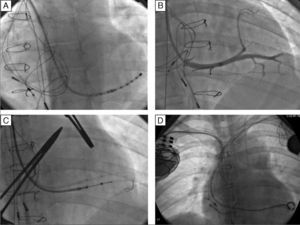
Foi obtido um acesso vascular através da veia subclávia direita, com implantação de elétrodo no ventrículo pulmonar, de fixação passiva – Fineline II Sterox 4457 (Boston Scientific) – e implantação de elétrodo auricular, de fixação ativa – Fineline II EZ Sterox 4457 (Boston Scientific) – na parede livre da AD. O SC foi cateterizado com bainha e auxílio de cateter diagnóstico de eletrofisiologia (Figura 4A). Foi obtida uma venografia do SC (Figura 4B), de modo a avaliar a veia tributária mais adequada para a entrega do eletrocateter de estimulação do ventrículo sistémico. Um eletrocateter bipolar (Boston Scientific) foi introduzido em veia póstero‐lateral, através de um fio guia (Figura 4C), com um bom limiar de estimulação e sem estimulação diafragmática. Os três elétrodos foram conectados ao sistema de pacing biventricular – Boston Scientific INVIVE (Figura 4D) – tendo o procedimento decorrido sem complicações. Com pacing biventricular a duração do QRS diminuiu de 196ms para 144ms (Figura 4B).
Implantação de sistema de ressincronização cardíaca por via subclávia direita, em paciente portadora de sistema de pacing DDDR à esquerda. A – Cateterização do seio coronário com o cateter diagnóstico e posterior introdução de cateter guia sobre o cateter. B – Venografia do seio coronário, revelando duas veias tributárias passíveis para entrega de eletrocateter de estimulação do ventrículo sistémico. C – Introdução de fio guia, através do cateter, na veia póstero‐lateral e posterior introdução de elétrodo de estimulação do ventrículo sistémico. D – Resultado final após a implantação de CRT, com elétrodos na aurícula direita, ventrículo pulmonar e ventrículo sistémico.
Em consulta de seguimento aos seis meses verificou‐se melhoria da classe funcional de IC (classe I‐II da NYHA), redução da dimensão diastólica do ventrículo sistémico (de 63mm para 58mm) (Figura 2C), desaparecimento do atraso eletromecânico sistémico quantificado pelo período de pré‐ejeção (de 163ms para menos de 100ms) (Figura 2D), bem como uma melhoria da fração de ejeção (de ≤35% para cerca de 47% pelo método de Teicholz e melhoria da relação dP/dt de 379mmHg/s para 511mmHg/s).
DiscussãoOs doentes com cc‐TGA que atingem a idade adulta têm vindo a aumentar. O atingimento de uma idade mais avançada levará a que apresentem maior disfunção do ventrículo sistémico e consequentemente sintomas de IC refratária à terapêutica médica.
A cc‐TGA está associada a várias perturbações do sistema de condução. A incidência de BAV é de cerca de 2%/ano1,8, chegando a ocorrer em cerca de 50% dos pacientes aos 20 anos de seguimento, com necessidade de implantação de pacemaker e, portanto, com potencial acrescido de dessincronia eletromecânica9. No caso apresentado destaca‐se a cirurgia de encerramento da CIV, que se complicou com BAV completo10 e implantação de pacing ventricular. Assim, nesta doente, a IC pode ser explicada não só pela exposição do ventrículo sistémico (VD morfológico) à elevada pressão sistémica11, mas também pelo efeito hemodinâmico negativo resultante da dessincronia eletromecânica produzida pelo pacing ventricular11.
Considerando que a doente ainda não apresentava critérios de gravidade suficiente para realização de transplante cardíaco e que uma nova cirurgia cardíaca estaria associada a elevado risco, foi decidida uma estratégia menos invasiva – a CRT. A CRT já provou ser útil na disfunção do ventrículo sistémico2. Janousek et al. reportaram que cerca de 37% dos pacientes foram removidos da lista de transplante cardíaco após a implantação de CRT12. No entanto, estes dados não podem ser extrapolados devido à particularidade dos pacientes com CCA e à ausência de estudos aleatorizados.
Nos pacientes com cc‐TGA, o SC habitualmente está localizado adjacente ao VD sistémico e drena na AD, o que o torna viável para a colocação de um elétrodo de estimulação2,3,11,13,14. Neste caso, contudo, optou‐se pela realização prévia de angiografia coronária por tomografia computorizada devido à heterogeneidade da anatomia venosa descrita2 e pelas cirurgias já realizadas.
A opção de não implantação de cardiodesfibrilhador implantável (CDI) também é controversa. Não existe, contudo, nas recomendações europeias15 ou americanas16 indicação para implantação de CDI em prevenção primária em pacientes com CCA. Ponderou‐se nesta paciente o risco/benefício associado à implantação de CDI. Oechslin et al.17 avaliaram o modo de morte em cerca de 200 adultos com cardiopatia congénita e verificaram que a morte súbita ocorreu em 26% da população, uma percentagem menor do que os 50 a 60% de morte súbita em pacientes com doença cardíaca adquirida18,19. Existem ainda as complicações inerentes ao elétrodo de desfibrilhação, tais como um risco acrescido de complicações major em caso de necessidade de extração de elétrodo20, bem como um risco de choques não apropriados. No estudo de Alexander et al.21 em que os pacientes apresentavam uma idade média de 18 anos (42% com cardiopatia congénita), a percentagem de choques inapropriados aos dois anos, situou‐se nos 25%; noutro estudo de Berul et al.22 em que quase metade dos pacientes implantou CDI em prevenção primária (46% da população do estudo com cardiopatia congénita), a percentagem de choques inapropriados foi de 21%; e mais recentemente, no estudo de Khairy et al.23 em 121 pacientes adultos com tetralogia de Fallot (implantação de CDI em prevenção primária em 56%), a percentagem de choques inapropriados foi de 25%. Deste modo, optou‐se pela não implantação de CDI.
A incidência de infeções relacionadas com os pacemakers/CDI situa‐se nos 1,9/1.000 devices/ano24. Dada a sua idade jovem e o facto de apresentar atualmente seis eletrocateteres, a paciente apresenta um elevado risco de infeção, pelo que se poderia pensar numa eventual extração de eletrocateteres. No entanto, perante a presença de uma cardiopatia congénita com um ventrículo sistémico, o risco de deslocação dos elétrodos do sistema de pacing biventricular e a taxa de complicações major de 7% associada à extração de três ou mais elétrodos em pacientes do sexo feminino20, foi decidido que o risco era superior ao benefício, não se tendo efetuado a extração dos eletrocateteres.
No caso reportado, as respostas clínicas, eletrocardiográfica e ecocardiográfica foram positivas após a implantação de CRT. No entanto, o tempo de follow‐up é reduzido e convém salientar que ainda não existem muitos estudos com follow‐up a longo prazo descritos na literatura25. Associa‐se a estes dados o facto de não se encontrar estabelecido qual o melhor local e modo de pacing neste grupo de pacientes26,27.
Na literatura, existem casos reportados de implantação de sistemas de pacing biventricular em pacientes com cardiopatias congénitas, incluindo cc‐TGA, e disfunção de ventrículo sistémico. No entanto, este caso clínico salienta‐se por se tratar do primeiro caso descrito em Portugal de terapia da ressincronização cardíaca por acesso transvenoso, em paciente com cc‐TGA e disfunção do ventrículo sistémico.
ConclusõesEste caso reforça a viabilidade da CRT em pacientes com cc‐TGA, disfunção do ventrículo sistémico e IC.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos de seu centro de trabalho acerca da publicação dos dados de pacientes e que todos os pacientes incluídos no estudo receberam informações suficientes e deram o seu consentimento informado por escrito para participar nesse estudo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflito de interessesOs autores declaram não haver conflito de interesses.