A doença cardiovascular é a causa mais comum de morte no mundo e a doença cardíaca isquémica mantém‐se como a principal etiologia, com elevados custos económicos tanto no seu tratamento como no seu diagnóstico. Nas últimas duas décadas a avaliação dos doentes com esta patologia tem sofrido várias modificações e a tomografia de emissão de positrões cardíaca tem emergido como um poderoso e versátil exame de imagem que permite diagnosticar e estratificar o risco destes doentes. Esta revisão teve como objetivo avaliar a utilidade deste exame, nomeadamente através da quantificação do fluxo sanguíneo total miocárdico e da reserva de fluxo sanguíneo miocárdico, no diagnóstico e estratificação de risco da doença arterial coronária. Comparativamente com outros métodos de imagem, a aferição por tomografia de emissão de positrões cardíaca destes parâmetros contribui para uma melhor caracterização da doença arterial coronária, com especial relevância na doença microvascular e multivascular equilibrada.
Cardiovascular disease is the leading cause of death worldwide and ischemic heart disease is the most frequent etiology, with high economic costs for both treatment and diagnosis. Over the past two decades, the assessment of patients with this disease has undergone various changes, with cardiac positron emission tomography (PET) emerging as a powerful and versatile imaging exam for diagnosis and risk stratification of these patients. This review aimed to assess the utility of this exam, particularly through quantification of myocardial blood flow and myocardial flow reserve in the diagnosis and risk stratification of coronary artery disease. Compared to other imaging methods, measurement of these parameters by cardiac PET provides a better characterization of coronary artery disease, with particular value in microvascular and balanced multivessel disease.
A doença arterial coronária é a patologia a nível global que causa mais mortes e incapacidade, segundo o último relatório da Organização Mundial de Saúde de 2016. Por este motivo, o enfoque nestes doentes tem estado não só na terapêutica e profilaxia, mas também no seu correto diagnóstico conjugando a clínica com os exames complementares.
A tomografia por emissão de positrões (PET) foi durante muitos anos exclusivamente utilizada como ferramenta de estudo em cardiologia, apenas ao alcance de centros de investigação avançada. No entanto, nas últimas décadas têm ocorrido enormes avanços tecnológicos e científicos que têm permitido que esta poderosa ferramenta seja implementada, cada vez mais, na rotina dos laboratórios de cardiologia nuclear contemporâneos, passando a ser um valioso aliado na prática clínica diária1. As indicações para a utilização da PET cardíaca são aliás, cada vez maiores2, principalmente pelo facto de permitirem a obtenção de imagens com alta resolução espacial e reprodutibilidade, submetendo os doentes a baixa exposição de radiação. Uma outra vantagem deste exame é o facto de permitir quantificar o fluxo sanguíneo miocárdico total (MBF) de forma não invasiva em termos absolutos, ou seja, em mililitros por grama por minuto (mL/g/min) de tecido.
Nesta revisão abordam‐se os princípios fundamentais da imagiologia cardíaca PET, as características dos marcadores atualmente disponíveis para avaliação da perfusão miocárdica, o método de quantificação do MBF e da reserva de fluxo sanguíneo miocárdico (MFR). Pretende‐se ainda efetuar uma comparação com outras técnicas disponíveis, com o objetivo de analisar se o MFR contribui para uma melhor deteção e caracterização da doença coronária, nomeadamente no que se refere à doença multivascular equilibrada e doença microvascular.
MétodosPara a elaboração dos pontos I, II, III e IV deste artigo, (considerações técnicas, marcadores radioativos, quantificação do fluxo sanguíneo miocárdico total e da reserva de fluxo sanguíneo miocárdico, respetivamente) que pretendem ser uma revisão narrativa introdutória ao ponto V (a reserva de fluxo sanguíneo miocárdico – uma mais valia na deteção da doença multivascular equilibrada e doença microvascular), foram analisados 82 estudos encontrados através de pesquisas nas bases de dados eletrónicas PubMed e Embase com preferência por artigos originais, revisões sistemáticas e guidelines. Utilizaram‐se como critérios de inclusão: (i) a data de publicação entre janeiro de 2000 e julho de 2018; (ii) serem escritos em inglês, português, espanhol ou francês; (iii) o acesso a texto integral; (iv) a adequação ao tema e a (v) relevância do conteúdo. Como critérios de exclusão consideraram‐se: (i) a inadaptação aos objetivos propostos ou (ii) a repetição do assunto.
Para a elaboração do ponto V foram apenas analisados estudos originais, que investigaram a utilização do MFR na doença coronária multivascular equilibrada e microvascular. Os critérios de seleção foram: (i) data de publicação entre janeiro de 2008 e julho de 2018; (ii) escritos em inglês, português, espanhol ou francês; (iii) realizados em humanos e (iv) com acesso a texto integral. Os estudos foram encontrados através de pesquisas nas bases de dados eletrónicas PubMed e Embase usando a seguinte estratégia de pesquisa: (Coronary Artery Disease AND Positrion Emission Tomography) AND (Myocardial Blood Flow OR Myocardial Flow Reserve OR Coronary Flow Reserve OR Myocardial Perfusion). Após a realização das pesquisas bibliográficas iniciais (n = 266 + n=131), foram excluídos os duplicados assim como todas as revisões da literatura. Após essa exclusão, o título e o resumo de cada estudo foram analisados pela autora sendo excluídos todos os artigos que não avaliavam de forma específica a doença arterial coronária (DAC) multivascular ou microvascular. Os textos completos de todos os estudos potencialmente relevantes foram posteriormente recuperados e analisados (n = 7). Destes, apenas 7 foram incluídos nesta revisão dado que avaliaram a utilidade da quantificação do MFR na DAC multivascular ou microvascular, usando critérios estatísticos passíveis de serem comparados no diagnóstico, estratificação de risco e prognóstico (sensibilidade, especificidade, área sob a curva, end‐point e hazard ratio). Os restantes 20 não foram incluídos por se tratarem de casos clínicos ou porque avaliavam populações especificas como diabéticos, obesos, pré/pós transplante ou pré‐pós revascularização.
Considerações técnicas – Breve explicação sobre a aquisição e interpretação de imagemA imagem PET baseia‐se na utilização de marcadores que decaem por emissão de positrões. Com mais detalhe, os positrões são emitidos durante a distribuição desses marcadores no corpo humano ocorrendo a colisão com eletrões próximos. Da colisão resulta a consequente aniquilação de ambos, com libertação de energia sob a forma de dois fotões de 511 keV em direções diametralmente opostas. Como a faixa média percorrida pelos positrões é pequena, na ordem de milímetros (mm), o decaimento pode ser considerado como tendo ocorrido ao longo da linha reta descrita pelos dois fotões de aniquilação. Os scanners PET contêm vários anéis de detetores que convertem a energia dos fotões de aniquilação num sinal elétrico proporcional. Assim sendo, o princípio básico da PET é a deteção de fotões com a mesma coincidência temporal e que chegam em direções opostas a um detetor em anel. A atual resolução espacial da PET situa‐se, aproximadamente, entre os 4 e os 7mm.
Na prática clínica, as imagens de perfusão PET são comummente classificadas de forma visual através de parâmetros qualitativos. A distribuição relativa dos marcadores é avaliada durante as condições de repouso e stress (hiperemia). Os defeitos de perfusão miocárdica são geralmente classificados na sua extensão, gravidade e localização. As orientações atuais recomendam também uma análise semiquantitativa usando um sistema de escala segmentar de 5 pontos num modelo de 17 segmentos para o ventrículo esquerdo3,4. Essas pontuações podem ser atribuídas para avaliações em repouso e stress com uma subsequente análise das diferenças observadas no sentido de identificar a reversibilidade. Os defeitos fixos são compatíveis com cicatrizes miocárdicas, enquanto a reversibilidade da hipoperfusão induzida pelo stress é compatível com isquémia5.
Além da classificação qualitativa e semiquantitativa, a PET também permite a quantificação absoluta da perfusão, estando atualmente disponíveis vários softwares automáticos que permitem aferir os valores de MBF por território miocárdico.
Marcadores radioativosDos vários marcadores de PET disponíveis para avaliação da perfusão, rubídio‐82 (82Rb), amónia‐N13 (13NH3) e água‐O15 (H215), são os mais usados clinicamente6, estando todos validados com elevadas taxas de reprodutibilidade7,8. O 18F‐flurpiridaz é um marcador de perfusão emergente que tem um grande potencial clínico, no entanto ainda não se encontra disponível para uso clínico9,10.
As características específicas de cada marcador, incluindo as suas vantagens e desvantagens, serão descritas abaixo e resumidas na Tabela 1. É importante perceber que nenhum dos marcadores de perfusão possui as características ideais, portanto, a escolha do marcador é multifatorial e depende de considerações práticas, bem como do objetivo do exame.
Características dos marcadores disponíveis para PET cardíaca
| H215O | 13NH3 | 82Rb | 18F‐Flupiridaz | |
|---|---|---|---|---|
| Tempo de semivida | ∼2 min | ∼10 min | 75 seg | ∼2 horas |
| Produção | Ciclotrão | Ciclotrão | Gerador | Ciclotrão |
| Tipo de stress | Farmacológico | Farmacológico | Farmacológico | Farmacológico+exercício |
| Qualidade da imagem | Razoável | Muito boa | Boa | Excelente |
| Custo | Muito elevado | Muito elevado | Elevado | Moderado |
| Status | Não aprovado | Aprovado | Aprovado | Não aprovado |
13NH3: amónia‐N13; 18F‐Flupiridaz; 82Rb: rubídio‐82; H215O: água‐O15.
O H215O é um marcador apenas utilizado na Europa e Ásia. Este marcador detém propriedades únicas para aferição do MBF nomeadamente o facto de ser metabolicamente inerte e possuir difusão livre, apresentando uma relação linear entre a perfusão e extração de primeira passagem. Outras características vantajosas deste marcador são o facto de ter um tempo de semivida curto e baixa dose de radiação, permitindo assim medições repetidas num tempo relativamente curto11. No entanto, este tempo de semivida curto apenas permite a utilização da modalidade farmacológica para induzir stress. As desvantagens para a utilização na prática clínica de rotina são o facto de requerer ciclotrão para produção, bem como a sua má relação sinal‐ruído resultando numa qualidade de imagem inadequada para avaliação9. Contudo, nos últimos anos têm surgido técnicas de subtração digital e imagens paramétricas criadas por softwares automatizados, que conseguem gerar imagens classificáveis de forma qualitativa, sendo que estes avanços poderão permitir o uso deste marcador na prática clínica futura12–14.
A 13NH3 é um marcador aprovado pela FDA desde 2000 para avaliar a perfusão miocárdica em pacientes com DAC conhecida ou suspeita15,16. Este marcador difunde‐se através do tecido capilar e intersticial para os miócitos por difusão passiva, numa relação não linear com o MBF, uma vez que ocorre o fenómeno roll‐off, sendo a retenção na primeira passagem de aproximadamente 80%. Esta retenção no miocárdio com rápida depuração do pool sanguíneo permite a obtenção de imagens de perfusão com excelente qualidade diagnóstica. Uma outra característica vantajosa da 13NH3 é o facto de o seu tempo de semivida ser mais longo, aproximadamente 10 minutos, permitindo assim o uso potencial do exercício como modalidade de stress, para além dos vasodilatadores11,17. A principal desvantagem da 13NH3 é a necessidade de ser produzido por ciclotrão, sendo que, muito embora o seu tempo de semivida seja bastante superior ao da H215O (9,96min versus 2,09min), acaba ainda assim por necessitar igualmente que o ciclotrão esteja localizado no laboratório.11
O 82Rb é um marcador aprovado pela FDA desde 1989, sendo amplamente utilizado nos EUA, Canadá e em várias regiões da Europa e Japão18. Este marcador é um análogo do potássio captado ativamente pelas células do miocárdio através do transportador Na+/K+ dependente de ATP. Uma das características do 82Rb que favorecem a sua utilização na prática clínica é o facto de ser produzido a partir de um gerador, não requerendo, portanto, um ciclotrão para a sua produção19. O seu tempo de semivida é muito curto (aproximadamente 76 segundos), permitindo apenas sequências de imagens repouso/stress com indução farmacológica, uma vez que o exercício é inviável com um tempo de semivida tão limitado11,20. Uma das grandes desvantagens do 82Rb é a sua baixa qualidade de imagem (mau contraste e má resolução espacial), consequência da sua baixa fração de extração e alta energia21.
O 18F‐flupiridaz é um novo marcador ainda não aprovado para uso clínico, mas que já se encontra em fase III dos ensaios clínicos, com resultados altamente promissores22–25. Este marcador é um análogo do piridabeno que se liga ao inibidor do complexo‐1 mitocondrial26–28. O 18F‐flupiridaz apresenta várias características que permitem obter imagens de elevada resolução e qualidade diagnóstica, nomeadamente o facto de possuir uma boa retenção na primeira passagem com lavagem lenta nos cardiomiócitos e o facto de a energia dos seus positrões ser a mais baixa de todos os marcadores10,23,29,30. Como desvantagem o 18F‐flupiridaz apresenta a necessidade de ciclotrão para produção. No entanto, como o seu tempo de semivida é o mais elevado de todos os marcadores (109,8min.), poderá permitir a utilização de ciclotrões regionais11. Assim sendo, se este marcador apresentar bom desempenho nos ensaios clínicos de fase III e receber a aprovação da FDA, poderá de facto passar a ser um marcador com elevada utilização a nível mundial.
Quantificação do fluxo sanguíneo miocárdico total (MBF) e da reserva de fluxo sanguíneo miocárdico (MFR)O suprimento sanguíneo do coração é assegurado pelas artérias coronárias e seus ramos epicárdicos. Os ramos subsequentes são cada vez menores e mais profundos (microcirculação), tipicamente com menos de 500mm de diâmetro, sendo estes os principais determinantes da resistência vascular31. A microcirculação coronária não é observada pela angiografia coronária, pela angiotomografia computadorizada ou por outros exames de imagem de rotina32. E é por este motivo que na cardiologia contemporânea, regra geral, não é tida em linha de conta na decisão terapêutica a presença de eventual disfunção microvascular.
No entanto, muito embora não exista nenhuma técnica que consiga visualizar in vivo a microcirculação, existem atualmente formas de aferir parâmetros que refletem e avaliam a presença de disfunção a este nível, nomeadamente através da aferição do fluxo sanguíneo miocárdico total (MBF). Esta avaliação é possível uma vez que existe uma autorregulação deste fluxo, no sentido de preservar o suprimento adequado de oxigénio miocárdico. Assim sendo, quando estamos na presença de artérias coronárias que possuem estenose por alteração aterosclerótica, a resistência da microcirculação é reduzida para normalizar o MBF33. Em condições de repouso, a estenose coronária necessitará de exceder 85% a 90% do diâmetro luminal antes de ocorrer uma diminuição significativa do MBF. Na condição de stress, por outro lado, o fluxo miocárdico total apresenta reduções significativas com estenose de 45% a 50%33.
Os valores de MBF, numa escala absoluta de mL/g/min, são obtidos a partir de curvas de atividade‐tempo baseadas nas imagens de transferência do marcador e na resposta do tecido miocárdico, sendo ajustadas em função de modelos cinéticos específicos validados para cada marcador15,34.
No sentido de permitir a implementação da quantificação do MBF na prática clínica, é necessária a utilização de sistemas automatizados que permitam uma análise rápida, prática e reprodutível das imagens obtidas por PET cardíaca. Vários sistemas de cálculo do MBF foram desenvolvidos15,35,36, sendo que cada um possui diferentes métodos de segmentação e amostragem da atividade do miocárdio e do pool sanguíneo para obter as curvas de atividade‐tempo. No entanto, existem elevada concordância e reprodutibilidade nos valores absolutos de MBF obtidos pelos diferentes sistemas.
Os valores de MBF obtidos são comparados com os intervalos de normalidade de fluxo fornecidos por bases de dados. Atualmente, os valores de normalidade considerados situam‐se entre 2 e 5mL/g/min em hiperemia. Esta variabilidade nos valores de normalidade é explicada pelas resistências microvasculares que dependem de características como a idade, o género e fatores de risco cardiovasculares3–5,37–39. Alternativamente é também possível interpretar os valores de MBF numa escala contínua para fins de diagnóstico e prognóstico, bem como para apoio na tomada de decisão clínica subsequente40,41.
A aferição do MBF é também passível de ser obtida por outros exames, nomeadamente pela tomografia computorizada, a ressonância magnética e a tomografia por emissão de fotão único. A viabilidade e validade das aferições de todos estes exames tem vindo a ser testada, apresentando‐se atualmente como alternativas a considerar face à quantificação por PET42–44. No entanto, existem ainda várias limitações que condicionam a aplicabilidade de forma generalizada destes: no caso da ressonância magnética a presença de etapas de pós‐processamento complexas, cobertura ventricular não volumétrica45 e a impossibilidade de ser realizada em doentes com claustrofobia, com dispositivos magnéticos e doença renal severa46; na tomografia computorizada a necessidade de elevadas doses de radiação47 e a elevada dependência em relação à frequência cardíaca48; na tomografia por emissão de fotão único a menor resolução de imagem bem como a presença de limitações em casos de alto débito49,50.
Assim sendo, a PET é considerada atualmente a referência padrão para a determinação do MBF2,8. As suas principais vantagens, por comparação com os restantes exames, são o facto de permitir protocolos curtos (30 minutos) 51, com imagens de alta resolução espacial e temporal, assim como uma baixa dose média de radiação por protocolo (1,8 mSv por comparação com 9,3 mSv na SPECT ou 3,7 a 9,6 mSv na TC)52–54. Contudo, a PET apresenta também desvantagens a considerar, nomeadamente elevados custos financeiros, o facto de requerer ciclotrão no caso da produção dos marcadores 13NH3, H215O e 18F‐flupiridaz11, bem como a exposição do doente a radiação, por comparação com a RM que não o realiza.
Um outro parâmetro possível de calcular, a partir do MBF, é a reserva de fluxo sanguíneo miocárdico (MFR). Este parâmetro representa a proporção de fluxo sanguíneo adicional, em condições de stress, que pode ser suprida ao miocárdio em comparação com o fluxo sanguíneo na condição de repouso55. O valor de MFR é influenciado não apenas pela estenose coronária, mas também por vários outros fatores incluindo frequência cardíaca, resistência coronária, circulação colateral coronária e vasodilatação coronária55–58.
Estudos de comparação com outras técnicas – FFRA avaliação do significado funcional de lesões coronárias pode ser aferida tendo em conta diversos parâmetros, nomeadamente através do fluxo de reserva coronário (FFR). O FFR é um parâmetro determinado de forma invasiva através de uma guia de pressão, aquando da realização de angiografia, tendo por base a razão entre a pressão distal e a pressão proximal à estenose, após vasodilatação máxima induzida farmacologicamente, geralmente com adenosina59.
Lesões com valores FFR < 0,8 ou < 0,75 foram associadas com isquémica induzível, sendo portanto consideradas hemodinamicamente significativas60,61. As estratégias de intervenção coronária que tiveram por base os valores de FFR obtiveram melhores resultados, por comparação com as intervenções guiadas por angiografia ou terapêutica médica isolada, em termos de prevenção de eventos cardiovasculares62,63.
Recentemente surgiu uma nova técnica de avaliação funcional como alternativa ao FFR, o instantaneous wave‐free ratio (iFR). As vantagens de não utilizar adenosina e a possibilidade de execução mais simples e rápida fazem com que esta técnica seja altamente promissora64–67, a título individual ou de forma híbrida com o FFR68,69, sendo já muito utilizada nos laboratórios de cardiologia. Os estudos comparativos entre os resultados obtidos com o iFR e com o FFR têm revelado uma elevada concordância70–73, no entanto é recomendada uma utilização prudente e crítica desta nova técnica74–76.
Em comparação com o FFR, que fornece uma medida específica de gravidade da lesão em função das alterações de pressão a nível coronário, o MFR determina o aumento do fluxo global em resposta à vasodilatação, podendo não só ser medido de forma invasiva como também de forma não invasiva, nomeadamente com recurso à PET.
Foram vários os estudos que validaram a realização de MFR, por comparação com o FFR, para aferir o significado funcional da DAC77–79, considerando que o MFR tem a vantagem de ser não invasivo, com tempos curtos e protocolos simplificados podendo facilitar a avaliação tanto para clínicos como para doentes78.
Um estudo comparativo inicial relatou uma correlação próxima entre MFR e FFR em pacientes com estenose de um vaso. No entanto, estudos posteriores realizados em pacientes com doença multivascular mostraram uma concordância apenas modesta entre MFR e FFR80, revelando assim discrepâncias na estimação do significado funcional da estenose coronária entre MFR e FFR. Esta discordância entre MFR e FFR é explicada pelo facto do FFR ser um índice específico das artérias epicárdicas, enquanto que a MFR é influenciada não só pela estenose epicárdica mas também pela função microvascular77,81.
Deste modo, para além da aplicação individual de cada um dos parâmetros, a utilização conjunta do MFR e do FFR pode ajudar a avançar na compreensão da fisiologia coronária, oferecendo uma oportunidade para melhorar os resultados dos pacientes através da identificação dos alvos para terapias médicas, bem como das melhores opções de intervenção82.
Reserva de fluxo sanguíneo miocárdico – Uma mais‐valia na deteção da doença multivascular equilibrada e doença microvascularA obtenção da imagem de perfusão do miocárdio (MPI) usando a PET tem demonstrado ser um poderoso e versátil exame complementar, uma vez que permite aferir de forma não invasiva o significado funcional da lesão. No entanto esta avaliação é realizada, regra geral, apenas em termos «relativos», ou seja, de forma semiquantitativa que é necessariamente dependente do operador. A realização dessa avaliação pressupõe que as regiões do miocárdio que apresentam a maior captação do marcador de perfusão sejam supridas por artérias coronárias epicárdicas visualmente normais e, portanto, não obstrutivas. O restante miocárdio é então normalizado para a região identificada como referência. Assim sendo, as regiões miocárdicas com diminuição da captação do marcador de perfusão são consideradas supridas por lesões epicárdicas obstrutivas. No entanto é preciso ter em conta que este tipo de avaliação apenas semiquantitativa apresenta algumas limitações, nomeadamente: (1) uma subestimação da extensão da isquémia e da aterosclerose obstrutiva no cenário de DAC multivascular equilibrada e (2) incapacidade de identificar pacientes com doença microvascular na ausência de aterosclerose obstrutiva.
No caso da doença arterial coronária que afete os três principais vasos, esta pode originar uma perfusão diminuída equilibrada em todos os territórios vasculares podendo levar a uma MPI relativa aparentemente «normal», sem defeitos visualmente identificáveis. Foram vários os estudos (Tabela 2) que face a esta limitação da análise visual ou semiquantitativa tentaram investigar soluções para aumentar a capacidade diagnóstica nestes casos.
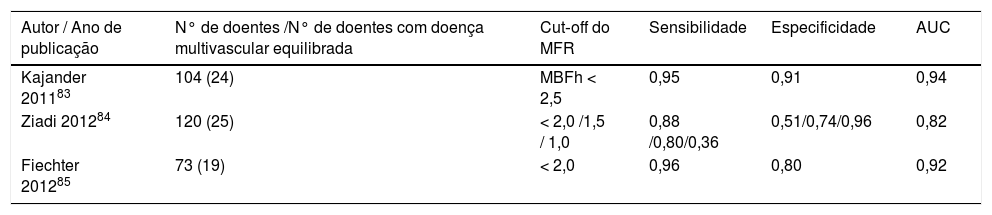
Valor diagnóstico do MFR na doença coronária multivascular
| Autor / Ano de publicação | N° de doentes /N° de doentes com doença multivascular equilibrada | Cut‐off do MFR | Sensibilidade | Especificidade | AUC |
|---|---|---|---|---|---|
| Kajander 201183 | 104 (24) | MBFh < 2,5 | 0,95 | 0,91 | 0,94 |
| Ziadi 201284 | 120 (25) | < 2,0 /1,5 / 1,0 | 0,88 /0,80/0,36 | 0,51/0,74/0,96 | 0,82 |
| Fiechter 201285 | 73 (19) | < 2,0 | 0,96 | 0,80 | 0,92 |
AUC: Área sob a curva; MBFh: Fluxo sanguíneo miocárdico total hiperemico; MFR: Fluxo sanguíneo de reserva miocárdico.
Em 2011 uma investigação levada a cabo por Kajander et al. em Turku, na Finlândia, com aferição do MBF por PET com H215O, em 104 doentes com DAC, concluiu que este parâmetro permitia, por comparação com a análise semiquantitativa do mesmo exame, uma maior acuidade diagnóstica. A análise semiquantitaviva apresentou valores de sensibilidade de 74% e especificidade de 73%, enquanto que a análise com recurso ao cálculo do MBF obteve, respetivamente, 95% e 91%. Assim sendo, estes investigadores concluíram que a aferição do MBF tem um grande impacto na interpretação funcional da perfusão do miocárdio com especial relevância na doença multivascular, que era significativamente mais diagnosticada por comparação com a análise semiquantitativa da imagem83.
Um estudo publicado no ano seguinte, em 2012, por Ziadi et al. concluiu que a quantificação do MFR < 2,0 era um preditor independente de doença coronária multivascular equilibrada superior à avaliação apenas relativa da imagem. Neste estudo realizado na University of Ottawa Heart Institut, no Canadá, onde foram avaliados 120 doentes com DAC conhecida ou suspeita por angiografia e PET com 82Rb, foi demonstrado também que o MFR é significativamente menor em doentes com doença de três vasos por comparação com doentes sem doença, possuindo uma sensibilidade diagnóstica de 88%84.
Ainda em 2012, outro estudo realizado com 13NH3 PET em Zurique, na Suíça, por Fiechter et al., com 73 doentes, comprovou também a maior acuidade diagnóstica na deteção de DAC calculando o MFR por comparação com a análise semiquantitativa. Neste estudo, 30% dos doentes, inicialmente classificados como não portadores de DAC com base na análise inicial semiquantitativa, foram através do recurso ao cálculo do MFR diagnosticados com DAC multivascular, ocorrendo assim um aumento na sensibilidade diagnóstica de 79% para 96%85.
Os estudos descritos e resumidos na Tabela 2 apontam no sentido de que a avaliação da quantificação absoluta do MFR aumenta a capacidade diagnóstica em relação à análise qualitativa ou semiquantitativa, que atualmente acontece na maioria dos laboratórios contemporâneos de cardiologia quando realizam PET cardíaca para avaliar os doentes com doença cardíaca suspeita ou estabelecida. Todos os estudos avaliados apresentam valores de área sob a curva > 0,80, sendo que dois deles inclusivamente apresentam valores > 0,90. Tendo em conta que este parâmetro estatístico reflete a acuidade global, uma vez que considera tanto a sensibilidade como a especificidade, estas investigações concluíram que a aferição do MFR apresenta uma elevada capacidade diagnóstica na deteção de doença multivascular equilibrada. Por outro lado, foram também reportados aumentos na sensibilidade e especificidade por comparação com a avaliação semiquantitativa, demonstrando a potencialidade da aferição do MFR no diagnóstico destes doentes. No entanto, e dado que os valores apresentados possuem alguma discrepância, é recomendável a realização de mais estudos para se definir de forma mais clara e consistente o valor incremental do MFR nesta patologia.
A doença microvascular na ausência de doença aterosclerótica epicárdica obstrutiva apresenta‐se também como um enorme desafio para os cardiologistas, uma vez que os exames não invasivos utilizados na prática clínica não conseguem, através da análise visual obtida, aferir a presença desta patologia. E é a doença microvascular a primeira alteração na escalada da DAC, sendo que a sua deteção pode permitir maximizar a capacidade diagnóstica precoce da DAC.
De facto, vários estudos (Tabela 3) foram realizados no sentido de perceber se o diagnóstico da DAC numa fase inicial, sem alterações significativas detetáveis na angiografia ou na MPI semiquantitativa, permitiria realizar uma melhor estratificação de risco bem como uma melhor avaliação prognóstica desses mesmos doentes. Em todas estas investigações não foram incluídos doentes com enfarte agudo do miocárdio prévio, com revascularização cardíaca ou com doença valvular conhecida.
Valor diagnóstico e prognóstico do MFR na doença coronária microvascular
| Autor / Ano de publicação | N° de doentes | Cut‐off do MFR | Seguimento médio (anos) | End‐point | HR |
|---|---|---|---|---|---|
| Naya 201386 | 901 | < 2,0 | 1,5 | MACE | 3,1 |
| Murthy 201487 | 1208 | < 2,0 | 1,3 | MACE | 0,8 para um aumento de 10% no MFR |
| Taqueti 201588 | 761 | < 2,0 | 2,8 | MACE | 2,25 |
| Taqueti 201889 | 201 | < 2,0 | 4,1 | MACE | 2,47 |
HR: Hazard ratio; MACE: Major cardiac events; MFR: Fluxo sanguíneo de reserva miocárdico.
Um estudo publicado em 2013 por Naya et al., com 901 indivíduos com DAC suspeita e MPI PET normal, comprovou que a presença de MFR comprometido, e não a extensão dos depósitos de cálcio, melhorou significativamente a estratificação de risco para estes doentes. Nesta investigação verificou‐se que para qualquer nível de score de cálcio coronário, a presença de MFR diminuído (< 2) foi consistentemente associada a uma taxa mais elevada de eventos cardíacos major (MACE), refletindo assim os efeitos combinados da aterosclerose não obstrutiva difusa e da disfunção microvascular coronária no prognóstico destes doentes.86
No ano seguinte, em 2014, Murthy et al. estudaram também uma coorte de 1218 indivíduos com DAC suspeita e com MPI por PET normais. Este estudo verificou também que um MFR comprometido (< 2) estava independentemente associado a MACE, sendo que esse fenótipo foi bastante prevalente, apresentando‐se em mais de 50% dos doentes87.
Em 2015 foram também publicados os resultados obtidos numa coorte de 761 indivíduos com dor torácica ou dispneia com probabilidade intermediária pré‐teste para DAC, mas com MPI por PET dentro dos parâmetros de normalidade semiquantitativa. Neste estudo, Taqueti et al. concluíram que um MFR diminuído (< 2) estava independentemente associado com MACE e com presença de troponinas positivas. Foi também possível aferir neste estudo que a presença de um MFR diminuído, reflexo das alterações microvasculares nestes doentes, era um marcador mais efetivo para MACE que a troponina positiva, de tal forma que apenas os doentes com troponina positiva e com comprometimento concomitante no MFR tiveram piores desfechos na população estudada88.
Um estudo publicado no fim de 2017 estudou, durante uma média de quatro anos, 201 indivíduos com DAC suspeita, mas sem estenose limitante de fluxo e sem diminuição de fração de ejeção do ventrículo esquerdo e com MPI por PET dentro dos parâmetros de normalidade. O principal objetivo a que o estudo se propôs era o de perceber se nestes doentes o cálculo do MFR era uma mais‐valia diagnóstica para a doença microvascular que permitisse estratificar o risco futuro para eventos MACE, hospitalização por insuficiência cardíaca com fração de ejeção preservada e disfunção diastólica. Taqueti et al. aferiram que a presença de MFR diminuído (< 2) nos doentes estava independentemente associado a todos estes outcomes89.
Os estudos descritos e resumidos na Tabela 3 evidenciam o acréscimo que a quantificação do MFR poderá representar na deteção da DAC numa fase inicial, através da identificação de doentes com disfunção microvascular. Todas as investigações, com cut‐off < 2 no MFR e end‐point MACE, obtiveram um hazard ratio (HR) > 1, o que significa que esta aferição se associa de forma muito consistente com um pior prognóstico. Deste modo, a quantificação do MFR nestes doentes permitiu uma caracterização e estratificação de risco mais detalhada da DAC.
Mais estudos deverão ser realizados no sentido de se poder definir de forma clara como selecionar os doentes que beneficiarão com esta quantificação, podendo assim criar algoritmos claros e exequíveis em ambiente clínico. Por outro lado, a evolução da relação custo/benefício da quantificação do MBF e MFR por PET será também, no futuro, um fator crucial na implementação desta tecnologia de forma mais ampla a nível mundial.
Considerações finaisAtualmente a mortalidade associada à DAC mantém‐se elevada, apesar dos progressos terapêuticos e das intervenções profiláticas. Deste modo, o seu correto diagnóstico através de métodos que avaliem não só alterações a nível anatómico, mas também repercussões na sua capacidade funcional, principalmente em estádios iniciais, é um recurso promissor para tentar diminuir o número de mortes associado a esta patologia.
A utilização da PET cardíaca, com a quantificação do MBF e MFR, tem comprovado ser um incremento potencial na caracterização e diagnóstico da DAC, com especial relevância na doença multivascular equilibrada e microvascular.
Apesar da sua elevada acuidade diagnóstica na quantificação de isquemia, a utilização na prática clínica da PET cardíaca com análise do fluxo miocárdico em termos absolutos encontra‐se dependente de uma maior disponibilidade do exame. Assim, são necessários mais estudos que possam definir quais os doentes com maior benefício da análise desta técnica e que devemos então selecionar preferencialmente para a quantificação do fluxo miocárdico por PET.
Conflitos de interesseOs autores declaram não haver conflito de interesses.