Determinar a prevalência de microalbuminúria (MAU) em doentes hipertensos (HTA) e/ou diabéticos tipo 2 (DM2) e em normotensos não diabéticos (grupo controlo). Como objetivos secundários, analisar as diferenças de distribuição da MAU nas quatro subpopulações e observar a associação de variáveis clínicas e epidemiológicas diversas com a MAU.
MétodosO RACE (micRoAlbuminsCreeningsurvEy) é um estudo epidemiológico descritivo, observacional de corte transversal, multicêntrico, que incluiu doentes acompanhados nos Cuidados de Saúde Primários (CSP) em Portugal. Os doentes com causas potenciais de falsos positivos para MAU foram excluídos. As avaliações principais foram a frequência da MAU, determinada pelo teste da tira reativa Micral‐Test®, a pressão arterial (PA), as variáveis demográficas, as doenças concomitantes, a medicação cardiovascular e antidiabética e as variáveis bioquímicas.
ResultadosUm total de 9198 participantes (3769 hipertensos, 3100 diabéticos tipo 2 hipertensos, 423 diabéticos normotensos e 1906 controlos), 54,7% do sexo feminino, foram incluídos na análise primária. A prevalência de MAU foi de 58% nos doentes com HTA+DM2, 51% nos doentes com DM2, 43% nos doentes com HTA e de 12% no grupo controlo (χ2: p<0,001 para todos os subgrupos). Numa análise multivariada, os preditores de MAU foram presença de DM2 ou de HTA, a HbA1c, o sexo masculino, a idade, a PA sistólica e o colesterol total.
ConclusõesA MAU é extremamente frequente nos doentes em CSP com diabetes e/ou hipertensão, particularmente em doentes com HTA e DM2 com risco cardiovascular elevado. O rastreio da MAU poderá facilitar a identificação de indivíduos em risco e aumenta a atenção para a doença renal e as lesões nos órgãos alvo.
To determine the prevalence of microalbuminuria (MAU) in outpatients with hypertension and/or type 2 diabetes mellitus (DM) and in normotensive, non‐diabetic outpatients (control group); and, as secondary objectives, to examine the differences in the distribution of MAU in the four subgroups and the association of different clinical and epidemiological variables with MAU.
MethodsRACE (micRoAlbumin sCreening survEy) was a multicenter, descriptive observational cross‐sectional study, which enrolled outpatients followed in primary care in Portugal. Patients with potential reasons for a false‐positive MAU test were excluded. The main outcome measures were the prevalence of MAU as assessed by Micral® test strips and blood pressure. Demographic variables, presence of comorbidities, use of cardiovascular and antidiabetic drugs and biochemical variables were also analyzed.
ResultsA total of 9198 patients (3769 with hypertension, 3100 with both DM and hypertension, 423 with DM and without hypertension, and 1906 controls), 54.7% women, were included in the primary analysis. Overall prevalence of MAU was 58% in patients with DM and hypertension, 51% in patients with DM, 43% in patients with hypertension, and 12% in controls (chi‐square: p<0.001 for all subgroups). In multivariate analysis, predictors for MAU were the presence of DM or hypertension, HbA1C, male gender, age, systolic blood pressure and total cholesterol.
ConclusionsMAU is extremely common in outpatients with DM and/or hypertension followed in primary care, especially in those with both hypertension and DM and high cardiovascular risk. MAU screening would help identify individuals at risk and increase awareness of kidney disease and target organ damage.
Antidiabéticos orais
Acidente isquémico transitório
Acidente vascular cerebral
Cuidados de saúde primários
Doença arterial coronária
Diabetes tipo 2
Doença vascular periférica
Hemoglobina glicada
Hipertensão
Hipertrofia ventricular esquerda
Insuficiência cardíaca
Índice de massa corporal
Lesão de órgão alvo
Microalbuminúria
Pressão arterial
Dados recentes sublinham a importância da microalbuminúria (MAU) como um significativo marcador de risco cardiovascular, tanto em hipertensos, como em diabéticos, e também – de uma forma global – na população em geral1–6. Estudos clínicos aludiram à associação da MAU com a hipertrofia ventricular esquerda, com o aumento da espessura da íntima‐média carotídea e com múltiplos estados cardiovasculares subclínicos, em doentes com um risco cardiovascular elevado7–11. Complementando, vários estudos epidemiológicos e experimentais – especialmente em doentes de risco – sublinharam a relação da excreção urinária de albumina com a maior incidência de mortalidade cardiovascular e total2,6,11–14, com efeito independente e cumulativo com a redução da função renal13–15; a associação da excreção urinária de albumina com o aumento da mortalidade cardiovascular, em indivíduos de risco elevado, foi afirmada mesmo com níveis de albuminúria inferiores aos habitualmente referidos como MAU13,16,17.
Desta forma, a identificação da albuminúria, justificadamente indicada nas recomendações mais recentes11 permite identificar, de forma rápida e precisa, os indivíduos merecedores de uma estratégia mais efetiva da redução de risco, em especial em prevenção primária (e é um bom aferidor complementar de risco em prevenção secundária). Apesar disso, tal gesto é frequentemente menos valorizado na prática clínica18. De alguma forma, o reconhecimento da albuminúria como marcador de lesão de órgão alvo (LOA) e fator prognóstico significativo é ainda, comummente, mitigado.
Os dados acerca da prevalência de albuminúria (e de MAU) em Portugal são escassos e os resultados, fruto de metodologias diversas e de heterogeneidades das populações, são frequentemente díspares8.
O estudo RACE (micRoAlbuminsCreeningsurvEy), apresentado aqui, é um estudo epidemiológico observacional que pretendeu (objetivo primário) determinar a prevalência da MAU em doentes hipertensos e/ou diabéticos tipo 2 e em normotensos não diabéticos acompanhados nos cuidados de saúde primários (CSP) em Portugal. Secundariamente, aspira a analisar as diferenças de distribuição da MAU nas quatro subpopulações consideradas e, ao mesmo tempo, examinar a associação de variáveis clínicas e epidemiológicas diversas com a MAU, em cada uma das subpopulações.
MétodosO estudo adotou as normas internacionais relativas a estudos epidemiológicos, contidas na International Guidelines for Ethical Review of Epidemiological Studies (Council for the International Organizations of Medical Sciences – CIOMS‐Genebra, 1991), em concordância com os princípios da Declaração de Helsínquia e em obediência com a International Conference on Harmonization of Good Clinical Practice (ICH GCP). Todos os participantes assinaram um consentimento informado, que documentou a sua participação voluntária. A recolha de dados obedeceu ao parecer positivo da Comissão Nacional de Proteção de Dados.
DoentesOs participantes elegíveis tiveram de integrar uma das quatro subpopulações (doentes hipertensos, doentes diabéticos tipo 2, doentes hipertensos e diabéticos tipo 2 e indivíduos normotensos não diabéticos), e de cumprir os critérios de inclusão e exclusão.
Os critérios de inclusão dos doentes hipertensos e/ou diabéticos tipo 2 foram: homens e mulheres com idade ≥18 anos, hipertensão arterial (pressão arterial [PA] ≥140/90mmHg ou a receber tratamento anti‐hipertensor) e/ou diabetes mellitus tipo 2 diagnosticada (glicemia em jejum ≥126mg/dl ou ≥200mg/dl 2 horas após sobrecarga de glicose ou a receber tratamento com antidiabéticos orais [ADO] e/ou insulina) e análises disponíveis nos últimos 12 meses. As mulheres grávidas, menstruadas ou a amamentar, assim como os doentes com acompanhamento regular em consulta de Nefrologia, com doença febril ou infeção concomitante do trato urinário, com diabetes tipo 1, com doenças autoimunes ou a receber tratamento com oxitetraciclina ou com atividade física intensa nas últimas 24 horas foram inelegíveis (critérios de exclusão), pela maior probabilidade da presença de falso‐positivos para a MAU.
Para inclusão no grupo controlo, os indivíduos, homens e mulheres, deveriam ter pelo menos 18 anos de idade e ter PA<140/90mm Hg, glicemia em jejum <110mg/dl e não estarem medicados com fármacos anti‐hipertensores ou com ADO (ou insulina).
Desenho do estudo e procedimentosO estudo RACE foi um estudo epidemiológico descritivo, observacional de corte transversal, multicêntrico. O recrutamento decorreu entre outubro de 2010 e janeiro de 2011 e nele participaram 469 médicos (145 da região Norte, 150 da Região Centro, 101 da Região de Lisboa, 36 do Alentejo, 17 do Algarve, 7 da Região Autónoma da Madeira e 13 da Região Autónoma dos Açores).
Para minimizar um potencial viés de seleção, cada médico registou todos os critérios de inclusão e exclusão dos quatro primeiros doentes de cada dia de consulta, até recrutar 20 participantes que cumpriam os critérios de inclusão do respetivo grupo e não apresentavam nenhum dos critérios de exclusão. Dos 20 participantes elegíveis, 15 deveriam pertencer ao grupo dos doentes com hipertensão arterial e/ou diabetes mellitus tipo 2 e 5 ao grupo controlo dos normotensos não diabéticos. O não cumprimento de todos os critérios colocava‐os como não ilegíveis (screening failure).
Para assegurar a consistência de resultados, todos os centros realizaram o rastreio da MAU através do teste de tiras reativas (dipstick) Micral‐Test®, com uma sensibilidade superior a 80% 19,20, e seguindo uma atuação padronizada na recolha da amostra e na execução do teste. Os níveis possíveis de MAU considerados, além do registo <20mg/l (resultado negativo), foram ≥20mg/l e <50mg/l, ≥50mg/l e <100mg/l e, finalmente, ≥100mg/dl; os resultados foram depois inseridos no registo dos doentes. Além disso, foram recolhidas as seguintes variáveis: demográficas (idade, sexo, peso, altura, índice de massa corporal [IMC], hábitos tabágicos e exercício físico); doenças concomitantes (dislipidemia, acidente vascular cerebral [AVC]/acidente isquémico transitório [AIT], doença vascular periférica[DVP], doença arterial coronária [DAC], hipertrofia ventricular esquerda [HVE], insuficiência cardíaca [IC] ou outra); medicação para o aparelho cardiovascular: antidislipidémicos, fármacos anti‐hipertensores, digitálicos, antiarrítmicos e antianginosos; anticoagulantes, antiagregantes plaquetários; ADO ou insulina. Foram feitas duas medições da PA, com um intervalo de, pelo menos, um minuto, seguindo os procedimentos habituais. Foram também recolhidas as seguintes variáveis analíticas: glicemia em jejum, hemoglobina glicada (HbA1c), creatinina sérica, colesterol total, HDL‐colesterol, LDL‐colesterol e triglicerídeos, se foram, pelo menos, avaliadas uma vez nos últimos 12 meses.
Análise estatística e tamanho da amostraO tamanho da amostra foi definido tendo em vista a estimativa para quatro subpopulações estudadas (hipertensos, diabéticos, hipertensos diabéticos e controlo). A prevalência de MAU calculada foi de 4 a 46%, tendo sido considerado este último valor para a estimativa do tamanho da amostra. Com um erro de amostragem de 5% (para 95% de intervalo de confiança), seriam necessárias 382 pessoas por região (correspondendo a cinco regiões NUTII+regiões autónomas) e por subpopulação. Para cada região seriam incluídos 1528 participantes e, na totalidade das regiões, 9168 participantes; assumindo que 10% não estariam disponíveis, o tamanho global da amostra deveria ser de 10 085 participantes.
Foram criadas estatísticas descritivas de todos os dados recolhidos. Para as variáveis quantitativas determinaram‐se a média, a mediana e o desvio padrão. Para os dados qualitativos, calcularam‐se as frequências absolutas e relativas. As estimativas dos parâmetros foram sempre acompanhadas dos intervalos de confiança com 95%. Foram realizados testes de normalidade das variáveis quantitativas (Kolmogorov‐Smirnov test), testes bivariados (t‐tests, ANOVA, teste χ2) e análises multivariadas de acordo com os objetivos do estudo. Os fatores independentes associados a MAU foram obtidos através de um modelo de regressão logística multivariável passo a passo regressiva de Wald (p=0,05 para inclusão e 0,10 para exclusão de variáveis). O nível de significância (α) para todas as análises foi de 0,05 (bilateral).
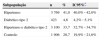
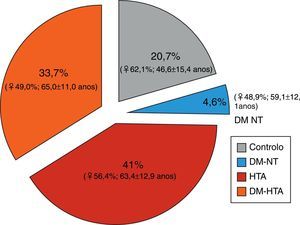
ResultadosPopulação em estudo, dados demográficos e antecedentes cardiovascularesDurante os três meses e duas semanas em que decorreu o estudo foram incluídos um total de 11 288 participantes; 1 641 (14,5%) foram não ilegíveis. Foram incluídos na análise 9198 participantes, sendo que 41% eram hipertensos (n=3769), 33,7% eram hipertensos diabéticos (n=3100), 4,6% eram diabéticos tipo 2 normotensos (n=423) e os restantes 20,7% pertenciam ao grupo controlo (normotensos não diabéticos; n=1906) (Tabela 1). O sumário dos dados demográficos está representado na Figura 1.
Distribuição da amostra total pelos 4 grupos em análise
| Subpopulação | n | % | IC95%* |
|---|---|---|---|
| Hipertenso | 3 769 | 41,0 | 40,0% ‐ 42,0% |
| Diabético tipo 2 | 423 | 4,6 | 4,2% ‐ 5,1% |
| Hipertenso e diabético tipo 2 | 3 100 | 33,7 | 32,7% ‐ 34,7% |
| Controlo | 1 906 | 20,7 | 19,9% ‐ 21,6% |
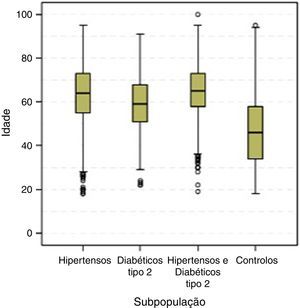
Globalmente, e de acordo com a distribuição por géneros, houve um discreto predomínio do sexo feminino (54,7%), particularmente (significativamente mais elevado) nos grupos controlo e hipertenso. Anote‐se que a subpopulação de diabéticos tipo 2 é a única em que a distribuição por género não difere significativamente da população portuguesa (Tabela 2). A comparação da média e da mediana de idades nos quatro subgrupos são apresentados na Tabela 3 e Figura 2. A idade (quando comparadas as medianas) difere significativamente em todas as subpopulações (p<0,001); a subpopulação de hipertensos diabéticos é significativamente mais velha (idade média: 65±11,1 anos), logo seguida da população de hipertensos (idade média: 63,4±12,9 anos), de diabéticos (idade média: 59±12,2 anos) e, por fim, do grupo controlo (idade média: 46,6±15,4 anos).
Distribuição da amostra por género em cada um dos grupos em análise
| Subpopulação | Género | n | % | p* | p** |
|---|---|---|---|---|---|
| Hipertenso | Masculino | 1 644 | 43,6 | <0,001 | <0,001 |
| Feminino | 2 125 | 56,4 | |||
| Diabético tipo 2 | Masculino | 216 | 51,1 | 0,697 | 0,179 |
| Feminino | 207 | 48,9 | |||
| Hipertenso e Diabético tipo 2 | Masculino | 1 581 | 51,0 | 0,273 | <0,001 |
| Feminino | 1 519 | 49,0 | |||
| Controlo | Masculino | 722 | 37,9 | <0,001 | <0,001 |
| Feminino | 1 184 | 62,1 |
Comparação da idade (anos) nos quatro subgrupos em análise
| Subpopulação | n | Dados omissos | Média (± DP) | Mediana (P25‐P75) | Mín.‐Máx. | P* |
|---|---|---|---|---|---|---|
| Hipertensos | 3 768 | 1 | 63,4 (±12,9) | 64b (55‐73) | 18‐95 | <0,001 |
| Diabéticos tipo 2 | 423 | 0 | 59,1 (±12,2) | 59c (51‐68) | 22‐91 | |
| Hipertensos e diabéticos tipo 2 | 3 098 | 2 | 65,0 (±11,1) | 65a (58‐73) | 19‐100 | |
| Controlos | 1 905 | 1 | 46,6(±15,4) | 46d (34‐58) | 18‐95 |
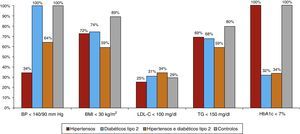
A maioria dos hipertensos tinham a hipertensão não controlada (PA<140/90mm Hg em 34%); na população diabética tipo 2 hipertensa o controlo da PA era melhor (63,7% destes participantes tinham uma PA<140/90mm Hg). Cerca de um terço ou mais dos participantes eram obesos; a percentagem de indivíduos obesos foi mais acentuada nos hipertensos diabéticos tipo 2 (59% aparentaram um IMC<30kg/m2). O controlo glicémico era também muito deficitário (HbA1c<7% em 32‐33% dos diabéticos). Num sentido global, a dislipidemia esteve presente em 73% da subpopulação de hipertensos diabéticos tipo 2, em 62,5% dos hipertensos não diabéticos e em 51% dos diabéticos tipo 2 normotensos. Mais de 60% da população mantinha um LDL‐colesterol<130mg/dl. No entanto, tendo em conta o perfil de risco da população em análise, LDL‐colesterol<100mg/dl só se verificou em 25% dos hipertensos, 31% dos diabéticos tipo 2 normotensos e 34% dos diabéticos hipertensos. A presença de valores tendencialmente favoráveis de triglicerídeos (< 150mg/dl) foi comum nesta população (e menos presente nos diabéticos hipertensos) (Figura 3). Quanto aos hábitos tabágicos, os fumadores foram mais prevalentes no grupo controlo (16%) e menos frequentes nos restantes subgrupos (11% nos diabéticos tipo 2, 10% nos hipertensos e 9,3% nos hipertensos diabéticos).
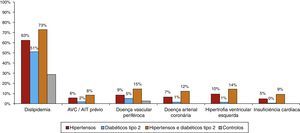
A Figura 4 resume as doenças concomitantes por subpopulação. O AVC/AIT prévio foi muito raro no grupo de controlo e atingiu uma proporção mais elevada (8,3%) no subgrupo dos hipertensos diabéticos tipo 2. A DVP e DAC eram também muito marginais no grupo controlo. A prevalência de DVP foi de 14,7% nos hipertensos diabéticos tipo 2, 9% nos hipertensos e 5,4% nos diabéticos tipo 2 normotensos. A maior prevalência de DAC verificou‐se na subpopulação de hipertensos diabéticos tipo 2 (12,3%).
Só um por cento dos controlos tinham HVE. Este valor remontou aos 9,9% nos hipertensos e 14,4% nos hipertensos diabéticos (no total, a frequência de HVE nos hipertensos foi de 11,9%); a prevalência nos diabéticos tipo 2 normotensos foi também muito baixa (1,4%). Por último, 9,4% dos diabéticos tipo 2 hipertensos tinham antecedentes de IC, com valores muito inferiores nos hipertensos não diabéticos (4,9%) e diabéticos normotensos (0,2%).
Finalmente, uma nota para a doença renal crónica (DRC); 17,8% dos hipertensos, diabéticos e não diabéticos, tinham DRC (estádio 3), com uma taxa de filtração glomerular (TFG) estimada<60ml/min/1,73 m2.
Risco cardiovascular global e medicação cardiovascular e antidiabéticaCotejando este perfil de fatores de risco – com um controlo muito deficitário – e a coexistência de outras doenças cardiovasculares, esta população tinha um perfil de risco global cardiovascular muito elevado. De acordo com os critérios definidos em 2012, pelas sociedades científicas europeias, de aferição do risco cardiovascular11,21, dos 8 823 doentes incluídos na análise (em 375 doentes não foi possível avaliar o risco) 22,3% tinham um risco cardiovascular muito elevado, 39,6% tinham um risco elevado (o que significa que, no total, 61,9% dos doentes tinham um risco elevado ou muito elevado), 18% um risco moderado e só 20,2% um risco baixo.
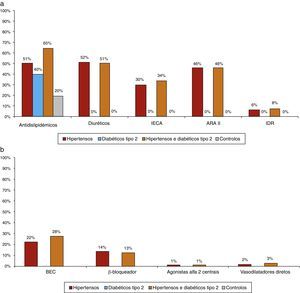
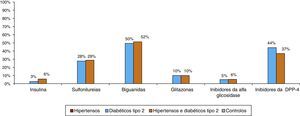
A maioria dos doentes estava medicada com fármacos cardiovasculares, nomeadamente antidislipidémicos (50,5% dos hipertensos e 64,9% dos hipertensos diabéticos tipo 2 estavam medicados com um antidislipidémico, tal como a 40,4% dos diabéticos normotensos e a 19,7% dos controlos), e anti‐hipertensores (nomeadamente moduladores do eixo renina‐angiotensina, prescritos em 84,8% dos hipertensos: 37,5% com inibidores da enzima de conversão da angiotensina, 54,3% com antagonistas dos recetores da angiotensina e 8,2% com inibidor direto da renina) (Figuras 5a e 5b). Na totalidade dos hipertensos (n=6 869), diabéticos ou não, 11,3% não estavam medicados. Dos 88,7% dos hipertensos medicados com, pelo menos, um anti‐hipertensor, 30% estavam a fazer um único anti‐hipertensor (monoterapia) – dos quais 54,6% mantinham valores tensionais não controlados –, 46% dois fármacos (combinações terapêuticas) e 24% mais de 2 anti‐hipertensores. O padrão de utilização de ADO nos diabéticos tipo 2, hipertensos ou não, está representado na Figura 6; de notar que não houve diferenças relevantes na prescrição destes fármacos nestas 2 subpopulações.
a) Percentagem de doentes medicados com antidislipidémicos, diuréticos e moduladores do eixo renina‐angiotensina por subpopulação b) Percentagem de doentes medicados com outros anti‐hipertensores por subpopulação.
Abreviaturas: ARA ‐ antagonista dos recetores da angiotensina; BEC ‐ bloqueador da entrada do cálcio (antagonistas do cálcio); IDR ‐ inibidor direto da renina; IECA ‐ inibidor da enzima de conversão da angiotensina.
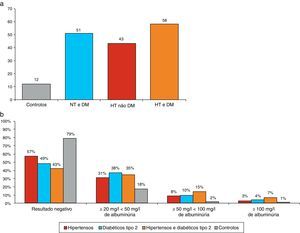
Na Figura 7a está indicada a frequência da MAU nas diferentes subpopulações. A frequência de MAU foi mais elevada nos hipertensos diabéticos tipo 2 com 58%, valor muito próximo do registado nos diabéticos tipo 2, normotensos (51%). A frequência de MAU nos hipertensos não diabéticos foi de 43% (na totalidade dos hipertensos, a frequência de MAU foi de 49,3%), marcadamente diversa dos 12% registados no grupo controlo. Estas diferenças entre subpopulações foram significativas (χ2: p<0,001). Na Figura 7b destaca‐se a distribuição percentual dos valores de MAU de acordo com os registados com recurso à tira reativa de análise urinária. Como se pode verificar 42,5% dos hipertensos, não diabéticos, tiveram um teste positivo para a MAU, valor ligeiramente inferior aos encontrados nos diabéticos tipo 2 (51,4%) e nos hipertensos diabéticos (57,6%); um teste positivo de MAU ocorreu em 20,6% dos indivíduos do grupo controlo.
Com recurso ao modelo de regressão logística, estiveram associados à positividade da tira reativa para a MAU os seguintes fatores (Tabela 4): ser diabético tipo 2 (OR=3,675; p<0,001), ser hipertenso (OR=2,350; p<0,001) e, curiosamente, ser hipertenso medicado com bloqueadores dos canais do cálcio (OR=1,261; p=0,039) ou com antiagregantes plaquetários (OR=1,391; p=0,001). Além disso, outros fatores estiveram também significativamente associados: idade, sexo masculino, HbA1c, colesterol total e a PA sistólica.
Análise multivariada (regressão logística multivariável) de fatores associados a positividade na microalbuminúria
| Variáveis | OR | IC95% OR | p |
|---|---|---|---|
| Idade (anos) | 1,012 | 1,004 ‐ 1,021 | 0,005 |
| Masculino | 1,253 | 1,044 ‐ 1,505 | 0,016 |
| HbA1c (%) | 1,320 | 1,192 ‐ 1,462 | <0,001 |
| Colesterol total (md/dL) | 1,004 | 1,001 ‐ 1,006 | 0,004 |
| Colesterol HDL (md/dl) | 0,990 | 0,982 ‐ 0,999 | 0,032 |
| Pressão sistólica (mmHg) | 1,016 | 1,010 ‐ 1,022 | <0,001 |
| Hipertenso | 2,350 | 1,494 ‐ 3,697 | <0,001 |
| Diabético tipo 2 | 3,675 | 2,140 ‐ 6,311 | <0,001 |
| Hipertenso e diabético tipo 2 | 0,295 | 0,172 ‐ 0,505 | <0,001 |
| Hipertenso+bloqueadores dos canais de cálcio | 1,261 | 1,012 ‐ 1,571 | 0,039 |
| Hipertenso+antiagregantes plaquetários | 1,391 | 1,135 ‐ 1,705 | 0,001 |
AUC=0,715 (IC95%: 0,694‐0,736); p (teste Hosmer e Lemeshow)=0,723; R2 (Cox e Snell)=14,30%; R2 (Nagelkerke)=19,30%.
Apesar da reconhecida importância da MAU como marcador de risco cardiovascular e de mortalidade total, nos doentes hipertensos, nos diabéticos e na população geral22,23, os dados acerca da sua prevalência em indivíduos de risco elevado não são muito abundantes. Os dados publicados variam marcadamente (desde os 4 até aos 46%)24, não facultando uma ideia concreta acerca do problema. Num estudo multicêntrico recente8 – com alguns pontos de semelhança e também, no caso, recorrendo à tira reativa urinária – a prevalência global de MAU foi de 58,4% (com valores muito variáveis, de 53‐71%, nos diferentes países).
Os dados de prevalência de MAU em Portugal são ainda mais escassos. Num trabalho que recrutou 1582 diabéticos hipertensos (a quase totalidade medicados com anti‐hipertensores; 41% com a PA controlada), a taxa de testes positivos (com o Micral‐Test®) para a MAU foi de 29%18. No nosso estudo, em doentes maioritariamente com um risco cardiovascular elevado, a frequência de MAU foi mais elevada, oscilando entre 43% nos hipertensos não diabéticos e os 58% nos diabéticos tipo 2 hipertensos. Tendo em conta que a MAU reflete, de algum modo, os efeitos deletérios a longo prazo sobre o sistema cardiovascular – desde a disfunção endotelial vascular sistémica à lesão renal (com disfunção dos podocitos e da função de barreia glomerular)25,26–, estes resultados fazem pressupor uma elevada carga de risco na população acompanhada em CSP em Portugal.
A aparente dissensão na prevalência de MAU nos diversos estudos – e também entre os resultados agora apresentados e outros trabalhos – podem e devem ser imputados a diferenças nas características das populações estudadas.
Naturalmente, a elevada prevalência, agora apontada, tem de ser concatenada com a população incluída no estudo (o que pode, de alguma forma, impedir uma possível generalização de resultados): 41% dos doentes eram hipertensos e 34% eram diabéticos tipo 2 hipertensos (só 4,2% eram diabéticos normotensos); com idade média ≥60 anos; com um controlo deficitário dos fatores de risco (hipertensão arterial, dislipidemia e hiperglicemia); com uma significativa prevalência de doenças concomitantes; com o uso moderado de fármacos anti‐hipertensores, estatinas ou ADO, em particular de fármacos «nefroprotetores», redutores da proteinúria (moduladores do SRAA e estatinas); e com uma acentuada preferência por doentes com perfil de risco cardiovascular alto (40%) ou muito alto (22%). De notar que os doentes com acompanhamento regular em consulta de Nefrologia foram excluídos, podendo prever‐se que os doentes com conhecimento de doença renal crónica (e MAU) possam não estar representados nesta população (apesar disso, quase 18% dos hipertensos incluídos tinham uma TFG<60ml/min/1,73m2).
Da análise dos resultados, ressalta a relação entre a presença de MAU e o género masculino, a presença de diabetes ou de hipertensão arterial – em particular com a PA sistólica e com a HbA1c –, e o uso de bloqueadores dos canais do cálcio ou com antiagregantes plaquetários, em perfeita consonância com outros estudos8 e reforçando a importância – reconhecida, mas frequentemente descurada – do controlo efetivo dos fatores de risco cardiovascular. De notar, que a relação da MAU com a prescrição de alguns grupos farmacológicos, mais do que derivar de algum efeito farmacológico mais ou menos reconhecido, pode resultar da severidade da doença de base (por exemplo, diabetes e hipertensão) e da concomitância de outras doenças ou LOA.
Apesar de o elevado número de indivíduos incluídos que, de alguma forma, reflete a prática médica diária, o que constitui um ponto importante do presente estudo, a sua interpretação deve ter em conta também algumas limitações. Em primeiro lugar, a população incluída proveio de doentes que recorreram, nesse período, a cuidados médicos, o que pode ter, potencialmente, introduzido algum viés de seleção. Por outro lado, no nosso estudo, a pesquisa da MAU só foi feita uma única vez. As recomendações científicas sugerem a repetição – uma ou duas vezes – do teste para afirmar a sua positividade. Desta forma, dos nossos dados não se pode ter uma quantificação exata de quantos doentes teriam uma avaliação positiva ou negativa numa segunda ocasião. No entanto, alguns dados sugerem que o cumprimento deste requisito só reduz o ponto de prevalência em um quinto ou, no máximo, em um terço27,28. Reconheçamos, entretanto, que muitas das situações arroladas a aumentos transitórios da excreção urinária de albumina foram suprimidas pelos critérios de exclusão seguidos no estudo. Finalmente, a natureza transversal do estudo não permite estabelecer relações de causalidade entre a MAU e as LOA ou as doenças cardiovasculares concomitantes, que só será possível afirmar com estudos longitudinais desenhados para o efeito. Estão, no entanto, programadas (e em realização) análises subsequentes acerca do valor preditor prognóstico da MAU nesta população20.
ConclusõesOs resultados do estudo RACE demonstram que a MAU é especialmente frequente nos doentes em CSP, particularmente em doentes hipertensos e diabéticos com risco cardiovascular elevado. O uso por rotina da tira de teste reativa para a MAU facilita o rastreio de indivíduos em risco e aumenta a atenção para a doença renal e LOA. Os doentes com MAU têm, muito comummente, outros fatores de risco; a MAU facilita a estratificação apurada do risco e aprimora a decisão terapêutica. É necessário – e fundamental – estimular o conhecimento, incentivar o tratamento efetivo e melhorar a prevenção cardiovascular.
Conflitos de InteressesA autora Teresa Carqueja é colaboradora da Novartis Farma ‐ Produtos Farmacêuticos S.A.
Os autores agradecem a colaboração de todos os Investigadores do estudo pela inclusão e recolha de informação dos doentes incluídos. Os autores agradecem igualmente a todos os doentes que participaram neste estudo.