A tromboembolia pulmonar (TEP) é uma emergência cardiovascular comum que, juntamente com a hipertensão pulmonar tromboembólica crónica (HPTEC), se associa a alta mortalidade e morbilidade. Não há ainda consenso quanto à consecutividade destas patologias. Este estudo pretende determinar a incidência e fatores de risco para o desenvolvimento de hipertensão pulmonar (HTP) após uma TEP de risco intermédio a elevado.
MétodosEstudámos retrospetivamente 213 doentes com TEP de risco intermédio a elevado, entre 2000-2010, e comparamos dados demográficos, clínicos, laboratoriais e imagiológicos entre os doentes que manifestaram HTP durante o seguimento clínico (doentes que, pelo menos três meses após a alta, mantivessem pressões sistólicas na artéria pulmonar acima de 40mmHg, estimadas por ecocardiografia) com os doentes que mantiveram pressões normais.
ResultadosIdentificou-se HTP após a TEP em 12,4% dos doentes. Foram fatores preditores para o desenvolvimento desta complicação a idade (hazard ratio [HR] 1,09 [intervalo de confiança {IC} 95% 1,02-1,20] por ano de idade, p=0,012) e o índice de massa corporal (HR 1,19 [IC 95% 1,04-1,36] por kgm−2, p=0,013).
ConclusõesA HTP após uma TEP foi uma complicação relativamente comum na nossa série de doentes com um episódio agudo de TEP de risco intermédio a elevado. Identificamos como fatores preditores do desenvolvimento desta complicação a idade avançada e a obesidade.
Pulmonary embolism (PE) is a common cardiovascular emergency that, when combined with chronic thromboembolic pulmonary hypertension (PH), is associated with high mortality and morbidity. We aimed to determine the incidence of and predisposing factors for the development of PH after a PE episode.
MethodsA retrospective study was conducted in 213 patients admitted to an intensive care unit with intermediate-to-high risk PE between 2000 and 2010. Clinical data at admission were collected and the incidence of PH as assessed by echocardiography (estimated pulmonary systolic artery pressure over 40 mmHg) was determined. Multivariate analysis was used to determine predictors of development of PH.
ResultsPH was detected in 12.4% of patients after a mean follow-up of three years. Only age (hazard ratio [HR] 1.09, 95% confidence interval [CI] 1.02-1.20 per year; p=0.012) and body mass index (HR 1.19, 95% CI 1.04-1.36) per kg/m2, p=0.013) emerged as independent predictors of the development of this complication during follow-up.
ConclusionsPH after PE was a relatively common complication in our series. We identified advanced age and increased body mass index as predisposing factors.
A tromboembolia pulmonar (TEP) é uma emergência cardiovascular comum, caracterizada pela oclusão por um êmbolo do lúmen arterial pulmonar. Esta obstrução aguda pode conduzir à falência ventricular direita que, apesar de potencialmente mortal, é passível de reversibilidade1. A mortalidade por TEP é de cerca de 12/10 000 pessoas por ano2-4, sendo que a taxa de mortalidade associada a um episódio agudo pode chegar aos 60%5.
À admissão, a apresentação clínica permite estratificar os doentes quanto ao risco de morte a curto prazo. Deste modo, os doentes que se apresentem em choque ou hipotensos são considerados de alto risco; os restantes dividem-se em risco intermédio (caso haja evidência de disfunção do ventrículo direito e/ou lesão miocárdica) ou em baixo risco (sem choque, hipotensão, disfunção ventricular direita ou marcadores de lesão miocárdica)6. A anticoagulação deve ser instituída ab initio, ainda durante o processo diagnóstico, caso se determine uma probabilidade alta ou intermédia de TEP, enquanto a terapêutica fibrinolítica deve ser reservada para doentes de alto risco (classe I) e para alguns doentes de risco intermédio (classe IIb), na ausência de contraindicações6. A fibrinólise provou conduzir a uma diminuição mais rápida dos defeitos de perfusão e da disfunção ventricular direita, mas não da mortalidade em doentes de risco intermédio7.
Embora se admita que na maioria dos doentes ocorra resolução do quadro de oclusão arterial pulmonar em cerca de 6-12 meses, o desenvolvimento de hipertensão pulmonar tromboembólica crónica (HPTEC) parece ser uma extensão da história natural após um episódio agudo de TEP7. Contudo, não há consenso quanto à sua incidência, que varia entre 0,6-7,0%7-11. A associação entre TEP e HPTEC pode chegar a apresentar taxas de mortalidade de 70-90%12, mas se corretamente identificados, a maioria dos doentes pode ser tratada recorrendo à endarterectomia pulmonar13. O continuum fisiopatológico entre as duas entidades parece ser influenciado não só pela incorreta resolução do quadro agudo obstrutivo e endotelização de trombos que ocluem ou estreitam as artérias pulmonares, mas também por alterações histológicas da microvasculatura pulmonar14. Foram descritos alguns fatores de risco que favorecem a evolução de um episódio de TEP agudo para a cronicidade, tais como a idade (mais jovem10 ou mais avançada15), a história de TEP prévia10, a presença de um defeito de perfusão extenso10, a apresentação idiopática9,10, a pressão sistólica da artéria pulmonar (PSAP) à admissão superior ou igual a 50mmHg11,16 e as dimensões do trombo inicial13. No entanto, o critério de seleção dos doentes nestes trabalhos foi pouco específico relativamente à estratificação de risco da TEP à admissão7–11.
O objetivo deste estudo é a determinação de fatores de risco de desenvolvimento de hipertensão pulmonar (HTP) numa população de doentes que apresentou um episódio agudo de TEP de risco intermédio a elevado.
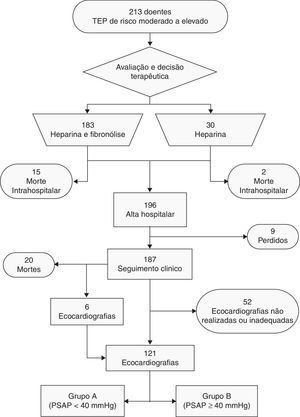
MétodosColheita de dadosPrecedeu-se a uma análise retrospetiva de uma base de dados prospetivamente contruída de 213 doentes, consecutivamente internados na unidade de cuidados intensivos coronários (UCIC) dos Hospitais da Universidade de Coimbra (HUC) com o diagnóstico de TEP de risco intermédio a elevado, entre 13 de maio de 2000 e 15 de outubro de 2010. O diagnóstico foi confirmado por angiografia tomográfica assistida por computador (angio-TC) ou cintigrafia de ventilação/perfusão. Os dados clínicos dos doentes recolhidos à data de admissão permitiram determinar a posteriori a estratificação do risco, aplicando as normas de orientação clínicas atuais6. Os dados foram complementados por análise individual dos processos clínicos dos doentes. A decisão para a realização de tratamento fibrinolítico com alteplase (Actylise®, Boheringer Ingelheim, Alemanha) esteve a cargo do médico assistente. A maioria dos doentes recebeu tratamento fibrinolítico (n=183). Inicialmente, os doentes foram anticoagulados com heparina não fracionada, à qual se associou anticoagulação oral com varfarina. Foi instituído suporte inotrópico, vasopressor e ventilatório de acordo com a avaliação clínica.
Foram considerados os seguintes fatores de risco para TEP: idade avançada (≥80 anos), obesidade, varizes dos membros inferiores, imobilidade recente, trombofilia conhecida, tromboembolismo venoso prévio, gravidez, toma de contracetivos orais, doença neoplásica conhecida, insuficiência cardíaca, traumatismo major ou cirurgia major recentes. Foram também recolhidas outras variáveis demográficas, clínicas, laboratoriais e imagiológicas. Foram considerados obesos os doentes com valores de índice de massa corporal (IMC) ≥30kg/m−2. Realizou-se um seguimento clínico com uma duração mediana de três anos para 187 dos 196 doentes que tiveram alta (95,4%).
Ecocardiografia transtorácicaO diagnóstico de HTP foi considerado para os doentes com PSAP ≥40mmHg, estimada em ecocardiografia transtorácica através da análise do gradiente de pressão de regurgitação tricúspide, pela fórmula PSAP =4 (VTR)2 + pressão venosa central. A pressão venosa central foi estimada de acordo com a análise da cinética da veia cava inferior17. O tempo mediano até à realização da ecocardiografia foi de 22 (13-38) meses, com um máximo de 137 meses. Foram consideradas válidas as ecocardiografias executadas no hospital, no mínimo três meses após a alta do doente; dos 187 doentes, 121 (56,8% do total) cumpriram estes requisitos. Nos indivíduos que realizaram múltiplas ecocardiografias durante o seguimento clínico, somente a mais recente foi considerada. Este processo permitiu distribuir os doentes por dois grupos: grupo A (PSAP <40mmHg), com 106 doentes (87,6%) e grupo B (PSAP ≥40mmHg), com 15 doentes (12,4%).
Análise estatísticaAs variáveis contínuas com distribuição normal foram expressas em média ± desvio padrão, enquanto as variáveis com distribuição não normal foram avaliadas pelo teste de Kolmogorov-Smirnov e expressas em mediana (intervalo interquartil). As variáveis categóricas foram apresentadas sob a forma de valores absolutos e percentagens. As comparações entre grupos foram feitas utilizando o teste t de Student, U de Mann-Whitney ou X-quadrado, de acordo com o tipo de variável. Em todos os testes foram considerados significativos os valores de p inferiores a 0,05. Os parâmetros que, em análise univariada, demonstraram associação com o desenvolvimento de HTP durante o período de seguimento clínico com um valor p inferior a 0,05 foram incluídos num modelo de análise multivariada. Os melhores pontos de corte para cada uma dessas varáveis foram determinados utilizando curvas receiver-operating characteristics (ROC). Foi utilizado, para análise estatística, o software SPSS 20.0 (Chicago, Illinois, EUA).
ResultadosDados demográficos e clínicosNo total, 213 doentes foram incluídos neste estudo (61,5% mulheres), com uma idade média de 61,1±18,1 anos (Figura 1). A maioria dos doentes (90,6%) apresentava pelo menos um fator de risco para TEP, enquanto 20 casos (9,4%) foram considerados idiopáticos; esta frequência não se mostrou significativamente diferente entre os doentes com ou sem hipertensão pulmonar após a TEP (13,2 versus 6,7%; p=0,692).
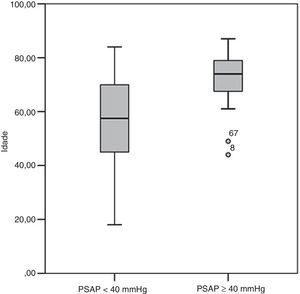
Dos fatores de risco para TEP (Tabela 1), observaram-se diferenças significativas entre os dois grupos relativamente à idade e à utilização de contracetivos orais. No grupo A, menos de 3% dos doentes tinham, à data de diagnóstico da TEP, idade superior a 79 anos, contrastando a frequência relativa de 53,3% determinada nos indivíduos do grupo B. A comparação das médias de idades permitiu determinar que os doentes do grupo B eram mais idosos do que os doentes do grupo A (70,7±11,8 versus 54,7±17,3 anos; p<0,001) à data do diagnóstico de TEP (Figura 2). No grupo B, nenhum dos doentes estava medicado com contracetivos orais à admissão, ao passo que esta característica foi identificada em cerca de um quarto dos doentes do grupo A. Os restantes fatores de risco apresentaram-se em frequência semelhante nos dois grupos. No grupo B encontrou-se uma maior proporção de indivíduos do sexo masculino (60,0 versus 31,1%, p=0,041).
Frequência dos fatores de risco para TEP nos dois grupos em estudo
| Variável | Grupo A / (n=106) (%) | Grupo B / (n=15) (%) | p |
| Idade ≥80 anos, n | 3/106 (2,83) | 8/15 (53,33) | 0,002 |
| Trombofilia, n | 2/106 (1,89) | 0/15 (0) | 1,000 |
| Varizes dos membros inferiores | 27/106 (27,36) | 3/15 (20,00) | 0,760 |
| TEV prévio, n | 29/106 (27,36) | 2/15 (13,33) | 0,350 |
| Gravidez, n | 1/106 (0,94) | 0/15 (0) | 1,000 |
| Contracetivos orais, n | 27/106 (25,47) | 0/15 (0) | 0,022 |
| Doença neoplásica, n | 11/106 (10,38) | 0/15 (0) | 0,356 |
| Insuficiência cardíaca, n | 8/106 (7,55) | 0/15 (0) | 0,594 |
| Traumatismo major, n | 12/106 (11,32) | 1/15 (6,66) | 1,000 |
| Cirurgia major, n | 20/106 (18,87) | 1/15 (6,66) | 1,000 |
| Idiopática, n | 14/106 (13,21) | 1/15 (6,66) | 0,691 |
TEV: tromboembolismo venoso.
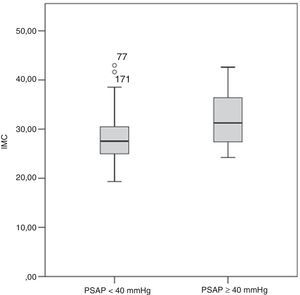
O grupo B apresentava um IMC mais elevado (31,3 [27,3-37,8] versus 27,6 [25,0-30,8] kg.m−2, p=0,036) e consequentemente uma maior incidência de obesidade (66,7% versus 29,63%, p=0,023) comparativamente ao grupo A (Figura 3 eTabela 2). À admissão, os doentes do grupo A registaram uma pressão arterial sistólica significativamente mais baixa do que os doentes do grupo B (113 [110-140] versus 140 [120-152] mmHg; p=0,027). Uma minoria dos doentes (5,6%) apresentou-se hipotenso à admissão, pelo que foram diagnosticados com TEP de risco elevado; destes, 50% faleceram antes da realização da ecocardiografia de seguimento clínico (três durante o internamento e três após a alta hospitalar). Nenhum dos seis sobreviventes de TEP de risco elevado desenvolveu hipertensão pulmonar durante o seguimento clínico.
Características dos doentes à admissão
| Variável | Grupo A (n=106) | Grupo B (n=15) | p |
| Idade | |||
| Média, mmHg | 54,66±17,29 | 70,73±11,76 | 0,000 |
| ≥68 anos, n (%) | 29/106 (27,36) | 11/15 (73,33) | 0,001 |
| Género | |||
| Masculino, n (%) | 33/106 (31,13) | 9/15 (60) | 0,041 |
| Feminino, n (%) | 73/106 (68,87) | 6/15 (40) | |
| IMC | |||
| Média, kg/m2 | 27,55 (24,97-30,81) | 31,25 (27,27-37,72) | 0,036 |
| IMC ≥30 kg/m2, n | 24/81 (29,63%) | 8/12 (66,67%) | 0,023 |
| FC, bpm | 94,00 (80,00-104,50) | 97 (85,00-101,50) | 0,714 |
| TA sistólica | |||
| Média, mmHg | 122,50 (110,00-140,00) | 140,00 (120,00-152,00) | 0,027 |
| <90mmHg, n | 6/106 (5,66%) | 0/15 (0,00%) | 0,594 |
| ≥135mmHg, n | 32/106 (30,19%) | 10/15 (66,67%) | 0,009 |
| Antecedentes | |||
| TEP, n | 5/106 (4,72%) | 0/15 (0,00%) | 1,000 |
| HTA, n | 49/106 (46,23%) | 11/15 (73,33%) | 0,058 |
FC: frequência cardíaca; HTA: hipertensão arterial; IMC: índice de massa corporal; TA: tensão arterial; TEP: tromboembolia pulmonar.
A avaliação dos dados da gasimetria arterial não detetou diferenças entre os dois grupos. Contudo, os doentes do grupo B apresentavam valores de hemoglobina superiores aos do grupo A (15,1 versus 13,3g.dL−1, p=0,014). Não se demonstraram diferenças significativas entre os dois grupos quer relativamente aos achados imagiológicos à admissão quer quanto à abordagem terapêutica, nomeadamente relativamente à utilização de fibrinolíticos (Tabelas 3 e 4). Durante o período de seguimento clínico, as recidivas de TEP nos dois grupos foram semelhantes, com sete casos (6,6%) no grupo A e um caso (6,7%) no grupo B.
Exames complementares de diagnóstico dos doentes à admissão
| Variável | Grupo A (n=106) | Grupo B (n=15) | p |
| Gasometria arterial | |||
| Saturação O2, % | 93,70 (90,18-95,40) | 92,00 (88,93-94,15) | 0,275 |
| pO2, mmHg | 62,70 (52,88-71,33) | 61,15 (53,40-67,43) | 0,722 |
| pCO2, mmHg | 31,50 (28,10-35,00) | 32,55 (28,00-37,68) | 0,483 |
| HCO3−, mEq/L | 21,95 (19,95-23,75) | 22,20 (19,53-23,35) | 0,986 |
| Sangue venoso | |||
| Hemoglobina, g/dL | 13,30 (12,20-14,48) | 15,10 (12,20-16,00) | 0,014 |
| Plaquetas, 109/L | 225,00 (174,00-275,00) | 190,00 (171,00-224,00) | 0,079 |
| Troponina I, ng/mL | 0,15 (0,05-0,46) | 0,36 (0,04-1,75) | 0,538 |
| D-Dímeros, μg/mL | 5,35 (3,50-10,03) | 8,00 (5,60-23,10) | 0,073 |
| Fibrinogénio, mg/dL | 3,75 (3,00-4,65) | 3,40 (2,85-4,29) | 0,649 |
| INR | 1,17 (1,07-1,30) | 1,25 (1,10-1,42) | 0,224 |
| TTPa, seg | 27,30 (24,33-32,78) | 30,60 (26,90-33,00) | 0,153 |
| Ecocardiograma | |||
| PSAP média, mmHg | 51,01±14,49 | 56,64±23,30 | 0,453 |
| PSAP ≥40mmHg, n (%) | 58/74 (78,38) | 9/11 (81,82) | 1,000 |
| PSAP ≥50mmHg, n (%) | 34/74 (45,95) | 5/11 (45,45) | 1,000 |
| Angio-TAC | |||
| Trombo nos ramos principais, n (%) | 66/78 (84,62) | 7/10 (70,00) | 0,365 |
INR: índice internacional normalizado; pCO2: pressão parcial de dióxido de carbono; pO2: pressão parcial de oxigénio; PSAP: pressão sistólica arterial pulmonar; TTPa: tempo de tromboplastina parcial ativado.
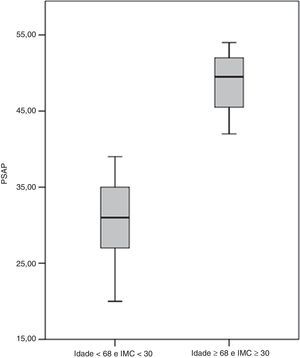
Incluíram-se na análise multivariável os seguintes parâmetros: idade (p=0,001), género (p=0,041), IMC (p=0,036), pressão arterial sistólica (p=0,027), hemoglobina (p=0,014) e utilização de contracetivos orais (p=0,022). Foram preditores de desenvolvimento de HTP a idade e o IMC. Dessa forma, calculou-se um hazard ratio de 1,09 (intervalo de confiança [IC] 95% 1,02-1,20; p=0,012) por cada ano de idade e de 1,19 (IC95% 1,04-1,36; p=0,013) por cada unidade de kg.m−2 de IMC. A Figura 4 reflete a diferença significativa (p<0,001) entre a PSAP dos doentes com idade inferior a 68 anos e IMC inferior a 30kg.m−2(31,2±4,6mmHg) e a dos doentes com idade igual ou superior a 68 anos e IMC igual ou superior a 30kg.m−2 (48,8±5,0mmHg).
DiscussãoNeste trabalho, identificámos fatores de risco para o desenvolvimento de HTP após TEP de risco intermédio a elevado numa coorte de 213 doentes maioritariamente submetidos a tratamento fibrinolítico. Em 12,4% dos 121 doentes que realizaram ecocardiografia foi detetada HTP, tendo sido identificados como fatores de risco para o seu desenvolvimento a idade avançada e a obesidade.
A incidência de HTP na nossa série é superior a outras publicadas na literatura. Em 2004, Pengo et al. relata uma incidência significativamente inferior (1,0% aos seis meses e 3,8% aos dois anos)10; no entanto, tal como Kline et al.7 (7,0%)7 e Klok et al.8 (0,6%), não apresenta dados relativamente à estratificação do risco de mortalidade da TEP à admissão. O mesmo se aplica ao trabalho de Becattini et al.9, que apresenta uma menor incidência de HTP pós-TEP (0,8% a três anos). Esta incidência mais baixa pode dever-se ao facto de terem sido realizadas ecocardiografias apenas a doentes que manifestassem dispneia persistente no seguimento clínico. No entanto, os doentes com HTP podem permanecer assintomáticos durante meses ou anos, habitualmente apresentando-se numa fase tardia da doença18. Dado que por vezes o único sinal evidente é a acentuação do componente pulmonar do segundo som cardíaco, a exclusiva seleção de doentes sintomáticos para a realização da ecocardiografia poderá ter subestimado a sua verdadeira incidência.
Na nossa população, a idade demonstrou ser um fator preditor de desenvolvimento de HTP após uma TEP, em concordância com os achados de Ribeiro et al.11, que constataram que uma idade superior a 70 anos é um fator de risco para o desenvolvimento de HPTEC. Paradoxalmente, Pengo et al10. descreve uma maior incidência de HPTEC nos doentes mais jovens à data de diagnóstico de TEP. Esta maior incidência de HTP nos doentes idosos pode tanto dever-se a uma maior incidência de fenómenos tromboembólicos de repetição, que são mais frequentes nesta idade12. Deve salientar-se que como a maioria dos estudos foi feito apenas com recurso a ecocardiografia, não podem ser excluídas outras formas de HTP que poderão contribuir para a elevação da pressão pulmonar, como a disfunção diastólica do ventrículo esquerdo19. Serão necessários mais dados para determinar o verdadeiro impacto da idade como fator de risco para a progressão para HPTEC.
A obesidade foi também identificada como fator de risco para o desenvolvimento de HTP pós-TEP. Verificámos que cada incremento de uma unidade no IMC aumentava em cerca de 20% a probabilidade de desenvolver HTP após uma TEP. Este dado é particularmente interessante, pois não se encontra anteriormente descrito na literatura. Algumas explicações podem ser avançadas para explicar esta associação. A dislipidémia, fortemente relacionada com a obesidade20, poderá condicionar a remodelação da microvasculatura pulmonar a jusante da obstrução, que se encontra associada não só à HPTEC como a outras causas de HTP14. De facto, por cada incremento de uma unidade no IMC, verifica-se elevação da PSAP de 0,1-0,4mmHg21. A obesidade pode contribuir de outras formas para o desenvolvimento de HTP, quer pelo aumento do débito cardíaco22 quer pela comorbilidade com outras causas bem conhecidas de HTP, nomeadamente a apneia obstrutiva do sono ou a insuficiência cardíaca diastólica17.
Na nossa população, a história prévia de TEP, a presença de uma TEP idiopática ou de um defeito de perfusão extenso, descritos como fatores de risco para o desenvolvimento de HPTEC10, não apresentaram diferenças estatisticamente significativas entre os dois grupos em estudo (assumindo que a presença de trombos nos ramos principais revela uma obstrução anatomicamente extensa). Analogamente, não se comprovou a relação com as dimensões do trombo inicial13 e também não foi possível demonstrar diferenças significativas na PSAP à admissão relativamente à incidência de HPTEC, tal como descrevem outros autores11. Contudo, a ausência destas associações deve ser interpretada à luz da gravidade clínica da grande maioria dos doentes aquando do diagnóstico, reflexo da deposição de um trombo de dimensões suficientemente elevadas para obstruir os ramos major da árvore vascular pulmonar e provocar um extenso defeito de perfusão. Este quadro condicionou um maior recurso à fibrinólise, permitindo uma mais rápida resolução do quadro obstrutivo quando comparado ao tratamento apenas com heparina6. Note-se a elevada taxa de doentes fibrinolisados no nosso estudo (86%) quando em comparação com outras séries publicadas na literatura (7-41%7,9–11)). Há, no entanto, dados preliminares que sugerem que a fibrinólise poderá estar eventualmente associada a menor incidência de HPTEC23.
A HPTEC é a única forma curável de hipertensão pulmonar, tornando fulcral o seu diagnóstico preciso e atempado. Este pode permitir a realização da endarterectomia pulmonar, uma técnica cirúrgica complexa mas que permite a recuperação total da capacidade funcional dos doentes e com uma mortalidade inferior a 5% nos centros de referência17,23. Para a minoria de doentes não operáveis, os fármacos vasodilatadores pulmonares podem ter indicação17. O riociguat, um estimulador da guanilato ciclase solúvel, demonstrou recentemente num ensaio clínico multicêntrico (CHEST-1) que melhora a capacidade funcional de doentes com HPTEC não-operável, avaliada através do teste de marcha dos seis minutos24.
Pelo facto de ter um desenho retrospetivo, este trabalho tem várias limitações. Consideramos que a principal limitação é o facto de o diagnóstico de HTP ter sido realizado por ecocardiografia e não por cateterismo direito, o método gold-standard6. Deste modo, além da possibilidade de alguns doentes serem falsos-positivos ou falsos negativos, não foi também possível identificar outras causas concomitantes de HTP, como disfunção ventricular esquerda. Salientamos que um diagnóstico de HPTEC apenas poderá ser confirmado ou excluído com segurança recorrendo à cintigrafia de ventilação-perfusão (ou à angiografia pulmonar) em associação com um cateterismo direito. A utilização da angio-TC nesta indicação está associada a uma taxa que pode chegar aos 50% de falsos negativos25. Desde modo, preferimos utilizar a nomenclatura HTP após-TEP, pois o diagnóstico de HPTEC (Grupo 4) exige as referidas técnicas diagnósticas. Outra limitação consiste na ausência de follow-up ecocardiográfico de parte da população em estudo, que pode induzir um viés na prevalência de HTP. Apenas a realização de um protocolo prospetivo poderá mitigar esta importante limitação.
Consideramos, no entanto, que a descrição pela primeira vez da prevalência de HTP pós-TEP de risco intermédio a grave pode despertar a atenção para este problema. Uma prevalência de cerca de 10% a três anos poderá motivar o seguimento clínico cuidadoso destes doentes, nomeadamente daqueles mais idosos e/ou mais obesos. Naturalmente, a realização do diagnóstico diferencial com outras causas de HTP mantém-se crítica para a correta seleção destes doentes para intervenções cirúrgicas ou médicas.
ConclusõesNa nossa população, a prevalência de HTP após um episódio agudo de TEP de risco intermédio a elevado foi de 12%. Foram fatores preditores para o seu desenvolvimento a idade avançada e a obesidade. Os nossos dados sugerem que doentes mais idosos e/ou mais obesos devem ser sujeitos a uma cuidadosa vigilância clínica e ecocardiográfica após uma TEP, pois este poderá possibilitar a identificação precoce de HTP, eventualmente permitindo atuar em fases mais iniciais da doença.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos de seu centro de trabalho acerca da publicação dos dados de pacientes e que todos os pacientes incluídos no estudo receberam informações suficientes e deram o seu consentimento informado por escrito para participar nesse estudo.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesOs autores declaram não haver conflito de interesses.