A não compactação isolada do ventrículo esquerdo (NCIVE) é uma cardiomiopatia rara, caracterizada pela presença de trabeculações miocárdicas proeminentes e recessos intertrabeculares profundos que comunicam com a cavidade ventricular. A existência de diferentes critérios de diagnóstico, bem como a ausência de recomendações consensuais relativas à sua terapêutica, têm contribuído para que sejam descritas séries de doentes com características clínicas e prognósticos distintos, o que dificulta o reconhecimento da verdadeira história natural desta patologia. Este trabalho tem por objetivo contribuir para a caracterização da NCIVE, através da descrição de uma população afetada, no que se refere à sua apresentação clínica, diagnóstico, estratificação de risco, terapêutica instituída e seguimento. A propósito da revisão dos casos, é feita uma discussão da literatura atual mais relevante acerca do tema.
Isolated left ventricular noncompaction (LVNC) is a rare cardiomyopathy characterized by excessive and prominent trabeculations associated with deep recesses that communicate with the ventricular cavity. Determining the natural history of this condition has been hampered by differences in clinical features and prognosis in published series, which are partly the result of differing diagnostic criteria and the lack of management guidelines. This work aims to contribute to the characterization of isolated LVNC by analyzing an affected population in terms of clinical presentation, diagnosis, risk stratification, treatment and follow-up. We also discuss the most relevant data from the literature concerning this cardiomyopathy.
A não compactação isolada do ventrículo esquerdo (NCIVE) é uma cardiomiopatia rara, que se caracteriza pela presença de trabeculações miocárdicas proeminentes e recessos intertrabeculares profundos, que comunicam com a cavidade ventricular mas não com a circulação coronária.
A sua verdadeira prevalência é desconhecida. O maior conhecimento desta patologia por parte da comunidade médica, assim como a evolução das técnicas de imagem, têm conduzido a um número crescente de casos reportados, embora se acredite que esta cardiomiopatia esteja, ainda, subdiagnosticada.
As manifestações clínicas mais frequentes são a insuficiência cardíaca, as arritmias ventriculares e os fenómenos tromboembólicos.
O diagnóstico é tradicionalmente efetuado por ecocardiograma, embora a ressonância magnética nuclear (RMN) esteja a assumir um papel cada vez mais relevante neste domínio.
Apesar de o interesse crescente despertado por esta cardiomiopatia, a sua história natural é pouco clara e a melhor estratégia terapêutica ainda está por definir.
Este trabalho tem por objetivo descrever a população de doentes com NCIVE seguidos no nosso centro, no que refere à sua apresentação clínica, diagnóstico, estratificação de risco, terapêutica instituída e evolução clínica. Paralelamente, procede-se à discussão da literatura atual mais relevante acerca deste tema.
Material e métodosAnalisamos retrospetivamente os registos clínicos dos doentes com o diagnóstico de NCIVE seguidos na consulta externa de Cardiologia do nosso hospital, até dezembro de 2011.
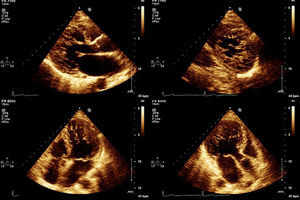
Todos os doentes foram avaliados por ecocardiograma bidimensional com Doppler codificado a cor (ecocardiógrafos iE33, Philips Medical Systems). Em todos, o estudo foi complementado com ecocardiografia tridimensional e, num doente, foi utilizado contraste para exclusão de trombo intraventricular. Foram considerados os critérios de diagnóstico de Jenni: relação entre a espessura da camada não compactada e a espessura da camada compactada>2 (medidas em sístole), presença de numerosas trabeculações proeminentes e de recessos intertrabeculares profundos preenchidos por sangue da cavidade ventricular (demonstrado no Doppler a cor), ausência de anomalias estruturais cardíacas associadas1.
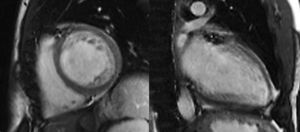
Em todos os doentes, o diagnóstico foi confirmado por RMN (1.5-Tesla Magneton Symphony, Siemens Medical Solutions). Foram utilizados os critérios de Petersen: relação entre a espessura da camada não compactada e a espessura da camada compactada>2,3 (medidas em telediástole)2.
Todos os doentes realizaram eletrocardiograma (ECG) basal e monitorização ambulatória por Holter. A realização de prova de esforço ou prova cardiopulmonar seguiu o critério do médico assistente.
Os doentes com compromisso da função sistólica do ventrículo esquerdo (VE) foram avaliados por tomografia computadorizada multidetetores (TCMD) ou cateterismo cardíaco para despiste de doença coronária.
A realização de estudo eletrofisiológico (EEF) para estratificação de risco arrítmico ficou à consideração do médico assistente. O protocolo de estimulação elétrica programada pré-estabelecido consistiu em dois ciclos base e dois extraestímulos prolongados até ao período refratário ventricular ou até ao acoplamento mínimo de 200 mseg.
A todos os doentes foi proposto o rastreio ecocardiográfico dos familiares em primeiro grau.
Os doentes índex com formas familiares de NCIVE realizaram estudo genético com pesquisa de mutações nos genes TAZ e LDB3.
O tempo mediano de seguimento foi de 36,5 meses (8-53 meses).
ResultadosAté dezembro de 2011, foram diagnosticados 10 doentes (primeiro caso em julho de 2007), todos de raça caucasiana, 6 do sexo masculino (60%), com idade mediana de 48 anos (13-72 anos).
À data do diagnóstico, 4 doentes apresentavam queixas de insuficiência cardíaca: um encontrava-se em classe iii da New York Heart Association (NYHA) e 3 em classe ii. Nos restantes doentes, a indicação para realização de ecocardiograma foi diversa (Tabela 1). Uma jovem de 18 anos referia episódios de síncope, tendo sido documentado um episódio de taquicardia ventricular (TV) monomórfica sustentada numa prova de esforço. Dois doentes apresentavam queixas de palpitações, tendo sido documentada fibrilhação auricular (FA) paroxística num deles e não se identificando nenhuma arritmia no outro. Um doente referia queixas de dor torácica atípica. Um adolescente de 13 anos foi diagnosticado na sequência de uma avaliação médico-desportiva. Um doente foi identificado através do rastreio familiar de um caso índex.
Características clínicas da população
| D | Idade | Sexo | Raça | Indicação para ecocardiograma | Dismorfias faciais | Forma familiar |
| 1 | 32 | M | Caucasiana | Dor torácica | Sim | Sim |
| 2 | 34 | F | Caucasiana | Palpitações | Não | Não |
| 3 | 72 | F | Caucasiana | IC (classe ii) | Não | Não |
| 4 | 58 | M | Caucasiana | Rastreio familiar | Sim | Sim (pai de D1) |
| 5 | 18 | F | Caucasiana | Síncope (TVS documentada) | Não | Não |
| 6 | 56 | M | Caucasiana | IC (classe iii) | Não | Não |
| 7 | 13 | M | Caucasiana | Avaliação médico-desportiva | Não | Não |
| 8 | 68 | M | Caucasiana | IC (classe ii) | Não | Não |
| 9 | 40 | M | Caucasiana | Palpitações (FA paroxística) | Sim | Sim |
| 10 | 57 | F | Caucasiana | IC (classe ii) | Não | Não |
D: doente; F: feminino; FA: fibrilhação auricular; IC: insuficiência cardíaca; M: masculino; TVS: taquicardia ventricular sustentada.
Nenhum dos doentes tinha história familiar de cardiomiopatia ou morte súbita cardíaca.
Em 3 doentes observaram-se dismorfias faciais (palato arqueado, implantação baixa dos pavilhões auriculares, proeminência da região frontal), sendo que os três apresentavam formas familiares de NCIVE. Não se encontraram doenças neuromusculares associadas (embora apenas três doentes tenham sido avaliados por um neurologista).
No que se refere aos achados ecocardiográficos (Tabela 2), seis doentes apresentavam dilatação do VE, sendo ligeira em dois casos e moderada nos restantes quatro. Sete doentes evidenciavam hipocinésia global do VE com depressão da sua função sistólica (ligeira num doente, moderada em quatro e grave em dois). A região mais frequentemente envolvida pela não compactação foi o ápex, seguida das paredes posterior e lateral, com um atingimento preferencial dos segmentos médio e apical. Em dois casos, a hipertrabeculação envolvia também o ápex do ventrículo direito (VD). A espessura das paredes ventriculares encontrava-se dentro dos limites normais ou ligeiramente aumentada. Cinco doentes apresentavam dilatação da aurícula esquerda.
Características ecocardiográficas da população
| D | SC(m2) | AE(mm) | AE(mm/m2) | SIV(mm) | PPVE(mm) | VE td(mm) | VE td(mm/m2) | FE (%) | Área de trabeculação (paredes) |
| 1 | 1,71 | 36 | 21 | 9 | 10 | 59 | 35 | 36 | Posterior, inferior e ápex |
| 2 | 1,69 | 38 | 22 | 9 | 10 | 59 | 35 | 58 | Lateral e ápex |
| 3 | 1,57 | 46 | 29 | 11 | 11 | 57 | 36 | 50 | Ápex |
| 4 | 1,98 | 40 | 20 | 11 | 12 | 56 | 28 | 40 | Posterior e ápex |
| 5 | 1,71 | 32 | 19 | 8 | 10 | 53 | 31 | 64 | Posterior, lateral e ápex |
| 6 | 1,96 | 54 | 18 | 10 | 10 | 68 | 35 | 28 | Ápex |
| 7 | 1,45 | 33 | 23 | 8 | 9 | 45 | 31 | 61 | Ápex |
| 8 | 1,76 | 46 | 26 | 11 | 11 | 58 | 33 | 40 | Posterior, lateral e ápex |
| 9 | 1,92 | 47 | 24 | 8 | 9 | 59 | 31 | 25 | Posterior, lateral e ápex |
| 10 | 1,73 | 43 | 25 | 11 | 11 | 58 | 34 | 33 | Ápex |
AE: diâmetro da aurícula esquerda; D: doente; FE: fração de ejeção; PPVE: espessura da parede posterior do ventrículo esquerdo; SC: superfície corporal; SIV: espessura do septo interventricular; VE td: diâmetro telediastólico do ventrículo esquerdo.
Na avaliação por RMN, foi observada a presença de realce tardio com gadolinium em dois doentes (Tabela 3).
Caracterização da população do ponto de vista arrítmico
| D | Idade | FE (%) | Síncope | RMN (RT) | ECG | Holter | PE/PCP | EEF | CDI | Seguimento | |
| Meses | TVS/FV | ||||||||||
| 1 | 32 | 36 | Não | Não | RS, HVE | Sem arritmias | Sem arritmias | Induçãode TVS | Sim | 53 | Não |
| 2 | 34 | 58 | Não | Não | RS | Sem arritmias | - | - | Não | 50 | Não |
| 3 | 72 | 50 | Não | Não | RS, AIRV | TVNS | Sem arritmias | Sem arritmias | Não | 46 | Não |
| 4 | 58 | 40 | Não | Sim | RS, ondasQ inferiores | TVNS | Sem arritmias | Sem arritmias | Não | 41 | Não |
| 5 | 18 | 64 | Sim | Não | RS | Sem arritmias | TVS | Induçãode TVS | Sim | 37 | Sim (TVS) |
| 6 | 56 | 28 | Não | Sim | RS, BFAE, BAV 1.°G | Sem arritmias | Sem arritmias | - | Sim | 36 | Não |
| 7 | 13 | 61 | Não | Não | RS | Sem arritmias | Sem arritmias | Sem arritmias | Não | 35 | Não |
| 8 | 68 | 40 | Não | Não | RS, BCRE | Sem arritmias | - | - | Não | 21 | Não |
| 9 | 40 | 25 | Não | Não | RS, BFAE, EV e ESV | FAP,EV | Sem arritmias | - | Sim | 17 | Não |
| 10 | 57 | 33 | Não | Não | RS, BCRE | EV | - | - | Não | 8 | Não |
AIRV: alterações inespecíficas da repolarização ventricular; BAV 1.°G: bloqueio auriculoventricular de 1.° grau; BCRE: bloqueio completo de ramo esquerdo; BFAE: bloqueio do fascículo anterior esquerdo; CDI: cardiodesfibrilhador implantável; D: doente; ECG: eletrocardiograma; EEF: estudo eletrofisiológico; ESV: extrassístoles supraventriculares; EV: extrassístoles ventriculares; FAP: fibrilhação auricular paroxística; FE: fração de ejeção; FV: fibrilhação ventricular; HVE: critérios de hipertrofia ventricular esquerda; PCP: prova cardiopulmonar; PE: prova de esforço; RMN (RT): realce tardio com gadolinium na ressonância magnética nuclear; RS: ritmo sinusal; TVS: taquicardia ventricular sustentada; TVNS: taquicardia ventricular não sustentada.
Dos sete doentes submetidos a coronariografia por TCMD ou cateterismo cardíaco, apenas um apresentava doença coronária (lesão única de 70% na artéria circunflexa proximal). Este doente foi submetido a uma cintigrafia de perfusão miocárdica, que não revelou defeitos de perfusão em repouso e em esforço, tendo sido considerado que a doença coronária encontrada não justificava a dilatação e compromisso da função do VE.
O ECG basal mostrava alterações em sete doentes (Tabela 3). As anomalias mais frequentemente encontradas foram as perturbações da condução intraventricular esquerda (bloqueio completo de ramo esquerdo e bloqueio de fascículo anterior esquerdo). Foram também observadas alterações da repolarização ventricular, critérios de hipertrofia ventricular esquerda, bloqueio auriculoventricular de primeiro grau e ondas Q patológicas.
A monitorização ambulatória por Holter revelou extrassistolia ventricular frequente em dois doentes e curtos períodos isolados de taquicardia ventricular não sustentada (TVNS) em outros dois doentes. Um doente apresentava períodos de FA paroxística.
Quatro doentes realizaram prova cardiopulmonar, que demonstrou uma capacidade funcional normal em todos os casos, com um VO2 pico mediano de 36ml/kg/min (21-53) e um atingimento mediano de 116% do valor preditivo (90-123). De salientar que 3 destes doentes apresentavam depressão da função sistólica do VE. Outros 3 doentes realizaram prova de esforço, com boa tolerância ao exercício e ausência de arritmias.
Cinco doentes foram submetidos a EEF para estratificação de risco arrítmico (Tabela 3). Dos restantes, dois foram referenciados diretamente para implantação de cardioversor-desfibrilhador (CDI) por disfunção ventricular (DV) esquerda grave, 2 não realizaram EEF por decisão do médico assistente e um por recusa do próprio doente. Após estimulação elétrica programada segundo o protocolo pré-estabelecido, foi induzida TV polimórfica sincopal em 2 doentes (um com TV monomórfica sustentada espontânea já documentada; o outro sem arritmias documentadas, com DV moderada, assintomático). Nos restantes doentes, não foi induzida qualquer arritmia.
O rastreio ecocardiográfico de familiares em primeiro grau foi positivo em dois casos (o pai de um doente índex foi diagnosticado desta forma e encontra-se incluído nesta série; a filha de outro doente índex, na altura com sete anos de idade, foi referenciada a uma consulta de cardiologia pediátrica e, portanto, foi excluída desta série). Convém referir que o rastreio não foi completo em todas as famílias devido à recusa de alguns elementos.
O estudo genético, realizado nos 2 doentes índex com formas familiares de NCIVE, foi negativo num caso e encontra-se em curso no outro.
No que se refere à terapêutica instituída, todos os doentes com depressão moderada ou grave da função sistólica do VE e/ou fibrilhação auricular iniciaram hipocoagulação oral. Os restantes doentes (exceto um adolescente com 13 anos) foram submetidos a antiagregação plaquetária com ácido acetilsalicílico. Todos receberam terapêutica para insuficiência cardíaca de acordo com o estado da arte. Quatro doentes foram submetidos a implantação de CDI: um em contexto de prevenção secundária (TV espontânea, reprodutível no EEF) e três em contexto de prevenção primária (dois por DV esquerda grave e um por TV indutível no EEF). Os restantes doentes mantiveram vigilância clínica com realização periódica de Holter.
Após um período de seguimento mediano de 36,5 meses (8-53 meses), a sobrevida foi de 100%. Os doentes assintomáticos na altura do diagnóstico permaneceram assintomáticos e, dos 4 doentes com insuficiência cardíaca, 3 mantiveram-se estáveis (classe ii) e um melhorou com a terapêutica (transitou da classe iii para a classe ii). A avaliação ecocardiográfica seriada não mostrou progressão da DV esquerda. Não se registaram eventos tromboembólicos. Aos 32 meses de seguimento, foi documentada uma terapia apropriada do CDI no doente tratado em prevenção secundária. Não se observaram terapias (apropriadas e inapropriadas) nos doentes tratados em prevenção primária, tendo sido registados curtos períodos de TVNS assintomática em todos eles. Nos doentes em vigilância clínica não se registaram taquiarritmias ventriculares.
DiscussãoApesar de a nossa experiência relativamente à NCIVE ser, ainda, recente e limitada, a decisão de a publicar prende-se com a necessidade de contribuir para a caracterização desta miocardiopatia, nomeadamente, no que se refere à população portuguesa. Trata-se de uma série algo heterogénea na forma como foi estudada e orientada, o que reflete a ausência de recomendações universais relativas à abordagem desta patologia. Por este motivo, fazemos o contraponto com o que mais recentemente tem sido publicado na literatura acerca do assunto.
A «persistência de sinusoides no miocárdio ventricular» foi inicialmente descrita em associação a cardiopatias congénitas com obstrução dos tratos de saída ventriculares ou atresia das válvulas semilunares3–5. Nestes casos, foi sugerido que a sobrecarga de pressão intraventricular impediria a regressão dos sinusoides miocárdicos embrionários, resultando em recessos intertrabeculares em comunicação com a cavidade ventricular e com a circulação coronária. A primeira descrição de «persistência isolada de sinusoides miocárdicos» remonta a 1984, quando Engberding e Bender descreveram esta morfologia miocárdica na ausência de outros defeitos cardíacos que justificassem o desenvolvimento anormal do miocárdio6. A designação de «não compactação isolada do miocárdio ventricular esquerdo» foi introduzida em 1990 por Chin et al. e sugere como mecanismo etiológico provável uma perturbação do normal processo de compactação do miocárdio7. Durante o desenvolvimento embriológico precoce, o miocárdio consiste numa rede «esponjosa» de fibras entrelaçadas em trabéculas e recessos intertrabeculares que comunicam com a cavidade do ventrículo, de onde provém o seu suprimento sanguíneo. Entre a quinta e a oitava semanas de vida embrionária decorre a compactação gradual do miocárdio, que se inicia do epicárdio para o endocárdio e da base para o ápex. A circulação coronária epicárdica desenvolve-se concomitantemente e os recessos intertrabeculares são reduzidos a capilares. Uma interrupção geneticamente determinada deste processo tem sido considerada como o mecanismo responsável pela NCIVE. Alguns autores têm descrito casos de NCIVE aparentemente adquirida, sobretudo em associação a doenças neuromusculares, sugerindo que este poderá não ser o único mecanismo patogénico envolvido8–11. No entanto, mesmo nestas situações, o fenótipo de não compactação poderá desenvolver-se em resposta a certos estímulos apenas em indivíduos geneticamente predispostos ou com uma estrutura miocárdica específica12.
Apesar de ainda estar incluída no grupo das cardiomiopatias não classificadas segundo a Organização Mundial de Saúde13, mais recentemente a American Heart Association classificou-a como uma cardiomiopatia primária genética14.
O processo de normal compactação é mais completo no VE do que no VD, o que confere a este último uma aparência mais trabeculada. Por este motivo, a distinção entre variantes normais e formas patológicas de não compactação no VD é mais difícil e diversos autores optam por restringir o diagnóstico de não compactação ao VE1,15.
A verdadeira prevalência da NCIVE é desconhecida, sendo habitualmente considerado que se encontra subdiagnosticada. Estudos observacionais reportaram uma prevalência inferior a 0,14% em adultos referenciados para ecocardiograma15,16.
Na nossa série, a distribuição etária à altura do diagnóstico encontra-se entre os 13 e os 72 anos, sendo a maioria do sexo masculino. Apesar de inicialmente descrita como uma patologia rara afetando crianças, encontram-se descritos na literatura vários casos de apresentação tardia na vida adulta. Os homens parecem ser mais afetados do que as mulheres e várias explicações foram propostas12,17. Por um lado, existem formas com hereditariedade ligada ao cromossoma X. Por outro lado, é possível que as mulheres sejam afetadas por formas mais graves, logo, com uma mortalidade precoce mais elevada, o que explicaria o predomínio do sexo feminino encontrado em algumas séries pediátricas. Outra hipótese é que os homens sejam mais predispostos ao desenvolvimento de formas adquiridas. Além disso, é possível que haja um viés de seleção na referenciação para ecocardiograma, com favorecimento do sexo masculino. É ainda necessário considerar que os critérios de diagnóstico atuais não são ajustados ao sexo. Um estudo recente demonstrou existirem diferenças entre os sexos na localização e extensão da não compactação, com as mulheres a apresentarem uma maior área atingida e envolvendo, preferencialmente, as paredes anterior, lateral e ínfero-posterior, e os homens a evidenciarem uma área de não compactação mais restrita e, sobretudo, apical. Contudo, as diferenças encontradas não se traduziram em características clínicas ou prognósticos distintos17.
Uma questão atualmente muito debatida é a limitação decorrente da ausência de critérios de diagnóstico universalmente aceites. O ecocardiograma transtorácico tem sido considerado o exame de eleição para o diagnóstico da NCIVE. Outras técnicas, como o ecocardiograma transesofágico, o ecocardiograma tridimensional e o ecocardiograma com contraste, podem ser úteis na melhor definição dos contornos do endocárdio e no diagnóstico diferencial com cordas tendinosas, músculos papilares e bandas musculares. Para além de Jenni, cujos critérios já foram previamente referidos (ver métodos), outros autores propuseram diferentes critérios de diagnóstico ecocardiográfico. Chin et al. sugerem que um quociente X/Y ≤ 0,5 estabelece o diagnóstico de NCIVE, onde X representa a distância entre a superfície epicárdica e o fundo de um recesso intertrabecular e Y corresponde à distância entre a superfície epicárdica e o pico de uma trabécula (medidas em telediástole)7. Já Stöllberger et al. propõem que o diagnóstico de NCIVE pode ser estabelecido quando existem mais de três trabeculações com origem na parede do VE (apicais em relação aos músculos papilares e visíveis num único plano de imagem) e recessos intertrabeculares perfundidos a partir da cavidade ventricular (visualizados no Doppler a cor)18.
Em 2008, Kohli et al. demonstraram que os critérios ecocardiográficos propostos por estes três autores apresentam fraca correlação entre si e são demasiado sensíveis, particularmente nos indivíduos de raça negra19. Neste estudo, Kohli levanta a hipótese de estarmos a assistir a um sobrediagnóstico de NCIVE, com o perigo de estarmos a submeter indivíduos normais a exames e terapêuticas desnecessários e, eventualmente, deletérios. Por este motivo, é urgente definir o que são os limites do normal padrão de trabeculação do VE, para os diferentes sexos e raças.
No nosso centro, optamos por seguir os critérios de Jenni por serem os mais frequentemente utilizados. Contudo, confrontamo-nos com a dificuldade em medir a espessura das camadas compactada e não compactada de forma rigorosa e reprodutível, o que, aliás, já tem sido demonstrado por diversos autores20,21. Por este motivo, todos os doentes foram submetidos a RMN para confirmação do diagnóstico. Esta técnica, além de ter demonstrado uma boa concordância com os achados ecocardiográficos, tem a vantagem de oferecer uma resolução espacial superior, permitindo uma melhor visualização do ápex e da parede lateral do VE, frequentemente envolvidos pela não compactação. Por este motivo, as imagens obtidas por RMN parecem-nos mais adequadas para avaliações quantitativas. Os critérios tradicionalmente aplicados são os propostos por Petersen, já referidos (ver métodos). Em 2010, Jacquier et al. demonstraram que a determinação do grau de trabeculação do VE, expresso como a massa da camada não compactada, pode ser utilizado no diagnóstico da NCIVE. Segundo estes autores, um valor de massa da camada trabeculada superior a 20% da massa global do VE é altamente sensível e específico para o diagnóstico de NCIVE22 (Figuras 1 e 2).
Outra vantagem da RMN é a identificação de focos de fibrose subendocárdica pelo realce tardio com gadolinium, o que pode ser útil na estratificação do risco arrítmico destes doentes. Na nossa série, apenas dois doentes apresentavam realce tardio na RMN, não tendo sido documentadas arritmias ventriculares malignas em nenhum deles.
O diagnóstico diferencial faz-se sobretudo com a cardiomiopatia hipertrófica (CMH) apical e a cardiomiopatia dilatada (CMD). Uma revisão dos casos publicados de doentes que não foram corretamente diagnosticados na primeira avaliação ecocardiográfica encontrou como diagnóstico inicial, além das duas cardiomiopatias já citadas, a fibroelastose endomiocárdica, a cardiomiopatia restritiva, a miocardite, trombos do VE, metástases cardíacas, cordas tendinosas aberrantes e abcessos ou hematomas intramiocárdicos23. Por outro lado, estão descritos casos de hipertrabeculação marcada em atletas de alta competição12.
O papel da genética no diagnóstico desta cardiomiopatia não é, ainda, muito claro. A NCIVE pode ocorrer de forma esporádica, mas encontram-se formas familiares em mais de 50% dos casos12. Na nossa série, o rastreio de familiares em primeiro grau (apesar de incompleto) foi positivo em dois de nove casos índex (22%). À semelhança de outras cardiomiopatias, a NCIVE é uma entidade geneticamente heterogénea, estando descritas várias mutações e diferentes formas de transmissão. A forma de transmissão mais frequentemente encontrada é a autossómica dominante, tendo sido também descritos casos de hereditariedade ligada ao cromossoma X e hereditariedade mitocondrial24,25. A NCIVE tem mostrado variabilidade fenotípica intrafamiliar e reduzida penetrância, com pessoas que partilham a mutação familiar a expressar formas assintomáticas ou subtis26. Algumas das mutações encontradas já tinham sido descritas em doenças neuromusculares e em outras cardiomiopatias, nomeadamente, na CMH e na CMD. De facto, os doentes com NCIVE familiar apresentam frequentemente doenças neuromusculares associadas e são encontradas formas de cardiomiopatia hipertrófica e dilatada nos seus familiares27. Esta sobreposição genotípica e fenotípica tem levado alguns autores a considerar que mais do que três entidades distintas, a NCIVE, a CMH e a CMD constituem um continuum de cardiomiopatias28. Teremos de aguardar por mais estudos até que o papel da genética no diagnóstico e prognóstico destes doentes e, também, no seguimento dos seus familiares, esteja mais bem definido.
Na nossa série, a apresentação clínica mais frequente foi a insuficiência cardíaca, o que está de acordo com as maiores séries publicadas15,16,29–31. Observaram-se dismorfias faciais em três doentes, dois deles familiares diretos e o terceiro também com uma forma familiar de NCIVE. Curiosamente, as dismorfias faciais encontram-se descritas, sobretudo, em séries pediátricas7. Já as séries de adultos referem habitualmente uma prevalência muito menor de dismorfias faciais ou não as referem de todo, o que sugere que talvez não sejam sistematicamente pesquisadas. Neste grupo de doentes, não foram observadas doenças neuromusculares. Esta associação frequente leva alguns autores a recomendar a avaliação sistemática por um neurologista18.
A avaliação ecocardiográfica revelou disfunção sistólica em sete doentes (70%), o que está de acordo com o descrito na literatura32. Apesar de o VE apresentar dimensões acima do normal em seis doentes, não foi observada dilatação grave em nenhum doente. Este aspeto, que também está de acordo com o reportado, constitui um critério importante no diagnóstico diferencial com a CMD, que se caracteriza habitualmente por um maior grau de dilatação do VE, associado a um maior grau de disfunção sistólica e de dilatação da AE33. Os segmentos mais frequentemente envolvidos pela não compactação foram os apicais, seguidos dos segmentos médios das paredes posterior e lateral. Esta distribuição, também reportada noutras séries, poderá estar relacionada com o anormal desenvolvimento embriológico já referido.
Dos sete doentes com compromisso da função ventricular esquerda, apenas um apresentava doença coronária e esta não era responsável pela DV. Diversos estudos com tomografia por emissão de positrões (PET) mostraram a existência de uma reserva coronária diminuída nos doentes com NCIVE, presumivelmente secundária a disfunção microvascular34. A identificação de defeitos de perfusão subendocárdica em estudos com RMN e a observação em estudos postmortem de focos de fibrose subendocárdica corroboram a teoria de que as anomalias na microcirculação coronária poderão contribuir para a disfunção contrátil e para a arritmogénese35,36. Uma hipótese apontada é que estas alterações da perfusão e da reserva coronária poderão estar relacionadas com a incapacidade da microcirculação coronária em acompanhar o crescimento da massa ventricular ou que haja compressão do leito coronário intramiocárdico pelo miocárdio hipertrofiado37. Por outro lado, a marcada trabeculação do VE pode comprometer igualmente a função diastólica, ao condicionar um relaxamento anormal e um enchimento restritivo38.
O ECG é anormal na maioria dos doentes com NCIVE, sendo as alterações mais frequentemente encontradas os defeitos de condução intraventricular esquerda15, o que também se verificou na nossa série.
Foi documentada taquicardia ventricular em três doentes (30%): dois episódios de TVNS na monitorização por Holter de dois doentes e um episódio de TV monomórfica sustentada na prova de esforço de outro doente. Estes achados vão ao encontro do reportado na literatura, com registos de TV (sustentada e não sustentada) a oscilar entre os 20 e os 47%15,16,29. Em contraste com estes resultados, numa série italiana de 238 doentes (adultos e crianças) foi documentada TV em apenas 4,6% doentes (sustentada em 0,8%), ao longo de um seguimento médio de quatro anos39. Por outro lado, a morte súbita cardíaca é uma das principais causas de morte na NCIVE, ocorrendo em até 18% dos doentes afetados15. Estes dados suportam a hipótese de que o miocárdio não compactado pode constituir um substrato altamente arritmogénico. Os mecanismos propostos incluem a interrupção concomitante do desenvolvimento do sistema de condução ou a isquemia progressiva por hipoperfusão das trabéculas. Por outro lado, os profundos recessos intertrabeculares podem constituir um substrato para a propagação de circuitos de reentrada subjacentes a zonas de cicatriz15.
A estratificação de risco arrítmico nestes doentes é extremamente difícil, tanto mais que a ocorrência de taquiarritmias ventriculares malignas tem sido demonstrada em doentes com função ventricular conservada. A monitorização periódica por Holter é útil, mas insuficiente. A prova de esforço poderá ser importante, nomeadamente, nos doentes com sintomas sugestivos de arritmia desencadeados pelo esforço, embora não seja recomendada por rotina pela maioria dos autores. O papel do EEF na abordagem dos doentes com NCIVE é, ainda, pouco claro e não se encontra contemplado nas recomendações europeias e americanas para a abordagem de doentes com arritmias ventriculares e prevenção de morte súbita cardíaca40. Kobza et al. realizaram um estudo retrospetivo em 12 doentes submetidos a implantação de CDI, dos quais sete tinham sido previamente submetidos a EEF por apresentarem sintomas sugestivos de arritmia ou DV esquerda (nos restantes doentes, a decisão para a implantação do CDI foi tomada com base na existência de taquiarritmias ventriculares documentadas). Estes autores verificaram que os três doentes a quem tinha sido induzida TV sustentada ou fibrilhação ventricular (FV) durante o EEF tiveram terapias apropriadas do CDI. Nos restantes quatro doentes, em que a estimulação elétrica programada não induziu nenhuma arritmia ou induziu TVNS, verificou-se apenas uma terapia apropriada (num doente com TVNS induzida)41. Num outro estudo, Steffel et al. analisaram retrospetivamente os resultados de um grupo de 24 doentes com NCIVE submetidos a EEF (segundo o critério do médico assistente). A estimulação elétrica programada resultou na indução de TV/FV em quatro doentes e de TVNS em cinco. Durante um seguimento médio de cinco anos, registaram-se terapias apropriadas do CDI em três dos nove doentes com arritmias indutíveis no EEF (2 com indução de TV/FV e um com indução de TVNS). Nos 15 doentes em o EEF foi negativo, não foram observados episódios de taquiarritmia ventricular ou morte súbita cardíaca, apesar de o tempo de seguimento ser inferior (2,5 anos em média) e de se terem perdido três doentes. Face a estes resultados, os autores sugerem que um EEF negativo poderá identificar os doentes com baixo risco de desenvolverem taquiarritmias ventriculares malignas, embora as limitações do estudo (reduzido número de doentes e tempo de seguimento desigual nos 2 grupos) não permitam extrair conclusões acerca do valor preditivo negativo do EEF nos doentes com NCIVE. De referir, ainda, que estes autores não encontraram nenhuma característica clínica, eletrocardiográfica ou ecocardiográfica que fosse preditiva da indutibilidade de taquiarritmias ventriculares no EEF42.
Na nossa série, apenas cinco doentes foram submetidos a EEF, com indução de TV polimórfica sincopal em dois casos. O protocolo de estimulação elétrica utilizado foi deliberadamente pouco agressivo no sentido de selecionar os doentes com baixo limiar de indução de taquiarritmias. Foi implantado um CDI em quatro doentes, tendo sido documentada uma terapia apropriada apenas no doente tratado em prevenção secundária.
No estudo de Kobza, foram observadas terapias apropriadas em 50% dos doentes tratados em prevenção secundária e em 25% dos doentes tratados em prevenção primária41. Num estudo mais recente englobando 44 doentes com NCIVE portadores de CDI, Caliskan et al. registaram terapias apropriadas em 33% dos doentes tratados em prevenção secundária e em 13% dos doentes tratados em prevenção primária43.
No estado atual do conhecimento, e apesar de as recomendações mais recentes permitirem a implantação de CDI em prevenção primária em doentes com NCIVE (indicação classe IIb, nível de evidência C)44, a maioria dos autores preconiza que sejam seguidas as recomendações atuais de prevenção primária e secundária estabelecidas para as cardiomiopatias não isquémicas42,43.
O tratamento da insuficiência cardíaca segue também as recomendações atuais. Em casos de DV esquerda grave e bloqueio de ramo esquerdo, deve ser considerada terapia de ressincronização cardíaca (CRT). Um estudo recente comparando a contrarremodelação ventricular após CRT em doentes com NCIVE e doentes com CMD revelou que, no grupo da NCIVE, a percentagem de super-respondedores era significativamente maior e que o grau de contrarremodelação ventricular era tanto maior quanto mais extensa a área de não compactação45. O transplante cardíaco deve ser considerado nos doentes com insuficiência cardíaca refratária.
Outro aspeto importante no tratamento destes doentes é a prevenção do tromboembolismo. Na NCIVE, a presença de recessos intertrabeculares profundos parece favorecer a estase de sangue com a consequente formação de trombos intraventriculares. As primeiras séries publicadas descreviam uma elevada prevalência de eventos tromboembólicos (24 a 38%), o que levou os seus autores a preconizarem hipocoagulação oral para todos os doentes com NCIVE7,15. Porém, as séries mais recentes registam uma taxa muito menor de tromboembolismo (4 a 9%), o que também poderá estar relacionado com o maior número de doentes hipocoagulados destas séries (até 60%)16,29. Atualmente, a maioria dos autores recomenda a hipocoagulação oral apenas para os doentes com DV esquerda grave, fibrilhação auricular, trombos intraventriculares ou história de tromboembolismo sistémico16,46,47. Na nossa série, não se verificaram eventos tromboembólicos nem foram encontrados trombos intraventriculares. Todos os doentes com depressão moderada a grave da função sistólica ou fibrilhação auricular foram hipocoagulados.
O prognóstico dos doentes com NCIVE não é, ainda, muito claro. Numa das primeiras séries publicadas, Oechslin descreve uma taxa de morte ou transplante de 47% aos 44 meses15. Já Murphy et al. descrevem uma mortalidade de 2% aos 46 meses29. O prognóstico mais favorável reportado nas séries mais recentes poderá estar relacionado com o estabelecimento de terapêuticas mais agressivas nos doentes com insuficiência cardíaca, arritmias e tromboembolismo. Por outro lado, o maior conhecimento da NCIVE por parte da comunidade médica, assim como a melhoria das técnicas de imagem, resultaram no diagnóstico de um espectro mais alargado de doentes com NCIVE, incluindo doentes assintomáticos, não incluídos nas séries iniciais32. Têm sido considerados fatores de mau prognóstico os seguintes: maior diâmetro diastólico do VE na primeira avaliação, insuficiência cardíaca classe iii ou iv de NYHA, fibrilhação auricular permanente e bloqueio de ramo esquerdo15. Os doentes com estes fatores de alto risco deverão ser candidatos a uma estratégia terapêutica mais agressiva, incluindo consideração para implantação de CDI e avaliação para transplante.
ConclusõesApesar de se tratar de uma cardiomiopatia rara, temos assistido nos últimos anos a um crescimento exponencial do número de trabalhos publicados na literatura acerca da NCIVE. Contudo, o conhecimento da verdadeira história natural desta cardiomiopatia tem sido dificultado pela ausência de grandes séries de doentes com seguimento prolongado. Por outro lado, a utilização de diferentes critérios de diagnóstico e a adoção de diferentes atitudes terapêuticas também contribuem para a diferença de resultados observada entre as séries publicadas. A criação de um registo internacional poderá facilitar a confluência de informações com vista ao estabelecimento de recomendações universais para o diagnóstico e tratamento destes doentes.
Em resumo, e à luz do conhecimento atual, a NCIVE é uma cardiomiopatia rara cujas principais manifestações clínicas são a insuficiência cardíaca, as arritmias e o tromboembolismo. O diagnóstico tem sido tradicionalmente estabelecido por ecocardiografia, embora a RMN esteja a ser cada vez mais utilizada. O prognóstico da NCIVE avançada é adverso, mas poderá ser melhorado pelo diagnóstico precoce, rastreio sistemático das famílias afetadas e estratégias terapêuticas agressivas nos doentes de alto risco.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos de seu centro de trabalho acerca da publicação dos dados de pacientes e que todos os pacientes incluídos no estudo receberam informações suficientes e deram o seu consentimento informado por escrito para participar nesse estudo.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesOs autores declaram não haver conflito de interesses.