A literatura mostra‐se inconsistente sobre o efeito da reabilitação cardiovascular (RVC) nos resultados de testes de campo.
ObjetivoFazer uma revisão sistemática com meta‐análise sobre os resultados de testes de campo usados em programas de RCV.
MétodosForam analisados estudos publicados nas bases de dados PubMed e Web of Science até maio de 2016. O tamanho do efeito (g) foi definido como a diferença média padronizada corrigida por viés (g de Hedges) e foi usado para medir a quantidade de modificações no desempenho do teste após o período de RCV. Diferenças potenciais entre os subgrupos foram testadas pelo teste Q baseado na análise de variância.
ResultadosCompuseram a revisão 15 estudos publicados entre 1996 e 2016, com amostra total de 932 pacientes e idade entre 54,4 e 75,3 anos. Catorze estudos usaram o teste de caminhada de 6min para avaliar a capacidade de exercício e um estudo usou o Shuttle Walk Test. O g de Hedges pela análise aleatória foi de 0,617 (p < 0,001), representou aumento de 20% no desempenho do teste de campo após a RCV. A metarregressão mostrou associação significativa (p = 0,01) para a duração do exercício aeróbio, ou seja, para cada aumento de 1min na duração do exercício ocorre o aumento de 0,02 no efeito para o desempenho no teste de campo.
ConclusãoTestes de campo identificam mudanças após a RCV e a maior duração do exercício aeróbio durante a RCV se associa com um melhor resultado.
The literature concerning the effects of cardiac rehabilitation (CR) on field tests results is inconsistent.
PurposeTo perform a systematic review with meta‐analysis on field tests results after programs of CR.
MethodsStudies published in PubMed and Web of Science databases until May 2016 were analyzed. The standard difference in means correct by bias (Hedges’ g) was used as effect size (g) to measure que amount of modifications in performance of field tests after CR period. Potential differences between subgroups were analyzed by Q‐test based on ANOVA.
ResultsFifteen studies published between 1996 e 2016 were included in the review, 932 patients and age ranged 54,4 ‐ 75,3 years old. Fourteen studies used the six‐minutes walking test to evaluate the exercise capacity and one study used the Shuttle Walk Test. The random Hedges's g was 0.617 (P<0.001), representing a drop of 20% in the performance of field test after CR. The meta‐regression showed significantly association (P=0.01) to aerobic exercise duration, i.e., for each 1‐min increase in aerobic exercise duration, there is a 0.02 increase in effect size for performance in the field test.
ConclusionField tests can detect physical modification after CR, and the large duration of aerobic exercise during CR was associated with a better result.
O exercício físico é uma intervenção importante na reabilitação cardiovascular (RCV). Porém, é fundamental uma avaliação física dos pacientes antes do início do treinamento1–5. Nesse sentido, o teste de esforço cardiopulmonar (TECP) fornece diversas variáveis relacionadas à função cardiorrespiratória, como o consumo máximo de oxigénio (VO2max)6,7, é considerado o padrão‐ouro para essa medida8–13. Entretanto, por ser complexo e exigir esforço máximo, o TECP não é usado frequentemente na prática clínica8,9,11,13–24. Por exemplo, 12% dos pacientes com doença arterial coronária são incapazes de fazer um teste fidedignamente máximo25. Assim, testes de campo foram desenvolvidos para predizer o VO2max e avaliar algumas limitações funcionais, permitem ser usados mais regularmente na prática clínica.
Existem diversos testes de campo usados na RCV. O teste de caminhada de seis minutos (TC6’) (maior distância percorrida durante seis minutos)26,27 apresenta forte evidência de resposta a mudanças clínicas10, correlaciona‐se com o VO2max no TECP em pacientes com insuficiência cardíaca28–30 e é sensível às mudanças na perceção dos sintomas da doença31. Já o Shuttle Walk Test (maior distância percorrida em um corredor de 10 m com aumento progressivo de intensidade) tem sido usado em pacientes no pós‐operatório de revascularização do miocárdio32, insuficiência cardíaca33 e doença de Chagas34.
Testes com degraus também são usados em pacientes com doenças respiratórias35, suspeita de obstrução coronária36 e em idosos com insuficiência cardíaca37–39. Os testes que usam degrau requerem pouco espaço, são facilmente transportados e fáceis de fazer40.
Entretanto, a literatura mostra‐se inconsistente sobre o efeito dos programas de RCV no desempenho dos testes de campo. Para além da importância de feitura de mais estudos, outros modelos de pesquisa possibilitam uma análise integrada de resultados divulgados. Nesse contexto, a revisão sistemática da literatura permite a busca e inclusão de referências por meio de estratégias definidas e substanciais; e a meta‐análise possibilita a aplicação de um modelo matemático para identificar potenciais variáveis que influenciam o desfecho. Em se tratando de testes de campo e RCV, não identificamos meta‐análises que tenham abordado essa questão. Assim, o objetivo do presente estudo foi revisar sistematicamente a literatura sobre os testes de campo usados em programas de RCV e aplicar o tratamento meta‐analítico para verificar: 1) o efeito da RCV no desempenho dos testes de campo; 2) variáveis do treinamento que podem influenciar tal efeito.
MétodosEstratégia de busca e seleção dos estudosA revisão de literatura foi conduzida nas bases de dados Medline/PubMed e Web of Science por dois pesquisadores (CFT e RRP) de forma independente. Foram selecionados artigos desde a sua data de publicação até maio de 2016. As dúvidas na seleção dos artigos foram solucionadas em conjunto pelos pesquisadores com base nos critérios de inclusão propostos. Foram usados descritores padronizados pelo Medical Subject Heading adicionados de termos e expressões no título ou no resumo. Como critérios de inclusão, foram considerados: 1) artigos em inglês, inclusive ensaios clínicos aleatorizados e não aleatorizados; 2) seres humanos (homens e/ou mulheres com mais de 18 anos); 3) diagnóstico de doenças cardíacas; 4) participantes de programas de RCV ambulatorial; 5) capacidade de exercício avaliada por meio de testes de exercício independentemente do TECP; 6) presença de variáveis da prescrição do treinamento; 7) grupo controle.
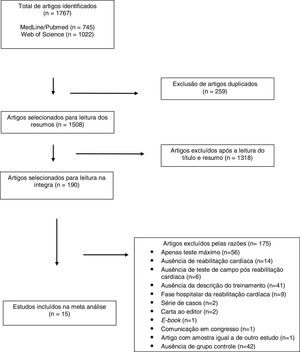
Estudos incluídos na revisão sistemáticaInicialmente foram identificados 1767 artigos em ambas as bases de dados: 259 foram excluídos por serem duplicados e 1318 foram excluídos pela análise do título e resumo. Após a leitura dos estudos restantes na íntegra, 15 compuseram a presente revisão (Figura 1).
Extração de dados e análise da qualidadeOs dados de qualidade dos estudos, fator de impacto da publicação, ano de publicação, sexo, idade, peso, altura, índice de massa corporal (IMC), fração de ejeção, VO2max, volume do treinamento, intensidade do treinamento, tipo de treinamento, local do treinamento, tipo do teste de campo usado e resultados do teste de campo foram extraídos independentemente por dois avaliadores (CFT e RRP) para uma planilha construída especificamente para tal finalidade. Com o uso da estatística kappa de Cohen, a concordância geral foi de 0,92. Discordâncias foram solucionadas por discussão presencial. O principal desfecho analisado foi a comparação dos valores dos testes de campo entre os grupos experimentais e controle dos estudos incluídos.
A qualidade dos estudos foi avaliada pela escala PEDro, a qual tem sido reportada como válida56 e reprodutível57. As medidas foram conduzidas em duplicatas e as dúvidas quanto à atribuição da pontuação foram resolvidas em conjunto. Os artigos não foram excluídos com base no resultado da qualidade.
Análise estatísticaCálculo do tamanho do efeitoPara medir a quantidade de modificações no desempenho dos testes de campo após o período de RCV (treino aeróbio ou treino aeróbio + resistência), foi usado o tamanho do efeito (g), o qual foi definido como a diferença média padronizada corrigida pelo viés (g de Hedges) no desempenho dos testes de campo pelos grupos experimental e controle. Para o cálculo da diferença média padronizada, inicialmente foram calculados a diferença emparelhada (média experimental – média controle) e o desvio‐padrão (DP) da diferença emparelhada (experimental DP2 + controle DP2‐ 2 x correlação interensaio x experimental DP x controle DP)1/2. Posteriormente, foram determinados a diferença média padronizada (diferença emparelhada x [2‐ 2 x correlação interensaio]1/2 ÷ diferença emparelhada do DP) e o erro‐padrão (EP) da diferença média padronizada ([1/n + diferença média padronizada2 ÷ {2 x n}]1/2 x [2 – 2 x correlação interensaio])1/2. Então, o fator de correção obtido pela equação 1 – {3 ÷ [4 x (n total – 2) – 1]} foi multiplicado pela diferença média padronizada para resultar no g de Hedges. Quando o estudo reportou apenas o valor do erro‐padrão, o DP foi calculado pela multiplicação do erro‐padrão pela raiz quadrada do n amostral. Nenhum estudo forneceu os dados da correlação interensaio (correlação entre os dados dos grupos experimental e controle) e, por isso, foi assumido o valor de 0,5 para todos os estudos. Valores positivos de g indicaram aumento no desempenho em relação aos valores do grupo controle.
A estatística Q foi calculada para verificar se os graus de similaridade nos tamanhos dos efeitos observados foram significativos. A estatística Q foi convertida para medida padronizada de homogeneidade (estatística I2) e valores de 25, 50 e 75% indicam baixa, moderada ou alta heterogeneidade, respetivamente. O risco de viés foi analisado pelo gráfico de funil versus diferença média padronizada. A análise do viés de publicação foi feita pela regressão não paramétrica de Egger (bicaudal) e pelo método de Duval e Tweedie.
Análises de subgrupos e variáveis moderadorasMeta‐análise e metarregressão foram feitas com o programa Comprehensive Meta Analysis (versão 2.2, BiostatTM Inc., Englewood, NJ, EUA) e uso do modelo de efeitos aleatórios e fator de correção g de Hedges. Na presença de heterogeneidade significativa, a análise de variáveis moderadoras foi usada para explicar a variabilidade nos gs dos desfechos. Foram incluídas como potenciais moderadoras as variáveis: idade, sexo, IMC, peso, altura, fração de ejeção inicial, VO2 inicial, tempo de treinamento, frequência semanal, duração do exercício aeróbio, qualidade dos estudos (escala PEDro), fator de impacto da publicação e ano de publicação do estudo.
A análise de subgrupo incluiu como variáveis: tipo de exercício (aeróbio; aeróbio + resistência), tipo de exercício aeróbio (caminhada, bicicleta, caminhada e/ou bicicleta), tipo de treinamento (contínuo; progressivo), local do treinamento (domiciliar ou clínica), tipo de patologia e intervenção (angina, enfarte agudo do miocárdio, insuficiência cardíaca, angioplastia e revascularização do miocárdio). Diferenças potenciais entre os subgrupos foram testadas pelo teste Q baseado na análise de variância.
ResultadosDescrição dos estudos incluídosOs dados gerais dos estudos incluídos estão descritos na Tabela 1. Foram identificados 15 estudos publicados entre 1996 e 2016. A amostra total foi de 932 pacientes (701 homens e 191 mulheres). Em um estudo48 com 40 participantes, o número de homens e mulheres não foi especificado. A média de idade variou entre 54,4 e 75,3 anos. Catorze estudos usaram o TC6’ para avaliar a capacidade de exercício e um estudo usou o Shuttle Walk Test48. Dessa forma, para fins de análise estatística de subgrupos e variáveis moderadoras, foram considerados apenas os estudos que envolveram o TC6’. Apenas sete estudos42,43,45,49,52,54,55 usaram o TECP em associação com o teste de campo.
Estudos incluídos na revisão sistemática da literatura
| Autor e ano | País | Amostra | Característica do treinamento – RCV clínica e domiciliar | Resultado do teste |
|---|---|---|---|---|
| McKelvie et al.41 | Canadá | IC GI = 90 H e M (64,8 anos) GC = 91 H e M (66,1 anos) | GI = RCV clínica supervisionada, caminhada, bicicleta estacionária, ergómetro de braço, 60 a 70% da FC máx, 30min, exercícios de resistência com aparelhos 40 a 60% de 1RM, 1 a 3 séries, 10 a 15 repetições, 3 vezes/sem, 12 sem GC = visitas mensais e encorajamento para continuar a atividade física habitual | TC6’ GI Inicial= 434±66,5m, GI Final= 456±71m GC Inicial = 421±75,84m, GC Final = 436 ±70m |
| Jónsdóttir et al.42 | Islândia | IC GI = 21 H e M (68 anos) GC = 22 H e M (69 anos) | GI = RCV clínica supervisionada, bicicleta, 50% da carga máxima (W), 15min, fortalecimento muscular com circuito, 20 a 25% de 1RM, 2 vezes/sem, 20 sem GC = não informado no texto | TC6’ GI Inicial= 489,3±75m, GI Final= 526,4±71,9m GC Inicial = 489,2±66,33m, GC Final = 494,6 ±66,4m |
| Freimark et al.43 | Israel | IC GI = 44 H e M (62 anos) GC = 12 H e M (61 anos) | GI = RCV clínica supervisionada, esteira, escada e bicicleta, 45min, 60 a 70% da FC máx, 2 vezes/sem, 18 sem GC = não informado no texto | TC6’ GI Inicial= 316,0±84,5m, GI Final= 443,6±83,8m GC Inicial = 320,0±99,6m, GC Final = 281,7 ±126,6m |
| Chan et al.44 | China | IC GI = 30 H e M (75,3 anos) GC = 28 H e M(73,5 anos) | GI = RCV clínica supervisionada, exercícios aeróbios 90min, 60 a 80% da FC reserva, 3 vezes/sem, 6 sem, GC = aconselhamento médico | TC6’ GI Inicial = 232,7±110,1m, GI Final= 360,2±106,9 m GC Inicial = 205,8±87,7m, GC Final = 299,9 ± 56,2m |
| Brubaker et al.45 | EUA | IC GI = 30 H e M (70,4 anos) GC = 29 H e M (69,9 anos) | GI = RCV clímica supervisionada, esteira ou bicicleta, 30 a 40min, 40 a 70% da FC reserva, 3 vezes/sem, 16 sem GC = ligações telefônicas dos pesquisadores a cada 2 sem por 16 sem, perguntando sobre mudanças no tratamento medicamentoso. Não foram questionados sobre a prática de exercícios | TC6’ GI Inicial= 406,3±30,6m, GI Final= 461,77±29,9m GC Inicial = 375,51±39,68m, GC Final = 423,06 ±23,8m |
| Gary et al.46 | EUA | IC GI = 12 H e M (59 anos) GC = 12 H e M (61 anos) + 24 | GI = RCV clínica supervisionada, 30 a 60min, 50 a 70% da FC reserva, 3 vezes/sem, 12 sem, fortalecimento muscular com theraband, 2 a 3 séries, 12 a 15 repetições GC = 5 a 6 visitas domiciliares no período de 12 sem | TC6’ GI Inicial = 364,3±80m, GI Final= 410,7±91,5m GC Inicial = 306,6±121,3m, GC Final = 309,7 ±135,4m |
| Babu et al.47 | Índia | IC GI = 14H e M (56,9 anos) GC = 13 H e M (58,8anos) | GI = RCV domiciliar não supervisionada, caminhada 10 a 80min, entre 4 e 6 na Escala de Borg Modificada, 7 vezes/sem, 8 sem GC = aconselhamento médico na alta hospitalar | TC6’ GI Inicial= 429,33±125,15m, GI Final= 514,53±135,12m GC inicial = 310,23 ± 121,11m, GC final = 357,15 ± 147,95m |
| Asbury et al.48 | Inglaterra | Angina GI = 20 (65,1 anos) GC = 20 (65,1 anos) | GI = RCV clínica supervisionada, circuito, 40 a 75% da FC reserva, 80min, 1 vez/sem, 8 sem GC = monitorização dos sintomas por 8 sem | ISWT GI Inicial = 248,2±121,7m, Final= 305±115,8m GC Inicial = 222±78,4m, Final= 248,5± 80m |
| Chen et al.49 | Taiwan | Angioplastia e RM GI = 21 H e M (69,7 anos) GC = 15 H e M (65,1 anos) | GI = RCV clínica supervisionada, bicicleta, 30min, 60 a 80% da FC reserva, 3 vezes/sem, 12 sem, fortalecimento muscular com pesos livres e aparelhos, 30min, 40 a 60% de 1RM, 12 a 15 repetições GC = tratamento medicamentoso e consultas médicas se necessário | TC6’ GI Inicial = 354,6±63,7m, GI Final = 373,3±62,4m GC Inicial = 329,7±47m, GC Final = 323,9 ± 146,2m |
| Sawatzky et al.50 | Canadá | Pré‐operatório de RM GI = 8 H e M (64 anos) GC = 7 H e M (63 anos) | GI = RCV clínica supervisionada, caminhada e bicicleta, 60min, 85% do VO2 máx, fortalecimento muscular com o peso corporal e theraband, 2 vezes/sem, 16 sem GC = 3 horas de reunião com enfermeira e médico anestesista, aconselhamento para hábito de vida saudável | TC6’ GI Inicial= 342±79m, GI Final= 474±101m GC Inicial = 337±52m, GC Final = 357 ±27m |
| Begot et al.51 | Brasil | EAM GI = 41 H e M (59 anos) GC = 45 H e M (57 anos) | GI = RCV domiciliar não supervisionada, caminhada 20 a 40min, 4 vezes/sem, 4 sem GC = Informações gerais sobre hábitos de vida saudável e importância de continuar a prática de atividade física iniciada no hospital | TC6’ GI Inicial= 460±106m, GI Final= 536±106m GC Inicial = 457±73m, GC Final = 487 ± 73m |
| Chrysohoou et al.52 | Grécia | IC GI = 33 H e M (63 anos) GC = 39 H e M (56 anos) | GI = RCV clínica supervisionada, bicicleta, 45min, 80 a 100% do VO2, 3 vezes/sem, 12 sem, fortalecimento muscular com aparelhos, 30 a 90% de 1RM, 3 séries, 10 a 15 repetições GC = tratamento médico usual | TC6’ GI Inicial = 422±77m, GI Final= 476±82 m GC Inicial = 406±64m, GC Final = 423 ± 65m |
Peixoto et al.53 | Brasil | EAM GI = 45 H e M (56,8 anos) GC = 43 H e M (56 anos) | GI = RCV domiciliar não supervisionada, caminhada, 20 a 40min, entre 4 e 5 na Escala de Borg Modificada, 4 vezes/sem, 4 sem GC = tratamento padrão e orientação de continuar a atividade física iniciada no período hospitalar | TC6’ GI Inicial = 434,2±86,3m, GI Final= 519,7±79,3m GC Inicial = 439,1±78,4m, GC Final = 452,1 ±111,2m |
| Piotrowicz et al.54 | Polônia | IC GI = 75 H e M (54,4 anos) GC = 32 H e M (62,1 anos) | GI = RCV clínica telemonitorada, caminhada nórdica, início de 10min (VO2 < 14 ml/kg/min); 15min (se VO2 entre 14 ‐ 20); 20min (se VO2 >20) progredindo até 45 ‐ 60min, 5 vezes/sem, 8 sem GC = tratamento padrão e recomendações sobre mudanças no estilo de vida e autocuidado | TC6’ GI Inicial = 428±93m, GI Final= 480±87m GC Inicial = 439±76m, GC Final = 465 ±91m |
| Safiyari‐Hafizi et al.55 | Canadá | IC GI = 20 H e M (57,8 anos) GC = 20 H e M (58,9 anos) | GI = RCV domiciliar supervisionada, caminhada progressiva, 10 a 50min, 80 a 85% do VO2 pico seguido de recuperação ativa de 40 a 50% VO2 pico, 2 vezes/dia a 5 vezes/sem, 12 sem; fortalecimento muscular com elásticos, 10 exercícios, resistência pelo comprimento do elástico, 1 a 3 séries, 15 repetições, 1 a 3/sem. GC = encorajamento para a prática de exercício moderado | TC6’ GI Inicial = 275±37,9m, GI Final= 312,2±42,1m GC Inicial = 259,6±25,1m, GC Final = 235,2 ±28,6m |
1RM: uma repetição máxima; EAM: enfarte agudo do miocárdio; FC: frequência cardíaca; GC: grupo controle; GI: grupo intervenção; H: homens; IC: insuficiência cardíaca; ISWT: Incremental Shuttle Walk Test; m: metros; M: mulheres; máx: máxima; min: minutos; RCV: reabilitação cardiovascular; RM: revascularização do miocárdio; sem: semanas; TC6’: teste de caminhada de seis minutos.
Dez estudos foram feitos em pacientes com insuficiência cardíaca41–47,52,54,55, dois em pacientes após enfarte agudo do miocárdio51,53, um em pacientes com angina48, um em pacientes pós‐angioplastia e revascularização do miocárdio49 e um estudo em pacientes no pré‐operatório de revascularização do miocárdio50.
Dos 10 estudos feitos em pacientes com insuficiência cardíaca, em apenas um estudo47 a RCV não foi supervisionada. A média de semanas de treinamento variou entre seis44 e 20 semanas42 e o número de sessões semanais foi de duas vezes42,43, três vezes por semana41,44–46, quatro vezes por semana52, cinco vezes por semana54,55 e sete vezes por semana47. Em um estudo55, os exercícios foram feitos diariamente (5‐10min) para os pacientes com capacidade funcional inferior a 3 METS; uma ou duas vezes por dia (15min) nos pacientes com capacidade funcional entre 3‐5 METS; e três a cinco sessões/semana (20 a 30min) em pacientes com capacidade funcional maior do que 5 METS. Todos os estudos usaram exercícios aeróbios no programa de RCV, com caminhadas41,47,55, caminhada nórdica54, bicicleta ergométrica41–43,45,52, esteira43,45, escada43 e ergómetro de braço41. Um estudo44 não especificou o tipo do exercício aeróbio. Sete estudos41,42,46,49,50,52,55 usaram exercícios de fortalecimento muscular, três com aparelhos41,49,52, três com elásticos46,50,55 e um com circuito42. O tempo do exercício aeróbio variou entre 10min47 e 90min44.
Dois estudos51,53 foram feitos em pacientes pós‐enfarte agudo do miocárdio, a RCV não foi supervisionada e os exercícios aeróbicos foram caminhadas (quatro semanas; quatro vezes por semana). Além disso, um estudo48 foi feito em pacientes com angina em um programa supervisionado (circuito; uma vez por semana; oito semanas). Um estudo foi conduzido em um programa supervisionado (três vezes por semana; 12 semanas; exercícios aeróbios em bicicleta e de resistência com peso corporal e aparelhos) com pacientes pós‐angioplastia e revascularização do miocárdio49. Um estudo50 foi feito em pacientes no pré‐operatório de revascularização do miocárdio, em programa supervisionado (duas vezes por semana; 16 semanas; exercícios aeróbios em bicicleta e caminhadas e exercício de resistência com peso corporal e elásticos). No geral, o tempo do exercício aeróbio variou de 10min54,55 a 80min48.
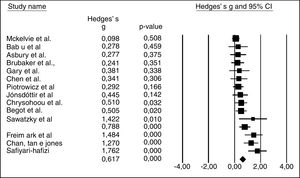
Teste de campo e meta‐análiseA Figura 2 mostra o tamanho do efeito dos 15 estudos incluídos. Os dados foram analisados em metros, consideraram‐se as médias e os desvios‐padrão pré e pós‐teste dos grupos controle e experimental, assim como o número de sujeitos de cada sessão. Os dados foram considerados heterogêneos (Q = 42,0; df = 14; I2 = 66,7%; p < 0,001). O tamanho do efeito de Hedges pelo modelo aleatório foi de 0,617 (0,373 a 0,86; p < 0,001), o que significou um aumento de 20% no desempenho do teste após a reabilitação cardiovascular.
A Tabela 2 mostra os dados das variáveis contínuas tratadas pela metarregressão. Apenas três variáveis mostram resultados significativos: duração do exercício aeróbio (p = 0,01), VO2max inicial (p < 0,01) e VO2max final (p = 0,01). Nesse contexto, em relação à duração do exercício aeróbio, para cada aumento de um minuto na duração do exercício, ocorre o aumento de 0,02 no tamanho do efeito para o desempenho no teste de campo. Já para o VO2max inicial e final, a associação foi negativa. Assim, para cada redução de 1mL.kg.min‐1 no VO2max inicial, há um aumento de 0,23 no tamanho do efeito; e para cada redução de 1mL.kg.min‐1 no VO2max final, há o aumento de 0,08 no tamanho do efeito. Variáveis contínuas como intensidade dos treinamentos aeróbio e de resistência, número de séries e número de repetições não foram submetidas à meta‐regressão, pois os dados foram apresentados em faixas amplas, impossibilitaram tanto a análise por metarregressão quanto a estratificação para análise por variáveis categóricas.
Variáveis analisadas pela metarregressão
| Variável | Número de estudos | Slope | p |
|---|---|---|---|
| Qualidade do estudo | 15 | ‐ 0,11 | NS |
| Fator de impacto | 14 | ‐ 0,05 | NS |
| Ano de publicação | 15 | 0,02 | NS |
| Sexo | 14 | ‐ 0,01 | NS |
| Idade (anos) | 15 | 0,003 | NS |
| IMC (kg.m‐2) | 9 | 0,04 | NS |
| Peso (kg) | 6 | ‐0,0003 | NS |
| Altura (m) | 3 | 0,005 | NS |
| Fração de ejeção inicial | 10 | 0,01 | NS |
| VO2max inicial (ml.kg‐1.min‐1) | 6 | ‐0,23 | < 0,01 |
| VO2max final (ml.kg‐1.min‐1) | 6 | ‐0,08 | 0,01 |
| Tempo de treinamento (semanas) | 15 | 0,01 | NS |
| Frequência semanal (dias) | 14 | ‐0,07 | NS |
| Duração do exercício aeróbio (min) | 12 | 0,02 | 0,01 |
IMC: índice de massa corporal; NS: valor não significativo; VO2max: consumo de oxigénio máximo.
A Tabela 3 mostra a análise de subgrupos das variáveis categóricas tratadas pelo teste Q baseado na análise de variância. Nesse grupo de variáveis, a duração do exercício aeróbio foi estratificada em três categorias (30‐35min; 45min; acima de 60min). A duração acima de 60min apresentou um tamanho de efeito significativamente maior do que a duração de 30‐35min. Além disso, foi possível observar diferença em relação ao tipo de treinamento, o efeito maior para o treinamento progressivo foi comparado ao treinamento contínuo.
Análise de subgrupo para as variáveis categóricas
| Variável | Categoria | N de estudos | Tamanho do efeito (IC 95%) | Comparação (teste Q baseado na análise de variância) |
|---|---|---|---|---|
| Tipo de treinamento | Contínuo Progressivo | 4 6 | 0,27 (‐0,11 a 0,65) 0,64 (0,3 a 0,98) | Progressivo > contínuo (p = 0,03) |
| Tipo de exercício | Caminhada Ciclo Caminhada + Ciclo | 6 3 4 | 0,66 (0,23 a 1,10) 0,45 (‐0,15 a 1,04) 0,66 (0,13 a 1,19) | NS |
| Local do treinamento | Casa Ambulatório | 5 10 | 0,74 (0,30 a 1,18) 0,56 (0,27 a 0,85) | NS |
| Patologia | EAM IC ANGIO/RM | 3 10 2 | 0,80 (0,21 a 1,40) 0,64 (0,33 a 0,96) 0,32 (‐0,42 a 1,05) | NS |
| Associação de treinamento | Aeróbio Aeróbio + resistência | 8 7 | 0,64 (0,30 a 0,98) 0,62 (0,24 a 1,01) | NS |
ANGIO: angioplastia; Ciclo: cicloergómetro; EAM: enfarte agudo do miocárdio; IC: insuficiência cardíaca; IC 95%: intervalo de confiança de 95%; NS: não significativo; RM: revascularização do miocárdio;
Não foi identificado viés de publicação pela regressão de Egger (p = 0,06) e pelo método de Duval e Tweedie (K = 15; Q = 31,38).
DiscussãoO objetivo do presente estudo foi verificar o tamanho do efeito e variáveis que influenciam os resultados de testes de campo usados em programas de RCV. Os resultados mostraram um predomínio do TC6’, o qual foi usado em 14 dos 15 estudos incluídos. O principal desfecho foi um aumento de 20% no desempenho do teste de campo final comparado ao inicial. Além disso, o desempenho no teste de campo está associado ao treinamento progressivo do exercício aeróbio, à maior duração desse exercício e aos valores iniciais e finais do VO2max.
Em relação ao exercício aeróbio, é estabelecido que esse tipo de exercício proporciona benefícios em pacientes com insuficiência cardíaca, por meio de mecanismos centrais (aumento do débito cardíaco, remodelação ventricular e modulação do sistema nervoso simpático) e periféricos (aumento da perfusão muscular periférica e da extração e uso de oxigénio)58. Em pacientes com fração de ejeção preservada, ocorre o aumento do VO2max por adaptações musculares e na microvasculatura59. Já em pacientes com doença arterial coronária, o exercício aeróbio diminui a progressão e reduz o tamanho das placas ateroscleróticas, melhora a função endotelial e aumenta a fração de ejeção do ventrículo esquerdo após o enfarte agudo do miocárdio60. Portanto, nossos resultados em relação à recomendação do exercício aeróbio reforçam os dados já descritos na literatura. Por outro lado, o presente estudo identificou que os melhores desempenhos em testes de campo foram obtidos a partir da execução do exercício aeróbio progressivo, ao invés da manutenção de uma mesma carga de esforço ao longo do período de treinamento. Nesse contexto, desde que o paciente tenha condições físicas e clínicas para suportar um esforço relativamente maior após um período de treinamento, o aumento gradual da intensidade pode ser uma estratégia interessante para um melhor desempenho. Contudo, os dados extraídos das referências que compuseram o presente estudo não possibilitaram concluir sobre a melhor intensidade de esforço ou o modelo de progressão, porque na maioria dos estudos esses dados foram mostrados em faixas amplas, não permitiram uma análise estatística adequada.
Sobre o tempo de execução do exercício aeróbio, nossos resultados mostraram que o maior efeito ocorre em relação direta com a duração do exercício. Contudo, dos 15 estudos incluídos, nove referências usaram um tempo de execução entre 30 e 45min; e apenas dois estudos usaram um tempo maior do que 60min. Embora nossos resultados mostrem que a cada um minuto de aumento na duração do exercício há um aumento de 0,02 no efeito, esse fato não significa, necessariamente, que exercícios extremamente longos serão positivos para o paciente. Dessa forma, ainda é prematuro assumir que os exercícios aeróbios devem ser feitos acima de 60min por pacientes cardiopatas. Por isso, outros estudos devem ser conduzidos com durações acima de 60min para permitir uma melhor análise dos resultados.
Sobre o VO2max, a metarregressão mostrou associação significativa tanto para os valores iniciais quanto finais com o desempenho no teste de campo. Esse fato sugere que pacientes com menor condicionamento físico no início da RCV respondem melhor do que os pacientes mais condicionados. De forma análoga, os pacientes que exibiram menor condicionamento no fim da RCV apresentaram um melhor tamanho do efeito. Ou seja, os pacientes menos condicionados tendem a apresentar melhor resposta no teste de campo após a RCV. Na mesma linha dos nossos achados, Uddin et al.61 demonstraram em um estudo de meta‐análise que o VO2max no momento inicial consiste em uma variável preditora para a capacidade de exercício após a RCV. Além disso, os autores também observaram que a intensidade do exercício consiste em outra variável preditora da capacidade de exercício no fim do programa de reabilitação.
Algumas outras variáveis, porém, não mostram relação com o aumento do desempenho, por exemplo sexo, altura, peso e IMC. Considerando que o TC6’ foi predominantemente citado e que esse tipo de teste pode ser afetado por diferenças antropométricas, poder‐se‐ia supor que sujeitos mais altos ou mais pesados sofressem alguma influência no desempenho. Porém, uma das possíveis explicações para a não confirmação dessa influência pode estar associada às características clínicas das amostras. Pelo fato de incluirmos apenas estudos com pessoas doentes, diferenças de altura, peso e sexo não tiveram o poder estatístico de influenciar os resultados. Contudo, cabe ressaltar que os estudos incluídos não reportaram, quando foi o caso, desfechos separados para o sexo ou para pontos de corte do IMC. Portanto, mesmo que nosso estudo não tenha identificado relação entre tais variáveis com o desempenho no teste, isso ainda precisa de confirmação. Além das variáveis antropométricas, o tempo de RCV e a frequência semanal das terapias não influenciaram o desempenho final. Isso pode ser explicado pela dificuldade de análise devido à heterogeneidade dos protocolos quanto ao tipo de supervisão, tipo de exercício aeróbio, duração e intensidade do treinamento.
Para além das variáveis fisiológicas ou associadas com o treinamento per si, também foram analisados os dados relativos a fator de impacto da publicação, qualidade dos estudos e ano de publicação. A justificativa para a inclusão dessas análises foi verificar a ocorrência de algum viés sobre estudos com diferentes qualidades, publicados em periódicos com diferentes fatores de impacto ou publicados em anos diferentes. Porém, não foram identificadas relações entre essas variáveis e o desfecho final.
ConclusãoEssa revisão sistemática com meta‐análise apresentou como principal resultado um aumento do desempenho dos testes de campo após a RCV e que a maior duração do exercício aeróbio representa melhor o desempenho. Esses resultados podem contribuir para prescrição das sessões de exercício da RCV.
Fontes de FinanciamentoEstudo parcialmente financiado pelo Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), Brasil (processo 303566/2013‐2).