O hematoma intramural da aorta (IMH) é uma síndrome aórtica aguda caracterizada pela ocorrência de hemorragia a nível da camada média da parede da aorta, sem evidência de rutura ou flap da íntima. A história natural desta entidade clínica é muito variável e ainda pouco conhecida, pelo que a sua abordagem terapêutica não está completamente estabelecida. Nalguns casos pode ocorrer regressão parcial ou completa do hematoma sob tratamento médico, mas numa proporção significativa existe evolução para dissecção, dilatação aneurismática ou rutura.
Os autores apresentam o caso de um homem de 44 anos, hipertenso, admitido com o diagnóstico de IMH da aorta descendente. Apesar de a resolução dos sintomas e do adequado controlo da tensão arterial com a terapêutica médica, o IMH evoluiu a curto prazo para a formação de um pseudoaneurisma, que foi tratado eficazmente por via endovascular.
Aortic intramural hematoma (IMH) is an acute aortic syndrome characterized by bleeding into the media of the aortic wall without intimal disruption or the classic flap formation. Its natural history is variable and still poorly understood, so strategies for therapeutic management are not fully established. In some cases there is partial or complete regression of the hematoma under medical treatment, but most progress to dissection, aneurysmal dilatation or aortic rupture.
The authors present the case of a 44‐year‐old hypertensive male patient admitted with a diagnosis of IMH of the descending aorta. Despite initial symptom resolution and optimal medical therapy, the IMH evolved to a pseudoaneurysm, which was successfully treated by an endovascular approach.
O hematoma intramural da aorta (IMH) é considerado uma variante da dissecção aórtica (DAo) clássica, caracterizado pela presença de hemorragia a nível da camada média da parede da aorta na ausência de rutura da íntima. Representa cerca de 10‐30% das síndromes aórticas agudas1 e tem apresentação clínica, morbilidade e mortalidade semelhantes à da DAo. No entanto, a sua história natural e abordagem terapêutica não estão tão bem estabelecidas como na DAo. Muita desta incerteza deve‐se ao seu comportamento dinâmico e imprevisível ao longo do tempo, podendo regredir ou evoluir para dissecção, dilatação aneurismática ou rutura, o que implica uma vigilância clínica e um follow‐up imagiológico continuados.
Caso clínicoDoente do sexo masculino, 44 anos de idade, fumador (48UMA), obeso (IMC de 31kg/m2) e com hipertensão arterial não medicada e não controlada. Recorreu ao serviço de urgência por início súbito de dor torácica intensa, que descrevia como «facada», com irradiação para a região interescapular e agravada na posição de decúbito dorsal. À admissão apresentava‐se hipertenso (160/85mmHg), sem diferencial significativo de pressões nos dois membros superiores, normocárdico (78 pulsações/minuto), com pulsos periféricos amplos e simétricos e sem outras alterações relevantes no exame objetivo.
No eletrocardiograma de 12 derivações apresentava ritmo sinusal e critérios de voltagem para hipertrofia ventricular esquerda (HVE). No estudo analítico destacavam‐se ligeira leucocitose com neutrofilia e elevação da proteína C reativa, sem elevação dos biomarcadores de necrose do miocárdio. O ecocardiograma transtorácico mostrou dilatação moderada da aurícula esquerda e ventrículo esquerdo de dimensões no limite superior do normal, HVE concêntrica de grau moderado, dilatação ligeira da raiz da aorta e aorta ascendente, sem evidência de flaps ou regurgitação aórtica, função sistólica de ambos os ventrículos globalmente conservada.
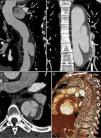
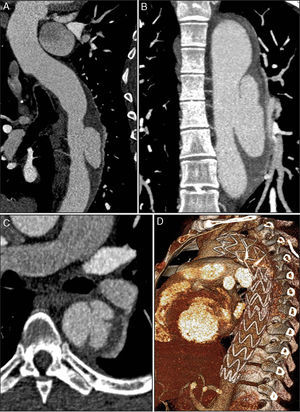
Para despiste de patologia da aorta, realizou‐se angiotomografia computorizada (angioTC) do tórax que evidenciou dilatação ligeira da aorta ascendente (diâmetro máximo de 42mm) e um espessamento circunferencial da parede da aorta (de aproximadamente 10mm), compatível com IMH, com início imediatamente após a origem da artéria subclávia esquerda e envolvendo toda a aorta descendente e porção proximal da aorta abdominal, até ao nível da emergência das artérias renais (figura 1). Além disso, evidenciava‐se também a presença de canal arterial patente tipo A (figura 1B) e na região proximal da aorta descendente duas ulcerações da parede e uma placa aterosclerótica parcialmente calcificada (figura 1B e C).
Imagens da primeira angioTC efetuada, onde se observa o espessamento circunferencial da parede da aorta (setas), compatível com hematoma intramural, com início imediatamente após a origem da artéria subclávia esquerda e envolvendo toda a aorta descendente e porção proximal da aorta abdominal (imagem A); imagem B – canal arterial patente (ponta de seta) e uma placa aterosclerótica parcialmente calcificada (seta); imagem C – as setas destacam duas ulcerações da parede da aorta descendente proximal.
Presumindo‐se o diagnóstico de IMH da aorta descendente (Stanford tipo B) não complicado, o doente foi internado na unidade de cuidados intensivos cardíacos e iniciou‐se terapêutica com nitroprussiato de sódio e labetalol por via endovenosa, tendo‐se conseguido um adequado controlo tensional e a resolução completa dos sintomas. O caso foi discutido em reunião médico‐cirúrgica e, atendendo à estabilidade clínica sob terapêutica médica e à ausência de complicações, foi decidido manter terapêutica médica e vigilância clínica e imagiológica.
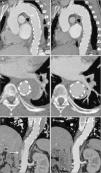
Ao oitavo dia de internamento foi repetida angioTC que mostrou um ligeiro aumento da espessura do hematoma (agora com cerca de 15mm), embora sem aumento da sua extensão longitudinal, e uma das ulcerações da parede da aorta apresentava um aspeto mais profundo e irregular (figura 2). O caso foi novamente discutido com a cirurgia cardiotorácica, tendo sido recusada intervenção cirúrgica, pelo que se manteve uma estratégia de vigilância e tratamento médico. O doente permaneceu clinicamente estável durante o internamento, tendo tido alta ao 19.° dia, medicado com quatro classes de anti‐hipertensores, incluindo bloqueador‐beta, orientado para a consulta externa de cardiologia e com controlo imagiológico agendado.
AngioTC de controlo ao oitavo dia mostrando um ligeiro aumento da espessura do hematoma (agora com 15mm e com um envolvimento em crescente da parede da aorta) (C), mantendo a sua extensão desde a subclávia esquerda até à emergência das artérias renais (A); uma das ulcerações da parede da aorta visualizadas na primeira angioTC apresentando um aspeto mais profundo e irregular (seta) (B).
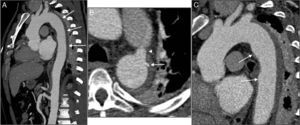
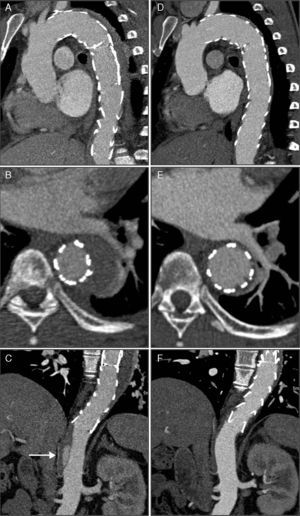
Na angioTC de controlo realizada um mês após a alta verificou‐se que tinha ocorrido rutura da íntima ao nível de uma das ulcerações da aorta e evolução para uma dissecção localizada, com imagem de pseudoaneurisma na porção proximal da aorta descendente, com dimensões de 27x51mm (figura 3). Face a isto, o doente foi novamente internado e, após discussão com cardiologia de intervenção e cirurgia cardiotorácica, foi decidido realizar tratamento percutâneo da aorta descendente (TEVAR), através da implantação de duas endopróteses (Valiant® 38x150mm e 34x150mm). A prótese proximal foi aposta à origem da artéria subclávia esquerda, sem condicionar compromisso do fluxo deste vaso, estendendo‐se a prótese distal até ao início da aorta abdominal, recobrindo‐se assim as ulcerações da aorta, o pseudoaneurisma, o canal arterial patente e a maior extensão do IMH. Na angioTC de controlo pós‐procedimento confirmou‐se o bom resultado da TEVAR e, distalmente à endoprótese distal, observou‐se uma imagem de dissecção da aorta abdominal, desde o tronco celíaco até ao nível da artéria mesentérica superior, sendo que estes dois vasos e as artérias renais tinham origem no verdadeiro lúmen (figura 4A, B e C). Não foi possível confirmar se esta dissecção estava já presente previamente à TEVAR, uma vez que a angioTC anteriormente efetuada tinha aquisição limitada à região torácica. Perante este achado, assumiu‐se uma estratégia conservadora.
AngioTC de controlo realizada 30 dias após a alta mostrando a evolução do IMH para dissecção e formação de um pseudoaneurisma com 27x51mm de maior diâmetro e colo de 23mm (A, B e C). O pseudoaneurisma localizava‐se ao nível da porção média da aorta descendente e a rutura da íntima teve origem na ulceração da parede da aorta que mostrara sinais de progressão na segunda angioTC. Imagem D: reconstrução tridimensional pela técnica de volume rendering da angioTC pós‐TEVAR, observando‐se as duas endopróteses parcialmente sobrepostas, recobrindo a aorta desde a artéria subclávia esquerda até ao início da aorta abdominal.
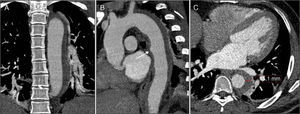
Imagens da angioTC realizada imediatamente após a TEVAR (A, B e C) e da angioTC de controlo seis meses após o tratamento (D, E e F). Observam‐se as duas endopróteses aórticas parcialmente sobrepostas, recobrindo o IMH e o canal arterial, desde a artéria subclávia esquerda até ao início da aorta abdominal, sem evidência de endoleaks (A). Na figura C, a imagem de DAo distalmente à prótese (seta), com origem ao nível do tronco celíaco e estendendo‐se até à artéria mesentérica superior. Comparativamente à angioTC pós‐procedimento, na angioTC de controlo aos seis meses observa‐se uma regressão quase total do IMH (D e E) e o desaparecimento da imagem de DAo abdominal (F).
Após a alta, o doente manteve seguimento regular em consulta externa de cardiologia. Na angioTC de controlo realizada aos seis meses mantinha bom resultado do tratamento e constatou‐se uma regressão quase total do IMH e desaparecimento da imagem de DAo abdominal (figura 4D, E e F). Atualmente, com 18 meses de follow‐up, mantém‐se clinicamente estável, assintomático e com perfil tensional controlado (média das 24 horas de 107/73mmHg em monitorização da pressão arterial em ambulatório), e mantendo bom resultado imagiológico na angioTC dos 12 meses.
DiscussãoO IMH caracteriza‐se pela ocorrência de hemorragia na camada média da parede da aorta, geralmente secundária a rotura espontânea de vasa vasorum ou a uma úlcera aterosclerótica que penetra na lâmina elástica interna1. A hipertensão arterial é o principal fator predisponente para a formação do IMH. Esta entidade clínica representa cerca de 10‐30% das síndromes aórticas agudas1, geralmente afeta doentes mais idosos (idade média de 68 anos) e com mais fatores de risco cardiovascular que a DAo, e envolve mais frequentemente a aorta descendente (60‐85% dos casos)2,3. À semelhança da DAo, a classificação de Stanford é utilizada para dividir os IMH em proximais ou tipo A (envolvendo a aorta ascendente) e distais ou tipo B quando não há envolvimento da aorta ascendente.
A apresentação clínica e diagnóstico do IMH e da DAo são semelhantes, sendo a dor o sintoma mais frequente. No caso dos hematomas proximais predomina a dor torácica anterior, enquanto nos hematomas envolvendo a aorta descendente é mais frequente a dor dorsal (interescapular) ou lombar4. Outras manifestações que podem ocorrer na DAo, como má perfusão de órgãos, défice de pulsos, enfarte do miocárdio ou sintomas neurológicos, são menos frequentes nos IMH.
Uma vez que a apresentação clínica das várias síndromes aórticas agudas é indistinguível, os métodos de imagem são fundamentais para o diagnóstico etiológico. A angioTC, a ressonância magnética e o ecocardiograma transesofágico têm acuidade diagnóstica semelhante5, mas a angioTC tem sido o método de imagem de primeira escolha no diagnóstico e seguimento dos IMH. Os critérios de diagnóstico são a presença de um espessamento circunferencial ou crescente da parede da aorta ≥7mm e/ou a evidência de acumulação de sangue na camada média da aorta, na ausência de rutura/flap da íntima5. Na angioTC o espessamento da parede tem densidade superior ao sangue e às camadas adjacentes da parede da aorta (aproximadamente 50‐70 unidades de Hounsfield) e não realça após administração de agentes de contraste.
A história natural dos IMH é muito variável e ainda pouco conhecida. De acordo com a literatura, em cerca de 10‐34% dos casos pode ocorrer regressão ou reabsorção completa do hematoma, em 28‐47% ocorre rotura da íntima e consequente disseção e 20‐45% evoluem para dilatação aneurismática e rutura2,6 A mortalidade intra‐hospitalar é semelhante à da DAo (20,7 versus 23,9%, respetivamente)2 e também à semelhança da dissecção, o comportamento clínico do IMH varia de acordo com a sua localização. Os hematomas que envolvem a aorta ascendente têm um risco maior e mais precoce de morte ou complicações como dissecção, rutura, regurgitação aórtica, tamponamento cardíaco ou enfarte agudo do miocárdio, enquanto os IMH tipo B têm geralmente um comportamento mais benigno. De facto, a taxa de progressão para DAo descrita na literatura é de 3‐14% nos IMH tipo B e de 11‐88% nos hematomas que envolvem a aorta ascendente7. Numa meta‐análise de 143 doentes, aqueles com IMH tipo A tratados por cirurgia tiveram menor mortalidade do que os que foram tratados medicamente (14 versus 36%), enquanto os doentes com IMH da aorta descendente tiveram mortalidade semelhante com terapêutica médica ou cirúrgica (14 versus 20%)3.
Embora não existam recomendações terapêuticas bem estabelecidas para os IMH, com base na evidência atual, a comunidade científica recomenda que os doentes com esta entidade clínica sejam tratados da mesma forma que os doentes com DAo7. A estabilização médica inicial aplica‐se a todas as síndromes aórticas agudas e baseia‐se na redução da pressão arterial com betabloqueadores endovenosos como agentes de primeira linha (ex. metoprolol, propanolol, labetalol ou esmolol), para valores‐alvo de tensão arterial sistólica de 100 a 120mmHg e frequência cardíaca<60 batimentos por minuto7,8. Quando necessário, podem associar‐se vasodilatadores endovenosos, como por exemplo, nitroprussiato de sódio ou nitroglicerina. Nos doentes com IMH tipo A, a cirurgia precoce é o tratamento de eleição, enquanto nos hematomas não complicados da aorta descendente recomenda‐se uma terapêutica médica intensiva (controlo agressivo da tensão arterial e terapêutica alfa e beta‐bloqueante), à semelhança da DAo tipo B6–10. Nestes doentes tratados medicamente, dada a evolução imprevisível dos IMH, é necessário manter um follow‐up clínico e imagiológico apertado 1, 3, 6 e 12 meses após o diagnóstico e anualmente depois1. Na presença de dor persistente ou recorrente, hipertensão refractária, isquemia de órgãos ou dos membros inferiores ou evidência de progressão (dilatação, dissecção ou ruptura) no follow‐up imagiológico, os IMH tipo B deverão ser alvo de tratamento endovascular ou cirúrgico, sendo que o primeiro se tem vindo a estabelecer nos últimos anos como a opção de primeira linha nestes casos7,11–13.
Embora não existam estudos aleatorizados comparando a cirurgia com a TEVAR para o tratamento das patologias da aorta, os resultados dos estudos realizados têm demonstrado que os doentes tratados com TEVAR têm uma menor mortalidade peri‐procedimento e uma redução das complicações neurológicas, hemorrágicas, cardíacas e respiratórias, comparativamente com a cirurgia convencional14. As principais complicações associadas ao tratamento percutâneo relacionam‐se com o acesso vascular, uma vez que para a colocação da endoprótese é geralmente necessário um acesso arterial de grande calibre (mínimo de 22‐24 F). O risco de paraplegia/paresia existe, mas tem sido significativamente inferior ao observado com a cirurgia14. Outro problema que tem sido associado à TEVAR é o risco de desenvolvimento de endoleaks, os quais podem surgir em até 10‐20% dos doentes7, e obrigar a re‐intervenção. Com base nos resultados favoráveis demonstrados a curto e médio prazo, a TEVAR tem vindo a ser utilizada num número cada vez maior de doentes, com diferentes tipos de patologias da aorta torácica, incluindo o IMH, embora persistam algumas dúvidas quanto à eficácia e durabilidade desta técnica a longo prazo. Após TEVAR é recomendado um seguimento imagiológico por angioTC (ou em alternativa ressonância magnética) antes da alta, aos 6 meses, aos 12 meses e depois anualmente 13.
Sendo a história natural dos IMH pouco conhecida e não estando a sua estratégia terapêutica bem estabelecida, nos últimos anos tem sido realizada alguma investigação com o objetivo de identificar fatores preditores de progressão dos IMH. A localização proximal dos IMH (Stanford tipo A) é considerada um fator preditor independente de progressão para dissecção, rutura ou formação de aneurisma4,15. Kaji et al. documentaram que os doentes com IMH tipo A e diâmetro máximo da aorta ≥50mm na angioTC inicial tinham um risco ainda maior de progressão da doença que aqueles com diâmetro aórtico<50mm16.
No caso dos IMH tipo B, um estudo de Sueyoshi et al.17 demonstrou que um diâmetro máximo da aorta ≥40mm e uma espessura máxima do hematoma ≥10mm na angioTC inicial eram preditores independentes de progressão. Num outro estudo o aumento progressivo do diâmetro da aorta ou da espessura da parede, a idade<55 anos e a ausência de terapêutica com betabloqueador foram também considerados fatores preditores de progressão dos IMH4.
A presença de uma úlcera penetrante em associação ao IMH tem sido também um dos principais fatores associados a maior risco de progressão sob terapêutica médica1,18. Numa série de 65 doentes com IMH tratados medicamente, a progressão para rutura aórtica, expansão do hematoma ou dissecção ocorreram de forma significativamente mais frequente em doentes com úlcera penetrante da aorta (48 versus 8% nos doentes sem úlcera penetrante), particularmente naqueles com úlceras de maiores dimensões (diâmetro máximo ≥20mm ou profundidade máxima ≥10mm)18. Com base nestes dados, tem sido sugerido por alguns autores que os doentes com hematomas da aorta descendente e úlcera penetrante sejam candidatos a tratamento endovascular.
No caso clínico que descrevemos, tratando‐se de um IMH tipo B sem evidência de complicações, foi decidida, de acordo com as recomendações atuais, uma estratégia inicial de tratamento médico e vigilância. Apesar de a resolução dos sintomas e da otimização tensional, a angioTC de controlo aos oito dias mostrava um ligeiro aumento da espessura do IMH e, um mês após a alta, foi documentada progressão para disseção e formação de pseudoaneurisma. Apesar de não existirem indicações claras quanto ao tratamento destes doentes, este caso alerta para a importância de manter um controlo imagiológico apertado que permita identificar precocemente complicações ou progressão do IMH e parece sustentar uma intervenção precoce quando há evidência de progressão da espessura do IMH.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos do seu centro de trabalho acerca da publicação dos dados de pacientes.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesOs autores declaram não haver conflito de interesses.