A existência de cardiopatia estrutural, a história de cirurgia cardíaca prévia (frequentemente envolvendo a aurícula esquerda) e a ablação percutânea da fibrilhação auricular conduziram a um aumento da incidência de taquicardias auriculares regulares, frequentemente apresentando‐se como flutters atípicos. Este tipo de flutter é particularmente frequente após isolamento das veias pulmonares, especialmente após extensa ablação auricular, incluindo lesões e/ou desfragmentação lineares.
Os autores descrevem o caso de um homem, 51 anos de idade, sem antecedentes patológicos conhecidos, encaminhado para a consulta de cardiologia, em 2009, por fibrilhação auricular paroxística. Após insucesso da terapêutica antiarrítmica, foi referenciado para ablação percutânea, com critérios de sucesso agudo. Três anos depois, reiniciou queixas de palpitações e foi documentado flutter auricular atípico. O estudo eletrofisiológico confirmou o diagnóstico de flutter atípico esquerdo e reaparecimento de atividade elétrica na veia pulmonar inferior direita. Fez re‐ablação da veia recanalizada com sucesso, sem qualquer recorrência arrítmica até ao momento.
Na era da ablação percutânea, é essencial perceber o mecanismo da arritmia e reconhecer a existência destes flutters atípicos.
Cardiac surgery for structural heart disease (often involving the left atrium) and radiofrequency catheter ablation of atrial fibrillation have led to an increased incidence of regular atrial tachycardias, often presenting as atypical flutters. This type of flutter is particularly common after pulmonary vein isolation, especially after extensive atrial ablation including linear lesions and/or defragmentation.
The authors describe the case of a 51‐year‐old man, with no relevant medical history, referred for a cardiology consultation in 2009 for paroxysmal atrial fibrillation. After failure of antiarrhythmic therapy, he underwent catheter ablation, with criteria of acute success. Three years later he again suffered palpitations and atypical atrial flutter was documented. The electrophysiology study confirmed the diagnosis of atypical left flutter and reappearance of electrical activity in the right inferior pulmonary vein. This vein was again ablated successfully and there has been no arrhythmia recurrence to date.
In an era of frequent catheter ablation it is essential to understand the mechanism of this arrhythmia and to recognize such atypical flutters.
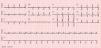
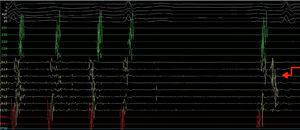
Os autores descrevem o caso de um homem, 51 anos de idade, referenciado à consulta externa de cardiologia por fibrilhação auricular (FA) paroxística, em 2009 (primeiro episódio objetivado em dezembro de 2008, com duração de 18h e término espontâneo); sem outros antecedentes patológicos conhecidos. Iniciou estudo complementar com ecocardiograma transtorácico, que revelou ausência de cardiopatia estrutural (cavidades cardíacas de dimensões normais; função sistólica biventricular conservada; sem evidência de disfunção diastólica; sem disfunção valvular); avaliação analítica que não demonstrou alterações significativas (incluindo função renal, tiroideia e hepática) e prova de esforço (protocolo de Bruce: 8min, 30seg; máxima; assintomática; sem alterações eletrocardiográficas significativas; sem evidência de distúrbio do ritmo cardíaco no esforço ou recuperação). Em 2010, referia vários episódios de palpitações (score EHRA III), com documentação de FA na monitorização de ambulatório (Holter). Inicialmente, estes episódios tinham periodicidade mensal. Após discussão das possíveis estratégias terapêuticas com o doente, foi decidido iniciar terapêutica antiarrítmica com flecainida e bisoprolol; por apresentar um score de CHA2DS2VASc de zero, não iniciou terapêutica antitrombótica. Apesar da terapêutica antiarrítmica, apresentou várias recorrências sintomáticas de FA, pelo que o doente foi referenciado para ablação percutânea. Fez isolamento das veias pulmonares em 2011 com radiofrequência, com critérios de sucesso agudo. Em 2014, iniciou novamente queixas de palpitações, com necessidade de recorrer ao serviço de urgência, onde foi detetado flutter auricular (FLA) atípico com resposta ventricular rápida (Figura 1). Durante esse episódio, foi anticoagulado e iniciou controlo da frequência cardíaca com bisoprolol e foi programada cardioversão elétrica após três semanas. Após esse período, fez cardioversão elétrica com sucesso, manteve anticoagulante durante quatro semanas e iniciou novamente terapêutica antiarrítmica com propafenona e bisoprolol. No entanto, manteve vários episódios recorrentes de FLA sintomáticos, pelo que foi decidido realizar estudo eletrofisiológico (EEF) e ablação do FLA.
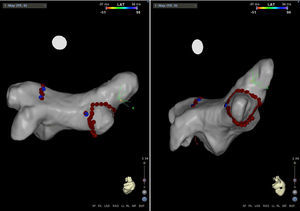
Em março de 2015 foi efetuado novo EEF, imediatamente antecedido de angiotomografia computorizada (angio‐TC) da aurícula esquerda e veias pulmonares, embora a anatomia fosse previamente conhecida do anterior procedimento, para quantificar a volumetria da aurícula esquerda e descartar estenose das veias pulmonares, situação que foi descartada. Estas imagens foram usadas na construção eletroanatómica da aurícula esquerda efetuada no EEF, sem que fosse efetuada a integração de imagem.
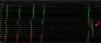
Foram introduzidos por cateterismo venoso femoral um cateter quadripolar na aurícula direita, ou na posição hisiana, e um cateter decapolar no seio coronário e, considerando os antecedentes de isolamento prévio das veias pulmonares e os algoritmos de localização do circuito pela morfologia das ondas de Flutter (ondas F) no eletrocardiograma (ECG) de superfície, foi de imediato efetuada dupla abordagem transeptal, com introdução de um cateter circular de dez polos (Lasso – Biosense) e um cateter de ablação irrigado com sensor de pressão (Smart‐Touch), que foram avançados para a aurícula esquerda. Com a manipulação do cateter Lasso para a construção da anatomia da aurícula esquerda e junto da veia pulmonar inferior, o FLA cessou por inibição mecânica (Figura 2).
EEF a demonstrar a conversão do FLA esquerdo a RS apenas com a manipulação do cateter Lasso na aurícula esquerda, por manipulação junto ou mesmo dentro da veia pulmonar inferior esquerda, sendo possível verificar existência de sinal de veia no primeiro batimento sinusal. CS1 – CS5: cateter decapolar no seio coronário; (L2‐L3) a (L9‐L10) – cateter Lasso circunferencial dez polos; RDFd – RDFp: cateter de ablação. Seta: sinais da veia pulmonar.
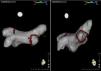
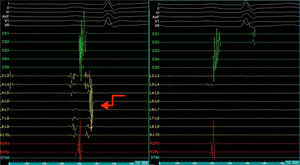
O mapeamento elétrico da aurícula esquerda mostrou tão‐somente recanalização elétrica da veia pulmonar inferior direita (Figura 3). Foi efetuada estimulação elétrica programada da aurícula, com três ciclos base e três extraestímulos acoplados até ao período refratário auricular, sem que fosse possível induzir FLA ou FA. Perante a não indutibilidade do FLA e, portanto, impossibilidade de efetuar o seu mapeamento detalhado, foi efetuado isolamento da veia inferior direita com critérios de sucesso agudo e sem complicações peri procedimento Figura 4).
EEF com demonstração de atividade elétrica a nível da veia pulmonar inferior direita (esquerda) e sem atividade elétrica após re‐ablação da veia (direita). CS1 – CS5: cateter decapolar no seio coronário; (L2‐L3) a (L9‐L10) – cateter Lasso circunferencial dez polos; RDFd – RDFp: cateter de ablação. Seta: sinais da veia pulmonar.
Com seis meses de follow‐up, o doente refere franca melhoria sintomática, apenas palpitações esporádicas. Repetiu monitorização eletrocardiográfica de 24 horas, que revelou ritmo sinusal (RS) e nove extrassístoles supraventriculares nesse período.
DiscussãoA FA é um desafio cardiovascular major da sociedade moderna. Estima‐se que tenha uma prevalência entre 1,5 e 2% da população geral e está associada a aumento do risco de acidente vascular cerebral (AVC) isquémico e insuficiência cardíaca congestiva, assim como maior mortalidade1,2.
Segundo as recomendações da Sociedade Europeia de Cardiologia, a ablação percutânea da FA paroxística sintomática deve ser considerada em doentes com recorrência sintomática de FA, apesar de terapêutica antiarrítmica (recomendação IA)1. O isolamento elétrico de todas as veias pulmonares é atualmente considerado o procedimento de referência na ablação percutânea1–3.
Nos últimos anos, assistiu‐se a um grande desenvolvimento das técnicas de ablação percutânea da FA e este procedimento tornou‐se um dos mais importantes na abordagem desta arritmia. No entanto, há variações consideráveis na taxa de sucesso da ablação, o que poderá ser explicado pelas características da população, diferenças técnicas e indexes de avaliação4.
A ablação da FA é mais eficaz na manutenção do RS do que os fármacos antiarrítmicos; no entanto, as recorrências a longo prazo são significativos. Estudos prévios reportaram uma taxa de sucesso de 85% no primeiro ano e 52% aos cinco anos com o uso de radiofrequência. A recorrência precoce parece ser o preditor negativo mais importante. Estudos prévios demonstraram que a idade do doente, as dimensões da aurícula esquerda, a cardiopatia estrutural, o tipo de FA e a duração de FA são, também, fatores preditores de recorrência1,2,4.
Recentemente Wei et al. avaliaram 267 doentes submetidos a isolamento das veias pulmonares e verificaram que, ao longo de um follow‐up médio de 300 dias, 44 (16,5%) doentes apresentaram recorrência: 21 doentes com FLA, 18 com FA e cinco com taquicardia auricular. Através da análise multivariada, verificaram que o tipo de FA, duração de FA, diâmetro da aurícula esquerda e diâmetro das veias pulmonares esquerdas foram fatores preditores de recorrência (Hazzard ratio respetivos de 3416; 2148; 4619 e 2811 com p<0,05)4.
Como última nota sobre a ablação da FA, a crioablação tem ganho cada vez mais aceitação como técnica de isolamento das veias pulmonares; embora a primeira geração de balões de crioablação tenha demonstrado eficácia clínica moderada a longo prazo combinada com perfil de segurança aceitável (principais efeitos adversos: paralisia do nervo frénico e lesão esofágica térmica); a 2.a geração de balões de crioablação (balões de 28mm com incorporação de um sistema de injeção refrigerante que providencia um arrefecimento homogéneo de todo o hemisfério distal do balão) demonstrou taxa de sucesso de 80% com o follow‐up de um ano (81% na FA paroxística e 77% na FA persistente de curta duração). Relativamente aos principais efeitos adversos, a incidência de lesão esofágica variou 12‐19%; enquanto a incidência de paralisia do nervo frénico variou consideravelmente entre centros (3,5‐19,5%)5.
O FLA pode ocorrer após ablação percutânea da FA.
O termo flutter surgiu pela primeira vez em 1887, com Mac William, que descreveu o fenómeno visual da estimulação auricular que resultou num flutter rápido6. Posteriormente, um mecanismo de macroreentrada foi comprovado por sistema de mapeamento no laboratório de eletrofisiologia7.
O FLA é menos frequente do que a FA; no entanto, a prevalência também aumenta com a idade. Estima‐se que a incidência de FLA em indivíduos com menos de 50 anos seja de 5/100000 e de 587/100000 nos com mais de 80 anos7.
O FLA pode coexistir ou preceder a FA e a relação entre ambos é complexa. Alguns autores defendem que, em doentes em que coexistam FA e FLA, deve ser realizada a ablação percutânea da FA e eventualmente em associação com a ablação do FLA7.
Em 1970, Puech e Grolleau propuseram uma classificação do FLA baseada na morfologia do ECG de 12 derivações. A forma mais frequente de FLA, designada «típica», era caraterizada por ondas F bifásicas predominantemente negativas nas derivações inferiores, com padrão «dentes de serra» e ondas F predominantemente positivas em v1. O FLA atípico correspondia aos FLA que não apresentavam a morfologia anteriormente descrita7.
Atualmente, o FLA é definido como uma taquicardia auricular regular com frequência ≥240bpm, com ausência de linha isoelétrica entre as deflexões. O designado FLA típico (dependente do istmo cavo‐tricúspide) ocorre quando o ponto pivot inferior corresponde à área delimitada anteriormente pela parte inferior do orifício da tricúspide e posteriormente pela porção inferior da veia cava1,7.
A existência de cardiopatia estrutural, a história de cirurgia cardíaca prévia (frequentemente envolvendo a aurícula esquerda) e a ablação percutânea da FA conduziram a um aumento da incidência de taquicardias auriculares regulares, frequentemente apresentando‐se como FLA atípicos. Este tipo de FLA é particularmente frequente após isolamento das veias pulmonares, especialmente após extensa ablação auricular incluindo lesões e/ou desfragmentação lineares. Também podem formar‐se gaps entre as linhas de ablação, que podem desempenhar um papel nos circuitos de reentrada. O mecanismo mais frequente é a reentrada mitral, teto‐dependente ou circuitos septais. Recentemente foram, também, reportados circuitos bi‐auriculares7,8.
A ferramenta mais útil para avaliar a origem (esquerda ou direita) de um FLA a partir do ECG de superfície é avaliar a morfologia das ondas F em v1. Se nesta derivação as ondas F apresentarem uma base ampla positiva, é altamente preditivo de origem esquerda; se, pelo contrário, as ondas F apresentarem um componente inicial isoelétrico (ou invertido) seguido de uma deflexão positiva, é compatível com FLA direito. Quando as ondas F são profundamente invertidas em v1 é muito sugestivo de origem direita. Por fim, quando as ondas F são bifásicas ou isoelétricas em v1 não são úteis na predição da câmara de origem9.
Relativamente ao caso clínico, dados os antecedentes do doente e as características eletrocardiográficas do FLA (onda F com ampla base positiva em v1) foi considerado desde o início tratar‐se de um FLA atípico esquerdo. Como o FLA mitral é um dos tipos de FLA mais frequentes após ablação de FA e ponderadas, também, as características eletrocardiográficas, foi considerado como hipótese diagnóstica tratar‐se de FLA mitral, o que não foi possível confirmar no EEF pela não sustentabilidade do FLA e, portanto, impossibilidade de efetuar o seu mapeamento detalhado. O EEF revelou tão‐somente recanalização elétrica da veia pulmonar inferior direita que foi re-isolada com sucesso.
A título de exemplo de um FLA atípico esquerdo, temos então FLA mitral que é constituído por um circuito de macrorreentrada em torno do anel mitral e áreas de baixa voltagem ou cicatrizes na aurícula esquerda. Gerstenfeld el al. descreveram as caraterísticas eletrocardiográficas do FLA mitral: a polaridade de cada onda F foi determinada 80ms antes do pico mais alto da deflexão positiva em V1. No FLA anti‐horário, as ondas F eram positivas nas derivações inferiores e pré cordiais e com um componente negativo em DI e aVL. No FLA mitral no sentido horário, as ondas F eram predominantemente negativas nas derivações inferiores e pré cordiais e com um componente positivo nas derivações DI e aVL7. O diagnóstico eletrofisiológico do FLA mitral é comprovado por técnicas de pacing usando um único cateter multipolar no seio coronário e quando o intervalo pós‐pacing é 30ms quer proximal quer distal no seio coronário7.
As Sociedades Europeia e Americana de Cardiologia recomendam a ablação percutânea do FLA não dependente do istmo cavo‐tricúspide sintomático refratário aos fármacos antiarrítmicos (recomendação IIa)8.
O sucesso de ablação do FLA atípico depende da identificação da porção crítica do circuito de reentrada, onde pode ser interrompido com a aplicação de radiofrequência. Os sistemas de mapeamento permitem a reconstrução tridimensional da sequência de ativação auricular em taquicardia e a localização de regiões de cicatriz ou bloqueios de condução. Em doentes com história de cirurgia cardíaca prévia, o relatório cirúrgico é uma ferramenta útil na definição da possível localização dos circuitos de reentrada próximos das incisões auriculares7,8.
Relativamente ao FLA mitral, este é particularmente difícil de tratar, uma vez que o bloqueio bidirecional do istmo mitral tem impacto limitado na recorrência desta arritmia e pode ser desafiante de atingir na fase aguda, necessitando de ablação potencialmente perigosa epicárdica no seio coronário e em até 60% com recuperação da condução tardia significativa apesar de bloqueio completo agudo. Recentemente, a modificação da linha mitral anterior demonstrou ser segura e eficaz, comparativamente a linha lateral, melhorando a percentagem de bloqueio do istmo mitral8,10.
Os autores pretendem com este caso realçar a importância da ablação percutânea da FA na atualidade e as formas de recorrência que poderão surgir no seguimento destes doentes. Neste caso, a recorrência ocorreu três anos após o isolamento das veias pulmonares, sob a forma de FLA atípico esquerdo de localização desconhecida. Este caso demonstra ainda que, na maioria dos FLA após o isolamento das veias pulmonares e na ausência de realização de linhas, os circuitos envolvidos estão relacionados com a recanalização elétrica de uma ou mais veias pulmonares, sendo o circuito de microrreentrada localizado próximo de uma delas com ativação centrífuga a ambas as aurículas e o tratamento eficaz consiste simplesmente no re‐isolamento das veias recanalizadas.
Concluindo, o caso aqui apresentado é um bom exemplo da hipótese colocada acima, dado que o nosso doente se encontra livre de sintomas, em RS e sem tratamento antiarrítmicos seis meses após a simples re‐ablação da veia pulmonar inferior direita, a única que tinha recanalizado eletricamente, sem que tenha sido possível mapear detalhadamente o circuito de reentrada envolvido na génese deste flutter atípico.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesOs autores declaram não haver conflito de interesses.
Os autores pretendem com este caso realçar a importância da ablação percutânea da FA na atualidade e as formas de recorrência que poderão surgir no seguimento destes doentes.