A intervenção coronária percutânea (ICP) com balão eluidor de fármaco (DEB) tem vindo a ser utilizada no tratamento da reestenose intra-stent (RIS) e na doença coronária de pequenos vasos. O objetivo foi avaliar a eficácia clínica desta estratégia num registo multicêntrico.
MétodosRegisto prospetivo de 2 centros com 156 doentes (dts) consecutivos incluídos, entre 2009 e 2010, submetidos a ICP com pelo menos um balão DEB. Definiu-se como endpoint primário a ocorrência combinada (MACE) de todas as causas de morte, EAM e revascularização da lesão alvo (TLR) a um ano de seguimento. Determinou-se os preditores independentes de prognóstico através da análise de regressão de Cox.
ResultadosForam tratadas 184 lesões com 206 DEB. O sucesso do procedimento foi obtido em 98% (150 dts). A um ano de seguimento, a sobrevida livre de endpoint composto ocorreu em 134 dts e foi de 86% (morte em 6%, EAM em 6% e TLR em 5%). Os preditores independentes de MACE foram a ICP na artéria descendente anterior (HR 2,81, 95% IC 1,21-6,51, p=0,02) e história prévia de EAM (HR 3,46, 95% IC 1,35-8,84, p=0,01). O diâmetro ou comprimento do DEB e a RIS não foram preditores de eventos.
ConclusõesA ICP com DEB em dts do mundo real e neste cenário complexo de lesões é eficaz com baixa taxa de MACE a um ano de seguimento, incluindo TLR. Os resultados são igualmente bons se a intervenção é no contexto de RIS ou na doença coronária de novo.
Percutaneous coronary intervention (PCI) with paclitaxel drug-eluting balloons (DEBs) is used mainly for treatment of in-stent restenosis (ISR) and small vessel disease. Our objective was to evaluate the clinical efficacy of this strategy in a multicenter registry.
MethodsBetween 2009 and 2010 a prospective registry from two centers enrolled 156 consecutive patients undergoing PCI with at least one DEB. A primary composite endpoint of major adverse cardiac events (MACE) (all-cause death, myocardial infarction [MI] and target lesion revascularization [TLR]) was assessed at one-year follow-up. Stepwise Cox regression was used to determine independent predictors of outcome.
ResultsDEBs (n=206) were used to treat 184 lesions. Procedural success was obtained in 98% of patients (n=150). At one-year follow-up, 86% (n=134) were free of the primary endpoint (6% death, 6% non-procedure related MI and 5% TLR). The independent predictors of MACE at one year were index PCI in the left anterior descending artery (HR 2.81, 95% CI 1.21-6.51; p=0.02) and a history of MI (HR 3.46, 95% CI 1.35-8.84; p=0.01). ISR and DEB diameter or length were not predictors of events.
ConclusionsPCI with DEBs in real-world patients with complex lesions is effective, with a low rate of MACE, including TLR, at one-year follow-up. The results are equally good whether the intervention is for ISR or for native coronary disease.
A angioplastia coronária apenas com balão ofereceu uma alternativa válida à cirurgia no campo da revascularização coronária1. No entanto, o risco de oclusão coronária aguda e a elevada reestenose associada ao recoil, ao remodeling negativo e à proliferação celular promoveram a procura constante de novas modalidades terapêuticas com menos risco de restenose2.
Mais recentemente, o uso de stents eluidores de fármacos antiproliferativos (DES) permitiu reduzir, de forma muito eficaz, o risco de reestenose eliminando o recoil e o remodeling negativo e reduzir significativamente a formação de hiperplasia neointimal3. Contudo, preocupações relativas ao risco associado de trombose de stent, à dependência de terapêutica antiagregante dupla prolongada e à manutenção de reestenose no contexto de lesões complexas levaram à procura de dispositivos alternativos que apresentassem baixo risco de reestenose, sem os inconvenientes associados aos DES4. Foi este o racional para o desenvolvimento dos balões eluidores de fármaco (DEB)2.
Vários estudos aleatorizados já demonstraram a segurança e eficácia desta nova tecnologia no tratamento da reestenose de stent que foi a primeira indicação aceite para o uso deste tipo de balões na doença coronária5,6. Estudos mais recentes têm alargado a sua indicação a outros campos da intervenção endovascular, nomeadamente, no tratamento de lesões coronárias de novo em pequenos vasos e na doença arterial periférica4.
Deste modo, torna-se importante confrontar os bons resultados obtidos nos ensaios clínicos com a prática do «mundo real», através de registos clínicos multicêntricos prospetivos do tipo all-comers. O objetivo deste estudo é avaliar a eficácia clínica de uma estratégia de intervenção coronária percutânea com balão eluidor de fármaco em doentes de um registo multicêntrico nacional.
MétodosPopulaçãoEstudo prospetivo de doentes consecutivos submetidos a ICP com DEB em 2 centros de Cardiologia de Intervenção nacionais terciários. Estão incluídos no registo 220 doentes, mas apenas foram avaliados neste estudo os doentes que foram submetidos a ICP com DEB há mais de 12 meses, de forma a possibilitar um seguimento clínico de pelo menos um ano. Foram elegíveis doentes com mais de 18 anos e com evidência clínica de isquemia miocárdica. Não houve critérios de exclusão relativamente à forma de apresentação da doença coronária ou à complexidade das lesões.
Os dados foram colhidos prospetivamente e registados numa base de dados informática presente igualmente nas duas unidades de cardiologia de intervenção (Cardiobase®, Infortucano™). Todos os doentes deram o seu consentimento informado.
Procedimento de intervenção coronáriaOs aspetos técnicos relacionados com o procedimento de ICP foram efetuados de acordo com as normas de boa prática habitualmente aceites. A seleção da técnica e estratégia de revascularização foi por decisão dos operadores, assim como a escolha do acesso vascular, o uso de inibidores da glicoproteína iib/iiia, a necessidade de pós-dilatação ou de colocação de stent em bail out. Foi recomendada a administração de heparina não fracionada em forma de bólus endovenoso numa dose de 70-100 U/kg.
Os balões eluidores de fármaco utilizados encontravam-se revestidos por paclitaxel numa dose de 3μg/mm2 (Sequent Please®, B-Braun™) e apresentaram diâmetros que variaram entre 2,5-4,0mm e comprimentos entre 10 e 30mm. Recomendou-se um ratio artéria-balão de 1:1 e um tempo de insuflação de 60 s.
Todos os doentes foram medicados na altura da intervenção com clopidogrel (75mg no caso de tratamento crónico com clopidogrel > 10 d, e 600mg, se não). Depois da ICP, todos os doentes foram medicados com aspirina (≤ 150mg/d) e clopidogrel (75mg/d) por um período mínimo de 3 meses, seguido de tratamento com monoagregação.
Seguimento clínico e endpoint do estudoO seguimento clínico foi efetuado por contacto telefónico e por consulta dos registos clínicos dos doentes. Todos os doentes foram seguidos aos 30 d e por um período mínimo de um ano ou até ocorrência de morte.
O endpoint do estudo foi uma combinação de morte por todas as causas, EAM não fatal e revascularização da lesão alvo (TLR). O endpoint foi analisado a um ano de seguimento.
As mortes foram classificadas como cardíaca ou não cardíaca, com todas as mortes consideradas de etiologia cardíaca, a menos que uma causa não cardíaca inequívoca fosse estabelecida. O EAM foi definido de acordo com a nova definição universal7. A revascularização da lesão alvo incluiu reintervenção percutânea ou cirúrgica no segmento previamente tratado envolvendo 5mm dos seus bordos proximal ou distal.
A trombose de stent definitiva ou provável foi definida segundo a definição da Academic Research and Consortium8.
Definiu-se como sucesso do dispositivo a capacidade do DEB ultrapassar a lesão e ser expandido com sucesso. O sucesso angiográfico foi definido como fluxo TIMI 3 final, com estenose residual inferior ou igual a 30%. O sucesso do procedimento foi definido como o sucesso do dispositivo sem a ocorrência de MACE durante o internamento index.
Análise estatísticaTodas as variáveis contínuas foram testadas para a distribuição normal através do teste de Kolmogorov-Smirnov e para a igualdade de variâncias pelo teste de Levene. As variáveis contínuas foram apresentadas por média ± desvio padrão e comparadas através do teste T de Student. As variáveis contínuas que não seguiram o padrão da normalidade ou semelhança de variâncias foram apresentadas por medianas com os respetivos intervalos interquartis e comparadas através do teste de Mann-Whitney. As variáveis categóricas foram apresentadas sob a forma de percentagem e comparadas utilizando o teste de Qui-quadrado ou de Fisher, conforme apropriado.
Procedeu-se ao cálculo dos hazard ratios (HR) e respetivo intervalo de confiança a 95% (IC) para a ocorrência de MACE a um ano de seguimento. Efetuou-se uma análise de regressão de Cox para avaliar o impacto das características demográficas, clínicas e de procedimento no endpoint do estudo a um ano. No modelo de análise multivariável, as variáveis foram selecionadas de acordo com o seu peso na análise univariada (valores de p<0,1 e menor intervalo de confiança de 95%). O modelo final foi construído por forward stepwise com p de entrada e saída de 0,05 e 0,1, respetivamente. A incidência cumulativa de eventos adversos foi calculado de acordo com o método de Kaplan-Meier e as diferenças foram avaliadas pelo teste de log-rank.
Foi considerado estatisticamente significativo quando p<0,05. A análise estatística foi efetuada em software Statistical Pack for Social Sciences (SPSS), versão 17.0 (Institute, Estados Unidos).
ResultadosCaracterísticas basaisForam incluídos 156 doentes consecutivos (idade média 66±10 anos, 73% sexo masculino) submetidos a intervenção coronária percutânea com balões revestidos por paclitaxel. As características basais e a apresentação clínica da ICP index encontram-se descritas na Tabela 1.
Características clínicas basais
| n=156 | |
| Idade, anos ± sd | 66 ± 10 |
| Sexo masculino, n (%) | 114 (73) |
| Fatores de risco cardiovasculares, n (%) | |
| - Diabetes Mellitus | 68 (44) |
| - Hipertensão arterial | 129 (83) |
| - Dislipidemia | 120 (77) |
| - Hábitos tabágicos | 78 (50) |
| - História familiar de CAD | 15 (10) |
| - IMC, kg/m2 ± sd | 26 ± 7 |
| História prévia CV, n (%) | |
| - EAM | 71 (46) |
| - ICP | 118 (76) |
| - CABG | 32 (21) |
| - Doença vascular periférica | 16 (10) |
| - Acidente vascular cerebral | 10 (6) |
| Insuficiência renal crónica, n (%) | 14 (9) |
| Disfunção ventricular esquerda, n (%) | 33 (21) |
| Doença coronária multivaso, n (%) | 111 (71) |
| Apresentação clínica, n (%) | |
| - Angina estável | 93 (60) |
| - Angina instável | 15 (10) |
| - EAM sem supraelevação de ST | 35 (22) |
| - EAM com supraelevação de ST | 13 (8) |
CABG: cirurgia de revascularização miocárdica; CAD: doença das artérias coronárias; CV: cardiovascular; EAM: enfarte agudo do miocárdio; ICP: intervenção coronária percutânea; IMC: índice de massa corporal; SD: standard deviation (desvio padrão).
Trata-se de uma cohort de doentes de elevado risco com 44% de diabéticos e 83% hipertensos. A maioria dos doentes apresentou doença coronária conhecida e intervencionada previamente (76% submetidos a ICP anteriormente e 21% a CABG). Cerca de três quartos da população apresentou doença coronária de 2 ou mais vasos e frequentemente a ICP foi no contexto de EAM (30%).
Características do procedimentoNos 156 doentes incluídos, foram tratadas 184 lesões com 206 DEB (Tabela 2). A artéria descendente anterior foi a mais frequentemente envolvida (43%). As indicações para o uso de DEB foram, de forma equilibrada, a reestenose intra-stent prévia em 52% (dos quais 30% foram stents metálicos e 70% stents revestidos por fármaco) e a doença coronária de novo em 48%, maioritariamente por doença dos pequenos vasos. O padrão da reestenose intra-stent foi em 48% dos casos difuso. Antes da utilização do DEB, a maioria dos doentes foi submetida a pré-dilatação (80%). As medianas do diâmetro e do comprimento do DEB foram de 2,5mm (intervalo interquartil [IQR] 2,5-3,0) e de 20mm (IQR 15-26), respetivamente. Cinco lesões foram submetidas a colocação de stent por bail-out (4 por dissecção e um por recoil significativo). O sucesso do dispositivo foi de 98%: em 3 doentes não foi possível atravessar a lesão com o DEB, um no contexto de reestenose intra-stent numa póstero-lateral (DEB 2,75/15mm) e 2 em doença coronária de pequenos vasos na circunflexa distal e descendente anterior média (DEB 2,5/15 e 2,5/17mm, respetivamente). O sucesso angiográfico por lesão foi de 98% (2 lesões com fluxo TIMI 2 final e 2 lesões com estenose residual superior a 30%). O sucesso do procedimento foi de 96%.
Características do procedimento
| n=156 dts | |
| 184 lesões | |
| Localização do vaso alvo, n (%) | |
| - Descendente anterior | 67 (43) |
| - Circunflexa | 38 (24) |
| - Coronária direita | 39 (25) |
| - Tronco comum | 9 (6) |
| - Bypass | 3 (2) |
| Classificação da reestenose intra-stent, n (%) | 81 (52) |
| - i | 42 (52) |
| - ii | 17 (21) |
| - iii | 8 (10) |
| - iv | 14 (17) |
| Tipo de stent com reestenose, n (%) | |
| - BMS | 24 (15) |
| - DES | 56 (36) |
| - Desconhecido | 1 (0,6) |
| Lesões coronárias de novo, n (%) | 74 (48) |
| - Doença dos pequenos vasos | 64 (41) |
| - Lesões calcificadas | 6 (4) |
| - Associada a ICP com BMS | 4 (3) |
| Pré-dilatação, n (%) | 124 (80) |
| Características do DEB, mediana (IQ) | |
| - Comprimento, mm | 20 (15-26) |
| - Diâmetro, mm | 2,5 (2,5-3,0) |
| - Pressão de insuflação, bar | 12 (10-14) |
| - Tempo de insuflação, s | 60 (43-90) |
| Pós-dilatação, n (%) | 4 (3) |
| Stent bail-out (por lesão), n (%) | 5 (3) |
| Sucesso do dispositivo (por lesão), n (%) | 181 (98) |
| Sucesso angiográfico (por lesão), n (%) | 180 (98) |
| Sucesso do procedimento, n (%) | 150 (96) |
BMS: stent metálico; DEB: balão eluidor de fármaco; DES: stent revestido por fármaco; ICP: intervenção coronária percutânea; IQ: mediana.
Aos 30 d de seguimento, houve 6 eventos cardiovasculares major (MACE), 2 mortes de causa cardiovascular, 4 EAM e 2 TLR.
A um ano de seguimento nove doentes (5,8%) faleceram, sete de causa cardíaca, nove tiveram um EAM (5,8%) e oito (5,1%) tiveram TLR, com uma incidência combinada de eventos de 14,1% (Tabela 3). Não houve nenhum caso de trombose de stent definitiva ou provável documentada.
Eventos CV adversos
| 30 dias | Um ano | |
| TLR, n (%) | 2 (1,3) | 8 (5,1) |
| EAM, n (%) | 4 (2,6) | 9 (5,8) |
| Morte CV, n (%) | 2 (1,3) | 7 (4,5) |
| Morte total, n (%) | 2 (1,3) | 9 (5,8) |
| MACE, n (%) | 6 (3,8) | 22 (14,1) |
EAM: enfarte agudo do miocárdio; CV: cardiovascular; TLR: revascularização da lesão alvo; MACE: eventos cardiovasculares major (morte todas as causas, enfarte agudo do miocárdio não fatal ou revascularização da lesão alvo).
Não houve diferenças na taxa de MACE ou TLR entre os grupos tratados com DEB por reestenose intra-stent ou doença coronária de novo (13,6% versus 14,7% de MACE, p=0,846 e 6,2% versus 4,0% de TLR, p=0,721). O tratamento da reestenose de stents farmacológicos (DES) com DEB apresentou as mesmas taxas de MACE (14,3% versus 12,5%; p=1,000) e TLR a um ano (5,4% versus 8,3%; p=0,633) comparadas com a ICP da reestenose de stents metálicos (BMS).
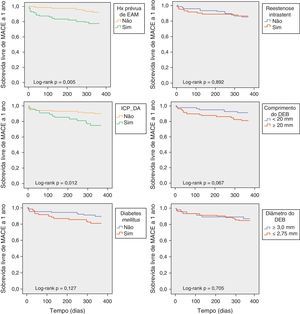
Por análise univariada (Tabelas 4 e 5), foram preditores de MACE a um ano a presença de EAM e CABG prévias, síndrome coronária aguda na apresentação e ICP da descendente anterior no caso índex. A doença multivaso esteve tendencialmente associada a mais eventos cardiovasculares adversos a um ano (HR 4,04; 95%IC 0,94-17,28; p=0,060). História prévia de CABG foi o único preditor de TLR a um ano (Tabela 6). Não foram preditores de MACE ou de TLR a 1 ano, a diabetes, a disfunção ventricular esquerda, assim como a reestenose intra-stent, o comprimento e o diâmetro do DEB.
Análise univariada das características basais e de procedimento para ocorrência de MACE
| MACE (n=22) | n-MACE (n=134) | p | |
| Idade, anos ± sd | 68 ± 11 | 66 ± 10 | 0,272 |
| Sexo masculino, n (%) | 14 (64) | 100 (75) | 0,281 |
| Fatores de risco cardiovasculares, n (%) | |||
| - Diabetes Mellitus | 13 (59) | 55 (41) | 0,120 |
| - Hipertensão arterial | 20 (91) | 109 (82) | 0,374 |
| - Dislipidemia | 17 (77) | 103 (77) | 0,986 |
| - Hábitos tabágicos | 9 (41) | 69 (52) | 0,340 |
| - História familiar de CAD | 2 (9) | 13 (10) | 1,000 |
| - IMC, kg/m2 ± sd | 25 ± 3 | 27 ± 7 | 0,316 |
| História prévia CV, n (%) | |||
| - EAM | 16 (73) | 55 (41) | 0,006 |
| - ICP | 18 (82) | 100 (75) | 0,499 |
| - CABG | 8 (36) | 24 (18) | 0,083 |
| - Doença vascular periférica | 4 (18) | 12 (9) | 0,248 |
| - Acidente vascular cerebral | 3 (14) | 7 (5) | 0,153 |
| Insuficiência renal crónica, n (%) | 3 (30) | 12 (22) | 0,685 |
| Disfunção ventricular esquerda, n (%) | 6 (40) | 27 (26) | 0,354 |
| Doença coronária multivaso, n (%) | 20 (91) | 91 (70) | 0,041 |
| Apresentação clínica, n (%) | |||
| - Síndrome coronária aguda | 14 (64) | 49 (37) | 0,021 |
| - Enfarte agudo do miocárdio | 11 (50) | 37 (28) | 0,042 |
| Localização do vaso alvo, n (%) | |||
| - Descendente anterior | 12 (55) | 37 (28) | 0,012 |
| - Circunflexa | 6 (27) | 32 (24) | 0,731 |
| - Coronária direita | 3 (14) | 36 (27) | 0,184 |
| - Tronco comum | 0 (0) | 3 (2) | 1,000 |
| - Bypass | 0 (0) | 9 (7) | 0,361 |
| Reestenose intra-stent, n (%) | 11 (50) | 70 (52) | 0,846 |
| Características do DEB, mediana (IQ) | |||
| - Comprimento, mm | 20 (16-26) | 17 (15-26) | 0,491 |
| - Diâmetro, mm | 2,5 (2,0-3,0) | 2,5 (2,0-3,0) | 0,629 |
| - Pressão de insuflação, bar | 12 (9-14) | 12 (10-14) | 0,671 |
| - Tempo de insuflação, s | 60 (34-90) | 60 (45-90) | 0,883 |
CABG: cirurgia de revascularização miocárdica; CV: cardiovascular; DEB: balão eluidor de fármaco; EAM: enfarte agudo do miocárdio; ICP: intervenção coronária percutânea; IMC: índice de massa corporal; IQ: mediana; MACE: eventos cardiovasculares major (morte todas as causas, enfarte agudo do miocárdio não fatal ou revascularização da lesão alvo); SD: standard deviation (desvio padrão).
MACE a um ano
| Análise univariada | Análise multivariada | |||||
| Variáveis | Hazard-ratio | IC 95% | p | Hazard-ratio | IC 95% | p |
| EAM prévio | 3,53 | 1,38-9,02 | 0,008 | 3,46 | 1,35-8,84 | 0,010 |
| CABG | 2,51 | 1,01-5,73 | 0,048 | 2,04 | 0,84-4,97 | 0,118 |
| Síndrome coronária aguda | 2,73 | 1,15-6,52 | 0,023 | 2,08 | 0,85-5,10 | 0,110 |
| ICP descendente anterior | 2,79 | 1,20-6,45 | 0,017 | 2,81 | 1,21-6,51 | 0,016 |
| Doença multivaso | 4,04 | 0,94-17,28 | 0,060 | |||
| Diabetes mellitus | 1,92 | 0,82-4,48 | 0,134 | |||
| Disfunção ventricular esquerda | 1,89 | 0,67-5,31 | 0,228 | |||
| Reestenose intra-stent | 0,94 | 0,41-2,18 | 0,892 | |||
| Diâmetro DEB | 0,81 | 0,28-2,31 | 0,688 | |||
| Comprimento DEB | 1,03 | 0,96-1,10 | 0,489 | |||
CABG: cirurgia de revascularização miocárdica; DEB: balão eluidor de fármaco; EAM: enfarte agudo do miocárdio; IC: intervalo de confiança; ICP: intervenção coronária percutânea.
TLR a um ano
| Análise univariada | Análise multivariada | |||||
| Variáveis | Hazard-ratio | IC 95% | p | Hazard-ratio | IC 95% | p |
| EAM prévio | 3,91 | 0,79-19,38 | 0,095 | 3,17 | 0,63-16,09 | 0,143 |
| CABG | 4,30 | 1,07-17,19 | 0,039 | 5,48 | 1,34-22,35 | 0,018 |
| ICP Descendente anterior | 3,80 | 0,91-15,90 | 0,068 | 4,76 | 1,11-20,36 | 0,035 |
| Diabetes mellitus | 2,20 | 0,52-9,20 | 0,281 | |||
| Reestenose intra-stent | 1,57 | 0,37-6,56 | 0,538 | |||
| Diâmetro DEB | 2,60 | 0,52-13,14 | 0,247 | |||
| Comprimento DEB | 0,98 | 0,87-1,11 | 0,799 | |||
CABG: cirurgia de revascularização miocárdica; DEB: balão eluidor de fármaco; EAM: enfarte agudo do miocárdio; IC: intervalo de confiança; ICP: intervenção coronária percutânea.
Após ajuste às variáveis demográficas e características clínicas basais, a análise multivariada identificou a história prévia de EAM (HR 3,46; 95% IC, 1,35-8,84; p=0,010) e a ICP da descendente anterior (DA) (HR 2,81; 95% IC, 1,21-6,51; p=0,016) como preditores independentes de MACE a 1 ano (Figura 1). Foram preditores independentes de TLR a um ano a história prévia de CABG (HR 5,48; 95% IC, 1,34-22,35; p=0,018) e ICP da DA (HR 4,76; 95% IC, 1,11-20,36; p=0,035).
Os doentes submetidos a intervenção percutânea com DEB na descendente anterior proximal (n=49 dts) apresentaram um maior perfil de risco cardiovascular, sendo mais frequentemente diabéticos e hipertensos (57% de diabéticos e 92% de hipertensos na ICP da DA versus 38% de diabéticos e 79% de hipertensos na ICP dos outros vasos, p=0,024 e p=0,051, respetivamente). Os doentes com história de enfarte prévio (n=71 dts) foram doentes com mais história de revascularização coronária prévia (90% submetidos a ICP prévia e 32% a CABG versus 64% de ICP prévia e 11% de CABG nos doentes sem história de EAM prévio, p<0,001 e p=0,001 respetivamente), pelo que, naturalmente, foram com mais frequência submetidos a ICP com DEB no contexto de reestenose intra-stent (68% versus 38% no grupo de dts sem EAM prévio, p<0,001). Neste subgrupo de doentes com história de eventos isquémicos agudos no passado foi mais frequente a presença de disfunção ventricular esquerda (40% versus 17% nos doentes sem história de EAM prévio, p=0,006).
DiscussãoEste estudo demonstrou com clareza que a angioplastia com DEB, numa população de doentes do mundo real com lesões complexas, é eficaz com elevado sucesso angiográfico imediato e com baixa taxa de eventos cardíacos adversos major a um ano de seguimento, incluindo revascularização da lesão alvo. Esta técnica foi igualmente eficaz no contexto de reestenose intra-stent prévia e doença coronária de novo.
Nos últimos anos, os balões eluidores de fármaco têm-se afirmado como uma alternativa válida para o tratamento da reestenose intra-stent, fruto dos bons resultados obtidos nos ensaios clínicos efetuados5,6. E, apesar de, em termos teóricos, apresentarem a mesma limitação do recoil agudo e do possível remodeling negativo tardio que apresentam os balões convencionais, a perda luminal tardia (late lumen loss) dos DEB ao longo do seguimento nos estudos prévios efetuados tem sido consistentemente baixa (aproximadamente 0,2mm)9. O PACCOCATH ISR I5 foi o primeiro estudo aleatorizado a comparar a angioplastia com DEB versus balão convencional na reestenose intra-stent e mostrou que a estratégia com DEB se associou a uma reduzida incidência de reestenose com uma late lumen loss in-segment de apenas 0,03±0,48mm aos 6 meses, e significativamente inferior à do balão convencional (p=0,002). O PEPCAD II comparou a segurança e eficácia do tratamento da reestenose de stents metálicos (BMS) com DEB versus angioplastia com stents Taxus™, revestidos por paclitaxel (DES). Mais uma vez, o endpoint primário foi a late lumen loss aos 6 meses, que foi inferior no grupo tratado com DEB (0,17±0,42 versus 0,38±0,61mm, p=0,03). Uma limitação apontada para estes estudos tem sido o facto de o end-point primário utilizado ser a late lumen loss, que é apenas um surrogate end-point dos resultados da angioplastia. No caso do PEPCAD II, este índice de comparação entre duas estratégias diferentes (balão versus stent) confere desvantagem à estratégia de angioplastia com stent, porque o cálculo da late lumen loss está diretamente dependente do acute gain, que é sempre superior na ICP com stent (quanto maior o ganho luminal na fase aguda, também maior vai ser a perda luminal tardia). Assim, é expectável que a estratégia de ICP com balão esteja associada a menor perda luminal no seguimento10. No entanto, ambos os estudos mostraram resultados clínicos favoráveis com redução de eventos cardiovasculares major (MACE) na estratégia de angioplastia com DEB5,6, diferenças que se mantêm num seguimento mais prolongado a 2 anos11 (46% balão não revestido versus 11% DEB, p=0,001) e a 5 anos12 (59,3% balão não revestido versus 27,8% DEB, p=0,009), e que se devem maioritariamente a uma redução da necessidade de revascularização da lesão alvo (38,9% balão não revestido versus 9,3% DEB a 5 anos, p=0,004). O presente estudo é uma análise dos MACE numa cohort de alto risco, com lesões complexas. A incidência combinada de eventos foi de 14% aos 12 meses, superior quando comparada com estudos randomizados prévios (9% no PACCOCATH ISR I e II e no PEPCAD II)6,11. Por outro lado, não encontrámos diferenças relativamente à taxa de TLR, que foi de 5% no nosso estudo, comparável à dos estudos prévios (4% no PACCOCATH ISR I e II e 6% no PEPCAD II)6,11. Isto pode ilustrar o facto de a nossa população ter sido all comers, com inclusão de doentes com enfarte agudo do miocárdio (30%), disfunção ventricular esquerda (21%) e insuficiência renal crónica (9%), contextos que são normalmente critérios de exclusão de estudos prévios. A taxa mais elevada de morte e de enfarte agudo do miocárdio no seguimento reflete assim a maior complexidade dos nossos doentes. Na Tabela 7 estão sumarizados os resultados clínicos da estratégia de angioplastia com DEB dos principais estudos randomizados e registos até à data.
Principais estudos e registos no contexto da intervenção coronária percutânea com DEB
| Nome do estudo | Indicação | N.° de doentes | MACE DEB (%) | TLR DEB (%) |
| PACOCCATH ISR I e II11 | RIS | 108 (54 DEB) | 9% aos 12 M | 4% aos 12 M |
| PEPCAD II6 | RIS | 131 (66 DEB) | 9% aos 12 M | 6% aos 12 M |
| PEPCAD I19 | Pequenos vasos (diâmetro < 2,8mm) | 114 (82 DEB) | 6,1% aos 6 M | 4,9% aos 6 M |
| PICCOLETO13 | Pequenos vasos | 57 (28 DEB) | 35,7% aos 9 M | 32,1% aos 9 M |
| BELLO15 | Pequenos vasos (diâmetro < 2,8 mm) | 182 | 7,8% aos 6 M | 4,4% aos 6 M |
| VALENTINES Registry22 | RIS | 250 | 11,1% 6-9 M | 7,4% 6-9 M |
| Spanish Registry23 | RIS | 126 | 16,7% aos 12 M | 12% aos 12 M |
| Sequent Please World Wide Registry24 | All comers | 2095 | 6,7% aos 9 M | 5,2% aos 9 M |
Fontes: Unverdorben et al.6, Kleber et al.9, Scheller et al.11, Cortese et al.13, Colombo et al.15, Stella et al.22, Vaquerizo et al.23, Wöehrle et al.24.
DEB: balão eluidor de fármaco; M: meses; MACE: eventos cardiovasculares major (morte todas as causas, enfarte agudo do miocárdio não fatal ou revascularização da lesão alvo); RIS: reestenose intra-stent.
Quando comparámos na nossa população a eficácia desta estratégia de revascularização na reestenose intra-stent versus na doença coronária de novo em pequenos vasos, os resultados foram igualmente bons. No estudo aleatorizado PICCOLETO13, a angioplastia com DEB em vasos pequenos esteve associada a uma maior percentagem de reestenose angiográfica e mais elevada taxa de MACE aos 9 meses do que a angioplastia com stent Taxus™, o que motivou a interrupção precoce do estudo. O DEB utilizado neste estudo foi o DIOR™ de primeira geração, que tem uma farmacocinética e bidisponibilidade diferente do Sequent Please® e com provável poder antirrestenótico inferior14. No outro extremo, mais recentemente, o estudo aleatorizado BELLO15 na doença coronária de novo em lesões com diâmetro de referência < 2,8mm, mostrou superioridade do DEB comparativamente ao stent Taxus™ relativamente ao objetivo primário aos 6 meses (late lumen loss 0,08±0,38mm versus 0,29±0,44mm, p=0,001), com uma baixa taxa de eventos clínicos no grupo do DEB (MACE em 7,8% e TLR em 4,4%). Sabe-se que a intervenção percutânea em vasos pequenos se encontra associada a uma taxa de reestenose elevada. Por esse motivo, está indicado, sempre que possível, o uso de stents farmacológicos capazes de suprimir a hiperplasia da neoíntima. Dados dos estudos E-SIRIUS16 e C-SIRIUS17 mostraram o benefício do stent Cypher™ no tratamento de lesões coronárias de novo longas em vasos pequenos ao reduzirem o risco de reestenose aos 8 meses quando comparado com stents sem fármaco (BMS). Contudo, stents implantados em pequenas artérias têm um maior ratio metal-artéria que pode aumentar o risco de reestenose18. Neste contexto, o facto de os DEB não apresentarem estrutura metálica pode ser uma clara vantagem. Estes balões têm ainda a vantagem de permitirem uma libertação homogénea do fármaco para a parede vascular, ao contrário dos DES, cujo fármaco está concentrado nos seus struts, impossibilitando a supressão da hiperplasia da neoíntima entre os struts e nas margens do stent. O fármaco escolhido para os DEB é o Paclitaxel, que, pelas suas propriedades lipofílicas elevadas, consegue permanecer no vaso até uma semana sem necessitar de uma estrutura de libertação controlada do fármaco associado a uma plataforma metálica e a um polímero. Assim se reduz o risco de inflamação crónica, trombose e a necessidade de tratamento antiagregante prolongado2,4.
Algumas das limitações que têm sido apontadas ao uso deste tipo de balões revestidos por fármaco é, por um lado, o facto de ocasionalmente não conseguirem atravessar a lesão a ser intervencionada e, por outro, poderem associar-se a dissecção ou recoil com um consequente resultado angiográfico subótimo e necessidade de stent em bail-out2. No nosso estudo, em apenas 3 doentes não foi possível atravessar a lesão e obtivemos uma taxa de sucesso angiográfico muito elevada com necessidade de bail-out ou stent em apenas 3% das lesões, muito inferior à descrita em estudos prévios (28% no estudo PEPCAD I19, 20% no estudo BELLO15).
Na avaliação dos preditores de eventos cardiovasculares major e TLR a um ano, mais uma vez se verificou que são as características dos doentes e a sua complexidade que determinam o prognóstico. Variáveis como o comprimento e o diâmetro do balão eluidor de fármaco utilizado não estiveram associados a mais reestenose clínica no seguimento. No entanto, numa análise cuidada das curvas de sobrevida livre de MACE, verifica-se que as curvas relativas à diabetes e ao comprimento do DEB (variáveis que são reconhecidas como preditoras de TLR em estudos prévios20) se afastam ao longo do seguimento, ilustrando diferenças que poderão vir a ser significativas com mais tempo de seguimento.
Quanto ao tratamento da reestenose, o estudo PEPCAD-DES21 mostrou que os resultados do DEB no tratamento da reestenose de stents farmacológicos foram superiores à angioplastia com balão convencional (POBA) com menos TLR (15,3% versus 36,8%, p=0,005) e menos MACE (16,7% versus 50,0%, p<0,001) aos 6 meses. No nosso registo, não encontramos uma taxa mais elevada de eventos associados à intervenção na reestenose de DES, o que confirma a efetividade da estratégia de angioplastia com DEB nestes doentes.
O estudo tem como limitações as que são por natureza associadas ao formato de todos os registos. Destacam-se como principais o número reduzido de doentes incluídos e o tempo de seguimento ainda curto. Será interessante, no futuro, a avaliação dos resultados a longo prazo da angioplastia com DEB (para além de um ano de seguimento), no sentido de confirmar a segurança e a persistência dos bons resultados já demonstrados.
ConclusãoEste registo nacional com doentes de dois Centros de Cardiologia de Intervenção mostrou que a intervenção coronária percutânea com um balão eluidor de fármaco, em doentes de alto risco com lesões complexas, é eficaz com elevado sucesso angiográfico e com baixa taxa de eventos cardíacos adversos major a um ano de seguimento, incluindo revascularização da lesão alvo. Os resultados são igualmente bons se a intervenção for no contexto de reestenose intra-stent ou na doença coronária de novo.
Responsabilidades éticasProteção dos seres humanos e animaisOs autores declaram que os procedimentos seguidos estavam de acordo com os regulamentos estabelecidos pelos responsáveis da Comissão de Investigação Clínica e Ética e de acordo com os da Associação Médica Mundial e da Declaração de Helsínquia.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos de seu centro de trabalho acerca da publicação dos dados de pacientes e que todos os pacientes incluídos no estudo receberam informações suficientes e deram o seu consentimento informado por escrito para participar nesse estudo.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesOs autores declaram não haver conflito de interesses.