A hipertensão pulmonar (HP) compreende um grupo de doenças progressivas caracterizadas por aumento na resistência vascular pulmonar, conduzindo a falência ventricular direita e morte prematura. A estratificação de risco é fundamental para a avaliação prognóstica e orientação terapêutica, sendo que a acuidade dos parâmetros convencionais é limitada, sobretudo no que respeita aos biomarcadores.
ObjetivosDeterminar o valor prognóstico de um painel de novos biomarcadores e avaliar o benefício da sua conjugação num score multibiomarcador para predição de morbimortalidade na HP.
MetodologiaEstudo de coorte prospetivo de doentes com HP submetidos a avaliação clínica, ecocardiográfica e laboratorial, incluindo doseamento da porção N‐terminal do péptido natriurético cerebral (NT‐proBNP) e dos seguintes novos biomarcadores: porção médio‐regional da pro‐adrenomedulina (MR‐proADM), copeptina, endotelina‐1, porção médio‐regional da pró‐hormona ANP (MR‐proANP) e recetor solúvel da interleucina‐33 (sST2). Determinou‐se a acuidade dos diferentes parâmetros de avaliação na predição de morte por qualquer causa e de morte ou hospitalização por causa cardíaca. Concebeu‐se um score multibiomarcador a partir da distribuição por tercis dos níveis séricos de novos biomarcadores e a sua acuidade prognóstica incremental foi avaliada comparativamente aos marcadores convencionais.
ResultadosIncluíram‐se 43 doentes com HP (72,1% sexo feminino; 59 ± 15 anos). A maioria dos doentes (65,1%) tinha HP, grupo 1. Durante um seguimento mediano de 34 meses, 26% dos doentes (n = 11) faleceram e 35% (n = 15) foram hospitalizados por causa cardíaca. Os diferentes parâmetros dimensionais ventriculares e auriculares, bem como a menor fração de área ventricular direita, foram preditores prognósticos relevantes. Relativamente aos biomarcadores, foram preditores independentes de mortalidade o NT‐proBNP (log) (hazard ratio [HR]: 31,14; intervalo de confiança a 95% [IC95%]: 3,12‐310,7; p = 0,003) e a renina (HR: 1,02; IC95%: 1,005‐1,038; p = 0,009), e do risco de morte ou hospitalização o MR‐proANP (HR: 1,008; IC95% 1,004‐1,011; p < 0,001) e o sST2 (HR: 1,005; IC95% 1,001‐1,009; p = 0,04). O score multibiomarcador, concebido a partir da distribuição por tercis dos níveis séricos de NT‐proBNP, MR‐proANP, renina e sST2, foi superior a qualquer dos parâmetros convencionais na estratificação prognóstica e possibilitou a identificação dos grupos de baixo risco, risco intermédio e risco elevado, cuja mortalidade aos três anos atingiu 77,8%.
ConclusãoUma abordagem multibiomarcadores é útil na estratificação prognóstica de doentes com HP. O score que incorpora o NT‐proBNP, MR‐proANP, renina e sST2 identifica com precisão os doentes de elevado risco.
Pulmonary hypertension (PH) covers a group of conditions characterized by an increase in pulmonary vascular resistance leading to right ventricular failure. Risk stratification is crucial for adequate prognostic and therapeutic assessment. However, the accuracy of conventional parameters is limited, especially biomarkers.
ObjectivesTo determine the prognostic value of new biomarkers and their combination in a multi‐biomarker approach to predict outcome in patients with PH.
MethodsIn this prospective cohort study, PH patients underwent clinical, echocardiographic and laboratory assessment, including quantification of serum N‐terminal pro‐brain natriuretic peptide (NT‐proBNP) and of the following new biomarkers: mid‐regional pro‐adrenomedullin (MR‐proADM), copeptin, endothelin‐1, mid‐regional pro‐atrial natriuretic peptide (MR‐proANP) and soluble ST2 (sST2), the interleukin‐33 receptor. The accuracy of the different parameters for predicting all‐cause mortality and death or hospitalization of cardiac causes was determined. The prognostic value of a multi‐biomarker score based on the tertile distribution of serum NT‐proBNP, MR‐proANP, renin and sST2 was compared to conventional markers.
ResultsForty‐three patients (72.1% female, age 59±15 years) were included, most of whom (65.1%) had group 1 PH. During a median follow‐up of 34 months, 26% of the patients died and 35% were hospitalized for cardiac causes. Atrial and ventricular dimensions and right ventricular fractional area change were prognostic predictors. Log NT‐proBNP (HR: 31.14; 95% CI: 3.12‐310.7; p=0.003) and renin (HR: 1.02; 95% CI: 1.005‐1.038; p=0.009) were independent predictors of mortality. MR‐proANP (HR: 1.008; 95% CI 1.004‐1.011; p<0.001) and sST2 (HR: 1.005; 95% CI 1.001‐1.009; p=0.04) were predictors of death or hospitalization. The prognostic value of the multi‐biomarker score was higher than any of the conventional parameters, and enabled identification of risk groups (the high‐risk group had three‐year mortality of 77.8%).
ConclusionA multi‐biomarker approach was superior for risk stratification to any single marker. A score that incorporates NT‐proBNP, MR‐proANP, renin and sST2 accurately identifies patients at low, intermediate and high risk.
A hipertensão pulmonar (HP) compreende um grupo de doenças progressivas caracterizadas por aumento da resistência vascular pulmonar, que conduzem a falência ventricular direita e morte prematura. Diversos processos patológicos estão envolvidos na progressão da insuficiência cardíaca (IC) secundária a HP, com destaque para a lesão miocárdica, remodelagem vascular e ativação neurohormonal resultantes da sobrecarga de pressão das câmaras cardíacas direitas. Na prática clínica, a estratificação de risco é fundamental para a avaliação prognóstica e orientação terapêutica, nomeadamente para o manejo e titulação das novas terapêuticas vasodilatadoras. Usualmente, é baseada na avaliação da capacidade de exercício, ecocardiografia e avaliação hemodinâmica por cateterismo cardíaco1. Contudo, a utilização generalizada de muitos destes parâmetros é limitada, devido ao seu carácter subjetivo, dependência do operador ou natureza invasiva.
Nos últimos anos, tem sido investigado o valor prognóstico de inúmeros biomarcadores na HP2, já que os mesmos poderão facultar um método eficiente e não‐invasivo de estratificação e monitorização. De acordo com as normas de orientação clínica internacionais, apenas a determinação do péptido natriurético cerebral (ou a sua porção N‐terminal [NT‐proBNP]) se encontra recomendada para a prática quotidiana1. No entanto, são reconhecidas as limitações da sua acuidade para efeitos de estratificação prognóstica, particularmente quando coexista doença cardíaca esquerda ou disfunção renal. Além disso, diversos estudos clínicos têm sugerido que a elevação substancial dos níveis séricos de NT‐proBNP ocorre muito tardiamente, numa fase de marcada dilatação ventricular e em que o reajuste terapêutico pode já não ser suficientemente efetivo3.
Reflexo da complexidade dos mecanismos subjacentes à HP tem sido investigada a utilidade adicional de uma abordagem multibiomarcadores. A investigação clínica tem sido fundamentalmente centrada na estratificação prognóstica dos doentes com IC esquerda e os biomarcadores considerados mais promissores têm vindo a ser subsequentemente testados em pequenos grupos de doentes com IC direita no contexto de HP, o que tem limitado a validade dos resultados. Vários dos biomarcadores investigados no âmbito da IC esquerda refletem processos biológicos cuja relevância poderá ser ainda maior na progressão da HP, com destaque para os marcadores de remodelagem vascular pulmonar (disfunção endotelial, trombose in situ e stresse oxidativo) e de sobrecarga ventricular direita. Por isso, a sua investigação é premente. Entre esses biomarcadores destacam‐se o recetor solúvel da interleucina‐33 (sST2), a renina plasmática, a adrenomedulina e a endotelina‐1 (ET‐1).
O sST2 é um biomarcador com efeitos pluripotenciais in vivo, cuja expressão é estimulada pela deformação mecânica dos fibroblastos cardíacos e dos cardiomiocitos4. Estudos recentes documentaram o aumento da sua concentração sérica no contexto da IC aguda e sugerem correlacionar‐se com processos de remodelagem e fibrose no contexto de IC crónica5. Contudo, o seu valor prognóstico na IC direita secundária a HP permanece desconhecido.
Vários estudos demonstraram que a hiperativação crónica do sistema renina‐angiotensina‐aldosterona (SRAA) em doentes com IC esquerda apresenta implicações prognósticas consideráveis. Contudo, a sua relevância permanece incerta na IC direita secundária a HP e o valor preditivo da renina plasmática nunca foi estabelecido neste grupo de doentes.
A adrenomedulina, um péptido vasoativo com propriedades natriuréticas produzido em vários tecidos do organismo, tem sido consistentemente associada ao prognóstico de doentes com IC esquerda6. O seu papel na estratificação prognóstica de doentes com HP permanece por determinar.
A ET1 é um potente vasoconstritor e constitui um alvo terapêutico na hipertensão arterial pulmonar7. Os seus valores séricos encontram‐se aumentados em vários estados de IC, contudo são necessários estudos de seguimento alargado para avaliar o seu impacto prognóstico.
No presente estudo, pretendemos determinar o valor prognóstico de um painel de novos biomarcadores e avaliar o benefício da sua conjugação num score multibiomarcador para predição de morbimortalidade por IC direita secundária a HP.
MétodosDesenho do estudoEstudo observacional prospetivo de doentes consecutivos admitidos na consulta multidisciplinar de HP com o diagnóstico de HP, confirmado por avaliação hemodinâmica. Os critérios de inclusão na presente análise compreenderam doentes com HP dos grupos I, III, IV e V (classificação de Nice, 20138), clinicamente estáveis nos últimos dois meses e em classe funcional≥II da Organização Mundial de Saúde (OMS). Os critérios de exclusão consistiram na presença de HP secundária a doenças do coração esquerdo, HP não desproporcionada no contexto de patologia respiratória crónica, história de cirurgia ou traumatismo nos últimos dois meses, doença neoplásica, cirrose hepática ou enfarte do miocárdio prévio. A diferença temporal entre o diagnóstico da doença ou instituição de terapêutica específica e o momento de referenciação à consulta multidisciplinar de HP, correspondente à inclusão no estudo, não constituiu critério de exclusão. O desenho do estudo foi aprovado pela Comissão de Ética da instituição proponente e todos os participantes forneceram consentimento informado.
Na avaliação basal, os doentes foram submetidos a avaliação clínica, ecocardiográfica e laboratorial, que incluiu o doseamento de um painel de biomarcadores novos e convencionais.
Ensaios laboratoriaisForam obtidas amostras de soro e plasma (EDTA) a partir de veia antecubital, após cinco minutos de repouso. Determinaram‐se o hemograma completo e concentrações séricas de creatinina (com determinação da taxa de filtração glomerular [TFG] pela equação Modification of Diet in Renal Disease9), sódio e ureia. As alíquotas de plasma foram armazenadas a ‐80¿ C até à subsequente determinação dos biomarcadores. Os níveis de NT‐proBNP foram determinados com fase sólida no ensaio imunométrico Immulite2000 (Siemens Healthcare Diagnostics, Breda, Holanda), disponível comercialmente e validado na prática clínica. A porção terminal da ET‐110, porção médio‐regional do péptido natriurético auricular11 (MR‐proANP), porção médio‐regional da pro‐adrenomedulina12 (MR‐proADM), copeptina13 e sST14 foram medidas através de ensaios de quimioluminescência no sistema Kryptor® (BRAHMS AG; Hennigsdorf, Alemanha).
Ecocardiografia transtorácicaEfetuou‐se estudo ecocardiográfico em aparelho GE Vivid 7 Dimension®, incluindo avaliação convencional bidimensional, modo‐M, Doppler e Doppler tecidular pulsado do anel lateral tricúspide. As imagens digitais foram analisadas em pós‐processamento utilizando o software EchoPAC Dimension® (GE Healthcare, Milwaukee, WI, EUA), com ocultação para a identificação dos doentes. A função sistólica do ventrículo direito (VD) foi avaliada pela fração de área do VD, excursão sistólica do plano do anel tricúspide (TAPSE) e velocidade sistólica de pico do anel lateral tricúspide.
Seguimento clínicoOs doentes foram avaliados presencialmente a cada 2‐3 meses, tendo sido registada a evolução sintomática, necessidade de titulação terapêutica e ocorrência de eventos clínicos adversos, incluindo hospitalização por causa cardíaca e óbito.
Definiram‐se como endpoints de análise: (1) ocorrência de óbito por qualquer causa; e (2) ocorrência de óbito ou internamento hospitalar por agravamento da HP durante o tempo de seguimento.
Análise estatísticaAs variáveis categoriais foram descritas pela sua frequência absoluta e relativa e foram comparadas por testes de qui‐quadrado e exato de Fisher. As variáveis contínuas com distribuição normal foram caracterizadas com a média e desvio‐padrão, e comparadas usando‐se teste T de Student e ANOVA. As variáveis contínuas com distribuição não normal foram descritas com a mediana e distribuição interquartil (DIQ), e comparadas com testes não paramétricos de Mann‐Whitney e Kruskal‐Wallis. Atendendo à distribuição não normal exponencial do NT‐proBNP, os seus valores foram sujeitos a transformação logarítmica previamente à sua inclusão nas análises de sobrevivência.
Para determinar a associação das diferentes variáveis ao risco de morte e de morte ou hospitalização por causa cardíaca durante o seguimento a longo prazo, utilizaram‐se análises de sobrevivência pelo método de Kaplan‐Meier e de regressão de Cox uni e multivariadas. As sobrevivências livres de eventos foram comparadas, com determinação do valor de log rank p, hazard ratio (HR) e respetivos intervalos de confiança a 95% (IC95%). Para evitar sobrevalorização de associações inespecíficas, apenas foram incluídas nas análises multivariadas aquelas variáveis com valor p inferior a 0,10 determinado em análise univariada. Além disso, as análises multivariadas foram efetuadas com o método stepwise forward conditional, com probabilidade de inclusão de 5% e de remoção de 10%.
A acuidade dos diferentes parâmetros para finalidade de estratificação prognóstica foi avaliada pela área sob a receiver operator characteristic curve (AUC), com determinação dos respetivos intervalos de confiança e valor p relativamente à ocorrência de óbito aos três anos, e de óbito ou hospitalização por causa cardíaca aos três anos. Calculou‐se um score multibiomarcador, determinado em cada doente a partir da distribuição por tercis dos níveis séricos de NT‐proBNP, MR‐proANP, renina e sST2. A acuidade prognóstica do score multibiomarcador foi comparada com aquela referente aos diferentes biomarcadores e parâmetros ecocardiográficos individualmente considerados, e avaliou‐se o impacto prognóstico da estratificação com base no score multibiomarcador através da distribuição da população por tercis.
ResultadosCaracterização da populaçãoEstudaram‐se 43 doentes, 72,1% dos quais do sexo feminino (n=31) e com idade mediana de 59 anos (DIQ: 43‐67 anos). Todos os doentes apresentavam manifestações de IC aquando da avaliação inicial, classificadas em classe OMS II e III em 74,4% (n=32) e 25,6% (n=11), respetivamente. No que respeita à classificação etiológica, a maioria dos doentes (65,1%; n=28) tinha hipertensão arterial pulmonar (HAP) do grupo 1 (Nice, 2013), mais frequentemente em associação a doenças do tecido conjuntivo (n=11) ou a cardiopatias congénitas (n=9). Além disso, 83,7% dos doentes (n=36) encontravam‐se já medicados com fármacos vasodilatadores específicos, com destaque para os inibidores da fosfodiesterase (58,1%; n=25) e os antagonistas do recetor da ET (55,8%; n=24). As características clínicas da população são adicionalmente detalhadas na Tabela 1.
Caracterização da população
| n | Proporção (%) | |
|---|---|---|
| Classificação etiológica (Nice, 2013) | ||
| Grupo 1 | 28 | 65,1 |
| Idiopática | 7 | 16,3 |
| Associada a doença do tecido conjuntivo | 11 | 25,6 |
| Associada a infeção HIV | 1 | 2,3 |
| Associada a cardiopatia congénita | 9 | 20,9 |
| Grupo 3 | 6 | 14,0 |
| Secundária a doença intersticial pulmonar | 4 | 9,3 |
| Secundária a doença pulmonar com padrão obstrutivo‐restritivo | 2 | 4,7 |
| Grupo 4 – hipertensão pulmonar crónica tromboembólica | 7 | 16,3 |
| Grupo 5 – associada a outra condição | 2 | 4,7 |
| Terapêutica vasodilatadora específica, aquando da avaliação inicial | 36 | 83,7 |
| Inibidor da fosfodiesterase | 25 | 58,1 |
| Antagonista do recetor da endotelina | 24 | 55,8 |
| Antagonistas dos canais de cálcio | 5 | 11,6 |
HIV: human immunodeficiency virus.
Os doentes foram submetidos a avaliação ecocardiográfica, realizada numa mediana de oito dias (DIQ: 2‐91) após a avaliação laboratorial. A caracterização ecocardiográfica é detalhada na Tabela 2. Destaca‐se que 51,2% dos doentes (n=22) apresentavam dilatação ventricular direita (diâmetro basal>42mm) e que 86% dos doentes (n=37) exibiam pelo menos um parâmetro de disfunção sistólica ventricular direita, incluindo diminuição da fração de área (<35%) em 41,9% (n=18), redução da TAPSE (<16mm) em 34,9% (n=15) e diminuição da velocidade sistólica do anel tricúspide lateral (≤10cm/s) em 39,5% (n=17). Além disso, observou‐se dilatação auricular direita traduzida por diâmetro máximo superior a 53mm em 51,2% (n=22).
Parâmetros ecocardiográficos aquando da avaliação inicial
| Aurícula direita | |
| Dimensão (quatro câmaras), mm | 56±14 |
| Área diastólica, cm2 | 22,5 (14,1‐33,8) |
| Área sistólica, cm2 | 16,5 (9,3‐25,8) |
| Fração de área, % | 21,4 (11,1‐35,8) |
| Ventrículo direito | |
| Diâmetro basal, mm | 42,9 (37,7‐54,0) |
| Área diastólica, cm2 | 22,5 (18,8‐35,0) |
| Área sistólica, cm2 | 15,5 (10,0‐20,1) |
| Fração de área, % | 37,4±12,1 |
| Excursão sistólica do plano do anel tricúspide, mm | 18,7 (15,8‐23,0) |
| Velocidade sistólica do anel tricúspide lateral, cm/s | 11,0 (9,0‐12,5) |
| Estimativa da pressão sistólica arterial pulmonar, mmHg | 64,6 (46,0‐84,7) |
Os parâmetros referentes à avaliação laboratorial são detalhados na Tabela 3. Apesar de a disfunção renal ter sido muito prevalente, o compromisso identificado foi de gravidade apenas ligeira (TFG: 60‐89mL/min; 24%; n=24) ou moderada (TFG: 30‐59mL/min; 25,6%; n=11). Destaca‐se que os doentes com dilatação ventricular direita exibiram níveis séricos mais elevados de NT‐proBNP (1338pg/mL [354‐2275] versus [236 111‐1005]; p=0,021) e MR‐proANP (159,7pg/mL [132,6‐287,9] versus 111,1 [66,1‐161,9]; p=0,032); aqueles com diminuição da fração de área do VD apresentaram NT‐proBNP mais elevado (1338pg/mL [822,0‐2393,5] versus 236 [186‐1258]; p=0,019); e aqueles com dilatação da aurícula direita (AD) tinham concentrações séricas aumentadas de NT‐proBNP (1522 [825‐2462] versus 215 [91‐719]; p<0,001), MR‐proANP (163,5 [152,6‐287,9] versus 94,9 [50,8‐127,4]; p<0,001) e sST2 (62,2 [38,3‐77,0] versus 30,1 [24,2‐47,9]; p=0,015).
Parâmetros laboratoriais aquando da avaliação inicial
| Ureia (mg/dL) | 45±16 |
| Creatinina (mg/dL) | 0,87 (0,75‐1,07) |
| Taxa de filtração glomerular (MDRD) (mL/min) | 72 (59‐82) |
| Cistatina C (mg/L) | 0,82 (0,76‐1,09) |
| Sódio (mmol/L) | 140±3 |
| Enzima conversora da angiotensina (ug/mL) | 719 (190‐1695) |
| Renina (mIU/L) | 15,5 (4,5‐50,8) |
| Aldosterona (pg/mL) | 91,7 (47,4‐181,6) |
| NT‐proBNP (pg/mL) | 719 (190‐1695) |
| MR‐proANP (pmol/L) | 151,9 (93,5‐183,9) |
| Copeptina (ng/mL) | 9,1 (5,0‐15,0) |
| Endotelina‐1 (pg/mL) | 82,7 (62,9‐122,1) |
| MR‐proADM (pg/mL) | 0,86±0,5 |
| sST2 (pg/mL) | 47,7 (27,1‐75,5) |
Durante um seguimento mediano de 34 meses (30‐38), 26% (n=11) dos doentes faleceram e 35% (n=15) foram hospitalizados por causa cardíaca. A terapêutica farmacológica foi reajustada com instituição de inibidor da fosfodiesterase em nove doentes (20,9%), de antagonista do recetor da ET em 14 doentes (32,6%) e de prostanóides parentéricos em cinco doentes (11,6%), de tal forma que todos os doentes passaram a estar medicados com pelo menos um fármaco vasodilatador específico.
Os doentes que faleceram durante o seguimento (n=11) haviam apresentado, aquando da avaliação ecocardiográfica inicial, maior dilatação do ventrículo e aurícula direitos e menor fração de área ventricular direita – Tabela 4. Os diferentes parâmetros dimensionais ventriculares e auriculares, bem como a menor fração de área ventricular direita foram preditores relevantes do risco de mortalidade. Entre os parâmetros ecocardiográficos, os preditores independentes do risco de morte identificados por análise multivariada de regressão logística foram o diâmetro basal do VD (HR: 1,17; IC95% 1,07‐1,27; p<0,001) e a fração de área da AD (HR: 0,87; IC95% 0,79‐0,97; p=0,008).
Associação das variáveis clínicas, laboratoriais e ecocardiográficas à ocorrência de óbito durante o seguimento clínico
| Comparação em função da evolução clínica | Análise univariada de regressão de Cox | |||||
|---|---|---|---|---|---|---|
| Óbito | Evolução favorável | Valor p | Hazard ratio | IC95% | Valor p | |
| (n=11) | (n=32) | |||||
| Características demográficas | ||||||
| Idade, anos | 63 (43‐72) | 56 (40‐66) | NS (0,42) | 1,01 | 0,98‐1,05 | NS (0,74) |
| Sexo feminino, n (%) | 7 (63,6) | 24 (75,0) | NS (0,47) | 0,57 | 0,17‐1,97 | NS (0,57) |
| Características clínicas | ||||||
| HP grupo 1 | 9 (81,8) | 19 (59,4) | NS (0,071) | 0,23 | 0,03‐1,98 | NS (0,18) |
| HP grupos 3 a 5 | 2 (18,2) | 13 (40,6) | NS (0,071) | 4,36 | 0,51‐37,72 | NS (0,18) |
| Características ecocardiográficas | ||||||
| AD: dimensão (quatro câmaras), mm | 71±11 | 51±11 | <0,001 | 1,08 | 1,03‐1,13 | 0,001 |
| AD: área diastólica, cm2 | 38,8 (28,7‐50,2) | 19,0 (13,0‐24,3) | <0,001 | 1,04 | 1,01‐1,06 | 0,007 |
| AD: área sistólica, cm2 | 31,0 (25,7‐48,0) | 13,2 (8,1 ‐ 20,1) | <0,001 | 1,09 | 1,04‐1,14 | <0,001 |
| AD: fração de área, % | 10,5 (6,9‐10,9) | 25,0 (14,0‐39,8) | 0,001 | 0,88 | 0,80‐0,97 | 0,013 |
| VD: diâmetro basal, mm | 57,8 (54,1‐64,9) | 39,3 (36,0‐45,1) | <0,001 | 1,12 | 1,06‐1,20 | <0,001 |
| VD: área diastólica, cm2 | 40,0 (25,1‐49,0) | 21,2 (16,8‐28,7) | 0,004 | 1,06 | 1,01‐1,11 | 0,012 |
| VD: área sistólica, cm2 | 26,7 (16,8‐33,4) | 12,2 (9,6‐18,3) | 0,003 | 1,08 | 1,02‐1,13 | 0,005 |
| VD: fração de área, % | 30±11 | 40±12 | 0,033 | 0,94 | 0,88‐0,99 | 0,033 |
| VD: excursão sistólica do plano do anel tricúspide, mm | 16 (13‐23) | 20 (16‐23) | NS (0,19) | 0,92 | 0,82‐1,05 | NS (0,22) |
| VD: velocidade sistólica do anel tricúspide lateral, cm/s | 10 (6‐11) | 12 (9‐13) | 0,026 | 0,80 | 0,61‐1,06 | NS (0,12) |
| Estimativa da pressão sistólica arterial pulmonar, mmHg | 88 (67‐96) | 61 (46‐76) | 0,013 | 1,02 | 0,99‐1,04 | NS (0,07) |
| Características laboratoriais | ||||||
| Taxa de filtração glomerular (MDRD)(mL/min) | 58 (44‐72) | 76 (66‐84) | 0,002 | 0,94 | 0,90‐0,99 | 0,01 |
| Cistatina C (mg/L) | 1,01 (0,77‐1,30) | 0,80 (0,75‐1,08) | NS (0,13) | 6,84 | 0,63‐73,95 | NS (0,11) |
| Sódio (mmol/L) | 139±4 | 140±3 | NS (0,25) | 0,86 | 0,71‐1,05 | NS (0,15) |
| Enzima conversora da angiotensina (ug/mL) | 30 (24‐51) | 31 (21‐42) | NS (0,59) | 1,01 | 0,99‐1,04 | NS (0,39) |
| Renina (mIU/L) | 55,2 (16,2‐142,5) | 10,8 (3,0‐23,1) | 0,004 | 1,01 | 1,004‐1,02 | 0,001 |
| Aldosterona (pg/mL) | 138,0 (31,2‐391,0) | 87,7 (48,1‐143,8) | NS (0,29) | 1,00 | 0,999‐1,001 | NS (0,49) |
| NT‐proBNP (log)* (pg/mL) | 2854 (1326‐5632) | 316 (174‐1163) | <0,001 | 9,44 | 2,40‐37,13 | 0,001 |
| MR‐proANP (pmol/L) | 1,24±0,45 | 0,73±0,45 | 0,006 | 1,004 | 1,002‐1,007 | 0,001 |
| Copeptina (ng/mL) | 18,84 (13,09‐25,16) | 6,14 (5,00‐10,29) | <0,001 | 1,1 | 1,04‐1,16 | 0,001 |
| Endotelina‐1 (pg/mL) | 142,8±62,9 | 76,5±38,2 | 0,014 | 1,01 | 1,005‐1,02 | 0,004 |
| MR‐proADM (pg/mL) | 1,19 (0,93‐1,40) | 0,62 (0,47‐0,85) | 0,001 | 3,06 | 1,19‐7,87 | 0,021 |
| sST2 (pg/mL) | 75,5 (56,7‐103,5) | 40,1 (25,4‐59,1) | 0,002 | 1,002 | 0,997‐1,007 | NS (0,48) |
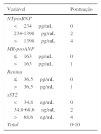
Relativamente aos parâmetros laboratoriais, detetaram‐se níveis mais elevados de NT‐proBNP, MR‐proANP, renina, copeptina, ET1, MR‐proADM e sST2 entre os doentes que faleceram durante o seguimento – Tabela 4. Além disso, o risco de morte agravou‐se com o declínio da função renal. Entre os diferentes biomarcadores estudados, apenas o NT‐proBNP (log) e a renina constituíram preditores independentes de mortalidade, com HR respetivamente de 31,14 (3,12‐310,7; p=0,003) e 1,02 (1,005‐1,038; p=0,009). O risco de morte durante o seguimento foi comparado em função da distribuição por tercis dos níveis séricos dos biomarcadores – Figura 1. Comparativamente aos doentes incluídos no 1.° e 2.° tercis, aqueles com níveis mais elevados de NT‐proBNP (3.° tercil:>1398pg/mL) apresentaram maior risco de morte (HR=6,16; IC95%: 1,63‐23,28; p=0,007), tendo‐se verificado o mesmo naqueles com níveis aumentados de renina (3.° tercil: > 36,5 pg/mL; HR: 6,70; IC95%: 1,94‐23,21; p = 0,003) e de sST2 (3.∘ tercil: > 68,6 ng/mL; HR: 7,85; IC95%: 2,05‐30,05; p = 0,003).
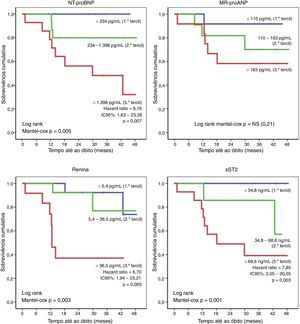
Os doentes que evoluíram desfavoravelmente, com óbito ou hospitalização por causa cardíaca (n=18), apresentaram igualmente parâmetros ecocardiográficos iniciais mais alterados no que respeita às dimensões e função das câmaras direitas – Tabela 5. Entre os parâmetros ecocardiográficos, o único preditor independentes do risco de morte ou hospitalização por causa cardíaca foi o diâmetro basal do VD (HR: 1,08; IC95% 1,04‐1,12; p<0,001). Além disso, os doentes que evoluíram desfavoravelmente exibiam também aumento dos níveis séricos de NT‐proBNP, MR‐proANP, renina, copeptina, ET1, MR‐proADM e sST2, os quais foram identificados como preditores prognósticos significativos. O risco de morte ou hospitalização não diferiu significativamente em função da TFG inicial. Entre os biomarcadores avaliados, constituíram preditores independentes do risco de morte ou hospitalização o MR‐proANP (HR: 1,008; IC95% 1,004‐1,011; p<0,001) e o sST2 (HR: 1,005; IC95% 1,001‐1,009; p=0,04). A sobrevivência livre de eventos foi comparada em função da distribuição por tercis dos níveis séricos de biomarcadores – Figura 2. Comparativamente aos doentes incluídos no 1.° e 2.° tercis, o risco de eventos adversos foi três vezes maior naqueles com níveis mais elevados de NT‐proBNP (3.° tercil:>1398pg/mL; HR=3,72; IC95%: 1,43‐9,70; p=0,007) e cerca de seis vezes maior naqueles com sST2 aumentado (3.° tercil:>68,6ng/mL; HR: 5,77; IC95%: 2,16‐15,39; p<0,001).
Associação das variáveis clínicas, laboratoriais e ecocardiográficas à ocorrência de óbito ou hospitalização por causa cardíaca durante o seguimento clínico
| Comparação em função da evolução clínica | Análise univariada de regressão de Cox | |||||
|---|---|---|---|---|---|---|
| Óbito ou hospitalização | Evolução favorável | Valor p | Hazard ratio | IC95% | Valor p | |
| (n=18) | (n=25) | |||||
| Características demográficas | ||||||
| Idade, anos | 59 (43‐66) | 62 (42‐67) | NS (0,95) | 1,003 | 0,97‐1,03 | NS (0,87) |
| Sexo feminino, n (%) | 11 (61,1) | 20 (80,0) | NS (0,17) | 0,49 | 0,18‐1,28 | NS (0,14) |
| Características clínicas | ||||||
| HP grupo 1 | 16 (88,9) | 12 (48,0) | NS (0,26) | 0,16 | 0,02‐1,44 | NS (0,11) |
| HP grupos 3 a 5 | 2 (11,1) | 13 (52,0) | NS (0,26) | 6,23 | 0,70‐55,81 | NS (0,11) |
| Características ecocardiográficas | ||||||
| AD: dimensão (quatro câmaras), mm | 65±14 | 50±11 | <0,001 | 1,07 | 1,03‐1,11 | <0,001 |
| AD: área diastólica, cm2 | 29,8 (23,7‐44,9) | 17,5 (12,5‐22,9) | 0,001 | 1,02 | 1,003‐1,04 | 0,026 |
| AD: área sistólica, cm2 | 25,0 (19,1‐37,2) | 12,3 (8,1‐18,7) | 0,001 | 1,06 | 1,02‐1,09 | 0,001 |
| AD: fração de área, % | 13,7 (9,9‐25,5) | 25,5 (13,5‐40,6) | 0,018 | 0,95 | 0,90‐0,99 | 0,032 |
| VD: diâmetro basal, mm | 54 (48‐63) | 38 (32‐43) | <0,001 | 1,08 | 1,04‐1,12 | <0,001 |
| VD: área diastólica, cm2 | 29,4 (23,4 ‐ 47,5) | 20,0 (16,2 ‐ 22,5) | <0,001 | 1,06 | 1,02‐1,09 | 0,002 |
| VD: área sistólica, cm2 | 19,2 (16,0 ‐ 31,7) | 11,0 (8,9 ‐ 17,2) | <0,001 | 1,08 | 1,03‐1,12 | 0,001 |
| VD: fração de área, % | 32±9 | 42±13 | 0,01 | 0,94 | 0,90‐0,99 | 0,012 |
| VD: excursão sistólica do plano do anel tricúspide, mm | 18 (14‐23) | 20 (16‐23) | NS (0,53) | 0,96 | 0,88‐1,06 | NS (0,45) |
| VD: velocidade sistólica do anel tricúspide lateral, cm/s | 10 (7‐12) | 12 (9‐13) | NS (0,17) | 0,92 | 0,76‐1,11 | NS (0,36) |
| Estimativa da pressão sistólica arterial pulmonar, mmHg | 85 (67‐97) | 56 (42‐72) | <0,001 | 1,02 | 1,01‐1,04 | 0,004 |
| Características laboratoriais | ||||||
| Taxa de filtração glomerular (MDRD) (mL/min) | 66 (52‐80) | 75 (65‐82) | NS (0,11) | 0,98 | 0,95‐1,01 | NS (0,23) |
| Cistatina C (mg/L) | 0,79 (0,74‐1,08) | 0,90 (0,76‐1,09) | NS (0,68) | 1,72 | 0,17‐17,65 | NS (0,65) |
| Sódio (mmol/L) | 140±3 | 140±3 | NS (0,53) | 0,97 | 0,82‐1,15 | NS (0,71) |
| Enzima conversora da angiotensina (ug/mL) | 29,5 (20,0‐49,5) | 32,0 (24,0‐42,0) | NS (0,83) | 1,02 | 0,99‐1,04 | NS (0,19) |
| Renina (mIU/L) | 38,7 (8,8‐84,6) | 9,4 (4,2‐23,1) | NS (0,07) | 1,004 | 1,001‐1,007 | 0,014 |
| Aldosterona (pg/mL) | 89,8 (39,3‐208,7) | 99,5 (48,7‐177,8) | NS (0,99) | 1,00 | 0,999‐1,001 | NS (0,99) |
| NT‐proBNP (log)* (pg/mL) | 1527 (1054‐3529) | 236 (161‐825) | 0,001 | 5,3 | 1,95‐14,39 | 0,001 |
| MR‐proANP (pmol/L) | 163,2 (153,3‐467,4) | 112,2 (74,3‐160,3) | NS (0,056) | 1,01 | 1,004‐1,01 | <0,001 |
| Copeptina (ng/mL) | 11,8 (5,0‐19,0) | 6,3 (5,0‐10,4) | 0,07 | 1,05 | 1,01‐1,10 | 0,013 |
| Endotelina‐1 (pg/mL) | 118,0±62,3 | 77,2±40,6 | 0,025 | 1,02 | 1,01‐1,03 | 0,001 |
| MR‐proADM (pg/mL) | 1,02±0,48 | 0,75±0,49 | NS (0,13) | 2,53 | 1,07‐5,95 | 0,034 |
| sST2 (pg/mL) | 74,7 (48,2‐100,5) | 40,0 (26,6‐47,9) | 0,003 | 1,01 | 1,001‐1,008 | 0,011 |
As análises de estratificação sugeriram que o impacto prognóstico dos diferentes biomarcadores não só é distinto, como o perfil temporal dos eventos que prenunciam e o tipo de eventos a que se associam (mortalilidade versus morbimortalidade) os distinguem. Assim, enquanto o NT‐proBNP e a renina exibiram associação predominante à mortalidade, o MR‐proANP e a sST2 mais fortemente se correlacionaram com a morbimortalidade. Por isso, considerámos a possibilidade de a conjugação destes biomarcadores proporcionar valor incremental na acuidade da estratificação prognóstica.
Para testar esta hipótese, desenvolvemos um score de estratificação tendo por base a distribuição por tercis dos níveis séricos de NT‐proBNP, MR‐proANP, renina e sST2, cujas pontuações foram ajustadas de acordo com os HR na predição quer de mortalidade, quer de morte – Tabela 6. A pontuação total corresponde ao somatório das pontuações referentes aos níveis séricos de cada um dos biomarcadores e varia entre 0‐10.
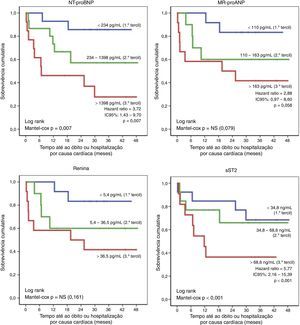
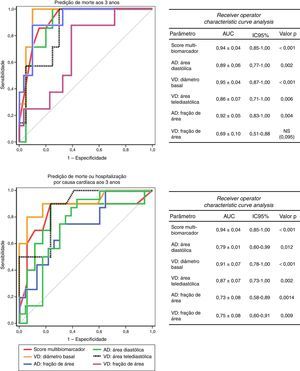
A acuidade do score multibiomarcador para predição de eventos dentro de três anos foi muito elevada, seja no que respeita à mortalidade (AUC: 0,94±0,04; IC95% 0,85‐1,00; p<0,001), seja no que concerne à ocorrência de morte ou hospitalização por causa cardíaca (AUC: 0,86±0,08; IC95% 0,70‐1,00; p=0,001). Além disso, a sua acuidade de estratificação prognóstica foi superior à dos biomarcadores que o integram individualmente (Figura 3) e também superior à dos vários parâmetros ecocardiográficos (Figura 4).
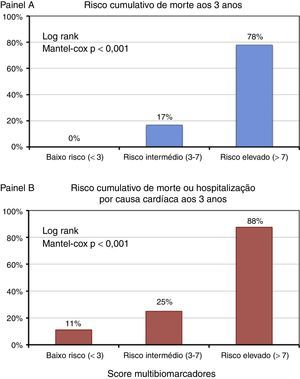
Tendo por base a distribuição por tercis do score multibiomarcador distinguiram‐se três grupos de doentes com prognóstico aos três anos claramente distinto (log rank Mantel‐Cox p<0,001): os doentes com score inferior a 3, de baixo risco, sem eventos fatais aos três anos e com taxa cumulativa de morte ou internamento de 11,1%; os doentes com score compreendido entre 3‐7, de risco intermédio, com taxa de mortalidade aos três anos de 16,7% e taxa de cumulativa de morte ou internamento de 25%; e os doentes com score superior a 7, de alto risco, cuja mortalidade aos três anos atingiu 77,8% e cuja taxa de morte ou hospitalização por causa cardíaca foi de 87,5% – Figura 5.
DiscussãoNeste estudo prospetivo, avaliámos a acuidade prognóstica de novos biomarcadores (MR‐proANP, renina, copeptina, ET1, MR‐proADM e sST2) numa população de doentes com IC direita secundária a HP e comparámo‐la com parâmetros ecocardiográficos bem estabelecidos. Confirmámos o valor prognóstico do NT‐proBNP e demonstrámos, pela primeira vez, que a avaliação conjugada dos níveis séricos de NT‐proBNP, MR‐proANP, renina e sST2 sintetizada num score multibiomarcador, apresenta utilidade adicional. Este score multibiomarcador apresentou elevada acuidade para estratificação prognóstica e possibilitou a identificação dos doentes de alto risco, os quais poderão eventualmente beneficiar de intervenções terapêuticas multidisciplinares intensivas precoces.
Os resultados deste estudo indicam que os novos biomarcadores são relevantes marcadores prognósticos e sugerem o benefício da sua aplicação clínica. Destaca‐se ainda que estes resultados foram obtidos numa população de doentes com IC direita secundária a HP (confirmada por cateterismo direito), mas relativamente heterogénea nas suas etiologias. De forma relevante, a acuidade prognóstica dos marcadores avaliados não diferiu em função da etiologia (classificação de Nice) da HP. Tal é de grande relevância para a prática clínica quotidiana, alargando o espectro da aplicabilidade da estratificação prognóstica com biomarcadores às múltiplas formas clínicas de HP.
Neste estudo confirmámos ainda existir relação entre vários parâmetros anatómicos e funcionais da AD e VD e o prognóstico. Em particular, a dimensão basal do VD e a fração de área da AD constituíram fortes preditores independentes do prognóstico. Destaca‐se que os parâmetros funcionais do VD, apesar de correlacionados com o prognóstico, tiveram menor impacto e não foram preditores independentes. Tal enfatiza a dificuldade na avaliação ecocardiográfica da função global ventricular direita, muito afetada pelo acoplamento ventrículo‐arterial inerente ao contexto de HP e, possivelmente, dependente de parâmetros de remodelagem como a hipertrofia parietal.
Os péptidos natriuréticos, atualmente considerados os biomarcadores gold standard na IC, desempenham um papel importante na homeostasia cardiovascular, incluindo na regulação do tónus vascular, volémia, permeabilidade endotelial e hipertrofia cardíaca. Entre os péptidos natriuréticos, destacam‐se o ANP e o BNP, produzidos primariamente nos miócitos das aurículas e ventrículos15, respetivamente. Ambos são produzidos em resposta à distensão miocárdica secundária à sobrecarga de pressão ou volume. As funções biológicas do ANP e BNP incluem vários mecanismos compensatórios, como a natriurese, diurese e vasodilatação16.
A maioria dos estudos relativos ao uso da classe de péptidos de tipo‐B centraram‐se no BNP ou no NT‐proBNP. O valor prognóstico destes péptidos encontra‐se bem demonstrado em todos os estadios da IC esquerda, sendo incremental relativamente a outros marcadores clínicos. Por exemplo, no registo ADHERE17 verificou‐se uma relação linear entre os níveis de BNP e a mortalidade dos doentes hospitalizados por IC descompensada, mesmo após ajustamento para outros marcadores de risco clínicos e laboratoriais.
O ANP, além da ação natriurética, apresenta potentes propriedades vasodilatadoras pulmonares18. A sua semivida plasmática é muito reduzida (2‐5 minutos)19, o que dificulta o seu doseamento. Por isso, a investigação tem‐se centrado na avaliação do MR‐proANP, um péptido mais estável do ponto de vista biológico. O valor prognóstico do MR‐proANP foi já avaliado em doentes com IC esquerda. No estudo PRIDE20, o MR‐proANP foi identificado como preditor independente de mortalidade em doentes com IC descompensada. No estudo BAC21 demonstrou‐se a não inferioridade do MR‐proANP relativamente ao BNP no diagnóstico de IC aguda em doentes com dispneia aguda. Além disso, os dados do estudo sugeriram maior acuidade do MR‐proANP na zona cinzenta do BNP e em doentes obesos.
O valor prognóstico dos péptidos natriuréticos tem sido pesquisado em cenários de HP e falência ventricular direita. Contudo, neste campo os resultados são mais limitados. Alguns trabalhos demonstraram que os níveis plasmáticos de BNP e NT‐proBNP aumentam em proporção ao grau de disfunção ventricular direita22 e capacidade funcional23, mas o valor prognóstico do MR‐proANP nunca foi avaliado. Os resultados do nosso estudo assumem por isso especial relevância, sugerindo benefício e complementaridade destes péptidos para finalidade de estratificação. Assim, o NT‐proBNP exibiu associação predominante à mortalidade (e ao risco a mais curto prazo), enquanto o MR‐proANP constitui preditor prognóstico independente de morbimortalidade (associando‐se ao risco de eventos a mais longo prazo). Os doentes com níveis mais elevados de NT‐proBNP (3.° tercil:>1398pg/mL) apresentaram seis vezes maior risco de morte e os doentes com níveis mais aumentados de MR‐proANP (3.° tercil) tiveram três vezes maior risco de morte ou hospitalização por agravamento da HP. Demonstrámos ainda que a conjugação destes biomarcadores proporcionou valor acrescido na acuidade da estratificação prognóstica. Tal está de acordo com a hipótese de que os péptidos natriuréticos são parte integrante do sistema de contrarregulação fisiológico em doentes com HP e disfunção ventricular direita, apresentando valor preditivo prognóstico indiscutível.
Estes resultados serão ainda mais interessantes se for considerado que estes péptidos podem, a curto prazo, constituir alvos terapêuticos. Como exemplo, foi recentemente demonstrado que a administração de ANP diminui significativamente a vasoconstrição e remodelagem adversa num modelo animal de HP24.
Os péptidos natriuréticos apresentam efeitos antagónicos relativamente ao SRAA25. A importância prognóstica do aumento da atividade do SRAA tem sido extensamente reconhecida na patologia do coração esquerdo25, mas permanece incerta no contexto da IC direita. Estudos sugerem que este sistema se encontra hiperativado na HP, integrando um mecanismo compensatório, embora com efeitos deletérios a longo prazo26. No entanto, ainda se sabe pouco relativamente às alterações de sinalização do eixo no contexto de HP. Dois estudos independentes reportaram que alguns polimorfismos da enzima conversora de angiotensina (ECA) e do recetor de angiotensina II tipo 1 se associaram a progressão mais acelerada da HAP idiopática, remetendo para o envolvimento do SRAA27,28. O hiperaldosteronismo tem sido descrito recentemente como um promotor da doença vascular pulmonar em modelos experimentais de HAP29. Maron et al.30 descreveram uma correlação positiva entre os níveis plasmáticos de aldosterona e parâmetros hemodinâmicos (resistência vascular pulmonar e gradiente transpulmonar) em doentes com HAP.
Forfia et al.31 demonstraram uma associação entre a ocorrência de hiponatremia (um indicador indireto da atividade do eixo), IC direita e mortalidade em doentes com HAP. Os nossos resultados não revelaram associação significativa entre a natremia e o risco de eventos após ajustamento para as outras variáveis. Tal traduzirá provavelmente a complexidade dos mecanismos subjacentes e o papel da terapêutica anticongestiva como fator modulador do potencial valor preditor dos níveis de sódio. Neste estudo, avaliaram‐se parâmetros que de forma mais direta medem a atividade do SRAA (ECA, renina e aldosterona), algo ainda não investigado de forma sistemática em seguimento clínico a longo prazo. Observámos que os doentes que evoluíram desfavoravelmente exibiam aumento dos níveis séricos basais de renina, sem modificação dos níveis de ECA ou aldosterona. Estes resultados apontam para a complexidade dos mecanismos envolvidos, não só no que respeita à modulação intrínseca do eixo como também na dissociação entre a magnitude da sua ativação e a gravidade da doença. Possíveis explicações são a presença de outros estados de hiperaldosteronismo (ex. hipertensão arterial sistémica), diferenças interindividuais na homeostasia do sódio e fatores regulatórios circadianos da síntese aldosterona32. Os nossos resultados remetem para o potencial papel de estratégias terapêuticas que interfiram com o eixo RAAS.
A ET1 e a vasopressina são péptidos com um papel fundamental na fisiologia cardiovascular, apresentando propriedades vasoconstritoras. A ET‐1, para além um potente vasoconstritor, apresenta propriedades proliferativas ao nível do músculo liso vascular, intervindo na patobiologia da HP. Os seus níveis séricos encontram‐se significativamente elevados em doentes com HAP33, correlacionando‐se com a gravidade da doença34, embora o seu valor prognóstico não tenha sido muito explorado.
A vasopressina é um péptido‐hormona sintetizado no hipotálamo e armazenado na neuro‐hipófise, apresentando propriedades antidiuréticas e vasoconstritoras. Os seus níveis encontram‐se elevados em doentes com IC35, contudo torna‐se difícil a sua quantificação devido à curta semivida e ligação às proteínas plasmáticas. No entanto, a sua porção C‐terminal (copeptina) é estável e pode ser facilmente quantificada, tendo sido estudada no contexto de IC e síndromes coronárias agudas. No estudo BACH36, níveis elevados de copeptina estavam associados a aumento da mortalidade aos 90 dias e internamentos por causa cardíaca. O valor prognóstico da copeptina na IC aguda e crónica foi subsequentemente confirmado37,38. Comparativamente à doença do coração esquerdo, o eixo neurohormonal tem sido pouco estudado em doentes com HP e IC direita. Na nossa população, observámos níveis mais elevados de copeptina e ET‐1 entre os indivíduos que evoluíram desfavoravelmente (com morte e/ ou internamento por causa cardíaca).
O sST2 é um membro da superfamília de recetores Toll‐like/IL‐1, apresentando uma forma solúvel (sST2) e outra transmembranar (ST2L), sendo a interleucina‐33 (IL‐33) o ligando para ambas as formas. Consiste num biomarcador com efeitos pluripotenciais in vivo, cuja expressão é estimulada pela deformação mecânica dos fibroblastos cardíacos e cardiomiocitos, estando envolvido em processos de remodelagem e fibrose no contexto de IC. Estudos recentes demonstraram a presença de concentrações plasmáticas aumentadas de sST2 em contexto de IC aguda, apresentando relação significativa com a presença de remodelagem adversa ventricular esquerda e prognóstico4,39. Sanada et al.40 demonstraram que a IL‐33 atuando através de ST2L antagoniza a hipertrofia miocitária induzida por mecanismos neuro‐hormonais. Estes autores reportaram também que o sST2 bloqueia os efeitos cardioprotetores da IL‐33. Shimpo et al.41 demonstraram que em doentes com enfarte agudo do miocárdio, níveis elevados de sST2 foram preditores de IC e morte. O sST2 tem sido bastante estudado em doentes com dispneia e suspeita de IC descompensada. Numa subanálise do estudo PRIDE, Januzzi et al.42 avaliaram os níveis de sST2 e NT‐proBNP em doentes com dispneia aguda. Demonstraram que os níveis de sST2 estavam mais elevados nos doentes com IC aguda, apresentando maior valor prognóstico comparativamente ao NT‐proBNP. Em doentes com IC crónica, o sST2 demonstrou ser preditor de morte súbita cardíaca43. Em resumo, o sST2 tem surgido nos últimos anos como um novo biomarcador de gravidade e prognóstico na IC, sendo que poucos estudos têm procurado avaliar o seu papel na IC direita secundária a HP. Zheng et al.44 demonstraram num estudo recente uma correlação entre os níveis plasmáticos de sST2 e parâmetros hemodinâmicos numa população de doentes com HAP idiopática. Carlomano et al.45 descreveram recentemente uma correlação entre os valores plasmáticos de sST2 e parâmetros dimensionais e de função ventricular direita avaliados por ressonância magnética cardíaca. Do ponto de vista hemodinâmico, doentes com pior função ventricular direita apresentam aumento das pressões de enchimento, maior stresse transmural com estiramento ventricular associado e maior produção de sST2. Assim, considerando a importância da função ventricular direita na estratificação de risco de doentes com HP46, com este estudo estabelece‐se de uma forma consistente o valor da sST2 como novo biomarcador de prognóstico na IC direita. Este pode ser integrado, em combinação com outros biomarcadores, no modelo de estratificação de risco proposto neste trabalho.
A adaptação do coração direito à sobrecarga de pressão e as alterações morfológicas decorrentes no contexto de HP foram já previamente caracterizadas por várias modalidade de imagem e particularmente por ecocardiografia. Vários trabalhos identificaram previamente preditores prognósticos morfológicos e funcionais da AD e VD em doentes com HP47. Contudo, ainda não está completamente estabelecida a relação existente entre a distorção anatómica/dilatação cavitária e os vários parâmetros de (dis)função ventricular direita. Além disso, parece existir maior consistência na definição de prognóstico destes doentes para parâmetros relacionados com a dilatação ventricular direita versus parâmetros de função ventricular48. Nos estudos de intervenção com terapêutica específica existe mesmo uma correlação entre estes mesmos parâmetros e a melhoria funcional dos doentes.
LimitaçõesEste estudo deve ser entendido como uma avaliação exploratória, numa população de doentes com IC direita secundária a HP (confirmada por cateterismo direito) de dimensão relativamente reduzida e durante um período de seguimento limitado. Além disso, a população incluída foi heterogénea no que respeita à etiologia, duração da doença e terapêutica em curso aquando da inclusão e durante o seguimento. As observações do presente trabalho terão que ser prospetivamente validadas em estudos externos de maior dimensão, antes que se possa perspetivar a sua utilização como critério de decisão clínica. Além disso, deverá ser avaliado o impacto da duração da doença e da terapêutica em curso no desempenho específico dos diferentes preditores prognósticos, seja dos biomarcadores, seja dos parâmetros anatómicos e funcionais da AD e VD.
ConclusãoNeste estudo prospetivo demonstrámos que vários novos biomarcadores (MR‐proANP, renina, copeptina, ET1, MR‐proADM e sST2) juntamente com o NT‐proBNP e os parâmetros dimensionais e de função das cavidades cardíacas direitas constituem preditores prognósticos relevantes em doentes com IC direita secundária a HP. Além disso, demonstrámos, pela primeira vez, que a avaliação conjugada dos níveis séricos de NT‐proBNP, MR‐proANP, renina e sST2 sintetizada num score multibiomarcador, melhora a acuidade da estratificação prognóstica. Este score multibiomarcador possibilitou a identificação dos doentes de alto risco, os quais poderão eventualmente beneficiar de intervenções terapêuticas multidisciplinares intensivas precoces.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflito de interessesOs autores declaram não haver conflito de interesses.