Na fibrilhação auricular não valvular, 90% dos trombos originam-se no apêndice auricular esquerdo. O seu encerramento percutâneo mostrou ser não inferior à varfarina na profilaxia do tromboembolismo.
ObjetivoAvaliar a experiência inicial de um centro no encerramento percutâneo do apêndice auricular esquerdo em doentes com elevado risco tromboembólico sem possibilidade, com contraindicação ou falência da anticoagulação oral.
MétodosDoentes com fibrilhação auricular não valvular, score CHADS2 ≥ 2 sem possibilidade, com contraindicação ou falência da anticoagulação oral foram submetidos a encerramento percutâneo do apêndice auricular esquerdo de acordo com a técnica padrão. Após implantação, foi mantida dupla antiagregação durante um mês e simples indefinidamente. Realizado seguimento com avaliação clínica, ecocardiografia transtorácica e transesofágica.
ResultadosO procedimento foi conseguido em 22 dos 23 doentes selecionados (95,7%): 70±9 anos, score CHADS2 de 3,2±0,9 e CHA2DS2-VASC de 4,7±1,4. Apenas no primeiro doente o dispositivo foi substituído por sobredimensionamento. Foram observadas as seguintes complicações periprocedimento: um pseudoaneurisma femoral, 3 hematomas femorais e 2 hemorragias da orofaringe, resolvidos com medidas locais. Durante o seguimento de 12±8 meses foram identificados um fluxo peridispositivo ligeiro e um trombo aderente ao dispositivo - que resolveu sob enoxaparina. A taxa de AVC/AIT foi inferior à esperada com base no score CHADS2 (0 versus 6,7±2,2%).
ConclusõesNa nossa experiência inicial este procedimento mostrou ser uma alternativa exequível, segura e eficaz em doentes com fibrilhação auricular para os quais a anticoagulação oral não é uma opção. Foram identificadas complicações de baixa severidade, com uma taxa de AVC/AIT inferior à esperada.
In non-valvular atrial fibrillation 90% of thrombi originate in the left atrial appendage (LAA). Percutaneous LAA closure has been shown to be non-inferior to warfarin for prevention of thromboembolism.
ObjectiveTo evaluate the initial experience of a single center in percutaneous LAA closure in patients with high thromboembolic risk and in whom oral anticoagulation was impractical or contraindicated or had failed.
MethodsPatients with non-valvular atrial fibrillation and CHADS2 score ≥2 in whom oral anticoagulation was impractical or contraindicated or had failed underwent percutaneous LAA closure according to the standard technique. After the procedure, dual antiplatelet therapy was maintained for one month, followed by single antiplatelet therapy indefinitely. Patients were followed by clinical assessment and transthoracic and transesophageal echocardiography.
ResultsThe procedure was performed in 22 of the 23 selected patients (95.7%), mean age 70±9 years, CHADS2 score 3.2±0.9 and CHA2DS2-VASC score 4.7±1.4. Intraprocedural device replacement was necessary only in the first patient, due to oversizing. The following periprocedural complications were observed: one femoral pseudoaneurysm, three femoral hematomas and two minor oropharyngeal bleeds, resolved by local hemostatic measures. During a 12±8 month follow-up a mild peri-device flow and a thrombus adhering to the device, resolved under with enoxaparin therapy, were identified. The rate of transient ischemic attack (TIA)/stroke was lower than expected according to the CHADS2 score (0 vs. 6.7±2.2%).
ConclusionsIn our initial experience, this procedure proved to be a feasible, safe and effective alternative for atrial fibrillation patients in whom oral anticoagulation is not an option. Only relatively minor complications were observed, with a lower than expected TIA/stroke rate.
A fibrilhação auricular (FA) é uma arritmia frequente na prática clínica, apresentando, em Portugal, uma prevalência de 2,5% para indivíduos acima dos 40 anos, de acordo com os dados do estudo FAMA1. Na população em geral, ela é identificada em 1-2%, aumentando com a idade e tendendo a um aumento significativo ao longo do tempo, prevendo-se que venha a duplicar nos próximos 50 anos2.
A FA associa-se a morbilidade e mortalidade elevadas, em virtude do seu potencial tromboembólico. Com efeito, a FA duplica de forma independente o risco de morte e aumenta, em 5 vezes, o risco de acidente vascular cerebral (AVC) comparativamente com a população da mesma idade em ritmo sinusal2,3. Devido ao tamanho elevado destes trombos, os AVC embólicos tendem a originar consequências mais severas quando comparadas com outras fontes de embolismo cerebral, sendo frequentemente fatais ou condicionando maior incapacidade, e associando-se a uma taxa de recorrência mais elevada2–6.
O risco tromboembólico está presente e deve ser considerado idêntico para todas as formas de FA, incluindo as paroxísticas1–3. O score CHADS2 é o método de avaliação recomendado pela Sociedade Europeia de Cardiologia, que pontua com 2 pontos antecedentes de AVC ou acidente vascular transitório (AIT) e com um ponto a idade > 75 anos, história de hipertensão arterial, de diabetes ou de insuficiência cardíaca. Na FA, um score CHADS2 ≥ 2 corresponde a um risco de AVC ≥ 4% ao ano, estando indicada a hipocoagulação oral. Para score CHADS2 de 0 ou 1 a decisão de hipocoagulação deve ser reavaliada tendo em conta fatores de risco tromboembólico «não major» clinicamente relevantes, através do score CHA2DS2-VASc: que atribui 2 pontos a história de AVC/AIT prévios e a idade > 75 anos, e um ponto a idade entre os 65 e 74 anos, história de hipertensão arterial, diabetes, insuficiência cardíaca, género feminino e doença vascular (enfarte do miocárdio, placa aórtica complexa, doença arterial periférica). Encontra-se igualmente indicada hipocoagulação oral para score CHA2DS2-VASc ≥ 2 (risco de AVC/ano ≥ 2,2%)2.
A terapêutica antitrombótica demonstrou ser eficaz na redução da mortalidade e do risco de AVC associados à FA2. A varfarina tem sido a terapêutica de primeira linha para profilaxia de tromboembolismo, tendo demonstrado redução do risco relativo de AVC em 60 a 73% para uma janela terapêutica de INR entre 2-32–9. Para este efeito, é superior ao ácido acetilsalicílico, que demonstrou uma redução de apenas 20% destes eventos2,7.
O receio da utilização da varfarina relaciona-se com potenciais complicações hemorrágicas, sendo a hemorragia intracraniana a mais temida, com risco aumentado para valores de INR acima de 3,52–7. Com efeito, um aspeto fundamental na decisão de hipocoagulação passa pela avaliação do risco hemorrágico do doente em causa, sendo recomendado para o efeito o score HAS-BLED (hipertensão arterial, alteração da função renal, alteração da função hepática, antecedentes de AVC, de predisposição para hemorragia, de INR lábil, idade > 65 anos, consumo habitual de determinados fármacos/álcool), em que um score ≥ 3 significa um risco hemorrágico elevado, devendo a terapêutica antitrombótica ser ponderada criteriosamente e associada a uma vigilância apertada2.
Apesar de a sua eficácia, a varfarina encontra-se contraindicada em 14-44% dos doentes com FA em risco de AVC10. Dos doentes considerados teoricamente elegíveis para esta terapêutica, apenas 54% se encontram hipocoagulados, o que advém de múltiplos fatores como a necessidade de monitorizações laboratoriais frequentes, de colaboração do doente e o próprio receio dos clínicos, que conduzem à não recomendação da varfarina em 46% dos doentes em risco4,5.
Por outro lado, os doentes hipocoagulados apenas apresentam INR dentro da faixa terapêutica em 50 a 68% das monitorizações9.
Todos estes condicionalismos dificultam a terapêutica com varfarina, tendo sido procuradas alternativas para profilaxia do tromboembolismo na FA.
Têm sido estudados novos anticoagulantes como alternativa à varfarina para prevenção de eventos tromboembólicos na FA, os quais se dividem em 2 classes principais: os inibidores diretos da trombina (p. ex. dabigatrano) e os inibidores do factor Xa (ex. rivaroxabano, apixabano, edoxabano, betrixabano). De uma forma genérica e comparativamente com a varfarina, todos apresentam vantagens, tais como uma janela terapêutica mais alargada, menor interferência com a alimentação, e não necessitam de controlo laboratorial da dose adminsitrada2. O dabigatrano (estudo RE-LY11), o rivaroxabano (ROCKET-AF12) e o apixabano (ARISTOTLE13) demonstraram já a sua não inferioridade comparativamente com a varfarina na prevenção de eventos tromboembólicos na FA, encontrando-se os 2 primeiros aprovados pela US Food and Drug Administration (FDA) para este fim14. Na mais recente atualização das Guidelines de FA da Sociedade Europeia de Cardiologia, o dabigatrano foi considerado alternativa à varfarina nos doentes com FA e indicação para anticoagulação oral2. Já a última revisão das Guidelines da Sociedade Canadiana de Cardiologia recomendou a utilização de dabigatrano preferencialmente à varfarina nesses doentes10.
Estes fármacos apresentam, contudo, elevados custos para uma terapêutica crónica, associam-se a um risco hemorrágico não desprezível e o seu antídoto não se encontra estabelecido, o que constitui uma barreira à sua utilização em muitos doentes. Nos diferentes estudos publicados com os novos anticoagulantes orais, também tem sido verificada uma taxa de descontinuação terapêutica não menosprezável, maioritariamente por intolerância/efeitos adversos, que no ARISTOTLE13 correspondeu a 25,3% dos doentes sob apixabano (versus 27,5% para varfarina), chegando mesmo a ser superior à verificada para a varfarina nos estudos RE-LY11 (21% para dabigatrano versus 17%) e ROCKET-AF12 (23,7% para rivaroxabano versus 22,2%).
Por outro lado, todos estes fármacos estão contraindicados em doentes com antecedentes de acidentes vasculares cerebrais hemorrágicos, condição que, associada a elevado risco tromboembólico, constitui um dilema no que respeita à prevenção do AVC.
O apêndice auricular esquerdo (AAE) tem sido identificado, em estudos post mortem, por ecocardiograma transesofágico ou por inspeção direta intraoperatória, como o local mais frequente de formação de trombos em doentes com FA, correspondendo a 58% dos locais de formação de trombo na FA valvular e a 90-98% na FA não valvular15–19.
Perante estas evidências, o encerramento percutâneo do AAE surgiu como possível alternativa não farmacológica à anticoagulação oral para profilaxia de tromboembolismo na FA não valvular. A sua exequibilidade foi já demonstrada em inúmeros ensaios clínicos, realizados com 3 tipos diferentes de dispositivos4,5,9,14,19.
O sistema Percutaneous Left Atrial Appendage Transcatheter Occlusion (PLAATO, eV3,Inc., Plymouth, Minnesota, Estados Unidos)20 foi o primeiro dispositivo a ser desenhado e utilizado para este fim. Era constituído por uma estrutura autoexpansível de nitinol revestida por uma membrana de politetrafluoretileno, a qual ocluía o fluxo para o AAE ao mesmo tempo que ia sendo re-epitelizada, e por 3 linhas de âncoras que fixavam a estrutura ao nível do orifício do AAE. Várias séries foram publicadas documentando a exequibilidade e eficácia da utilização deste dispositivo no encerramento percutâneo do AAE para profilaxia de tromboembolismo na FA, tendo, contudo surgido alguns receios relativos a complicações graves, embora pouco frequentes, que foram verificadas. A comercialização deste dispositivo acabou por ser descontinuada pelo fabricante19,20.
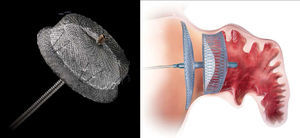
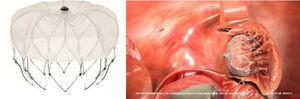
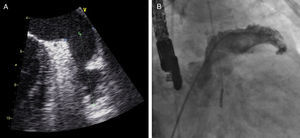
Outro dispositivo desenvolvido para o encerramento do AAE foi o Amplatzer Cardiac Plug (ACP; St. Jude Medical, Plymouth, Minnesota, Estados Unidos)21, que consiste numa estrutura autoexpansível de nitilol com patch de poliéster, constituída por um lobo e um disco unidos por uma barra central. O lobo apresenta ganchos para fixação e estabilização dentro do AAE, enquanto o disco se destina a recobrir e selar o ostium do AAE (Figura 1). Encontra-se disponível em 8 tamanhos diferentes com base nas dimensões do lobo (16 a 30mm, com diferença de 2mm entre cada tamanho)21. A exequibilidade e segurança da sua implantação foi demonstrada em diferentes séries, que identificaram sempre uma taxa de AVC/AIT inferior à esperada com base no score CHADS2. Nestas séries os doentes foram medicados após procedimento com clopidogrel durante um a 3 meses e ácido acetilsalicílico durante 3 meses ou indefinidamente. Mais recentemente, surgiram preocupações relacionadas com a formação de trombos peridispositivo, que motivaram um alerta pelo fabricante com uma atualização da técnica a utilizar e recomendação de terapêutica após o procedimento com aspirina durante 6 meses (deixando ao critério do clínico a decisão de a manter posteriormente) e a associação a clopidogrel ou outro antiagregante de acordo com as «normas padrão»19. Com vista a avaliar a eficácia deste dispositivo, encontra-se a decorrer o estudo ACP, prospetivo e randomizado, que compara o ACP com a varfarina em doentes sem contraindicação à mesma, com FA e score CHADS2 superior ou igual a 222.O dispositivo WATCHMAN (Boston Scientific, Plymouth, Minnesota, Estados Unidos)9 foi também desenhado para o encerramento percutâneo do AAE, sendo constituído por uma estrutura de nitinol autoexpansível com filamentos de fixação, coberta por uma membrana de poliéster apenas na porção exposta à AE (Figura 2). Encontra-se disponível em 5 tamanhos diferentes, nos diâmetros de 21 a 33mm, com incrementos de 3mm9. A exequibilidade e segurança da sua utilização foram também publicadas para séries que incluíram, após implantação, um período de 45 d de anticoagulação com varfarina, associada a ácido acetilsalicílico indefinidamente e, a dada altura da sua utilização, também a clopidogrel entre os 45 d e os 6 meses19. Com este dispositivo, foi inclusivamente estabelecida a não inferioridade do encerramento percutâneo do AAE comparativamente com a varfarina, através do estudo randomizado PROTECT AF8,19. Este incluiu doentes com FA não valvular e score CHADS2 ≥ 1. A implementação desta técnica num número superior de doentes e o seu seguimento continuado (CAP registry23) permitiu desmistificar alguns receios iniciais relativos à segurança do procedimento. Com efeito, verificou-se que as complicações relacionadas com o encerramento percutâneo do AAE ocorriam sobretudo periprocedimento, diminuíam com a experiência do operador e condicionavam menor incapacidade funcional comparativamente às relacionadas com a varfarina, que, por sua vez, apresentavam um risco cumulativo crescente ao longo do tempo19,23.
Tendo em conta o carácter invasivo do encerramento percutâneo do AAE, os doentes que teoricamente apresentariam uma melhor relação risco-benefício seriam aqueles com risco tromboembólico mais elevado e contraindicação a terapêutica anticoagulante. Contudo, o PROTECT AF8 incluiu doentes com score CHADS2 ≥ 1, sendo questionada a reprodutibilidade destes resultados em doentes com risco tromboembólico superior. Neste estudo, os doentes foram medicados com varfarina nos primeiros 45 d após o procedimento, o que também limita a sua aplicabilidade a doentes com contraindicação a esta terapêutica.
O encerramento percutâneo do AAE foi já descrito em regime de antiagregação (ácido acetilsalicílico associado ou não a clopidogrel, com duração muito variável para ambos os antiagregantes) sem período de anticoagulação inicial após a implantação, em séries publicadas com o dispositivo PLAATO – sem se ter verificado uma taxa elevada de eventos tromboembólicos19, com o dispositivo ACP – com alguns casos descritos de formação de trombo peridispositivo19, e, mais recentemente, no registo prospetivo não randomizado ASA Plavix Feasibility Study With WATCHMAN Left Atrial Appendage Closure Technology (ASAP)24. Este incluiu 150 doentes com FA não valvular, com score CHADS2 ≥ 1 e contraindicação à varfarina, que foram submetidos a encerramento percutâneo do AAE com o dispositivo WATCHMAN, e medicados após procedimento com clopidogrel durante 6 meses e ácido acetilsalicílico indefinidamente, tendo os autores concluído que a implantação foi segura e eficaz sem medicação transitória com varfarina25.
O presente trabalho pretendeu avaliar a experiência de um único Centro no encerramento percutâneo do AAE em doentes com FA e elevado risco tromboembólico sem possibilidade, com contraindicação ou falência da hipocoagulação oral, durante o período de maio de 2010 a junho de 2012.
MétodosSeleção de doentesEntre maio de 2010 e junho de 2012, foram selecionados, para encerramento percutâneo do AAE num único centro, 23 doentes com FA não valvular de qualquer tipo (permanente, persistente ou paroxística), com risco de tromboembolismo – objetivado por score CHADS2 ≥ 2, sem condições para anticoagulação oral, com contraindicação à mesma, ou em que esta se tivesse mostrado ineficaz na prevenção de tromboembolismo.
Considerou-se que não estavam reunidas condições para anticoagulação oral quando a medicação com antagonistas da vitamina k era inadequada, por INR lábil ou impossibilidade de vigilância de INR.
A contraindicação à hipocoagulação oral foi definida pela presença de antecedentes de hemorragia cerebral, de hemorragia grave sob hipocoagulação oral ou sob antiagregação, ou antecedentes de doença hematológica com discrasia sanguínea. A ineficácia da hipocoagulação oral foi estabelecida pela ocorrência de evento embólico com identificação de trombo no AAE sob hipocoagulação com varfarina e INR em níveis terapêuticos.
A escolha de um score CHADS2 ≥ 2 para a inclusão de doentes deveu-se ao facto de este ser o nível de risco tromboembólico a partir do qual se encontra indicada a profilaxia com anticoagulação oral. Dado que se pretendia incluir doentes sem possibilidade de hipocoagulação oral, considerou-se que esse critério permitiria selecionar os doentes que teoricamente mais beneficiariam com a alternativa não farmacológica em avaliação.
Foram considerados critérios de exclusão a presença de doença cardíaca congénita, doença valvular, estado de hipercoagulabilidade previamente conhecido ou suspeito, gravidez, alergia ao níquel, endocardite ativa ou possível fonte de bateriémia, presença de prótese valvular mecânica, de elétrodos de pacemaker ou de cardioversor-desfibrilhador implantável nas cavidades cardíacas, trombo intracardíaco ou AAE com dimensões inadequadas para encerramento com os dispositivos disponíveis no mercado.
De modo a excluir estes 2 últimos critérios, foi realizado em todos os doentes ecocardiograma transesofágico antes do procedimento, para medição do ostium do AAE e exclusão de trombo, sobretudo no AAE.
Implantação do dispositivo e protocolo de seguimentoOs doentes selecionados foram internados na véspera do procedimento e medicados com dupla antiagregação (ácido acetilsalicílico 100mg id e clopidogrel 75mg id), enoxaparina subcutânea 1mg/kg/h de 12-12h (com supressão da toma prévia à intervenção) e soro fisiológico a 1mL/kg/h iniciado 12h antes e mantido 24h depois, para profilaxia de nefropatia de contraste e maior repleção de volume intravascular e do AAE. Foi realizada profilaxia de endocardite bacteriana com administração de 750mg de cefuroxima endovenosa uma hora antes do procedimento.
Todos os encerramentos percutâneos do AAE foram realizados sob sedação profunda/anestesia geral com apoio de Anestesista.
As implantações foram realizadas por via femoral, guiadas por fluoroscopia e ecocardiografia transesofágica.
Durante o procedimento, foram administrados bólus de heparina endovenosa de modo a atingir um tempo de coagulação ativado de pelo menos 250 s.
Em cada doente foi utilizado um dos 2 tipos de dispositivo de encerramento disponíveis no Serviço: ACP ou WATCHMAN, todos implantados pelo mesmo operador.
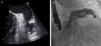
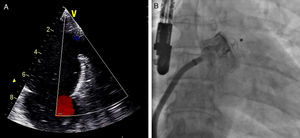
Sob sedação profunda/anestesia, efetuou-se o ecocardiograma transesofágico, realizado aos 0°, 45°, 90° e 135°, para excluir novamente a presença de trombos no AAE, medir a profundidade e o maior diâmetro do ostium (Figura 3).
Foi efetuada punção transeptal, sob controlo fluoroscópico e ecocardiografia transesofágica, e colocado guia superstiff, através do qual foi avançado um cateter multipurpose até ao AAE. De seguida, foram efetuadas 2 injeções de contraste (RAO 20° caudal 20°, RAO 20° cranial 20°) com preenchimento do AAE (Figura 3) para sua medição.
O dispositivo inicialmente utilizado no nosso Centro foi o ACP, e só posteriormente foi utilizado o WATCHMAN. O tamanho dos dispositivos foi selecionado com base nas medições ecocardiográficas e angiográficas do AAE, de modo a que o lobo do ACP fosse superior ao diâmetro do ostium do AAE em 2mm, requerendo um ostium com diâmetro entre 12,6 e 28,5mm e uma landing zone ≥ 10mm, e que o WATCHMAN fosse 10 a 20% superior ao diâmetro do ostium do AAE, o qual deveria medir entre 16,8 e 30,4mm.
A preparação do ACP consiste num flush com soro para expulsar bolhas de ar presentes dentro do dispositivo, durante a introdução no cateter de entrega.
Os dispositivos foram colocados no AAE, seguindo-se uma avaliação ecocardiográfica e fluoroscópica do seu posicionamento e fixação.
Considerou-se que o ACP estava bem posicionado quando 2/3 do lobo se encontravam distais à artéria circunflexa por ecocardiograma transesofágico, e assumia uma conformação que traduzisse alguma compressão do lobo pelo AAE. Foi ainda avaliada a presença de fluxo peridispositivo, considerando-se critério de sucesso a ausência de blush significativo por fluoroscopia, e um fluxo peridispositivo < 3mm (ligeiro) por ecocardiograma transesofágico, com base na classificação proposta por Ostermayer e et al26.
Para avaliar o posicionamento do WATCHMAN foram utilizados os critérios PASS: Position – o dispositivo deve estar distal ou ao nível do ostium do AAE; Anchor – testar a estabilidade do dispositivo sob controlo fluoroscópico: as âncoras devem estar fixas e o dispositivo estável, se mudar de posição para local com menor compressão ou aposição, deve ser reposicionado; Size – o dispositivo deve estar comprimido em 8 a 20% da dimensão original, sendo a medição efetuada por ecocardiograma transesofágico após o posicionamento; Seal – o dispositivo deve abranger o ostium de modo a não haver fluxo peridispositivo.
Após se satisfazerem todos estes critérios de bom posicionamento, o dispositivo foi libertado e realizou-se nova avaliação fluoroscópica e ecocardiográfica (Figura 4) para avaliar eventuais complicações imediatas, como deslocamento ou migração do dispositivo, formação de trombo intracardíaco ou adjacente ao dispositivo, derrame pericárdico, compressão da artéria circunflexa ou da veia pulmonar superior esquerda, ou a presença de fluxo residual. No caso de estes critérios não se encontrarem satisfeitos, o dispositivo deveria ser total ou parcialmente recapturado e reposicionado antes de ser libertado.
Após o encerramento percutâneo do AAE, os doentes foram medicados com dupla antiagregação (ácido acetilsalicílico 100mg id e clopidogrel 75mg id) durante um mês e antiagregação simples indefinidamente. Foi escolhida dupla antiagregação devido aos critérios de seleção utilizados, já que a maioria dos doentes apresentava contraindicação ou ausência de condições para hipocoagulação oral. A duração do tratamento com cada um dos antiagregantes foi determinada tendo por base os estudos prévios realizados com o dispositivo ACP19, tendo os dispositivos WATCHMAN sido implantados antes de serem conhecidos os resultados do estudo ASAP25.
Foi mantida vigilância clínica em regime de internamento até 24h após o procedimento, para vigilância de complicações relacionadas com o acesso vascular, hemorragias, estabilidade hemodinâmica. Foi realizado ecocardiograma transtorácico no primeiro dia após encerramento para avaliação de derrame pericárdico, deslocamento ou migração do dispositivo, fluxo peridispositivo ou formação de trombo aderente ao mesmo.
Ao fim do primeiro mês após encerramento, foi realizado ecocardiograma transesofágico para avaliação de sinais de endotelização incompleta (fluxo peridispositivo ≥ 3mm), formação de trombo aderente ao dispositivo, deslocamento ou migração do implante, ou sinais de compressão da veia pulmonar superior esquerda ou da artéria circunflexa. Na ausência de complicações, a dupla antiagregação era substituída por antiagregação simples. Caso estivessem presentes sinais de endotelização incompleta, o esquema de dupla antiagregação seria prolongado. A formação de trombo implicaria anticoagulação.
Foi mantido seguimento ecocardiográfico posterior com recurso a ecocardiograma transtorácico aos 3, 6 e 9 meses e ecocardiograma transesofágico aos 12 meses, para avaliar novamente complicações locais, tais como deslocamento ou migração do dispositivo, formação de trombo aderente, fluxo peridispositivo, sinais de compressão da veia pulmonar superior esquerda ou da artéria circunflexa.
Foi mantida vigilância clínica aquando da realização dos ecocardiogramas ou quando necessário, tendo sido pesquisados eventos adversos como morte, AVC/AIT ou necessidade de cirurgia por complicação relacionada com o procedimento/dispositivo.
Análise estatísticaFoi realizada uma análise descritiva das variáveis numéricas, com cálculo do valor médio e desvio padrão, e das variáveis categóricas – que foram descritas quanto às frequências absolutas e relativas de cada categoria. As frequências relativas apresentam-se expressas em percentagem, arredondadas às décimas. A análise estatística foi realizada com recurso ao software SPSS versão 17.
ResultadosCaracterização da populaçãoO encerramento percutâneo do AAE foi conseguido em 22 dos 23 doentes inicialmente selecionados.
Estes apresentaram um score CHADS2 médio de 3,2 ± 0,9 e CHA2DS2-VASC de 4,7 ± 1,4. O score HAS-BLED era de 3,7 ± 1,3, sendo ≥ 3 em 81,8% dos doentes. A FA era permanente em 72,7%, persistente em 13,6% e paroxística em 13,6% dos doentes.
As características desta população apresentam-se na Tabela 1.
Caracterização da população submetida a encerramento percutâneo do AAE
| Característica | |
| Idade (anos) | 70 ± 9 |
| Sexo masculino, n (%) | 15 (68,2) |
| Tipo de FA, n (%) paroxística | 3 (13,6) |
| Persistente | 3 (13,6) |
| Permanente | 16 (72,7) |
| Score CHADS2 | 3,2 ± 0,9 |
| Risco CHADS2(%/ano) | 6,7 ± 2,2 |
| Score CHA2DS2-VASC | 4,7 ± 1,4 |
| Risco CHA2DS2-VASC (%/ano) | 6,2 ± 2,7 |
| Score HAS-BLED | 3,7 ± 1,3 |
| HAS-BLED ≥ 3, n (%) | 18 (81,8) |
Risco CHADS2: risco de AVC/AIT ao ano previsto com base no CHADS2; Risco CHA2DS2-VASC: risco de AVC/AIT ao ano previsto com base no CHA2DS2-VASC.
Em 12 doentes (54,5%), a seleção deveu-se a contraindicação à hipocoagulação oral por: anemia sideroblástica adquirida (1; 4,5%), antecedentes de hemorragia cerebral (2, 9,1%; um caso de hemorragia espontânea sob hipocoagulação oral e outro de traumatismo cranioencefálico), hemorragia grave sob hipocoagulação com varfarina (6; 27,3%), hemorragia grave sob antiagregação simples (3; 13,6%). Em 8 doentes (36,4%) a hipocoagulação oral não era exequível por INR lábil (4; 18,2%) ou por limitação na realização de controlos de INR e risco trombótico e hemorrágico elevado (4; 18,2%). Outros 2 doentes (9,1%) foram eleitos para o procedimento por falência da hipocoagulação oral, após AVC isquémico sob INR terapêutico e identificação de trombo no AAE.
Exequibilidade da técnicaDos 23 doentes selecionados, apenas em um não foi possível proceder ao encerramento percutâneo do AAE devido à presença de doença venosa difusa, que impossibilitou o acesso vascular, tendo sido verificada uma taxa de sucesso do procedimento de 95,7%.
A implantação do dispositivo foi conseguida com o primeiro dispositivo escolhido com exceção do um doente (95,4%), em que houve necessidade de substituição do dispositivo por um tamanho inferior, devido a sobredimensionamento inicial. Esta decorreu sem complicações. Em todos os casos em que foi implantado um dispositivo, foi obtido um resultado final adequado, tendo por base os critérios definidos, comprovado por ecocardiograma transesofágico com Doppler cor e fluoroscopia sob injeção de contraste imediatamente após a implantação.
Em 20 doentes (90,9%) foi utilizado o dispositivo ACP. Em 2 das implantações mais recentes foi utilizado o dispositivo WATCHMAN.
Na Tabela 2 apresentam-se as características técnicas do AAE, dispositivo e procedimento.
Características técnicas do AAE, dispositivo e procedimento
| AAE | |
| Área do AAE por ETE (cm2) | 4,7 ± 1,2 |
| Profundidade do AAE por ETE (mm) | 32,6 ± 8,3 |
| Óstium do AAE (mm) | |
| Medição por ETE | 20,4 ± 2,9 |
| Medição por fluoroscopia | 20,7 ± 2,7 |
| N.° lobos do AAE, n (%) | |
| 1 | 10 (45,4) |
| ≥ 2 | 12 (54,5) |
| Grau contraste espontâneo ≥ 3 no AAE, n (%) | 5 (22,7) |
| Hipocontratilidade do AAE, n (%) | 12 (54,5) |
| Técnica e dispositivo | |
| Doentes selecionados, n (%) | 23 (100) |
| Implantação de dispositivo, n (%) | 22 (95,7) |
| Sucesso na implantação, n (%) | |
| Por ETE | 22 (100) |
| Por fluoroscopia | 22 (100) |
| Tipo de dispositivo, n (%) | |
| ACP | 20 (90,1) |
| WATCHMAN | 2 (9,1) |
| Tamanho do dispositivo usado (mm) | |
| ACP | 22,8 ± 2,3 |
| WATCHMAN | 25,5 ± 2,1 |
| Substituição de dispositivo, n (%) | 1 (4,5) |
AAE: apêndice auricular esquerdo; ACP: Amplatzer Cardiac Plug; ETE: ecocardiograma transesofágico.
Durante as primeiras 24h após o procedimento, foram identificadas 2 hemorragias da orofaringe em relação com a entubação orotraqueal, que resolveram em poucas horas com medidas de tamponamento local. Foram também verificados 3 hematomas inguinais na dependência do local de punção venosa, um deles complicados com formação de pseudoaneurisma arterial femoral, todos eles resolvidos com medidas locais minimamente invasivas. Identificou-se ainda um derrame pericárdico ligeiro por ecocardiograma transtorácico, que se resolveu espontaneamente.
As principais complicações identificadas encontram-se resumidas na Tabela 3.
Complicações identificadas no período periprocedimento e durante o seguimento
| Complicação | n (%) | Dispositivo implantado | Identificação |
| Derrame pericárdico ligeiro | 1 (4,5) | ACP | Periprocedimento |
| Hematoma inguinal | 3 (13,6) | ACP | Periprocedimento |
| Pseudoaneurisma femoral | 1 (4,5) | ACP | Periprocedimento |
| Hemorragia da orofaringe | 2 (9,1) | ACP | Periprocedimento |
| Trombo aderente ao dispositivo | 1 (4,5) | ACP | 1.° mês |
Não foram verificadas outras complicações periprocedimento, nomeadamente deslocamento ou embolização do dispositivo, AVC/AIT, morte, necessidade de cirurgia por complicação do procedimento/dispositivo ou hemorragias graves com necessidade de transfusão.
MedicaçãoApós o encerramento percutâneo do AAE, a grande maioria dos doentes cumpriu o esquema terapêutico inicialmente proposto, de dupla antiagregação durante um mês seguida de antiagregação simples indefinidamente. Foram, contudo, realizadas adaptações individualizadas de acordo com complicações apresentadas por 4 doentes. Um deles ficou sem terapêutica antiagregante devido aos antecedentes de hemorragia grave, verificada sob anticoagulação oral, mas também sob antiagregação simples, acrescida de uma complicação vascular major periprocedimento – pseudoaneurisma femoral e hematoma significativo no local de punção vascular. Os 2 doentes com antecedentes de AVC embólico com documentação de trombo no AAE sob anticoagulação com varfarina e INR terapêutico, cumpriram dupla antiagregação durante um mês associada a dabigatrano 110mg 2id, tendo posteriormente mantido hipocoagulação oral. Noutro doente a dupla antiagregação foi substituída por enoxaparina subcutânea 1mg/kg de 12-12h ao fim do primeiro mês de dupla antiagregação, altura em que foi identificado um trombo aderente ao dispositivo ACP. A hipocoagulação com enoxaparina foi mantida durante 5 meses, até à resolução do trombo, tendo sido, então, retomada a antiagregação simples – decisão que se deveu aos seus antecedentes de hemorragia grave sob hipocoagulação oral com INR terapêutico.
Complicações durante o seguimentoNo ecocardiograma transesofágico de controlo realizado um mês após o encerramento percutâneo do AAE, foi identificado em um doente um trombo atapetando a face auricular do dispositivo ACP. Nessa altura, foi substituída a dupla antiagregação em curso por enoxaparina na dose de 1mg/kg de 12-12h. Foram também intensificados os controlos por ecocardiograma transesofágico: uma semana depois, documentando regressão ligeira do trombo, posteriormente com periodicidade mensal até aos 6 meses de seguimento, altura em que foi verificada regressão quase completa do trombo. Tendo em conta os antecedentes de hemorragia severa sob hipocoagulação oral com INR terapêutico, foi retomada antiagregação simples. Nessa altura foram realizados estudos de trombofilia e autoimune, que foram negativos. Três meses depois, o doente apresentou anemia subaguda sem perdas hemáticas evidentes, tendo sido feito um estudo no decurso do qual foi diagnosticada uma neoplasia do cólon submetida a cirurgia e a quimioterapia. No ecocardiograma transesofágico realizado 12 meses após a implantação do dispositivo não foi verificado trombo.
Foi apenas identificado um caso de fluxo peridispositivo, que, contudo, apresentava uma largura de jato de cor < 3mm (ligeiro de acordo com a classificação de Ostermayer e et al.26). Este foi visualizado no ETE do primeiro mês, realizado para seguimento de um dispositivo WATCHMAN.
Durante o seguimento realizado de 12 ± 8 meses, nenhum doente morreu e não se verificaram outras complicações ou eventos tromboembólicos.
DiscussãoOs dados apresentados demonstram a exequibilidade do encerramento percutâneo do AAE, já que foi conseguido com sucesso na grande maioria dos doentes em que foi tentado, devendo-se o único caso de insucesso a dificuldades de acesso vascular e não à técnica de implantação do dispositivo. A taxa de sucesso apresentada é idêntica à das principais séries publicadas de encerramento percutâneo do AAE (Tabela 4)19.
Principais resultados e complicações verificadas nas principais séries publicadas com os diferentes tipos de dispositivos de encerramento do AAE
| Ensaio Clínico | Ostermayer et al.26 | Park et al.21 | Sick et al.28 | Holmes et al.PROTECT-AF8 |
| Tipo de disp. | PLAATO | ACP | WATCHMAN | WATCHMAN |
| Critérios de inclusão | - FA não reumática ≥ 3 M duração- risco elevado de TE (≥ 1 na Europa ou ≥ 2 na A. Norte: DCA, critérios CHADS2 ou critérios de ETE*)- ACO contraindicada | - FA paroxística ou permanente- outros NE | - FA paroxística ou permanente- score CHADS2 ≥ 1- elegíveis para ACO | - idade > 18 anos- FA não valvular, paroxística, persistente ou permanente- score CHADS2 ≥ 1- elegíveis para ACO |
| Score CHADS2 | 2,5 ± 2,3 | NE | NE | NE |
| Disp. programados | 111 | 143 | 75 (1.°G: 16; 2.a G: 59) | 449 de 463 |
| Disp. implantados | 108 (97,3%) | 137 (95,8%) | 1.a G: 14/16 (87,5%)2.aG: 53/59 (89,8%) | 408 de 449 (grupo de intervenção) |
| Troca de disp. | NE | 23/137 (16.8%) | NE | NE |
| Sucesso da implantação | 108 (97,3%) | 132/137 (96%) | 1.a G: 13/14 (92,8%)2.a G: 53/53 (100%) | 408/449 (90,9%) |
| Embolização de disp. | 0 (0%) | 2/137 (1,4%) | 1.a G: 2/14 (14,3%)2.a G: 0/53 (0%) | 3/449 (0,7%) |
| Derrame pericárdico NT | 5 (4,5%) | 5/137 (3,6%) | 1.a G: 1/14 (7,1%)2.a G: 1/53 (1,9%) | 22/449 (4,9%) |
| Trombo aderente ao disp. | 1 (0,9%) | NE | 1.a G: 0/14 (0%)2.a G: 4/53 (7,5%) | NE |
| Medicação pós-proc. | - AAS 300-325mg id indef.- Clopidogrel 75mg id ao critério do investigador | - AAS 300-325mg id indef.- Clopidogrel 75mg id 1 a 3 M | - AAS (81-100mg id) indef.- Varfarina 45 d- últimos doentes: Clopidogrel 75mg id do 45.° d aos 6 M | -AAS (81-325mg id) indef.-Varfarina 45 d-Clopidogrel 75mg id do 45.° d aos 6 M |
| Tempo de Seguimento | 10 M | NE | 24 M | 18 M |
| AVC/AITAVC+AIT/ano-verificado-esperado CHADS2 | 2 (1,8%)/3 (2,7%)2,2%6,3% | 3(2,2%)/0(0%)NENE | 0 (0%)/2 (2,7%)NE1,9% AVC/ano | 15/694,6 (2,2%)NENE |
| Mortes: relação com proc.-Relacionada-Não relacionada | 0 (0%)6 (5,4%) | NENE | 0 (0%)2/75 (2,7%) | 2/463 (0,4%)19/463 (4,1%) |
| Cirurgia por complicação proc. | 1 (0,9%) | 0 (0%) | 1.a G: 1/14 (7,1%)2.a G: 0/53 (0%) | 8/449 (1,8%) |
AAS: ácido acetilsalicílico; ACO: anticoagulação oral; A. Norte: América do Norte; critérios de ETE*: velocidade de fluxo no AAE < 20cm/s ou presença de contraste espontâneo moderado a grave; DCA: doença coronária aterosclerótica (estenose significativa conhecida ou antecedentes de enfarte); disp.: dispositivo; FA: fibrilhação auricular; indef.: indefinidamente, M: meses; NE: não especificado; NT: necessidade de tratamento (pericardiocentese ou cirurgia; 1.a G: dispositivo de primeira geração; 2.a G: dispositivo de segunda geração.
A experiência recente com um segundo dispositivo pode ainda facilitar estes encerramentos, alargando a gama de diferentes dimensões disponíveis e disponibilizando dispositivos com conformação e técnicas diferentes, permitindo escolher aquele que melhor se poderá adaptar a cada AAE.
No que respeita à segurança da técnica, na nossa série apenas foram verificadas complicações ligeiras, resolvidas espontaneamente ou com recurso a tratamentos minimamente invasivos, sem consequências funcionais para os doentes.
A complicação mais frequentemente reportada no encerramento percutâneo do AAE tem sido o derrame pericárdico severo com compromisso hemodinâmico e necessidade de pericardiocentese evacuadora19, mas que nesta série não se verificou. Também não foram verificadas complicações reportadas em outras séries, como deslocamento ou migração do dispositivo, necessidade de cirurgia ou morte como complicação do procedimento (Tabela 4)19.
A mais preocupante das complicações identificadas foi um trombo aderente ao dispositivo, possivelmente relacionado com uma síndroma paraneoplásica, diagnosticado posteriormente. Não é ainda consensual o melhor protocolo antitrombótico para os doentes selecionados, já que a maioria tem contraindicação ou não tem condições para anticoagulação, não correspondendo aos doentes-tipo do estudo PROTECT AF, em que todos os doentes foram submetidos a anticoagulação com varfarina durante 45 d após encerramento do AAE. Contudo, os autores consideram que o protocolo de medicação e seguimento foi adequado, pois identificou precocemente a complicação trombótica verificada e permitiu realizar os ajustes terapêuticos necessários.
Neste estudo foram selecionados doentes com elevado risco hemorrágico, com um score HAS-BLED médio de 3,7±1,3, ≥ 3 em 81,8% dos doentes. Apesar disso, não foi verificada nenhuma hemorragia grave periprocedimento. Esta também não ocorreu durante o seguimento, considerando-se adequado o esquema de antiagregação implementado.
A maioria das complicações verificadas ocorreu em doentes que tinham implantado um dispositivo ACP, mas tal seria o esperado, já que este foi utilizado em 90,1% das implantações.
O único fluxo peridispositivo detetado foi de grau ligeiro, de acordo com a classificação de Ostermayer e et al.26. De acordo com dados recentemente publicados por Viles-Gonzalez e et al.27, que tiveram por base uma análise retrospetiva dos doentes do grupo de intervenção do PROTECT-AF, os fluxos peridispositivo não aumentam significativamente ao longo do tempo, não acrescem risco tromboembólico, nem apresentam significado prognóstico, resultados que foram independentes da severidade do fluxo ou de medicação prolongada com varfarina27.
A série apresentada incluiu doentes com um risco tromboembólico superior ao das principais séries publicadas19, traduzido por um score CHADS2 médio mais elevado (3,2±0,9), facto que se deveu aos critérios de seleção utilizados. A taxa de AVC/AIT verificada (0% em 12±8 meses) foi inferior ao risco médio esperado com base nos scores CHADS2 (6,8±2,2%/ano) e CHA2DS2-VASC (6,4±2,5%/ano), tal como verificado em múltiplas séries publicadas19.
ConclusõesEm doentes com FA e elevado risco tromboembólico e hemorrágico, o encerramento percutâneo do AAE foi exequível, mostrou ser uma técnica segura e eficaz, com uma taxa de AVC/AIT inferior à esperada com base nos scores CHADS2 e CHA2DS2-VASC. Este tratamento não farmacológico afirma-se, assim, como uma alternativa à anticoagulação oral para os doentes nos quais esta não é possível, indicada ou eficaz.
Responsabilidades éticasProteção dos seres humanos e animaisOs autores declaram que os procedimentos seguidos estavam de acordo com os regulamentos estabelecidos pelos responsáveis da Comissão de Investigação Clínica e Ética e de acordo com os da Associação Médica Mundial e da Declaração de Helsínquia.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos de seu centro de trabalho acerca da publicação dos dados de pacientes e que todos os pacientes incluídos no estudo receberam informações suficientes e deram o seu consentimento informado por escrito para participar nesse estudo.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
FinanciamentoNão financiado.
Política de privacidade, consentimento informado, proteção de dados e dos doentesTodos os doentes foram devidamente informados e assinaram um consentimento informado antes do procedimento. Os dados dos doentes não são, em nenhum momento deste trabalho, revelados.
Conflito de interessesOs autores declaram não haver conflito de interesses.