A fibrilhação auricular é uma arritmia frequente na prática clínica. Associa-se a morbilidade e a mortalidade elevadas, em virtude do seu potencial tromboembólico, o que confere especial relevância à profilaxia do tromboembolismo. Para este efeito, a varfarina tem sido a terapêutica de primeira linha, no entanto, associa-se a inúmeras limitações, que a tornam contraindicada ou sub-utilizada. A localização frequente no apêndice auricular esquerdo dos trombos formados na fibrilhação auricular conduziu a que o seu encerramento percutâneo fosse desenvolvido para profilaxia do tromboembolismo. Este artigo pretende fazer um enquadramento da evidência atual para o encerramento percutâneo do apêndice auricular esquerdo, através de uma revisão e atualização dos resultados dos inúmeros estudos realizados até ao momento.
Atrial fibrillation is a common arrhythmia in clinical practice. It is associated with high morbidity and mortality due to its thromboembolic potential, which makes thromboembolic prevention particularly important. Warfarin has been the first-line therapy for this purpose, but it has various limitations and is often contraindicated or underutilized. The fact that thrombi are frequently located in the left atrial appendage in atrial fibrillation led to the development of percutaneous closure for thromboembolic prevention. This article examines the current evidence on percutaneous closure of the left atrial appendage by reviewing the results of the numerous clinical trials on the technique.
A fibrilhação auricular (FA) é uma arritmia frequente. O seu potencial tromboembólico é a principal causa de morbilidade e mortalidade. A varfarina tem sido a terapêutica de primeira linha na sua prevenção. Apresenta, contudo, inúmeras contraindicações e limitações. Na FA, a formação de trombos ocorre mais frequentemente no apêndice auricular esquerdo (AAE), pelo que o seu encerramento tem sido considerado como uma alternativa à varfarina na prevenção do tromboembolismo.
O impacto da fibrilhação auricular no mundo atualA FA é a arritmia cardíaca mais comum na prática clínica. Em Portugal apresenta uma prevalência de 2,5% acima dos 40 anos, de acordo com os dados do estudo FAMA1. Na população em geral ela é identificada em 1-2%, aumentando com a idade, com tendência a um aumento significativo ao longo do tempo, prevendo-se que venha a duplicar nos próximos 50 anos2.
A importância do tromboembolismo na fibrilhação auricularA FA aumenta em cinco vezes o risco de acidente vascular cerebral (AVC) comparativamente com a população da mesma idade em ritmo sinusal2,3. Devido ao elevado tamanho dos trombos que estão na origem destes AVC, as suas consequências tendem a ser mais graves quando comparadas com outras fontes de embolismo cerebral2,4–6.
Profilaxia crónica com varfarinaA anticoagulação oral crónica com varfarina mantém-se como terapêutica de primeira linha para prevenção de eventos tromboembólicos na FA, estando indicada sempre que os scores CHADS2 ou CHA2DS2-VASC tenham pontuação superior ou igual a dois, devendo também ser considerada para o score de um2. A sua eficácia tem sido demonstrada em inúmeros ensaios clínicos randomizados para uma janela terapêutica de INR entre dois e três, com uma redução de risco relativo de AVC que varia entre 60 a 73% nos diferentes estudos2,4–9. Encontra-se estabelecida a sua superioridade relativamente ao ácido acetilsalicílico (AAS), que demonstrou uma redução de 20% destes eventos2,7, à combinação de AAS com clopidogrel ou de antiagregação simples com uma dose inferior de varfarina2,10,11.
Contudo, a varfarina encontra-se contraindicada em 14-44% dos doentes em risco de AVC12. Mesmo nos doentes considerados elegíveis, apenas 54% se encontram hipocoagulados4,5. Para tal, contribuem inúmeros fatores, sendo o risco de hemorragia o principal responsável pelo receio da sua utilização. A par deste, uma janela terapêutica reduzida e uma farmacocinética sensível a inúmeros fármacos e alimentos, conduz à necessidade de monitorização laboratorial frequente e de colaboração do doente. Também o risco de traumatismos, as barreiras geográficas à monitorização do INR, a insegurança do clínico ou mesmo a preferência do doente põem em causa a exequibilidade deste tratamento4. Por todos estes fatores, a hipocoagulação é frequentemente inadequada, com valores de INR dentro da janela terapêutica em apenas de 50 a 68% das monitorizações9.
Novos anticoagulantes oraisTêm sido procurados novos anticoagulantes como alternativa à varfarina para prevenção de eventos tromboembólicos na FA. Estes dividem-se em 2 classes principais: os inibidores diretos da trombina (ex. dabigatrano) e os inibidores do fator Xa (ex. rivaroxaban, apixaban, edoxaban, betrixaban). De uma forma genérica, todos apresentam vantagens, tais como, uma janela terapêutica mais alargada, menos interferências com a alimentação e a não necessidade de controlo laboratorial2. Destes apenas o dabigatrano (estudo RE-LY13), o rivaroxaban (ROCKET-AF14) e o apixaban (ARISTOTLE15) demonstraram já a sua não inferioridade comparativamente com a varfarina na prevenção de eventos tromboembólicos na FA, e apenas os 2 primeiros se encontram aprovados pela US Food and Drug Administration (FDA) para este fim16. O dabigatrano foi considerado na última atualização das Guidelines de FA da Sociedade Europeia de Cardiologia como alternativa à varfarina em doentes de elevado risco embólico, sempre que esta se encontre contraindicada ou não seja exequível2. Também a última revisão das Guidelines da Sociedade Canadiana de Cardiologia recomendou a utilização de dabigatrano preferencialmente à varfarina em doentes com FA e indicação para anticoagulação oral17.
Estes fármacos apresentam, contudo, elevados custos para uma terapêutica crónica, associam-se a um risco hemorrágico não desprezível e não têm um antídoto estabelecido, o que constitui uma barreira à sua utilização em muitos doentes. Nos diferentes estudos publicados, tem sido também verificada, com os novos anticoagulantes orais, uma taxa de descontinuação terapêutica não menosprezável, maioritariamente por intolerância/efeitos adversos, que no ARISTOTLE15 correspondeu a 25,3% dos doentes sob apixaban (versus 27,5% para varfarina), chegando mesmo a ser superior à verificada para a varfarina nos estudos RE-LY13 (21% para dabigatrano versus 17%) e ROCKET-AF14 (23,7% para rivaroxaban versus 22,2%).
A importância do apêndice auricular esquerdo no tromboembolismoO AAE é um remanescente embrionário da aurícula esquerda (AE) constituído por um corpo longo, tubular, com paredes finas (podem ter apenas 1mm de espessura), geralmente multilobulado e trabeculado, que comunica com a AE através de um orifício oval18,19. Este está associado classicamente a um papel de regulação do volume corporal através de diferentes mecanismos fisiológicos, como a produção de 30% do peptídeo natriurético auricular, a regulação da sede, a modulação da relação volume e pressão, melhorando a compliance da AE e consequentemente o débito cardíaco20–22.
O AAE é o local mais frequente de formação de trombos intracardíacos na FA (98%), facto que tem sido verificado em inúmeros estudos com base em autópsias, ecocardiograma transesofágico (ETE) ou por inspeção direta intra-operatória11,12,18,19, sendo esta localização mais frequente na FA não valvular (90%) do que na FA valvular (57%)12,18,19, e em doentes com antecedentes de AVC isquémico, comparativamente àqueles que nunca o sofreram20.
Perante estas evidências a «exclusão» do AAE da circulação surgiu como uma alternativa não farmacológica à anticoagulação para prevenção de tromboembolismo na FA, tendo sido desenvolvidas diferentes abordagens de maior ou menor grau de invasividade12,13.
A exclusão cirúrgica do apêndice auricular esquerdoA primeira tentativa de remoção cirúrgica do AAE foi descrita nos anos 30 durante a cirurgia valvular mitral5. O estudo LAAOS23 foi o primeiro estudo randomizado na área da oclusão cirúrgica do AAE. Incluiu doentes candidatos a cirurgia de revascularização do miocárdio considerados em risco de FA ou AVC isquémico, tendo concluído que a exclusão cirúrgica do AAE era segura e não aumentava o tempo cirúrgico ou complicações hemorrágicas perioperatórias23.
A oclusão cirúrgica do AAE começou então a ser realizada em vários centros mas verificou-se que era frequentemente incompleta, com uma taxa de sucesso muito variável nas diferentes séries (dos 10,3 aos 60%22) condicionada por técnicas cirúrgicas muito diversificadas, pouca experiência cirúrgica em cada série e diferentes critérios de sucesso.
Kanderian et al.22 realizaram uma avaliação retrospetiva dos ETE realizados após exclusão cirúrgica do AAE, o que até então não era procedimento de rotina. Encontraram uma taxa de insucesso superior à verificada nas séries mais pequenas, que não tinham sido tão exigentes quanto aos critérios de encerramento. Concluíram que a técnica cirúrgica mais eficaz era a excisão do AAE, e que a oclusão incompleta aumentava a estase e a propensão à formação de trombo, e recomendaram a descontinuação da varfarina somente após a confirmação de oclusão completa por ETE22.
A oclusão do AAE por cirurgia aberta foi ainda experimentada por via epicárdica utilizando o sistema Atriclip Atricure (Cincinnati, OH, Estados Unidos) em doentes com FA aquando de uma cirurgia de revascularização do miocárdio ou de substituição valvular, tendo-se verificado uma taxa de sucesso na oclusão de 100% aos três meses13. A abordagem epicárdica por toracoscopia foi também utilizada para oclusão do AAE numa série de 15 doentes com FA somente para profilaxia de TE, e em muitas outras pequenas séries, aquando da ablação de FA24. Esta abordagem associou-se a complicações adicionais, como pneumotórax ou necessidade de conversão em cirurgia aberta por complicações hemorrágicas, aderências ou outras24.
Devido ao caráter invasivo da oclusão cirúrgica do AAE, esta apenas tem sido realizada aquando de cirurgia cardíaca por outro motivo. Atualmente é utilizada como parte do procedimento de MAZE5,22 e encontra-se recomendada pela American Heart Association e pelo American College of Cardiology aquando da cirurgia valvular mitral25.
A oclusão do apêndice auricular esquerdo por técnicas minimamente invasivasTendo em conta o carácter invasivo da oclusão cirúrgica do AAE, foram desenvolvidos dispositivos de encerramento do AAE e técnicas minimamente invasivas.
Neste contexto, surgiram técnicas mistas, associando as vias epi e endocárdica. Para este efeito foi já aprovado pela FDA o sistema LARIAT® (SentreHeart, Palo Alto, CA, Estados Unidos) que combina um sistema epicárdico de entrega de sutura em forma de laço através de um cateter de pequeno calibre, e um cateter balão conduzido por via endocárdica através de um fio guia magnético, que ajuda na orientação e no posicionamento da sutura em redor da base do AAE. Este sistema foi avaliado em doentes com FA aquando de cirurgia valvular mitral ou ablação de FA, tendo sido demonstrada a exequibilidade da técnica26.
Têm também sido desenvolvidas técnicas de encerramento percutâneo do AAE por via exclusivamente endocárdica.
A oclusão endocárdica percutânea do apêndice auricular esquerdoO encerramento do AAE por via endocárdica percutânea é realizado com recurso a um dispositivo libertado por um catéter percutâneo introduzido por via venosa femoral e conduzido ao AAE através de punção transseptal. A implantação do dispositivo é guiada por fluoroscopia e/ou ETE. O procedimento é feito sob administração endovenosa de bólus de heparina, de modo a atingir um tempo de tromboplastina parcial activado de pelo menos 250 s20,27,28.
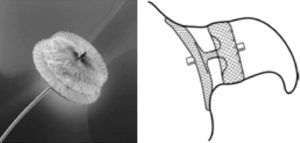
O dispositivo Percutaneous Left Atrial Appendage Transcatheter OcclusionO primeiro dispositivo a ser desenhado e utilizado para este fim foi o sistema Percutaneous Left Atrial Appendage Transcatheter Occlusion (PLAATO, eV3, Inc., Plymouth, MN, Estados Unidos)27. Era constituído por uma estrutura autoexpansível de nitinol revestida por uma membrana de politetrafluoroetileno, a qual ocluía o fluxo para o AAE ao mesmo tempo que ia sendo re-epitelizada. O sistema possuía ainda três linhas de âncoras que fixavam a estrutura ao nível do orifício do AAE (Figura 1)27.
Dispositivo PLAATO (eV3,Inc., Plymouth, MN, Estados Unidos). Adaptado de: Sievert et al27. AAE: apêndice auricular esquerdo; AE: aurícula esquerda.
O primeiro ensaio clínico em humanos foi conduzido na Europa por Sievert et al27. Incluiu 15 doentes com FA permanente não reumática, risco elevado de tromboembolismo (critérios CHADS2 ou contraste espontâneo no AAE) e contraindicação à varfarina. A implantação do dispositivo foi bem sucedida em todos os doentes, sem evidência de shunt residual, trombo peridispositivo, deslocamento do mesmo ou fenómenos tromboembólicos após um mês de seguimento. A única complicação verificada foi um derrame pericárdico que resolveu com pericardiocentese27. Na Tabela 3 apresentam-se os detalhes mais importantes dos principais ensaios clínicos publicados com o dispositivo PLAATO.
Principais características e resultados dos principais ensaios clínicos realizados com o dispositivo PLAATO (eV3,Inc., Plymouth, MN, Estados Unidos)
| Ensaio clínico | Sievert et al.27 | Ostermayer et al.28 | Park et al.29 | Block et al.30 |
| Desenho | Prospetivo um centro Europa | Prospetivo 5 centros Europa + A. Norte | Prospetivo um centro Europa | Prospetivo 10 centros A.Norte |
| Ano de publicação | 2002 | 2005 | 2009 | 2009 |
| D. amostra (n) | 15 | 111 | 73 | 64 |
| Critérios de inclusão | -FA permanente não reumática-Risco elevado de TE (≥ 1: critérios CHADS2 ou auto-contraste no AAE)-ACO contraindicada | -FA não reumática ≥ 3M duração-risco elevado de TE (≥1 na Europa ou ≥ 2 na A.Norte: DCA, critérios CHADS2 ou critérios de ETE*)-ACO contraindicada | -FA reumática ou não, paroxística ou permanente-ACO recusada/contraindicada ou AVC embólico sob ACO | -FA não valvular, permanente ou paroxística-Score CHADS2 ≥2-ACO contraindicada |
| Score CHADS2 | NE | 2,5±2,3 | 2,5±1,4 | 2,6 |
| Medicação Pós-proc. | -AAS 300mg id indef.-Clopiogrel 75mg id 6M | -AAS 300-325mg id indef.-Clopidogrel 75mg id A. Norte – 1,5M; Europa – critério do investigador-Profilaxia endocardite: 6M na A. Norte | -AAS 100mg id indef.-Clopidogrel 75mg id 6M | -AAS 325mg id indef.-Clopidogrel 75mg id1-1,5M |
| Troca de disp. | 4 (26,7%) | NE | 9 (12,3%) | 1(1,6%) |
| Sucesso na implantação | 15 (100%) | 108 (97,3%) | 71 (97,3%) | 61 (93,85%) |
| Tempo proc. | 90’ | 68’ | NE | NE |
| Seguimento | ||||
| -tipo-duração | -ETE e Rd. Tórax1 M | 10 M | -ETE (3-6M)-Entrevista aos 24 M24 M | -ETE: 1, 6M: 20 Dts-ETT: outros-Entrevista, análises e Rd.Tórax: 1, 3, 6, 12,24, 36, 48, 60 M3,75 anos |
| AVC/AIT | 0 (0%)/0 (0%) | 2 (1,8%)/3 (2,7%) | 1 (1,4%)/0 (0%) | 8 (12,5%)/1 (1,6%) |
| AVC+AIT/ano | ||||
| -verificado-esperado (CHADS2) | NENE | 2,2%6,3% | 1,4%5,0% | 3,8%6,6% |
| Embolização de disp. | 0 (0%) | 0 (0%) | 1 (1,4%) | 0 (0%) |
| Derrame pericárdicoNT | 1 (6,7%) | 5 (4,5%) | 0 (0%) | 1 (1,6%) |
| Relação: Morte/Proc. | ||||
| -Relacionada-Sem relação | 0 (0%)0 (0%) | 0 (0%)6 (5,4%) | 1 (1,4%)10 (13,7%) | 0 (0%)17 (26,6%) |
| Trombo aderente disp. | 0 (0%) | 1 (0,9%) | 0 (0%) | 0 (0%) |
| Cirurgia por complicação proc. | 0 (0%) | 1 (0,9%) | 1 (1,4%) | 1 (1,6%) |
AAE: apêndice auricular esquerdo; AAS: ácido acetilsalicílco; ACO: anticoagulação oral; A. Norte: América do Norte; critérios de ETE*: velocidade de fluxo no AAE <20cm/s ou presença de contraste espontâneo moderado a severo; D.amostra: dimensão da amostra; DCA: doença coronária aterosclerótica (estenose significativa conhecida ou antecedentes de enfarte); disp.: dispositivo; Dts: doentes; ETE: ecocardiograma transesofágico; ETT: ecocardiograma transtorácico; FA: fibrilhação auricular; indef.: indefinidamente; M: meses; NE: não especificado; NT: necessidade de tratamento (pericardiocentese ou cirurgia); Rd.: radiografia; Tempo proc.: duração média do procedimento.
Seguiu-se um estudo prospetivo multicêntrico internacional desenvolvido por Ostermayer et al.28, que incluiu resultados de múltiplos centros da Europa e da América do Norte, tendo sido o maior realizado com o dispositivo PLAATO.
Foram incluídos 111 doentes com FA não reumática com pelo menos três meses de duração, contraindicação à terapêutica com varfarina e risco elevado de tromboembolismo (antecedentes de estenose coronária significativa ou enfarte, critérios CHADS2 ou critérios ecocardiográficos: velocidade de fluxo no AAE < 20cm/s ou contraste espontâneo de moderado a grave). Foi o primeiro estudo a utilizar uma classificação angiográfica para avaliar o sucesso da oclusão (Tabela 1), o qual era adicionalmente avaliado por ETE com Doppler cor e quantificado através de uma escala (Tabela 2).
Classificação angiográfica do encerramento do AAE. O sucesso na oclusão era determinado por um grau de oclusão ≥ 3
| Grau de oclusão/tipo de leak | Fluxo por angiografia |
| Grau 1: grave | Enche todo o AAE |
| Grau 2: moderado | Enche ≤ 2/3 do AAE |
| Grau 3: ligeiro | Enche ≤ 1/3 do AAE |
| Grau 4: traço ou ausente | Blush ligeiro ou indetetável |
AAE – apêndice auricular esquerdo.
Adaptado de Ostermermayer et al28.
Classificação ecocardiográfica por Doppler cor do encerramento do AAE. O sucesso na oclusão era determinado por um grau de oclusão ≥ 3
| Grau de oclusão/tipo de leak | Fluxo por Doppler cor |
| Grau 1: grave | Múltiplos jatos ou fluxo livre |
| Grau 2: moderado | Jato com >3mm de diâmetro |
| Grau 3: ligeiro | Jato com 1-3mm de diâmetro |
| Grau 4: traço de leak | Jato com < 1mm de diâmetro |
| Grau 5: ausência de leak | Ausência de jato |
Adaptado de Ostermermayer et al28.
A oclusão foi bem-sucedida em 97,3% dos casos (108/111). Durante um seguimento médio de 10 meses, a taxa de AVC foi de 2,2%. Estes eventos ocorreram entre os 6-7 meses pós-procedimento, em contexto de posicionamento adequado do dispositivo, ausência de shunt significativo ou de trombo aderente. Os autores consideraram esta taxa três vezes inferior à que seria prevista com base no score CHADS2 médio de 2,5 (risco estimado de AVC de 6,5%/ano).
Verificaram-se derrames pericárdicos em cinco doentes de entre os primeiros dos vários centros, que foram atribuídos à inexperiência inicial. Um deles necessitou de abordagem cirúrgica e acabou por falecer por complicação pós-operatória. Não foram identificadas outras complicações de relevo, nomeadamente deslocamentos/migração do dispositivo (Tabela 3)28.
A maior série de encerramento percutâneo do AAE com o dispositivo PLAATO decorreu num único centro alemão (Park et al.)29. A oclusão do AAE foi realizada em 71 doentes com FA (reumática ou não, na maioria permanente, mas em oito casos paroxística) com contraindicação à anticoagulação oral ou com antecedentes de AVC sob terapêutica anticoagulante.
A oclusão foi bem-sucedida em 97,3% dos doentes. O seguimento foi mantido durante 24 meses, tendo-se verificado um AVC minor (1,4%), taxa inferior à esperada de 5% (com base num score CHADS2 médio de 2,5). Foi ainda verificada uma embolização do PLAATO com oclusão do trato de saída do ventrículo esquerdo, que resultou na morte do doente, e um caso de instabilidade do dispositivo com necessidade de cirurgia aberta para sua remoção.
Durante o tempo de seguimento foram reportadas 10 mortes (7%), mas apenas a já referida foi atribuída ao procedimento ou à técnica. Ocorreu um derrame pericárdico resolvido sem pericardiocentese (Tabela 3)29.
Outro ensaio clínico prospectivo não randomizado e multicêntrico decorreu na América do Norte (Block et al.)30. Incluiu 64 doentes com FA não valvular (permanente ou paroxística), não candidatos a terapêutica crónica com varfarina e com score CHADS2 superior ou igual a dois.
O procedimento foi bem-sucedido em 93,8% dos doentes.
O seguimento médio foi de 3,75 anos, tendo chegado até aos cinco anos em alguns casos.
Foi reportada uma taxa de AVC de 3,8%: 5 major, ocorridos entre 7-53 meses, e 3 minor, entre 8-23 meses. Ocorreu um acidente vascular transitório (AIT). A taxa total de AVC/AIT foi de 3,8% - segundo os autores quase metade do esperado com base no score CHADS2 médio de 2,6 (6,6%).
Ocorreram duas mortes: uma por hemorragia cerebral, outra por complicação de cirurgia não relacionada com o dispositivo ou com a técnica de encerramento. A única complicação atribuída ao encerramento percutâneo do AAE foi um derrame pericárdico com necessidade de cirurgia (Tabela 3)30.
Outras séries mais pequenas de múltiplos centros foram publicadas, todas elas concluindo eficácia do PLAATO na prevenção do AVC na FA. Contudo, este dispositivo acabou por ser retirado do mercado pelo fabricante.
Os dispositivos AmplatzerO segundo dispositivo a ser utilizado para encerramento percutâneo do AAE foi o Amplatzer septal occluder (St. Jude Medical, Plymouth, MN, Estados Unidos) previamente utilizado para encerramento de defeitos do septo interauricular. Foi testado numa série de 16 doentes de quatro centros em 2002 por Meier et al., tendo tido como única complicação uma embolização do dispositivo por tamanho inadequado31. Este não voltou a ser utilizado para este fim, tendo sido desenvolvido um dispositivo dedicado para o encerramento do AAE: o Amplatzer Cardiac Plug (ACP; St. Jude Medical, Plymouth, MN, Estados Unidos)32, que consiste numa estrutura autoexpansível de nitilol com patch de poliéster, constituída por um lobo e um disco unidos por uma barra central. O lobo apresenta ganchos responsáveis pela sua fixação e estabilização, enquanto o disco se destina a selar o orifício do AAE (Figura 2). Encontra-se disponível em oito tamanhos diferentes com base nas dimensões do lobo (16 a 30mm, com diferença de 2mm entre cada tamanho)32.
Dispositivo ACP (St. Jude Medical, Plymouth, MN, Estados Unidos). Adaptado de: Park et al32.
O ACP começou a ser utilizado em inúmeros centros. No seguimento das preocupações com a segurança dos dispositivos, Park tomou a iniciativa de compilar a experiência dos vários centros para avaliar o perfil de segurança do novo ACP32. Avaliou retrospetivamente as implantações decorridas desde o início da sua utilização, em dezembro de 2008, até novembro de 2009, reunindo um total de 143 doentes com FA de 10 centros europeus. Em todos os casos a varfarina foi interrompida antes da implantação do AC, tendo sido mantida dupla anti-agregação durante um a três meses, seguida de antiagregação simples indefinidamente (Tabela 4).
Principais características e resultados dos principais ensaios clínicos realizados com dispositivos AMPLATZER (St. Jude Medical, Plymouth, MN, Estados Unidos) e WATCHMAN (Boston Scientific, Plymouth, MN, Estados Unidos)
| Ensaio clínico | Meier et al.31 | Park et al.32 | Sick et al.20 | Holmes et al. PROTECT-AF8 |
| Tipo de disp. | ASO | ACP | WATCHMAN | WATCHMAN |
| Desenho do ensaio clínico | Prospetivo4 centrosEuropa e A. Norte | Retrospetivo10 centrosEuropa | Prospetivo7 centrosEuropa e A. Norte | ProspetivoRandom., control.59 centrosEuropa + EE. UU. |
| Ano de publicação | 2003 | 2009 | 2007 | 2009 |
| Critérios de inclusão | -FA paroxística ou permanente-Outros NE | -FA paroxística ou permanente-Outros NE | -FA paroxística ou permanente-Score CHADS2 ≥ 1-Elegíveis para ACO | -Idade > 18 anos-FA não valvular, paroxística, persistente ou permanente-Score CHADS2 ≥ 1-Elegíveis para ACO |
| Score CHADS2 | NE | NE | NE | NE |
| Disp. programados | 16 | 143 | 75 (1.ªG: 16; 2.ªG: 59) | 449 de 463 |
| Disp. implantados | 16 (100%) | 137 (95,8%) | 1.ªG: 14/16 (87,5%)2.ªG: 53/59 (89,8%) | 408 de 449(grupo de intervenção) |
| Troca de disp. | 0 (0%) | 23/137 (16,8%) | NE | NE |
| Sucesso da implantação | 15 (93,8%) | 132/137 (96%) | 1.ªG: 13/14 (92,8%)2.ªG: 53/53 (100%) | 408/449 (90,9%) |
| Tempo proc. (min) | NE | NE | NE | NE |
| Embolização de disp. | 1 (6,2%) | 2/137 (1,4%) | 1.ªG: 2/14 (14,3%)2.ªG: 0/53 (0%) | 3/449 (0,7%) |
| Derrame pericárdico NT | 0 (0%) | 5/137 (3,6%) | 1.ªG: 1/14 (7,1%)2.ªG: 1/53 (1,9%) | 22/449 (4,9%) |
| Trombo aderente ao disp. | 0 (0%) | NE | 1.ªG: 0/14 (0%)2.ªG: 4/53 (7,5%) | NE |
| Medicação pós-proc. | -1 centro: Varfarina 6 semanas | NE | -AAS (81-100mg id) indef.-Varfarina 45 d-Últimos doentes: Clopidogrel 75mg id do 45.° d aos 6 M | -AAS (81-325mg id) indef.-Varfarina 45 d-Clopidogrel 75mg id do 45.° d aos 6 M |
| Seguimento | ||||
| -tipo-duração | ETE4 M | NENE | -ETE: 45.° d, 6M, depois anual até aos 5 anos24 M | -ETE: 45.° d-Av. clínica: 45.° d, 6, 9, 12 M, depois 2/ano-Ex. neurológico: início, 6, 9,12 M, depois 2/ano18 M |
| AVC/AIT | 0 (0%) | 3(2,2%)/0(0%) | 0 (0%)/2 (2,7%) | 15/694,6 (2,2%)/NE |
| AVC+AIT/ano | ||||
| -verificado-esperado CHADS2 | 0 (0%)NE | NENE | NE1,9% AVC/ano | NENE |
| Mortes: relação com proc. | ||||
| -Relacionada-Não relacionada | 0 (0%)0 (0%) | NENE | 0 (0%)2/75 (2,7%) | 2/463 (0,4%)19/463 (4,1%) |
| Cirurgia por complicação proc. | 1 (6,2%) | 0 (0%) | 1.ªG: 1/14 (7,1%)2.ªG: 0/53 (0%) | 8/449 (1,8%) |
ACO: anticoagulação oral; A. Norte: América do Norte; ASO: Amplatzer Septal Occluder; disp.: dispositivo; EUA: Estados Unidos da América; FA: fibrilhação auricukar; indef.: indefinidamente; M: meses; NE: não especificado; NT: necessidade de tratamento (pericardiocentese ou cirurgia); Tempo proc.: duração média do procedimento; 1.aG: dispositivo de primeira geração; 2.aG: dispositivo de segunda geração.
Este registo não pretendeu avaliar as indicações do encerramento do AAE ou a eficácia do procedimento, mas sim sua exequibilidade e segurança do ACP nas primeiras 24h após a sua implantação. Esta foi bem sucedida em 96% dos doentes, não tendo sido conseguida nos restantes por embolização do dispositivo (2 doentes) ou por condições anatómicas desfavoráveis (3 doentes)31. Houve necessidade de mudança de dispositivo em 17% dos casos.
Verificaram-se complicações graves em 10 doentes (7%): três por AVC por embolização de ar ou trombo intracardíaco; dois embolizações do ACP, que foi recapturado por via percutânea, sem sequelas; e cinco derrames pericárdicos necessitando de pericardiocentese. Complicações menos importantes foram também observadas, como quatro derrames pericárdicos ligeiros, isquémia miocárdica transitória por embolização de ar em quatro doentes, e uma perda do dispositivo no sistema venoso - eficazmente removido por via percutânea (Tabela 4).
Os autores concluíram que o ACP era passível de uma implantação bem-sucedida num número ligeiramente superior ao verificado no PROTECT AF8, com uma taxa de eventos adversos não muito diferente. Também salientaram a importância da curva de aprendizagem na diminuição das complicações relacionadas com o procedimento. A distensibilidade do AAE em adaptação às condições de pressão foi referida como a principal responsável pelo dimensionamento inadequado do dispositivo. Também consideraram o ACP um dispositivo mais flexível, que se adaptaria melhor à conformação oval do orifício do AAE. Uma causa identificada de derrame pericárdico foi a perfuração do AAE, tendo sido chamada a atenção para a sua reduzida espessura. Como causa de AVC periprocedimento foi referida a embolização de ar e a presença de pequenos trombos no AAE situados dentro de lobos completamente contraídos, não visualizáveis no ETE, sugerindo múltiplas injeções de contraste para os identificar. A incidência de AVC periprocedimento foi de 2%32.
Neste trabalho de Park et al. não foi feita referência à formação de trombo aderente ao ACP. Contudo, foram posteriormente reportados alguns casos de trombo aderente ao ACP, como um doente com FA permanente, score CHADS2 de 2 e contraindicação à hipocoagulação oral, com encerramento percutâneo do AAE bem-sucedido, mantido sob clopidogrel durante um mês, e indicação para AAS indefinidamente. No ETE realizado ao terceiro mês de seguimento foi identificado um trombo aderente ao dispositivo, que resolveu sob enoxaparina 60mg 2id associada a AAS, que o doente manteve posteriormente33. Outro caso publicado num doente com FA permanente, score CHADS2 de 6 e contraindicação a hipocoagulação oral crónica por hematúrias recorrentes, submetido a encerramento percutâneo do AAE com ACP, que foi bem-sucedido, tendo ficado medicado com AAS e clopidogrel. O ETE realizado ao sexto mês de seguimento identificou um trombo aderente ao dispositivo, tendo o doente sido medicado com heparina EV. Contudo, só se verificou diminuição do trombo após três semanas, tendo sido iniciada hipocoagulação oral, que teve posteriormente de ser suspensa por hematúria, sem terem sido identificados eventos tromboembólicos34.
Perante a preocupação crescente com esta complicação, o fabricante (na altura ainda a AGA Medical) emitiu, em janeiro de 2011, após investigação dos casos, um comunicado a todos os centros intervenientes na implantação de ACP com uma atualização das instruções do procedimento. Nesse documento foi referida como causa mais provável para a formação de trombos adjacentes ao dispositivo uma implantação demasiado profunda no AAE, tendo sido salientada a importância da medição em profundidade do local correto à implantação do ACP. Foi também referido que a adequação da anticoagulação/antiagregação poderia ser um fator importante na formação de trombo, recomendando medicação após o procedimento com aspirina durante seis meses (ficando ao critério do clínico a decisão de a manter posteriormente); recomendava ainda que clopidogrel ou outro antiagregante se encontra indicado e que a sua prescrição deve seguir as «normas padrão»35.
Em abril de 2011 Plicht et al. apresentaram uma série em que foi avaliada a formação de trombo aderente ao dispositivo ACP nos 31 doentes em que este foi implantado. Após a intervenção estes foram medicados de acordo com o indicado pelo fabricante e realizaram ETE antes da alta e aos três e seis meses de seguimento. Foi identificado trombo aderente ao dispositivo em três doentes no ETE pré-alta e noutros três no ETE aos três meses. Em três desses doentes o trombo resolveu sob heparina EV durante uma semana, mas noutros três houve necessidade de iniciar anticoagulação oral durante mais três meses, sendo que um deles ainda mantinha trombo à data da publicação. Os autores não encontraram diferenças significativas entre o local de implantação do ACP nos doentes com e sem formação de trombo, tendo considerado que na sua série a formação de trombo aderente não se parecia relacionar com uma implantação profunda do dispositivo36.
Em maio de 2012 foi publicada a experiência de um centro suíço por Guérios et al37. Esta procurou avaliar a segurança e a eficácia a curto prazo da implantação do ACP em doentes com FA não valvular, paroxística ou permanente, com pelo menos um fator de risco para eventos tromboembólicos e contraindicação ou aversão a hipocoagulação oral crónica. O procedimento foi guiado apenas por angiografia. Após a implantação os doentes foram medicados com clopidogrel durante um mês e AAS durante 3-4 meses, ou indefinidamente se antecedentes de doença coronária significativa. Foi realizado ETE pré-alta e entre três a seis meses de seguimento. O procedimento foi bem-sucedido em 85 dos 86 casos em que foi tentado (99%). O caso de insucesso foi atribuído à dificuldade acrescida ocasionada pelo encerramento prévio de um foramen ovale patente com um Amplatzer Septal Occluder, com múltiplas tentativas de implantação a originarem tamponamento pericárdico, que resolveu com pericardiocentese. Nos restantes 85 doentes foram implantados 87 dispositivos, sendo que 81 foram conseguidos com o primeiro dispositivo escolhido e quatro necessitaram de substituição do dispositivo. Em dois casos o encerramento foi incompleto, tendo sido utilizado um ACP adicional num dos casos, e um Amplatzer vascular Plug (St. Jude Medical, Plymouth, MN, Estados Unidos) noutro, com bom resultado final.
Em 48 doentes (55,8%) a implantação do ACP foi combinada com outra técnica, como encerramento do septo interauricular, angioplastia coronária ou implantação percutânea de prótese valvular aórtica.
Foi verificada uma embolização de ACP, 15 min após a sua implantação, durante uma angioplastia, tendo sido removido o dispositivo, que foi substituído por um ACP menor. No período periprocedimento foi ainda identificado um derrame pericárdico sem compromisso hemodinâmico, dois eventos cerebrais isquémicos (um por embolização de ar, outro possivelmente tromboembólico) e uma morte 6 d após a implantação por hemorragia de tumor gastrointestinal. Dos restantes doentes apenas em 69 foi conseguido o seguimento, realizado durante 25,9 anos/doente, tendo sido verificadas duas mortes, uma não cardiovascular (por broncopneumonia) e outra cardiovascular em doente com doença coronária de três vasos. Não foram observados eventos embólicos adicionais ou fluxos peridispositivo, mas foram identificados trombos imóveis em seis doentes, que resolveram com três meses de anticoagulação; em quatro doentes não se conseguiu excluir a presença de trombo, tendo sido iniciada varfarina durante quatro meses num doente, sem modificação da imagem ecocardiográfica, e mantido ácido AAS indefinidamente nos outros três. Após revisão dos resultados, os autores concluíram que em 70% dos casos associados a trombo o ACP tinha sido implantado numa posição mais profunda do que o desejável.
Com vista a avaliar a eficácia deste dispositivo, encontra-se a decorrer o estudo ACP, prospetivo e randomizado, que compara o ACP com a varfarina em doentes sem contraindicação à mesma, com FA e score CHADS2 superior ou igual a 238.
O dispositivo WATCHMANO dispositivo WATCHMAN (Boston Scientific, Plymouth, MN, Estados Unidos) foi desenhado especificamente para o encerramento percutâneo do AAE. Consiste numa estrutura de nitinol autoexpansível com filamentos de fixação e coberta por uma membrana de poliéster apenas na porção exposta à AE (Figura 3). Encontra-se disponível nos diâmetros de 21, 24, 27, 30 e 33mm, que deverá ser superior ao orifício em 10-20%20.
Dispositivo WATCMAN (Boston Scientific, Plymouth, MN, Estados Unidos). Adaptado de Fountain et al9.
O primeiro ensaio clínico com este dispositivo foi conduzido por Sick et al. com o objetivo de avaliar a sua exequibilidade no encerramento do AAE20. Incluiu prospetivamente 75 doentes de múltiplos centros da Europa e da América do Norte com antecedentes de FA (paroxística ou permanente) e score CHADS2 superior ou igual a um, sem contraindicação à hipocoagulação oral.
Após a implantação os doentes mantinham varfarina durante 45 d. À alta eram também medicados com AAS diário (81-100mg), que mantinham indefinidamente. Aos 45 d realizavam ETE de controlo. Se o AAE se encontrasse devidamente encerrado (critérios: fluxo ausente ou com jacto inferior a 3mm em torno do dispositivo) a varfarina era suspensa. A dada altura do ensaio começaram a medicar com clopidogrel 75mg após suspensão da varfarina, o qual era mantido até aos seis meses.
O encerramento foi conseguido com sucesso em 93% dos casos (54 de 58). Os primeiros 16 doentes receberam um dispositivo de primeira geração, que condicionou um número considerável de complicações, como duas embolizações de dispositivo, uma embolização de ar provocando uma arritmia maligna com necessidade de reanimação, e uma fratura da guia de entrega. Após estes resultados o sistema de entrega foi modificado e o dispositivo foi redesenhado. O dispositivo de segunda geração foi utilizado em 53 doentes, sem se verificar nenhuma embolização. Derrames pericárdios ocorreram em 4% dos casos (3 de 75), 2 relacionados com a punção transseptal e um com um puxão vigoroso que era utilizado para testar a fixação do dispositivo. Esta técnica foi modificada passando a visualizar-se o AAE durante o puxão (por fluoroscopia ou ETE), sem registo de casos adicionais.
Não foram verificados AVCs durante o seguimento de 24 meses, comparativamente com a taxa esperada com base no score CHADS2 de 1,9% ao ano. Ocorreram 2 AIT: um aos quatro meses, sem trombo visível no dispositivo, e outro aos seis meses, com uma camada fina de trombo disposto à sua superfície. Foram ainda identificados mais três casos de trombo à superfície do dispositivo, que não se acompanharam de sintomas neurológicos. Os autores concluíram que o processo de endotelização não estaria terminado aos 45 d após implantação, altura em que a varfarina seria descontinuada, pelo que alteraram o esquema terapêutico inicial para iniciar nessa altura clopidogrel, que se mantinha até aos seis meses, em associação ao AAS.
No que respeita a complicações hemorrágicas, verificaram-se três hemorragias major: dois derrames pericárdicos necessitando de pericardiocentese, e uma hemorragia interna por embolização do dispositivo. Hemorragias minor ocorreram em dois doentes.
Dois doentes morreram durante o seguimento: um por dissecção da aorta ascendente, e outro com disfunção multiorgânica após uma cirurgia da bexiga.
Os autores consideraram os resultados idênticos aos obtidos com o dispositivo PLAATO, mas que tinham sido prejudicados pelo dispositivo de primeira geração e pela curva de aprendizagem.
Entre fevereiro de 2007 e junho de 2008 decorreu o estudo PROTECT AF8,9, o primeiro ensaio clínico randomizado a comparar diretamente o encerramento percutâneo do AAE (com o dispositivo WATCHMAN) com a varfarina. Teve como objetivo demonstrar a não inferioridade daquela terapêutica em termos de eficácia e segurança8.
Foram incluídos 707 doentes de 59 centros da Europa e Estados Unidos da América com FA não valvular paroxística, persistente ou permanente, score CHADS2 superior ou igual a um, sem contraindicação à varfarina. Estes foram randomizados numa razão de 2:1, com 463 doentes para implantação do dispositivo (grupo de intervenção), e 244 para terapêutica com varfarina (grupo de controlo). Os resultados foram publicados com um seguimento de 18 meses.
No grupo de controlo o INR alvo entre 2 e 3 foi avaliado de duas em duas semanas nos primeiros seis meses, seguindo-se uma monitorização mensal, tendo-se mantido dentro da janela terapêutica em 66% das monitorizações.
No grupo de intervenção a varfarina foi mantida durante os primeiros 45 d após o procedimento, com o intuito de facilitar a endotelização do dispositivo. Aos 45 d era repetido o ETE para avaliar o sucesso no encerramento (definido como fluxo peridispositivo ausente ou com < 5mm de largura (< 3±2mm). Nessas condições, a varfarina era substituída por dupla anti-agregação com clopidogrel (75mg) e AAS (81-325mg) durante seis meses, seguida de AAS indefinidamente. Eram realizadas visitas de seguimento aos 45 d, aos 6, 9, 12 meses e posteriormente duas vezes por ano. Era realizada avaliação neurológica no início, aos 12, 24 meses e sempre que ocorresse um evento neurológico.
A implantação do WATCHMAN foi bem conseguida em 88% dos doentes (408/463) e em 91% dos doentes em que foi tentada (408/449), tendo sido possível suspender a varfarina aos 45 d em 86% e aos seis meses em 92%.
Para avaliação de eventos relacionados com a eficácia, foi utilizado um endpoint composto (AVC isquémico, AVC hemorrágico, morte de causa cardiovascular ou desconhecida e embolismo sistémico). Este ocorreu numa taxa de 3%/ano no grupo de intervenção versus 4,9%/ano no grupo controlo (rate ratio [RR] 0,62, IC 95% 0,35-1,25), com uma probabilidade de não inferioridade superior a 99,9%.O número total de acidente vascular cerebral foi superior no grupo de controlo
A taxa de AVC isquémico foi superior para o grupo de intervenção, tendo um ocorrido antes da implantação do dispositivo, cinco periprocedimentos – relacionados com a embolização de ar, e nove fora da janela de tempo considerada periprocedimento. No grupo de controlo foram verificados seis AVC isquémicos. Em ambos os grupos todos os valores de INR avaliados à data do AVC eram subterapêuticos.
Os AVC hemorrágicos foram mais frequentes no grupo controlo (6 AVC), 5 dos quais foram fatais, tendo todos ocorrido sob níveis terapêuticos de varfarina. No grupo de intervenção foi verificado um AVC hemorrágico sob terapêutica com varfarina.
Ocorreram 21 mortes no grupo de intervenção (4,5%), que se deveram a AVC (2; 0,4%), causa cardiovascular ou desconhecida (4; 0,9%) e causa não cardiovascular (15; 3,2%). No grupo de controlo verificaram-se 18 mortes (7,4%): por AVC (6; 2,4%), causa cardiovascular ou desconhecida (6; 2,4%) e causas não cardiovasculares (6; 2,4%). A taxa de mortalidade cumulativa para o grupo de intervenção e para o grupo controlo foi de 3 versus 3,1% a um ano, e de 5,9 versus 9,1% a dois anos, respetivamente.
O endpoint composto de segurança incluiu hemorragia major (requerendo pelo menos duas unidades de glóbulos vermelhos ou cirurgia para sua correção) e complicações relacionadas com o procedimento como AVC, embolização do dispositivo ou derrame pericárdico grave (com necessidade de drenagem percutânea ou cirúrgica). No grupo de intervenção estes eventos ocorreram numa taxa superior (7,4 versus 4,4%/ano, no grupo de controlo), e mais precocemente (55% no dia do procedimento versus 50% entre 45 d a um ano, no grupo de controlo).
O evento de segurança mais frequente no grupo de intervenção foi o derrame pericárdico grave, verificado em 22 doentes (4,8%), com necessidade de cirurgia em 7 doentes, tendo resolvido com pericardiocentese nos restantes, sem nenhuma morte relacionada. A sua frequência foi declinando com a experiência do investigador, tendo sido mais frequente nos primeiros três doentes de todos os centros (7,1%) comparativamente com os restantes (4,4%).
A embolização de dispositivo ocorreu em três doentes, uma identificada durante o procedimento, tendo o dispositivo sido removido com sucesso por via percutânea; os outros dois casos foram assintomáticos, tendo sido identificados por ETE após 45 d e removidos por via cirúrgica.
Os autores concluíram que, em termos de eficácia, o encerramento percutâneo foi não inferior à varfarina, tendo-se verificado a não inferioridade mesmo quando excluídos os doentes com risco tromboembólico mais baixo (score CHADS2 de um). No que respeita à segurança, os eventos mais frequentes no grupo de intervenção foram reduzindo com a experiência no procedimento, e nenhum desses casos condicionou incapacidade permanente ou morte. Sugeriram que o risco inicial associado à implantação do dispositivo seria ultrapassado pelo risco cumulativo progressivo da terapêutica crónica com varfarina.
A principal limitação à aplicabilidade destes resultados na população de doentes com FA prende-se com a inclusão de doentes com baixo risco embólico (65% com score CHADS2 de um ou dois), não se sabendo até que ponto serão reprodutíveis numa população de risco superior, e nomeadamente naqueles com contraindicação à varfarina.
Perante estes resultados, a FDA recomendou um seguimento mais prolongado, tendo sido criado um registo de avaliação contínua do encerramento do AAE com o dispositivo WATCHMAN (registo CAP: «Continued Access to PROTECT AF»), com o objetivo de avaliar a sua segurança39.
Os seus resultados foram publicados em janeiro de 2011 e incluíram 542 doentes do grupo de intervenção do PROTECT AF em que o procedimento foi tentado, e adicionalmente 460 doentes, recrutados em 26 centros que participaram no PROTECT AF, mantendo os mesmos critérios de inclusão, seguimento e medicação. Na técnica de implantação, os autores salientaram a lavagem periódica do cateter com solução salina para minimizar a embolização de ar.
A mediana do tempo de seguimento foi de 2,5 anos para o PROTECT AF (entre 0 e 4,7 anos) e de 0,4 anos para o CAP (entre 0 e 1,6 anos).
A eficácia foi avaliada através de um endpoint composto semelhante ao do PROTECT AF, considerando derrames pericárdicos como graves sempre que condicionavam prolongamento do internamento.
No que respeita à composição da população, o PROTECT AF e o CAP diferiram sobretudo na idade e no score CHADS2, que foram superiores para o CAP (idade média de 74±8 versus 72±9 e CHADS2 de 2,4±1,2 versus 2,2±1,2, com p<0,001 para ambos).
De modo a avaliar o efeito da curva de aprendizagem e da experiência do investigador, os resultados do CAP foram comparados com os do PROTECT AF, e neste último, foram ainda comparados os do PROTECT AF inicial (primeira metade dos doentes) versus final (segunda metade), e PROTECT AF para os primeiros três doentes de cada centro versus restantes. Verificou-se uma redução da duração média do procedimento, um aumento da taxa de sucesso na implantação e uma redução na taxa de eventos de segurança, de derrames pericárdicos graves e de AVC relacionados com o procedimento do PROTECT AF inicial para o PROTECT AF final e deste para o CAP (Tabela 5), com uma taxa de eventos no PROTECT AF final (5,5%) bem mais próxima da verificada no CAP (3,7%). Comparando os resultados do PROTECT AF dos primeiros três doentes verificou-se também uma redução de 33% na duração média do procedimento e de 52% na taxa de eventos relacionados com a segurança (Tabela 5).
Eventos de segurança verificados no PROTECT AF e no CAP. Resultados expressos em: n.°/total (%); valores de p obtidos por testes de χ2 ou ANOVA
| PROTECT | PROTECT AF | PROTECT AF | CAP | Pa | Pb | Pc | |||
| AF | Inicial | Final | 1.°s 3D | > 3.°D | |||||
| Duração do proc. | 62±34 | 67±36 | 58±33 | 82±40 | 55±29 | 50±21 | <0,001 | <0,001 | <0,001 |
| Sucesso na implantação | 485/542 (89,5%) | 239/271 (88,2%) | 246/271 (90,8%) | 133/154 (86,4%) | 352/388 (90,7) | 437/460 (95,0%) | 0,001 | 0,001 | 0,136 |
| Eventos de segurança nos 1°s 7D | 42/542 (7,7%) | 27/271 (10,0%) | 15/271 (5,5%) | 19/154 (12,3%) | 23/388 (5,9%) | 17/460 (3,7%) | 0,007 | 0,006 | 0,012 |
| Derrame pericárdico grave: 1°s 7D | 27/542 (5,0%) | 17/271 (6,3%) | 10/271 (3,7%) | 10/154 (6,5%) | 17/388 (4,4%) | 10/460 (2,2%) | 0,019 | 0,018 | 0,308 |
| AVC relacionados com proc. | 5/542 (0,9%) | 3/271 (1,1%) | 2/271 (0,7%) | 1/154 (0,7%) | 4/388 (1,0%) | 0/460 (0%) | 0,039 | 0,039 | 0,675 |
Adaptado de: Reddy et al.39.
D: doentes; P. AF: PROTECT AF; proc.: procedimento.
aRelativo à comparação entre o grupo do PROTECT AF e o do CAP.
bDa comparação de 3 grupos: PROTECT AF inicial, PROTECT AF final e CAP.
cDa comparação entre os resultados dos primeiros 3 doentes de cada centro relativamente aos subsequentes.
A distribuição ao longo do tempo dos eventos relacionados com a segurança foi avaliada separando os que ocorreram nos primeiros 7 d com o seguimento restante. No total, 94% destes eventos ocorreram nos primeiros 7 d (91% no PROTECT AF e 100% no CAP).
Os derrames pericárdicos graves ocorreram em 3,8% dos doentes (5,2% no PROTECT AF e 2,2% no CAP).
Ocorreu AVC periprocedimento em 0,9% dos doentes no PROTECT AF e não foi verificado no CAP (0%).
A taxa de embolização de dispositivo foi 0,6% no PROTECT AF versus 0% no CAP.
Foram verificados trombos no dispositivo em 20 doentes (4,2%) do PROTECT AF, complicação não identificada no CAP.
Outra análise importante realizada no seguimento do PROTECT-AF foi relativa ao impacto funcional dos eventos adversos relacionados com a segurança, identificando aqueles que condicionaram morte ou incapacidade significativa (definida como uma variação no score Rankin modificado). Para qualquer definição de incapacidade significativa (variação no score superior ou igual a um, dois ou três), verificou-se uma taxa de eventos de segurança com impacto funcional sempre inferior no grupo de intervenção comparativamente com o grupo de controlo, com um risco relativo de aproximadamente 0,4 (Tabela 6).
Impacto funcional dos eventos relacionados com a segurança
| Grupo de intervenção N.°/total (%/ano) | Grupo controlo N.°/total (%/ano) | Risco relativo (IC 95%) | |
| Morte ou SRM ≥ 1 | 19/1 042,2 (1,8) | 24/559,5 (4,3) | 0,43 (0,24-0,82) |
| Morte ou SRM ≥ 2 | 16/1 047,1 (1,5) | 21/563,9 (3,7) | 0,41 (0,22-0,82) |
| Morte ou SRM ≥ 3 | 15/1 048,5 (1,4) | 19/567.5 (3,3) | 0,43 (0,22-0,88) |
Adaptado de: Reddy et al39.
SRM: score Rankin modificado.
Os autores concluíram que os eventos relacionados com segurança no grupo de intervenção ocorrem sobretudo periprocedimento, diminuíram com a experiência do operador e condicionaram menor incapacidade funcional que os relacionados com a varfarina, que por sua vez apresentam um risco cumulativo crescente ao longo do tempo39.
Quer o PROTECT-AF, quer o registo CAP, incluíram no seu protocolo um período de 45 d de medicação com varfarina após o encerramento percutâneo do AAE, limitando a sua aplicação a doentes com contraindicação à hipocoagulação oral, para os quais este procedimento poderia ser uma alternativa. No sentido de avaliar o perfil de eficácia do encerramento percutâneo do AAE nestes doentes foi iniciado o registo prospetivo não randomizado ASA Plavix Feasibility Study With WATCHMAN Left Atrial Appendage Closure Technology (ASAP)40. Este incluiu 150 doentes de três centros na Alemanha e um centro na República Checa, com FA não valvular e os mesmos critérios de inclusão/exclusão que o PROTECT-AF, exceto na contraindicação à varfarina, que foram submetidos a encerramento percutâneo do AAE com o dispositivo WATCHMAN. Após o procedimento foi mantido clopidogrel durante seis meses e aspirina indefinidamente, e realizado ETE aos três e 12 meses. Os resultados preliminares foram apresentados na Heart Rhythm Society 2012 Scientific Sessions41. A implantação foi bem-sucedida em 94% dos doentes (141/150). Durante um seguimento de 14,2±8,7 meses foi identificada uma embolização sistémica, seis casos de trombo relacionado com o dispositivo e quatro AVC, com uma taxa de AVC isquémico de 1,8%, o que, segundo os autores, corresponderia a uma redução em 75% dos eventos face ao esperado com base no CHADS2 médio de 2,8±1,2,caso o tratamento fosse somente aspirina (7,1%) e uma redução de 64% em relação ao esperado para tratamento com aspirina e clopidogrel indefinidamente (5%). Os autores concluíram que a implantação de WATCHMAN foi segura e eficaz sem medicação transitória com varfarina em doentes com contraindicação à mesma41.
Não se conhecendo o impacto do encerramento incompleto do AAE por via percutânea, o qual foi verificado nas técnicas cirúrgicas tendo sido acompanhado de um risco acrescido de eventos embólicos, Viles-Gonzalez et al. realizaram uma análise retrospetiva dos doentes do grupo de intervenção do PROTECT-AF, que foi publicada em março de 201242. Esta consistiu na avaliação de fluxo peridispositivo, classificado nesta análise como minor (< 1mm), moderado (1 a 3mm) ou major (> 3mm), nos ETE realizados aos 45 d, 6 e 12 meses. Dos 485 doentes em o WATCHMAN foi implantado com sucesso, apenas 445 realizaram o ETE ao 45.° d, 414 aos seis meses e 389 aos 12 meses. A presença de qualquer fluxo peridispositivo diminuiu ao longo do tempo, de 40,9% ao 45.° d, para 33,8% aos seis meses e 32,1% aos 12 meses (p=0,001). A severidade do fluxo identificado ao 45.° d foi minor em 7,7%, moderada em 59,9% e major em 32,4%, sendo que esta distribuição não se alterou significativamente aos seis e 12 meses (p=0,731). A largura média e máxima do fluxo peridispositivo era de 2,8 e 6,2mm ao 45.° d, 2,9 e 6,8mm aos 3 meses, 2,9 e 6mm aos 12 meses.
O endpoint composto de eficácia do PROTECT-AF não foi significativamente diferente entre os doentes com fluxo peridispositivo (2,8%) comparativamente àqueles em que este não foi identificado (2%; p=0,635). Também não foi verificada uma diferença significativa nestes eventos quando tida em conta a severidade do fluxo peridispositivo (versus ausência de fluxo: HR 0,85, 0,83 e 0,48, para fluxo minor, moderado e major, respetivamente, p=0,798). Foi ainda analisado para este endpoint o impacto do aumento em 1mm no tamanho do fluxo, não tendo sido verificada diferença significativa entre os grupos (HR 0,84, p=0,256).
Também foi avaliado um segundo endpoint composto por AVC e embolização sistémica, para o qual também não se verificou diferença significativa em relação à presença de fluxo ou à sua severidade.
Esta análise foi também realizada separadamente nos doentes que continuaram varfarina após os 45 d e nos que a descontinuaram nessa altura, mais uma vez sem ter sido identificada diferença quanto à presença de fluxo peridispositivo (p=0,857).
Os autores concluíram que nesta amostra de doentes não houve interacção entre a presença de fluxo residual peridispositivo e eventos embólicos, tendo sido feita a ressalva de que estes resultados poderão não se aplicar a outros dispositivos diferentes do WATCHMAN, sugerindo a realização desta avaliação para os outros mesmos42.
Encontra-se a decorrer um segundo ensaio clínico randomizado com o dispositivo WATCHMAN, o estudo PREVAIL43. Este apresenta um desenho idêntico ao do PROTECT AF, mas com modificação dos critérios de inclusão, apenas incluindo doentes com score CHADS2 de um com pelo menos uma das seguintes características: mulher com idade ≥ 75 anos, fração de ejeção do ventrículo esquerdo entre 30 a 34,9%, idade entre os 65 e os 74 anos associada a diabetes ou a doença coronária, ou idade ≥ 65 anos com insuficiência cardíaca congestiva documentada.
ConclusõesO encerramento percutâneo do AAE foi um passo importante na prevenção de eventos cardioembólicos na FA, sobretudo na de etiologia não valvular. A exequibilidade da técnica foi já demonstrada em múltiplas séries. O PROTECT AF foi fundamental pois conseguiu demonstrar uma eficácia semelhante à da varfarina na redução de eventos tromboembólicos, contudo, à custa de uma taxa superior de eventos de segurança relacionados sobretudo com o procedimento. O seguimento destes doentes e a criação do registo CAP mostrou resultados encorajadores à continuação desta prática, pois demonstrou que as complicações relacionadas com o procedimento eram significativamente reduzidas com a experiência do operador, condicionavam menor taxa de mortalidade ou incapacidade comparativamente com a varfarina, sugerindo um melhor perfil de risco a longo prazo.
De acordo com estes dados, o encerramento percutâneo do AAE legitimou-se na prevenção do tromboembolismo em doentes com FA não valvular com risco tromboembólico elevado, sem contraindicação à hipocoagulação oral. Contudo, e sendo a técnica atrativa sobretudo nos doentes sem possibilidade de hipocoagulação oral, tem sido tentada nestes doentes.
Porém, uma das temíveis complicações, a formação de trombo aderente ao dispositivo, tem sido descrita, arrefecendo o entusiasmo inicial em torno desta técnica e fazendo ponderar a possível necessidade de hipocoagulação durante um período de tempo após implantação em alguns doentes.
Contrariamente ao verificado para a oclusão incompleta do AAE por técnica cirúrgica, a oclusão incompleta do AAE com o dispositivo WATCMAN não se associou a aumento dos eventos embólicos no único estudo realizado até ao momento.
Apesar de ser ainda necessária uma avaliação de eventuais complicações tardias relacionadas com o dispositivo, ou com eventuais consequências fisiológicas do encerramento do AAE, as quais ainda não são verdadeiramente conhecidas, o encerramento percutâneo do AAE surge como uma alternativa segura e eficaz à hipocoagulação oral em doentes com risco elevado e, no futuro, poderá também legitimar-se como alternativa para doentes de baixo risco. O papel dos novos anticoagulantes orais na profilaxia do tromboembolismo será também determinante na definição do tipo de doentes que poderá beneficiar com o encerramento percutâneo do AAE.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflito de interessesOs autores declaram não haver conflito de interesses.