A prevalência da diabetes mellitus tipo 2 (DMT2) continua a aumentar e a sua associação com a doença cardiovascular (CV) tem levado à incorporação e valorização de endpoints CV nos ensaios clínicos sobre o tratamento da DMT2.
Este artigo faz uma revisão dos vários ensaios já realizados e em desenvolvimento, neste âmbito, com especial enfoque no estudo EMPA‐REG OUTCOME. Neste estudo, a empagliflozina, um inibidor do cotransportador tipo 2 de sódio/glicose (iSGLT2), demonstrou efeitos benéficos na redução do risco CV em doentes com DMT2 e doença CV estabelecida, para além de segurança CV e diminuição dos valores de HbA1c, representando uma mudança de paradigma com impacto ao nível das recomendações internacionais para o tratamento da DMT2. Estes resultados mantiveram‐se em análises de subgrupos posteriores, nomeadamente na insuficiência cardíaca, doença renal crónica e doença arterial periférica, ainda que muitas questões se coloquem sobre os mecanismos envolvidos nestes efeitos – se efeitos hemodinâmicos, efeitos metabólicos ou se a diminuição das concentrações de sódio citoplasmático no miocárdio.
Com a diminuição do risco de eventos CV major em doentes com DMT2, os resultados do estudo EMPA‐REG OUTCOME demonstraram, pela primeira vez, proteção CV associada ao efeito de um fármaco anti‐hiperglicémico e iniciaram uma nova era no tratamento e gestão da DMT2. Este estudo levou ao desenvolvimento de outros ensaios, ainda a decorrer, que permitirão estabelecer quais os doentes que mais beneficiarão desta terapêutica, nomeadamente na relação à existência de comorbilidades.
The prevalence of type 2 diabetes (T2D) continues to increase, and its association with cardiovascular (CV) disease has led to the inclusion of CV endpoints in clinical trials on the treatment of T2D.
This article explores the various trials already performed and under development in this field, with particular focus on the EMPA‐REG OUTCOME trial. In this trial, empagliflozin, a sodium‐glucose co‐transporter 2 inhibitor, demonstrated a reduction in CV risk in patients with T2D and established CV disease, in addition to CV safety and a decrease in glycated hemoglobin. This represents a paradigm shift that has led to changes in the international guidelines for the treatment of T2D. These results were maintained in subsequent subgroup analysis for heart failure, chronic kidney disease and peripheral arterial disease, although there are many questions concerning the mechanisms involved in these effects, including whether they are hemodynamic, metabolic or due to decreased myocardial cytoplasmic sodium concentrations.
With this reduction in risk for major CV events in patients with T2D, the EMPA‐REG OUTCOME trial demonstrated CV protection from a hypoglycemic drug for the first time, and opened a new era in the treatment and management of T2D. This study has led to the development of ongoing trials that will establish which patients will benefit most from this therapy, particularly with regard to comorbidities.
A diabetes mellitus (DM) é uma das doenças crónicas com maior impacto a nível mundial devido à sua elevada prevalência e aos elevados custos económicos diretos e indiretos motivados, em grande parte, pelo desenvolvimento de complicações micro e macrovasculares. Apesar dos vários esforços ao nível de políticas de saúde e de educação, a prevalência da DM tipo 1 (DMT1) e, sobretudo, da DM tipo 2 (DMT2) continua a aumentar1.
Existe uma associação entre a DM e a doença cardiovascular (DCV), nomeadamente no que diz respeito ao enfarte agudo do miocárdio (EAM), acidente vascular cerebral (AVC), doença arterial periférica (DAP), cardiomiopatia e insuficiência cardíaca (IC)1. A DCV é a principal causa de morbilidade e mortalidade em pessoas com diabetes, especialmente no que concerne o EAM e AVC, em relação aos quais são reportados valores de prevalência quatro vezes mais elevados nas pessoas com diabetes1–3. Em Portugal, de acordo com o Programa Nacional para a Diabetes, cerca de um terço dos internamentos por EAM e AVC foram de pessoas com DM, sendo a mortalidade por EAM, nestes indivíduos, superior à da população não diabética4.
A IC tem também uma elevada prevalência em pessoas com DM, sendo 2,5 vezes superior nestes indivíduos5; um em cada cinco diabéticos com mais de 65 anos tem IC6. Doentes com DM e IC apresentam pior prognóstico, com uma taxa de mortalidade de causa CV superior e um número e duração de hospitalizações mais elevados5,7. Contudo, embora a IC seja reconhecidamente parte dos eventos cardiovasculares major relacionados com a DMT2, é frequentemente subvalorizada enquanto alvo terapêutico nos múltiplos estudos desenvolvidos7.
Considerando este elevado impacto, a diabetes é atualmente considerada um fator de risco major e independente de DCV, a par do consumo de tabaco, da hipertensão arterial (HTA) e da dislipidemia, devendo o tratamento das pessoas com diabetes ser focado na melhoria do risco cardiovascular (CV)2,8. A abordagem terapêutica na diminuição e prevenção de complicações CV na DMT2 deve contemplar o controlo da glicemia, mas deve também ser cada vez mais multifatorial, incluindo o controlo da pressão arterial, do perfil lipídico e do peso corporal, o combate ao sedentarismo e a cessação tabágica9. Contudo, a redução de eventos CV na diabetes é uma área particularmente desafiante e complexa, já que outros fatores de risco CV estão também presentes nos indivíduos com DMT21.
O paradigma clássico relaciona a génese do risco cardiovascular associado à DMT2 ao estado permanente de hiperglicemia, sugerindo uma relação quase linear entre as perturbações metabólicas e lesão vascular10. Este paradigma foi contrariado pelos resultados de fármacos que, apesar de otimizarem o controlo glicémico, não têm conseguido demonstrar os efeitos benéficos esperados na diminuição do risco cardiovascular, como foi o caso da generalidade dos inibidores da dipeptidil peptidase 4 ‐iDPP4, das sulfonilureias e da insulina10.
Atualmente, os ensaios clínicos têm vindo a incorporar e a valorizar endpoints CV no tratamento da DMT2 em adição aos endpoints relacionados com o controlo metabólico, nomeadamente ocorrência de EAM e de AVC e morte por causa CV11.
Estado da arte nos estudos de outcomes CV na DMT2Têm sido muitos os esforços para encontrar agentes farmacológicos que demonstrem benefícios inequívocos nos outcomes CV em doentes com DMT2, com inúmeros estudos de diferentes classes farmacológicas. No entanto, os resultados têm sido, em muitas situações, inconsistentes ou pouco significativos, especialmente no que concerne as complicações macrovasculares12.
Historicamente, cinco grandes estudos avaliaram de forma pioneira o efeito do controlo glicémico intensivo comparativamente ao controlo standard no risco CV em doentes com DMT2 – os estudos UKPDS13, UGDP14, VADT15, ADVANCE16 e ACCORD17. Embora estes estudos tenham incluído doentes com diferentes estádios de DCV e por períodos de follow‐up distintos, globalmente podem ser retiradas algumas conclusões18.
Os dados disponíveis sugerem que a redução intensiva da glicose tem efeitos benéficos sobre o risco microvascular13,15,16; no entanto, para resultados macrovasculares e mortalidade, a evidência não foi concordante14–17. Considerando os indivíduos com excesso de peso, ocorreu uma redução da mortalidade por todas as causas, da mortalidade associada à diabetes e da ocorrência de EAM13. Adicionalmente, uma análise retrospetiva, a longo prazo, ao grupo de doentes incluídos no estudo UKPDS19 e no estudo VADT15 revelou uma redução nos eventos CV com terapia intensiva versus o tratamento padrão.
Após uma meta‐análise ter associado a rosiglitazona, da classe terapêutica das tiazolidinedionas, a um aumento significativo de eventos CV e de mortalidade quando comparada a outros antidiabéticos orais, foi desencadeada uma discussão sobre a necessidade de avaliar mais detalhadamente as terapias antidiabéticas de uma perspetiva cardiovascular20.
Dada a incerteza sobre os efeitos CV dos antidiabéticos, a Food and Drug Administration (FDA)21 em 2008 e a European Medicines Agency (EMA)22 em 2012 emitiram uma orientação para a indústria farmacêutica sobre a realização de ensaios clínicos para novos fármacos no tratamento da DMT2, com enfoque nos resultados CV. Desde então, vários estudos têm sido desenvolvidos para avaliar o risco‐benefício de novas terapêuticas anti‐hiperglicémicas. Estes estudos – CVOT (Cardiovascular Outcome Trials) – têm sido desenhados para demostração de segurança CV e do benefício da terapêutica antidiabética, maioritariamente na DMT2, e incluem nos seus endpoints a mortalidade por causa CV, EAM, AVC, hospitalizações por síndrome coronária aguda ou procedimentos urgentes de revascularização, em populações com maior risco CV, mais idosas e com algum grau de insuficiência renal23,24. A Tabela 1 apresenta um resumo dos ensaios realizados desde 2008, após a emissão da orientação da FDA.
CVOTs realizados após a orientação da FDA de 2008
| Ensaio | Situação | Fármaco | Classe terapêutica | Intervenção | Endpoint primário | N | Identificação no Clinicaltrials.gov |
|---|---|---|---|---|---|---|---|
| EXAMINE | Finalizado | Alogliptina | iDPP‐4 | Alogliptina vs. Placebo | Morte CV, EAM, ou AVC | 5.380 | NCT00968708 |
| SAVOR‐TIMI53 | Finalizado | Saxagliptina | iDPP‐4 | Saxagliptina vs. Placebo | Morte CV, EAM, ou AVC | 18.206 | NCT01107886 |
| EMPA‐REG OUTCOME | Finalizado | Empagliflozina | iSGLT2 | Empagliflozina 10mg vs. Empagliflozina 25mg vs. Placebo | Morte CV, EAM, ou AVC | 7.064 | NCT01131676 |
| ELIXA | Finalizado | Lixisenatido | arGLP‐1 | Lixisenatido vs. Placebo | Morte CV, EAM, AI, ou AVC | 6.068 | NCT01147250 |
| TECOS | Finalizado | Sitagliptina | iDPP‐4 | Sitagliptina vs. Placebo | Morte CV, EAM, AI, ou AVC | 14.671 | NCT00790205 |
| LEADER | Finalizado | Liraglutido | arGLP‐1 | Liraglutido vs. Placebo | Morte CV, EAM, ou AVC | 9.340 | NCT01179048 |
| SUSTAIN‐6 | Finalizado | Semaglutido | arGLP‐1 | Semaglutido 0.5mg vs. Semaglutido 1.0mg vs. Placebo | Morte CV, EAM, ou AVC | 3.297 | NCT01720446 |
| FREEDOM‐CVO | Finalizado | Exenatido via DUROS® | arGLP‐1 | ITCA 650 (exenatido via DUROS®) vs. Placebo | Morte CV, EAM, AVC ou hospitalização por AI | 4.156 | NCT01455896 |
| CANVAS | Finalizado | Canagliflozina | iSGLT2 | Canagliflozina 100mg vs. Canagliflozina 300mg vs. Placebo | Morte CV, EAM, AI, ou AVC | 4.418 | NCT01032629 |
| EXSCEL | Finalizado | Exenatido | arGLP‐1 | Exenatido semanal vs. Placebo | Morte CV, EAM, ou AVC | 14.752 | NCT01144338 |
| CARMELINA | Ongoing(2018) | Linagliptina | iDPP‐4 | Linagliptina vs.Placebo | Morte CV, EAM, AI, ou AVC | 8.000 | NCT01897532 |
| PIONEER | Ongoing(2018) | Semaglutido | arGLP‐1 | Semaglutido vs. Placebo | Morte CV, EAM, ou AVC | 3.176 | NCT02692716 |
| TOSCA‐IT | Ongoing(2018) | Pioglitazona | Agonista do PPAR‐γ | Pioglitazona vs. Sulfonilureia | Morte CV, EAM, AVC, ou revasculização coronária | 3.371 | NCT00700856 |
| HARMONY Outcomes | Ongoing(2019) | Albiglutido | arGLP‐1 | Albiglutido vs. Placebo | Morte CV, EAM, ou AVC | 9.400 | NCT02465515 |
| REWIND | Ongoing(estimada‐2019) | Dulaglutido | arGLP‐1 | Dulaglutido vs. Placebo | Morte CV, EAM, ou AVC | 9.622 | NCT01394952 |
| VERTIS CV | Ongoing(2019) | Ertugliflozina | iSGLT2 | Ertugliflozina vs. Placebo | Morte CV, EAM, ou AVC | 8.000 | NCT01986881 |
| DAPA‐HF | Ongoing(2019) | Dapagliflozina | iSGLT2 | Dapagliflozina vs.Placebo | Morte CV, hospitalização por EAM, ou consulta de urgência por EAM | 4.500 | NCT03036124 |
| CAROLINA | Ongoing(2019) | Linagliptina | iDPP‐4 | Linagliptina vs. Glimepirida vs. Placebo | Morte CV, EAM, AI, ou AVC | 6.072 | NCT01243424 |
| DECLARE‐TIMI58 | Ongoing(2019) | Dapagliflozina | iSGLT2 | Dapagliflozina 10mg vs. Placebo | Morte CV, EAM, ou AVC | 17.276 | NCT01730534 |
| CREDENCE | Ongoing(2019) | Canagliflozina | iSGLT2 | Canagliflozina 300mg vs. Placebo | DRC + Morte CV e hospitalização por IC | 4.331 | NCT02065791 |
| EMPEROR Preserved | Ongoing(2020) | Empagliflozina | iSGLT2 | Empagliflozina vs. Placebo | Morte CV ou hospitalização por IC | 4.126 | NCT03057951 |
| EMPEROR Reduced | Ongoing(2020) | Empagliflozina | iSGLT2 | Empagliflozina vs. Placebo | Morte CV ou hospitalização por IC | 2.850 | NCT03057977 |
| DAPA‐CKD | Ongoing(2020) | Dapagliflozina | iSGLT2 | Dapagliflozina vs.Placebo | Declínio da eGFR ≥50%, ouDoença Renal Estádio 5, Morte CV, ouMorte Renal | 4.000 | NCT03036150 |
AI: angina instável; arGLP‐1: agonista do recetor do GLP‐1; AVC: acidente vascular cerebral; CV: cardiovascular; DRC: doença renal crónica; EAM: enfarte agudo do miocárdio; eGFR: taxa de filtração glomerular estimada; IC: insuficiência cardíaca; PPAR‐γ: recetores ativados por proliferador de peroxissoma gama.
A primeira classe a reportar resultados, após esta alteração, foi a classe dos iDPP‐4. Os estudos com saxagliptina25, alogliptina26 e sitagliptina27 mostraram segurança CV, ainda que com efeitos neutros no endpoint cardiovascular primário. Adicionalmente, no estudo com saxagliptina, verificou‐se um aumento do risco de hospitalização por IC25. Aguardam‐se os resultados dos ensaios CAROLINA (linagliptina versus glimepirida)28 e CARMELINA (linagliptina versus placebo)29 que poderão trazer informação adicional sobre os efeitos desta classe terapêutica no risco CV.
Após a publicação destes estudos, gerou‐se algum desânimo na comunidade científica, pois parecia que nenhuma terapêutica antidiabética era capaz de melhorar o prognóstico cardiovascular. No entanto, verificou‐se uma mudança de paradigma com a apresentação dos resultados do estudo EMPA‐REG OUTCOME30. Neste estudo, a empagliflozina, um inibidor do cotransportador tipo 2 de sódio/glicose (iSGLT2), demonstrou, para além de segurança CV, efeitos benéficos na redução do risco CV em doentes com DMT2 e doença CV estabelecida. Este benefício foi observado logo após três meses de estudo e ampliou‐se ao longo do tempo de seguimento, com uma redução significativa de 38% no risco relativo de morte CV30.
Este ensaio clínico aleatorizado, em dupla ocultação, pretendeu avaliar a não inferioridade, mas com a possibilidade de testar superioridade, da empagliflozina (10mg ou 25mg, uma vez por dia) comparativamente a placebo, ambos em associação com o tratamento standard (antidiabéticos, anti‐hipertensores e antidislipidémicos), na ocorrência de um compósito de MACE (Major Adverse Cardiovascular Events) – morte por causa CV, AVC não fatal ou EAM não fatal30.
Os resultados demonstraram uma redução significativa do risco de ocorrência de eventos CV no grupo a fazer empagliflozina, independentemente da dose utilizada, face a placebo na ocorrência do endpoint primário (10,5% versus 12,1%; p = 0,04), redução em grande parte impulsionada pela redução da mortalidade cardiovascular (3,7% versus 5,9%; p < 0,001)30. Adicionalmente, verificou‐se uma significativa redução de 32% no número de mortes por qualquer causa e de 35% nas hospitalizações por IC nos doentes sob terapêutica com empagliflozina (respetivamente 5,7% versus 8,3%; p < 0,001 e 2,7% versus 4,1%; p = 0,002)30.
Posteriormente, o Programa CANVAS31 demonstrou um benefício de um outro inibidor da iSGLT2, a canagliflozina, na redução de eventos CV e das hospitalizações por IC, mostrando uma consistência dentro da classe dos iSGLT2. Este Programa incluiu doentes com DMT2 diabetes tipo 2 e elevado risco CV (DCV estabelecida ou múltiplos fatores de risco CV) em tratamento com canagliflozina versus placebo31. Foi definido como outcome primário um compósito de MACE – morte por causa CV, EAM não fatal ou AVC não fatal – e, como outcomes secundários, morte por qualquer causa, morte por causa CV e um compósito de dois pontos – morte por causa CV e hospitalização por IC31. Verificou‐se uma diminuição, estatisticamente significativa, de eventos no compósito de três pontos MACE: 26,9 no grupo canagliflozina versus 31,5 no grupo placebo por 1000 doentes/ano (hazard ratio, HR, 0,86; intervalo de confiança, IC, 95% 0,75‐0,97; p < 0,001 para não inferioridade e p = 0,02 para superioridade)31. Contudo, excetuando a menor ocorrência de hospitalizações por IC no grupo a fazer tratamento com canagliflozina, esta não foi estatisticamente superior a placebo nos restantes eventos CV avaliados, nomeadamente na morte CV, EAM e AVC fatal e não fatal – apesar da redução apresentada nestes parâmetros31. Nos doentes tratados com canagliflozina, verificou‐se um aumento do número de amputação nos membros inferiores, metatarsos, pés e pernas e de fraturas31 que, a par da redução não significativa de morte CV, foram as principais diferenças entre este estudo e o ensaio clínico com a empagliflozina30,32.
Na classe dos iSGLT2, aguardam‐se os resultados dos ensaios em curso com outras moléculas (dapagliflozina e ertugliflozina) para esclarecer possíveis efeitos de classe33,34.
Na classe dos agonistas do recetor do peptídeo 1 semelhante ao glucagon (arGLP‐1 – glucagon‐like peptide 1), o liraglutido35 e o semaglutido36 vieram confirmar o novo paradigma no tratamento para diminuição do risco de complicações CV na DMT2, embora com resultados só ao fim de cerca de 12 meses. Os ensaios demostraram benefícios no outcome primário, o compósito de morte por causa CV, EAM não fatal ou AVC não fatal, mas com resultados distintos em alguns endpoints quando avaliados isoladamente, nomeadamente a ocorrência de EAM não fatal35,36.
Mais recentemente, o ensaio com exenatido (EXSCEL) não apresentou diferenças significativas face a placebo nos vários endpoints CV avaliados37, tal como havia acontecido no estudo ELIXA38, em que o lixisenatido não mostrou superioridade em relação a placebo na ocorrência de eventos CV em doentes recém‐diagnosticados com síndrome coronária aguda, confirmando que as moléculas da classe dos arGLP‐1 apresentam características diferentes entre si, sendo por isso difícil falar num efeito de classe. Aguardam‐se ainda os resultados de segurança CV do dulaglutido39 e do albiglutido40, que poderão trazer mais informação sobre os arGLP‐1.
Benefício CV da empagliflozina em doentes com DMT2 e doença CV estabelecidaOutcomes CV do EMPA‐REG OUTCOMEO ensaio clínico EMPA‐REG OUTCOME30 incluiu 7020 indivíduos com DMT2 (HbA1c entre 7,0 e 9,0% para indivíduos não medicados e 7,0 a 10% nos indivíduos com terapêutica anti‐hiperglicemiante prévia), com DCV estabelecida (doença arterial coronária, DAP ou história de EAM ou de AVC), taxa de filtração glomerular estimada (eGFR) superior a 30mL/min/1,73m2 e índice de massa corporal (IMC) igual ou inferior a 45kg/m2.
Foi definido como outcome primário o compósito de três pontos MACE (morte por causa CV, EAM não fatal ou AVC não fatal) e, como outcome secundário, a conjugação dos outcomes primários com hospitalização por angina instável; adicionalmente pretendeu‐se avaliar a ocorrência isolada de morte por causa CV, EAM não fatal, AVC não fatal, internamento devido a IC e mortalidade por qualquer motivo30.
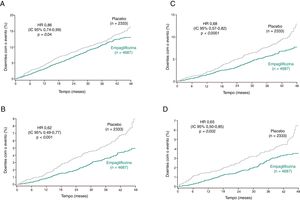
Os resultados (Figura 1) mostraram uma redução significativa do risco para a ocorrência do outcome primário para o grupo a receber empagliflozina, comparativamente ao grupo placebo (HR 0,86; IC 95% 0,74‐0,99; p < 0,001 para não inferioridade e p = 0,04 para superioridade)30. Adicionalmente, houve uma redução significativa do risco de morte por causa CV (HR 0,62; IC 95% 0,49‐0,77; p < 0,001) na morte por qualquer causa (HR 0,68; IC 95% 0,57‐0,82; p < 0,001) e do número hospitalizações por IC no grupo tratado com empagliflozina (HR 0,65; IC 95% 0,50‐0,85; p = 0,002)30.
Verificou‐se, também, uma diminuição ao nível dos valores de HbA1c no grupo tratado com empagliflozina comparativamente ao grupo placebo, bem como do peso, da circunferência abdominal, ácido úrico plasmático e da pressão arterial sistólica e diastólica30.
A empagliflozina mostrou um bom perfil de segurança e de tolerabilidade, com uma incidência de eventos adversos comparável ao grupo placebo, exceção feita à maior incidência de infeções genitais, porém sem diferenças no que concerne a infeções urinárias30.
A diminuição, com diferença estatística significativa, de 38% do risco relativo (RR) de morte por causa CV, de 35% de hospitalização por IC e de 32% de morte por qualquer causa demonstrada pelo estudo EMPA‐REG OUTCOME foi surpreendente em termos de magnitude e da precocidade com que se verificou o afastamento das curvas dos braços do estudo (com e sem empagliflozina), com a diferença nos resultados entre grupo tratado com empagliflozina e placebo a verificar‐se seis a 12 semanas após o início do estudo30.
Considerando a elevada prevalência de IC associada a diabetes e a inexistência de fármacos antidiabéticos que tenham demostrado uma redução dos outcomes relacionados com IC (ocorrência, hospitalizações e morte)5, foi feita uma análise posterior do EMPA‐REG OUTCOME em que se pretendeu avaliar, em maior detalhe, os resultados referentes à insuficiência cardíaca dividindo os participantes em subgrupos, incluindo doentes com e sem IC prévia41.
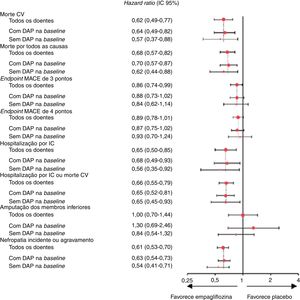
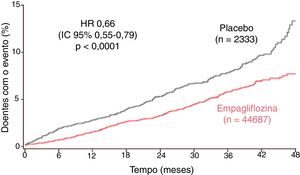
Cerca de 10% (n = 706) dos participantes do EMPA‐REG OUTCOME apresentavam IC na avaliação inicial. Nesta subanálise, considerou‐se o outcome compósito de hospitalização por IC e morte CV, tendo‐se verificado menor ocorrência destes eventos no grupo medicado com empagliflozina (5,7% versus 8,5% no grupo placebo; HR 0,66; IC 95% 0,55‐0,79; p < 0,001; Figura 2)41. Esta redução manteve‐se após o ajuste dos resultados por sexo e subgrupos de idade, etnia, eGFR, IC prévia, classes de medicamentos para controlo de risco CV, pressão arterial e tratamento prévio para a diabetes, demonstrando que o efeito da empagliflozina é consistente entre subgrupos (Tabela 2)41. Com uma redução global de hospitalização por IC e morte CV de 34% (28% nos doentes com IC estabelecida e 37% nos doentes sem IC à data de início da terapêutica), de acordo com esta análise, bastaria tratar 36 doentes durante três anos para evitar a ocorrência de um destes eventos41.
Outcomes CV em doentes com e sem insuficiência cardíaca no início do estudo (adaptado de 42)
| Placebo N (%) | Empagliflozina N (%) | Hazard ratio (IC95%) | |
|---|---|---|---|
| Hospitalização por IC ou morte CV | |||
| Todos os doentes | 198 (8,5) | 265 (5,7) | 0,66 (0,55‐0,79) |
| Com IC na baseline | 149 (7,1) | 190 (4,5) | 0,63 (0,51‐0,78) |
| Sem IC na baseline | 49 (20,1) | 75 (16,2 | 0,72 (0,50‐1,04) |
| Hospitalização por IC | |||
| Todos os doentes | 95 (4,1) | 126 (2,7) | 0,65 (0,50‐0,85) |
| Com IC na baseline | 65 (3,1) | 78 (1,8) | 0,59 (0,43‐0,82) |
| Sem IC na baseline | 30 (12,3) | 48 (10,4) | 0,75 (0,48‐1,19) |
| Morte CV | |||
| Todos os doentes | 137 (5,9) | 172 (3,7 | 0,62 (0,49‐0,77) |
| Com IC na baseline | 110 (5,3) | 134 (3,2) | 0,60 (0,47‐0,77) |
| Sem IC na baseline | 27 (11,1) | 38 (8,2) | 0,71 (0,43‐1,16) |
| Morte por todas as causas | |||
| Todos os doentes | 194 (8,3) | 269 (5,7) | 0,68 (0,57‐0,82) |
| Com IC na baseline | 159 (7,6) | 213 (5,0) | 0,66 (0,51‐0,81) |
| Sem IC na baseline | 35 (14,3) | 56 (12,1) | 0,79 (0,52‐1,20) |
CV: cardiovascular; IC: insuficiência cardíaca; IC 95%: intervalo de confiança a 95%.
Nota: Foi considerado um valor de p < 0,05 para a interação entre os dos subgrupos nos diversos outcomes
Outra subanálise do EMPA‐REG OUTCOME avaliou se o benefício da empagliflozina se mantinha, independentemente do risco estimado de IC, nos participantes sem esta patologia na avaliação inicial, de acordo com o score de risco de IC Health ABC42. Nos doentes a fazer empagliflozina sem IC prévia houve uma redução do número de hospitalizações ou morte por IC, independentemente da sua categoria de risco, contrariamente ao grupo placebo, em que se verificou um aumento do número de hospitalizações ou morte por IC com o aumento do risco calculado de IC42 (Figura 3). Os efeitos favoráveis da empagliflozina mantiveram‐se quando foi avaliado o endpoint de morte por causa CV, com uma redução do risco absoluto de morte CV de 4,9% nos doentes com IC previamente estabelecida ou incidente durante o ensaio e de 1,5% nos que não tinham nem desenvolveram IC42 (Tabela 3). Verificou‐se uma maior percentagem de eventos adversos nos doentes com IC prévia comparativamente aos que não apresentavam IC, quer nos doentes tratados com empagliflozina, quer naqueles que fizeram placebo42.
Resultados por risco de IC a cinco anos de acordo com o score de risco de IC Health ABC na avaliação inicial (adaptado de 43)
CV: cardiovascular; DAP: doença arterial periférica; IC: insuficiência cardíaca; IC 95%: intervalo de confiança a 95%; MACE: eventos cardiovasculares major.
Nota: Foi considerado um valor de p <0,05 para a interação entre os dos subgrupos nos diversos outcomes.
Mortes CV em subgrupos de doentes com IC na avaliação inicial ou incidente durante o estudo EMPA‐REG OUTCOME (adaptado de 43)
| Subgrupos de IC | Placebo | Empagliflozina | HR (IC95%) | Percentagem total de mortes CV |
|---|---|---|---|---|
| IC na baseline (n = 706) | 11,1% | 8,2% | 0,71 (0,43‐1,16) | 21,0% |
| Hospitalização por IC (n = 221) | 24,2% | 14,3% | 0,65 (0,35‐1,22) | 13,3% |
| IC reportada como EA pelo investigador (n = 347) | 26,6% | 17,6% | 0,73 (0,46‐1,16) | 23,9% |
| Doentes com ocorrência de eventos de IC (n = 958) | 15,3% | 10,4% | 0,67 (0,47‐0,97) | 37,9% |
| Doentes sem ocorrência de eventos de IC (n = 6.062) | 4,2 | 2,7% | 0,63 (0,48‐0,84) | 62,1% |
EA: evento adverso; IC: insuficiência cardíaca.
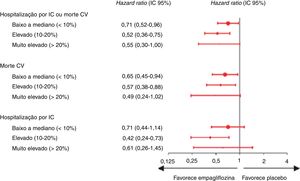
Outra análise dos dados do EMPA‐REG OUTCOME incidiu sobre o efeito da empagliflozina nos 2250 participantes que apresentavam doença renal crónica (DRC) na avaliação inicial43. Também neste grupo de doentes, comparativamente a placebo, a empagliflozina reduziu o risco de morte por causa CV em 29% (HR 0,71; IC 95% 0,52‐0,98), o risco de morte por todas as causas em 24% (HR 0,76; IC 95% 0,59‐0,99), o risco de hospitalização por IC em 39% (HR 0,61; IC 95% 0,42‐0,87) e o risco de hospitalização por todas as causas em 19% (HR 0,81; IC 95% 0,72‐0,92)43 (Figura 4). A ocorrência de eventos adversos foi semelhante entre os subgrupos com diferentes níveis de função renal à entrada no estudo, sem se ter verificado um aumento de eventos adversos como infeção urinária, insuficiência renal, hipercaliémia, fraturas, amputações ou hipoglicemias no grupo tratado com empagliflozina versus o grupo placebo43.
Morte CV, hospitalização por IC, morte por todas as causas e hospitalização por todas as causas em doentes com e sem DRC (eGFR < 60 mL/min/1,73m2 e/ou macroalbuminúria [UACR > 300 mg/g]) na avaliação inicial do estudo EMPA‐REG OUTCOME (adaptado de 44)
CV: cardiovascular; IC: insuficiência cardíaca; IC 95%: intervalo de confiança a 95%.
Nota: Foi considerado um valor de p < 0,05 para a interação entre os dos subgrupos nos diversos outcomes.
Também na análise do subgrupo de doentes com DAP do EMPA‐REG OUTCOME (n = 1.461), a empagliflozina demonstrou redução nos outcomes CV, quer nos compósitos de 3 e 4 pontos MACE (respetivamente 16%, HR 0,84; IC 5% 0,62‐1,14; e 7%, HR 0,93; IC 95% 0,70‐1,24), quer nos endpoints individuais, com uma redução de 43% da morte por causa CV (HR 0,57; 95% 0,37‐0,88), de 38% da morte por qualquer causa (HR 0,62; IC 95% 0,44‐0,88), de 44% na hospitalização por IC (HR 0,56; IC 95% 0,35‐0,92) e de 46% na incidência ou agravamento de nefropatia (HR 0,54; IC 95% 0,41‐0,71), de forma consistente com os resultados no grupo sem DAP44 (Figura 5). A redução da morte por causa CV traduz‐se na necessidade de tratar 29 doentes com DAP e DMT2 durante 3,1 anos para evitar uma ocorrência44. Em termos de segurança, o grupo sob terapêutica com empagliflozina foi semelhante ao grupo placebo nos doentes com e sem DAP na avaliação inicial, sem aumento do risco de ocorrência de amputação44.
Resultados CV, morte por todas as causas, amputações dos membros inferiores e nefropatia incidente ou agravada por DAP na avaliação inicial do estudo EMPA‐REG OUTCOME (adaptado de 45)
CV: cardiovascular; DAP: doença arterial periférica; IC: insuficiência cardíaca; IC 95%: intervalo de confiança a 95%; MACE: eventos cardiovasculares major.
Nota: Foi considerado um valor de p < 0,05 para a interação entre os dos subgrupos nos diversos outcomes.
Todas estas análises parecem demonstrar que os resultados benéficos da empagliflozina nos outcomes CV se estendem para subgrupos de população mais vulneráveis e em maior risco de morbilidade CV e mortalidade. Contudo, muitas questões ainda se colocam sobre quais os mecanismos que levam a estes efeitos.
Possíveis mecanismos para o benefício CV da empagliflozinaOs resultados do estudo EMPA‐REG OUTCOME levantaram, desde cedo, muitas questões sobre os mecanismos subjacentes aos benefícios CV demonstrados pela empagliflozina. Embora estes mecanismos estejam por comprovar, as propostas avançadas apontam para a possibilidade de efeitos hemodinâmicos, efeitos metabólicos e a diminuição das concentrações de sódio intracelular estarem na origem deste benefício45,46.
Os efeitos imediatos hemodinâmicos de depleção de volume e aumento do hematócrito poderão fazer sentido para explicar a precocidade dos benefícios observados. Aliás, o efeito hemodinâmico parece ser o mecanismo de ação mais consensualmente apontado como responsável pelo benefício CV precoce da empagliflozina, suportado pela redução na pressão arterial e do volume intravascular e indução de diurese osmótica47–49. O aumento da diurese poderá resultar na diminuição de volume circulante e na consequente redução da pré‐ e pós‐carga cardíaca e aumento da hemoconcentração, com maior libertação de oxigénio nos tecidos, traduzindo‐se numa redução do risco de IC e morte CV50.
Os resultados inesperados na redução de hospitalização por IC suscitaram interesse no mecanismo de ação cardíaca da empagliflozina51. Em alguns estudos de investigação fundamental, foi demonstrada uma diminuição na instalação e progressão da hipertrofia cardíaca e cardiomiopatia – explicada como resultado das alterações na reabsorção de sódio a nível gastrointestinal ou eventual otimização no metabolismo cardíaco47. Sabendo‐se que uma das complicações fisiopatológicas que ocorrem na IC resulta da acumulação de sódio e cálcio no citoplasma e da diminuição de cálcio mitocondrial nos cardiomiócitos45,51, foi demonstrado, em roedores, a capacidade da empagliflozina em modificar a atividade do permutador de sódio‐hidrogénio (NHE) cardíaco – um dos principais transportadores de sódio – com resultante diminuição de sódio e cálcio citoplasmático e aumento de cálcio mitocondrial, sendo que este mecanismo provou ser independente da ação da empagliflozina sobre o SGLT245, sugerindo efeitos adicionais deste fármaco.
Outros autores teorizaram que as mudanças metabólicas cardíacas resultantes da ação da empagliflozina (alteração metabólica com redução de utilização de lípidos e glicose e maior consumo de corpos cetónicos) resultariam num aumento da eficácia do processo metabólico cardíaco, da contratilidade miocárdica e eficiência cardíaca, tendo‐se admitido que esta mudança poderia verificar‐se, igualmente, no tecido muscular e renal52.
Significativamente, a diferença no controlo glicémico não pode justificar as diferenças observadas. A reduzida variação de HbA1c entre grupos no EMPA‐REG OUTCOME, com diminuição de 0,4% nos grupos sob empagliflozina comparativamente ao grupo placebo, a semelhança aos resultados metabólicos encontrados nos iDPP425,27,53, a diferença precoce entre grupos nos endpoints CV (notória algumas semanas após o inicio do estudo quando, em estudos anteriores, a diminuição do risco CV surgia após vários anos de follow‐up), todos enfraquecem a hipótese dos efeitos encontrados se deverem ao controlo metabólico induzido pelo fármaco54.
Outra hipótese que tem ganhado forma como mecanismo determinante na ação da empagliflozina prende‐se com a mudança metabólica resultante da inibição mantida dos iSGLT2, com benefícios cardio‐renais52. A constante perda de glicose, por diminuição mantida da reabsorção de glicose no túbulo contornado proximal, pode resultar numa readaptação fisiológica de diferentes mecanismos como: a sobreativação dos cotransportadores SGLT1 a jusante, compensando parte das perdas de glicose; o aumento da produção de glicose endógena através do aumento de glucagon e diminuição dos níveis de insulina sérica; uma mudança metabólica sistémica com aumento da oxidação lipídica e redução da dependência de oxidação de glicose; e o aumento do consumo de hidratos de carbono no contexto da diminuição de glicemia, insulina e massa corporal52,55,56.
Tem sido colocada a hipótese de que mecanismos adjuvantes ao nível mitocondrial, para além dos registados no estudo EMPA‐REG OUTCOME, possam ser determinantes para os efeitos benéficos obtidos57. Esta hipótese pressupõe que em estados de hipercetonémia ligeira mas persistente, tal como acontece com a influência dos iSGLT2, o consequente aumento de β‐hidroxibutirato circulante ofereça cardioproteção, podendo, cumulativamente, otimizar o metabolismo de outros órgãos, nomeadamente o metabolismo renal57. Desta forma, os efeitos da empagliflozina parecem induzir uma alteração metabólica com produção de um sistema energeticamente mais eficiente – através de uma mudança de consumo de glicose/ácidos gordos para um sistema que privilegia a utilização de corpos cetónicos, otimizando o desempenho cardíaco e renal. Tal poderia explicar os efeitos benéficos CV observados no EMPA‐REG OUTCOME apenas três meses após o início do estudo54.
Todas estas teorias necessitam, porém, de ser ainda comprovadas para que melhor se compreenda que mecanismos contribuem para o benefício CV da empagliflozina.
Segurança e tolerabilidadeA análise dos dados do estudo EMPA‐REG OUTCOME e as suas subanálises, bem como a de ensaios clínicos de fase I, II e III com doentes medicados com empagliflozina, têm demonstrado que esta é bem tolerada, tanto na sob dosagem de 10 como de 25mg diários30,58.
Numa meta‐análise recente que analisou 15 ensaios e quatro estudos de extensão, incluindo o EMPA‐REG OUTCOME, envolvendo mais de 15 000 doentes medicados com empagliflozina, verificou‐se que esta apresenta um perfil de risco benefício favorável58. Nesta meta‐análise, verificou‐se que o número de eventos adversos não foi superior nos doentes tratados com empagliflozina, independentemente da sua gravidade ou de levarem ou não à descontinuação do tratamento58.
Não se verificou um risco superior de hipoglicemia nos doentes tratados com empagliflozina, quando comparados ao grupo placebo, com a exceção de doentes medicados, concomitantemente, com sulfonilureias ou insulina48,58, justificando a advertência para que seja considerado o ajuste da dosagem de sulfonilureia e/ou insulina quando iniciado o tratamento com empagliflozina59.
Em eventos adversos relacionados com depleção de volume, foi demonstrado semelhante perfil de segurança e tolerabilidade da empagliflozina, comparativamente ao grupo placebo, com a exceção de doentes com idade superior a 75 anos ou a receber tratamento com diuréticos da ansa58.
Acompanhando o perfil de segurança da sua classe, a empagliflozina demonstrou uma incidência superior de infeções micóticas genitais, comparativamente ao grupo placebo, mais acentuado no grupo com idade superior a 65 anos. Relativamente a infeções urinárias, não se verificaram diferenças entre os grupos tratados com empagliflozina e o grupo tratado com placebo em termos da incidência, gravidade ou situações que levassem à descontinuação do tratamento, bem como no número ou prolongamento de hospitalizações58.
A empagliflozina demonstrou, ainda, resultados semelhantes ao grupo placebo no que diz respeito a fraturas ósseas, neoplasias, eventos adversos renais, lesão hepática ou pancreática, cetoacidose diabética e amputação de membros inferiores58.
Aliás, uma análise posterior das amputações de membros inferiores ocorridas durante o estudo EMPA‐REG OUTCOME mostrou que não só a incidência destes eventos foi semelhante entre o grupo a fazer tratamento com empagliflozina e o grupo placebo, como também o tempo até à ocorrência do primeiro evento, sendo estes resultados transversais à análise de subgrupos de existência de fatores de risco prévios para amputação60. Tal demonstra que a ocorrência de amputações dos membros inferiores não é uma situação decorrente de um efeito de classe dos iSGLT2.
O posicionamento da empagliflozina no tratamento da diabetesOs resultados positivos do estudo EMPA‐REG OUTCOME30, aliados a resultados positivos da canagliflozina31, levaram a alterações das recomendações para o tratamento da hiperglicemia na DMT2, sugerindo a utilização mais precoce de um iSLGT2 no tratamento de doentes com DM e DCV8,9. Na atualização das recomendações das Associações Americana e Europeia da Diabetes9, de 2015, a classe dos iSGLT2 foi apresentada como a grande alteração às recomendações de 2012. Os iSGLT2 que surgiram como uma nova opção terapêutica para a redução da glicose, devido ao seu mecanismo de ação ser independente da insulina, podiam ser utilizados em qualquer estádio da DMT2, com vantagens adicionais ao nível da redução de peso e pressão arterial9.
Na última atualização das guidelines de tratamento da DM da Associação Americana de Diabetes (ADA)61, publicada em 2018, a empagliflozina é o iSGLT2 recomendado em segunda linha associado a metformina e alterações do estilo de vida, em doentes com DMT2, por ter demonstrado forte evidência na redução de eventos CV major e na redução de mortalidade CV. A empagliflozina é apresentada como tendo benefício em doentes com DCV aterosclerótica, com IC crónica e nefropatia diabética61.
Futuras linhas de investigação da empagliflozina: estudos EMPEROR (insuficiência cardíaca) e EMPA‐Kidney (doença renal crónica)O carácter pioneiro do estudo EMPA‐REG OUTCOME ficou estabelecido através de uma significativa redução do risco para eventos CV major em doentes com DMT2 e por esta mesma redução se verificar na comparação da empagliflozina com os restantes fármacos antidiabéticos, sejam da mesma, sejam de outras classes de agentes antidiabéticos49,50,57.
Por outro lado, estes resultados levantam questões sobre os mecanismos responsáveis pelos efeitos observados e que seguramente ultrapassam o mero controlo da glicemia. É agora fundamental identificar quais os doentes que mais beneficiarão da inibição farmacológica de SGLT2, considerando quer o tempo de duração da doença, quer comorbilidades existentes. Também será importante confirmar se o benefício da empagliflozina é extensível ao importante capítulo da prevenção primária10.
A redução da hospitalização por insuficiência cardíaca parece legitimar um papel da empagliflozina na alteração da fisiopatologia do eixo/síndroma cardio‐renal. Os resultados dos estudos EMPEROR (EMPagliflozin outcomE tRial in Patients With chrOnic heaRt Failure)62, que incluem doentes com IC com fração de ejeção reduzida (EMPEROR‐Reduced) e doentes com IC com fração de ejeção preservada (EMPEROR‐Preserved), com e sem diabetes, poderão revelar‐se particularmente esclarecedores neste contexto. No seguimento destes estudos foram, recentemente, anunciados dois ensaios clínicos funcionais que irão avaliar o efeito da empagliflozina na capacidade de realização de exercício físico e nos sintomas de IC, em doentes com IC crónica com fração de ejeção reduzida (EMPERIAL‐Reduced) e com fração de ejeção preservada (EMPERIAL‐Preserved)63, no qual se prevê a participação de centros portugueses. Aguarda‐se, igualmente, a definição da eficácia e segurança da empagliflozina na DRC, com o estudo EMPA‐Kidney, já anunciado, e que irá envolver aproximadamente 5000 doentes com DRC, com e sem diabetes tipo 264.
O primeiro estudo publicado de outcomes CV pós‐EMPA‐REG OUTCOME, o estudo CANVAS31, conseguiu demonstrar efeitos benéficos similares, embora sem evidenciar o mesmo alcance dos resultados observados com a empagliflozina. São esperados para breve os resultados de dois outros estudos com iSGLT2, o CREDENCE (canagliflozina)65 e o DECLARE TIMI58 (dapagliflozina)66, que podem vir a clarificar alguma das teorias propostas. Adicionalmente, estão em fase de recrutamento três ensaios adicionais com a dapagliflozina, dois incluindo doentes com IC (Dapa‐HF e PRESERVED‐HF)67,68 e um de doentes com DRC (Dapa‐CKD)69. Podendo ser ainda precoce afirmar a existência de um efeito de classe, existe uma cada vez mais fundada expetativa da existência de um mecanismo comum subjacente à redução de risco cardiorrenal associado à inibição farmacológica do cotransportador de tipo 2 de sódio/glicose.
ConclusãoÉ inequívoco o papel da empagliflozina, e do pioneirismo do estudo EMPA‐REG OUTCOME, na alteração do paradigma de tratamento dos doentes com DMT2, tendo‐se iniciado uma nova era no tratamento e gestão desta patologia. Com a possibilidade de existência de proteção CV, para além do efeito anti‐hiperglicémico dos fármacos, hoje e futuramente, sempre que escolhermos um fármaco antidiabético com evidência de proteção cardiovascular estaremos a prevenir a morbilidade CV associada à diabetes, mais do que apenas a tratá‐la, o que virá a ter repercussões benéficas ao nível da epidemiologia desta doença.
FinanciamentoEste trabalho teve o apoio não restritivo da Boehringer Ingelheim e da Lilly.
Conflitos de interessePedro Monteiro – Investigador do estudo EMPA‐REG Outcome; Carlos Aguiar – Recebeu honorários por serviços de consultoria prestados às seguintes entidades: AstraZeneca, Bial Portela, Boehringer Ingelheim, Novo Nordisk, Tecnimede;
Pedro Matos – Advisory Board: MSD, AstraZeneca; Speaker honoraria: MSD, AstraZeneca, Novo Nordisk, Boehringer Ingelheim; José Silva‐Nunes – Auferiu honorários da Boehringer Ingelheim/ Lilly por ações de formação/ consultoria; Rita Birne – Consultoria a AstraZeneca, Boehringer Ingelheim, Eli Lilly, Gilead, Novartis e Sanofi; Patrícia Branco – Sem conflitos de interesses com a Boehringer Ingelheim; Joaquim Calado – Recebeu nos dois últimos anos honoraria referente a atividade de consultoria científica e médica das seguintes entidades: Boheringer Ingelheim, Lilly e AstraZeneca; Miguel Melo – Financiamento para projetos de investigação e honorários como consultor ou palestrante: Bial, Boehringer Ingelheim, Lilly, Eisai, Janssen, Novo Nordisk, Sanofi/Genzyme; Jorge Polónia – Sem conflitos de interesse.












![Morte CV, hospitalização por IC, morte por todas as causas e hospitalização por todas as causas em doentes com e sem DRC (eGFR < 60 mL/min/1,73m2 e/ou macroalbuminúria [UACR > 300 mg/g]) na avaliação inicial do estudo EMPA‐REG OUTCOME (adaptado de 44) CV: cardiovascular; IC: insuficiência cardíaca; IC 95%: intervalo de confiança a 95%. Nota: Foi considerado um valor de p < 0,05 para a interação entre os dos subgrupos nos diversos outcomes.](https://static.elsevier.es/multimedia/08702551/0000003800000010/v2_202002060715/S0870255119304809/v2_202002060715/pt/main.assets/thumbnail/gr4.jpeg?xkr=ue/ImdikoIMrsJoerZ+w9znTMwFdb/TnkS0koegILxs=)