A distrofia muscular de Emery Dreifuss tipo 1 (DMED1) é uma doença familiar, com transmissão recessiva ligada ao X, resultante da mutação de uma proteína do invólucro nuclear, a emerina. As manifestações clínicas ocorrem geralmente na adolescência e incluem contraturas, atrofia e fraqueza musculares e perturbações da condução cardíaca. Descreve-se o caso clínico de um jovem de sexo masculino, 16 anos, com bloqueio aurículo-ventricular (AV) de primeiro grau e limitação da extensão de ambos os antebraços. Apresentava CK elevada e a monitorização cardíaca demonstrou doença grave do tecido de condução, com pausas sinusais significativas, insuficiência cronotrópica e períodos de dissociação AV durante o esforço. A imunomarcação com anticorpos antiemerina de um fragmento de tecido muscular confirmou a ausência desta proteína e o estudo genético identificou uma mutação associada à DMED1. O estudo do seu único irmão, de 21 anos, estabeleceu igualmente o diagnóstico de DEMD1. Por apresentarem ambos doença do tecido de condução significativa optou-se por implantação de pacemaker definitivo nos dois casos. As manifestações músculo-esqueléticas, de momento, não justificavam qualquer intervenção. A identificação de anomalias da condução em idades jovens obriga à exclusão de determinadas doenças genéticas, nomeadamente, distrofias musculares.
Emery-Dreifuss muscular dystrophy type 1 (EDMD1) is a familial disease with X-linked recessive transmission, caused by a mutation in a nuclear envelope protein, emerin. Clinical manifestations usually occur in adolescence and include contractures, muscle atrophy and weakness, and cardiac conduction disturbances. We describe the case of a young male, aged 16, with first-degree atrioventricular (AV) block and limited extension of both forearms. He had elevated CK, and cardiac monitoring showed severe conduction tissue disease, with significant sinus pauses, chronotropic incompetence and periods of AV dissociation during exercise. Immunohistochemical staining using an emerin antibody showed absence of the protein in a fragment of muscle tissue and genetic study identified a mutation associated with EDMD1. Study of his brother, aged 21, also established a diagnosis of EDMD1. Both individuals received a permanent pacemaker but musculoskeletal manifestations at that time did not warrant any other intervention. Screening for certain genetic diseases, including muscular dystrophies, is mandatory following identification of conduction abnormalities in young people.
A distrofia muscular de Emery DreIfuss (DMED) é uma miopatia crónica, descrita pela primeira vez por Emery e Dreifuss, em 19661. Estes autores identificaram uma forma benigna, recessiva ligada ao X, atualmente designada como DMED tipo 1. Mais tarde, na década de 80, outros autores descreveram formas de DMED com transmissão autossómica2. Ambas apresentam prevalência mal definida3 e resultam de mutações de genes que codificam proteínas do invólucro nuclear. As principais manifestações clínicas incluem o aparecimento precoce de contraturas, o desenvolvimento progressivo de atrofia e fraqueza musculares e perturbações da condução cardíaca. A suspeita diagnóstica baseia-se na identificação destes achados clínicos e eletrocardiográficos e pode ser confirmada através da realização de biópsia muscular e estudo genético.
Caso clínicoJovem de sexo masculino, caucasiano, 16 anos, segundo filho de um casal não consanguíneo, referenciado à consulta de Cardiologia por alterações eletrocardiográficas. Como queixas referia apenas tonturas esporádicas e sensação de cansaço durante a atividade desportiva. Negava pré-sincope, síncope ou palpitações. Relativamente aos antecedentes patológicos, salientavam-se os diagnósticos prévios de asma e rinite alérgicas. Dos antecedentes familiares destacava-se apenas a morte de uma tia materna em idade jovem, por provável doença neuromuscular. Ao exame objetivo apresentava fácies incaracterístico, índice de massa corporal normal, auscultação cardíaca irregular, sem sopros, auscultação pulmonar normal, pulsos radiais e femorais palpáveis e simétricos e abdómen mole e depressível, sem organomegálias.
Em termos laboratoriais, as análises de rotina não revelavam alterações, exceto o doseamento da enzima creatina fosfocinase (CK), cujo valor (887 UI/L) excedia em cerca de cinco vezes o limite superior do normal (< 171 UI/L). O doseamento das hormonas da tiroide era normal.
O eletrocardiograma (ECG) apresentava ritmo sinusal, bloqueio aurículo-ventricular (BAV) de primeiro grau, eixo elétrico 70o, duração do QRS e intervalo QT corrigido normais.
O estudo complementar cardíaco, nomeadamente o ECG-Holter, demonstrava ritmo sinusal com frequências cardíacas mínima, média e máxima de 32, 54 e 90 bpm, respetivamente, e períodos de BAV de primeiro grau. Identificou-se ainda extrassistolia supraventricular frequente com episódios de taquicardia supraventricular de 3 complexos, extrassistolia ventricular rara e múltiplas pausas sinusais, a maior de 11.020 mseg, às 0h50min, assintomática. No ecocardiograma foram identificadas cavidades de dimensões normais, boa função biventricular e ausência de anomalias valvulares. Durante a prova em esforço, registou-se um defeito cronotrópico acentuado (apenas 54% da frequência cardíaca máxima foi atingida ao fim de 12 min) e períodos de dissociação aurículo-ventricular no pico do esforço. O estudo eletrofisiológico demonstrou a presença de disfunção do nódulo sinusal, com tempo de recuperação deste último muito prolongado (5.280 ms).
O compromisso significativo do tecido de condução associado à elevação moderada da CK sugeria uma provável doença neuromuscular com envolvimento cardíaco. Quando interrogado relativamente a queixas do foro musculo-esquelético, o doente referia apenas uma discreta limitação da extensão dos cotovelos, não valorizada previamente, pois não condicionava incapacidade funcional significativa.
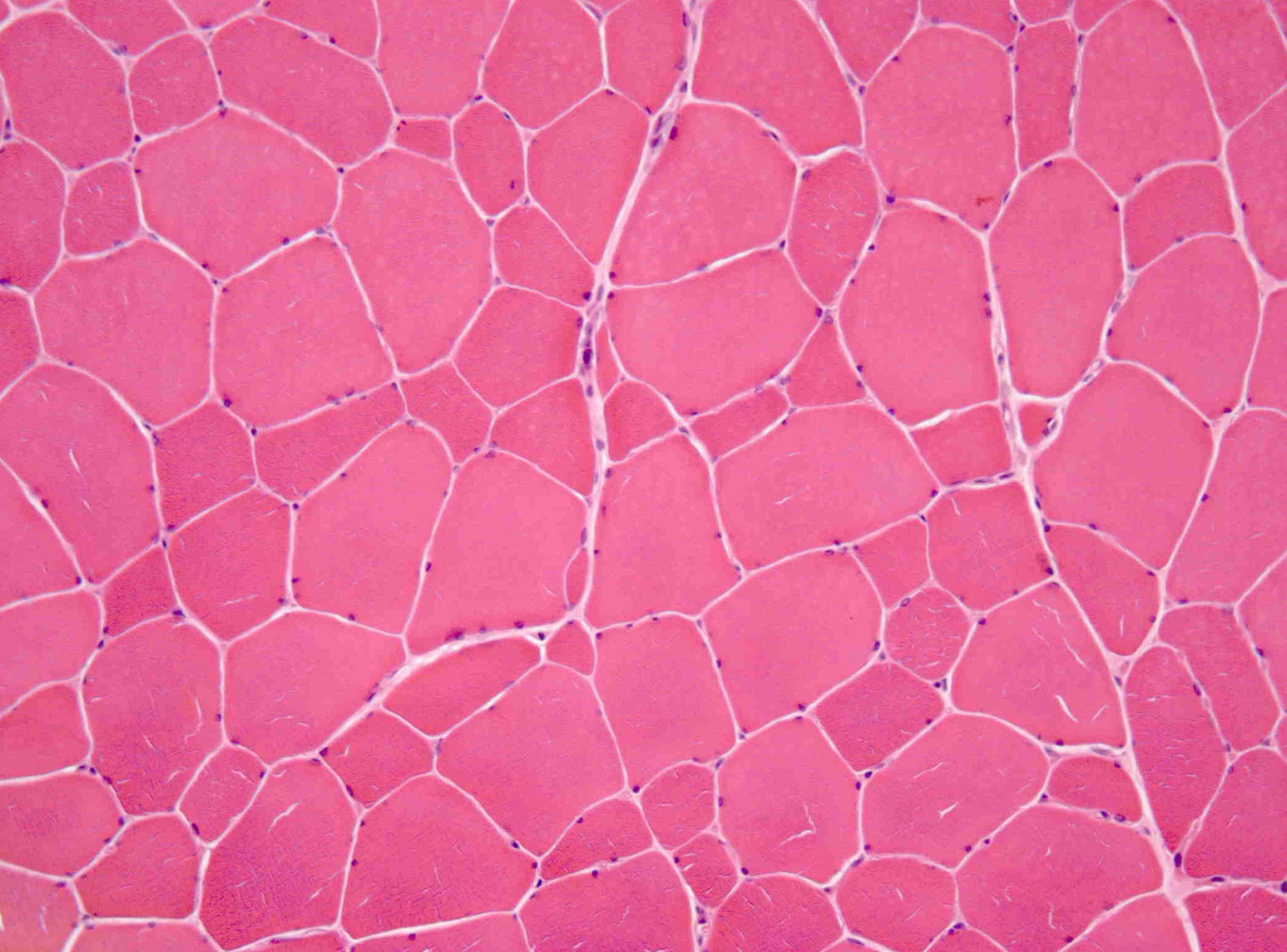
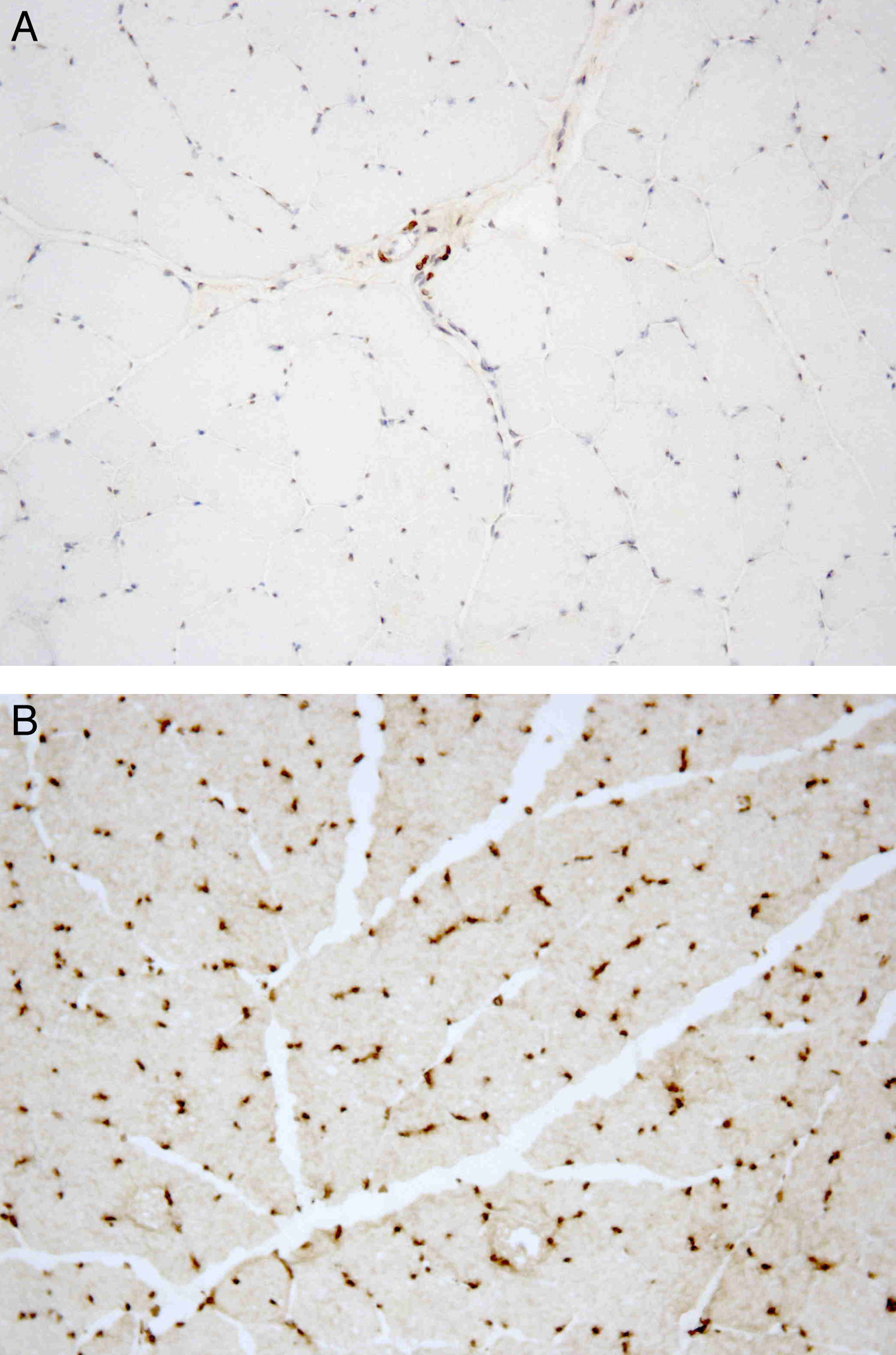
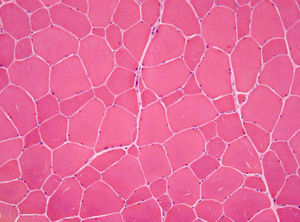
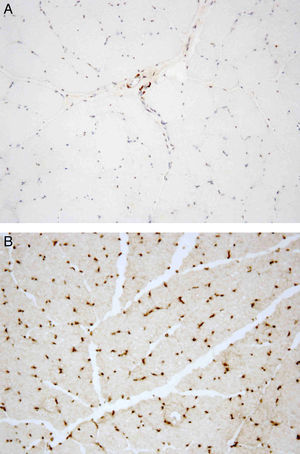
Posteriormente, foi referenciado à consulta de Doenças Neuromusculares do nosso hospital. Ao exame objetivo foi identificada contratura moderada de ambos os cotovelos, com ausência de atrofia e fraqueza musculares e de défices sensitivo-motores. A eletromiografia de agulha nos músculos deltoide e bíceps braquial foi normal, bem como o estudo da condução nervosa motora e sensitiva. A biópsia do músculo deltoide esquerdo demonstrou aumento da normal variabilidade do diâmetro das fibras musculares (Figura 1) e a análise imuno-histoquímica, através da aplicação de anticorpos antiemerina, evidenciou ausência de imunomarcação em todos os núcleos das fibras musculares (Figura 2A e B). O estudo genético confirmou o diagnóstico de DMED tipo 1 ao identificar a mutação c.266-27_266-10del no gene que codifica a emerina.
Uma vez estabelecido o diagnóstico, decidiu-se pela implantação de pacemaker definitivo (DDDR). As contraturas esqueléticas não justificavam qualquer intervenção.
A observação do irmão do doente, jovem adulto de 21 anos, revelou uma auscultação cardíaca irregular, e ao exame neurológico identificou-se hiporreflexia miotática, atrofia ligeira, sem fraqueza dos músculos dos membros superiores, limitação da extensão dos antebraços aos +150/1600 e mobilidade da coluna vertebral preservada. O doseamento da CK encontrava-se igualmente aumentado (613 UI/L). O eletrocardiograma revelou fibrilhação auricular com resposta ventricular controlada, sem outras alterações. A monitorização ao longo das 24 horas confirmou esse ritmo de base e uma frequência cardíaca média de 60 bpm. Foram também detetadas extrassistolia ventricular rara e múltiplas pausas sinusais, a maior de 3300 ms. Durante a prova de esforço registou-se uma normal evolução da pressão arterial e da frequência cardíaca e ausência de perturbações da condução AV. No ecocardiograma não foi identificada cardiopatia estrutural. Por fim, o estudo genético identificou a mesma mutação presente no irmão. Após estabelecimento do diagnóstico de DMED1, decidiu-se pela implantação de pacemaker definitivo - VVIR.
Os dois irmãos mantêm-se sob vigilância, com consultas anuais de Cardiologia e Neurologia. Até ao momento, encontram-se assintomáticos do ponto de vista cardíaco e sem sinais músculo-esqueléticos de progressão da doença.
DiscussãoA DMED tipo 1 resulta da mutação do gene que codifica a proteína emerina, localizado no locus Xq28. Esta proteína foi identificada a nível da membrana nuclear interna de praticamente todas as células, mas apresenta maior expressividade nos núcleos das células musculares esqueléticas e cardíacas. As suas funções encontram-se mal definidas; no entanto, é provável que desempenhe um papel determinante na regulação da expressão génica e na manutenção da estrutura nuclear. Atualmente são já conhecidas mais de 70 mutações, que conduzem, na sua maioria, à perda completa da emerina4. Em alguns casos, uma produção reduzida de emerina pode ser observada4. Neste âmbito, salientamos também a ausência de correlação entre o defeito genético presente e a expressão fenotípica, traduzida numa enorme variabilidade clínica, não só a nível interfamiliar, mas também no seio de uma mesma família5. Os casos clínicos descritos refletem esta característica, pois os dois irmãos eram portadores da mesma mutação, mas desenvolveram manifestações cardíacas distintas. O atingimento dos dois filhos de sexo masculino deste casal não consanguíneo, aparentemente saudável, era sugestivo de uma forma de transmissão recessiva ligada ao X, onde a mãe surge necessariamente como portadora. A favorecer a transmissão de origem materna existe o relato de uma tia falecida por provável doença neuromuscular.
As formas autossómicas assumem expressão clínica idêntica, mas resultam de mutações dos genes LMNA, que codificam as laminas A e C. Estas correspondem a proteínas filamentosas, presentes na membrana nuclear interna e nucleoplasma de quase todas as células, e que exibem funções de suporte mecânico e de regulação da replicação do ADN.
Na DMED ligada ao X, o aparecimento dos sintomas ocorre geralmente na adolescência. No entanto, as manifestações da doença podem iniciar-se durante o período neonatal ou só mais tarde, no decorrer da terceira década de vida6. A tríade clínica clássica inclui: contraturas, mais frequentes a nível dos cotovelos, tendão de Aquiles e músculos cervicais posteriores; atrofia e fraqueza musculares, com distribuição inicial preferencial umeroperoneal; e alterações da condução cardíaca.
As contraturas geralmente precedem o aparecimento da atrofia muscular7 e raramente conduzem à perda completa da deambulação8. Um programa de reabilitação atempado ou eventuais correções cirúrgicas minimizam a incapacidade funcional a elas associadas.
A fraqueza e atrofia musculares assumem geralmente distribuição bilateral e simétrica e progressão lenta. Numa fase inicial, os músculos proximais dos membros superiores e os distais dos membros inferiores são os mais comummente afetados. O envolvimento da cintura escapular e pélvica geralmente é mais tardio.
As anomalias da formação e condução do estímulo elétrico cardíaco são muito frequentes, de tal forma que é bastante raro encontrar-se um ECG normal em indivíduos com 35-40 anos9. Estas alterações surgem habitualmente após o desenvolvimento de fraqueza muscular e podem provocar síncope ou até mesmo morte súbita. Esta última pode inclusivamente constituir a primeira manifestação da doença, daí a dificuldade em estabelecer uma correta prevalência para esta distrofia6. As anomalias descritas são múltiplas, nomeadamente, bradicardia sinusal, arritmias supraventriculares e ventriculares e bloqueios AV. O prolongamento do intervalo PR é um achado inicial comum8. As aurículas são primeiramente afetadas que os ventrículos e, por isso, as arritmias supraventriculares, como fibrilhação e flutter, são frequentes9. Um achado típico é a presença de ritmo juncional associado a standstill auricular. Nas fases mais tardias pode ocorrer substituição dos miócitos por tecido fibroadiposo10, com consequente compromisso da atividade contrátil e dilatação das cavidades cardíacas.
Nos casos aqui descritos as anomalias musculares também precederam as manifestações cardíacas; no entanto, não foram valorizadas, uma vez que não condicionavam limitação funcional significativa. As perturbações da condução cardíaca associadas a esta distrofia justificaram a implantação de um pacemaker definitivo em ambos os casos, ao passo que as manifestações músculo-esqueléticas, por serem discretas, não requereram qualquer tratamento.
O diagnóstico desta doença deve ser precoce e suspeitado após identificação dos achados clínicos acima descritos. Uma elevação discreta da CK, presente nos dois casos, favorecia também a suspeita de doença muscular. Elevações marcadas (maiores do que dez vezes o limite superior do normal) sugerem outro tipo de distrofias, nomeadamente, a de Duchenne e Becker7. Valores de CK normais são raros, mas não excluem o diagnóstico11. O ECG é recomendado em todos os doentes6. O ecocardiograma deve ser realizado para exclusão de cardiopatia estrutural. O eletromiograma (EMG) pode ser normal ou demonstrar várias alterações (aumento da atividade de inserção, fibrilações, ondas positivas), que auxiliam na confirmação da natureza miopática da doença e no seu diagnóstico diferencial12. A biópsia muscular deve ser realizada em todos os casos em que haja suspeita de DMED1. Os achados histológicos mais comuns são as variações do tamanho das fibras musculares11, tal como verificado no nosso caso. A identificação de fibras necróticas e regenerativas e o aumento do tecido conjuntivo endomisial podem também ocorrer. A complementação da análise histológica com técnicas imuno-histoquímicas permite o diagnóstico diferencial com outras miopatias13.
Não existe um tratamento específico para a DMED1. A implantação de pacemaker definitivo é recomendada em todos os doentes com evidência de doença do tecido de condução9 e associou-se a uma redução do risco de morte súbita11,14. Contudo, existem relatos de morte súbita mesmo em portadores de pacemakers9. No momento atual, a implantação profilática de um cardioversor desfibrilhador não apresenta indicações claras9. Um estudo não randomizado demonstrou uma percentagem significativa de choques apropriados, o que favorece a implantação15. Estudos adicionais são necessários para estabelecimento de recomendações precisas.
Nos casos complicados, com desenvolvimento de miocardiopatia dilatada, a terapêutica habitual da insuficiência cardíaca está recomendada. O transplante cardíaco justifica-se nos casos refratários.
A evolução é geralmente benigna, apesar da possibilidade de contraturas graves e do risco de morte súbita. As mulheres portadoras, apesar de não desenvolverem manifestações músculo-esqueléticas, podem apresentar anomalias da condução, havendo inclusivamente casos reportados de morte súbita9. Assim, a realização anual de ECG é recomendada6. O ECG da mãe dos casos descritos era normal.
Portanto, o aparecimento de perturbações da condução em indivíduos jovens exige, antes do seu tratamento, a exclusão de algumas doenças genéticas raras, nomeadamente, de distrofias musculares que cursem com envolvimento cardíaco frequente.
Conflito de interessesOs autores declaram não haver conflito de interesses.